Щелочной металл для удобрения
Обновлено: 05.10.2024
Серная кислота, как двухосновная кислота, производит два ряда солей — сульфатов щелочных металлов. Нейтральные сульфаты растворяются в воде, давая нейтральную реакцию; кислые сульфаты или гидросульфиты M I HSO4 при растворении дают кислую реакцию. Все сульфаты щелочных металлов легко растворимы в воде.
За исключением сульфата лития, сульфаты щелочных металлов способны образовывать с соответствующими фторидами конгруентно плавящиеся двойные соединения типа M2SO4·MF. Относительно эффективного объема SО4-группы в сульфатах щелочных металлов (и в BaSO4), а также о влиянии природы катиона на связь S — О.
Сульфат натрия. Na2SO4 получают в больших количествах в качестве побочного продукта при производстве соляной кислоты из хлорида натрия и серной кислоты. Его также получают как побочный продукт из остаточных растворов при производстве хлорида калия. Эти остатки содержат NaCl и MgSO4. Из остаточного раствора на холоду кристаллизуется содержащая воду соль Na2SO4·10H2O
Сульфат натрия выделил еще Глаубер в 1658 г. при получении соляной кислоты из хлорида натрия и серной кислоты. В природе сульфат натрия встречается в многочисленных минеральных водах; безводный сульфат встречается в виде тенардита. В залежах солей калия он встречается главным образом в виде двойных солей, таких, как глауберит Na2SO4·CaSO4, астраканит Na2SO4·MgSO4·4H2O, левеит Na2SO4·MgS04·2,5H2O, вантгоффит 3Na2SO4·MgSO4, глазерит Na2SO4·3K2SO4.
Сульфат натрия кристаллизуется из водных растворов ниже 32,383 ° в виде содержащих воду больших бесцветных моноклинных призм состава Na2SO4·10Н2О, которые на воздухе постепенно выветриваются, отдавая воду. При нагревании выше 32° они плавятся в собственной кристаллизационной воде с образованием безводной соли. При соприкосновении с раствором выше 32,383° устойчива только безводная соль.
Сульфат натрия легко образует пересыщенные растворы. Содержащий кристаллическую воду сульфат натрия обычно называют глауберовой солью.
Содержащий воду кристаллический сульфат натрия (глауберова соль) растворяется в воде с сильным охлаждением (—18,76 ккал/моль). Его применяют иногда для охлаждения; в медицине его используют как слабительное. В промышленности Na2SO4 применяют при крашении и в аппретурах для хлопчатобумажных тканей.
Безводный сульфат натрия, называемый в технике чаще просто сульфатом, в больших количествах находит применение в стекольном производстве и для получения ультрамарина.
Смесь 1 моля глауберовой соли с 1 молем поваренной соли имеет точку перехода при 17,9°. Превращение (дегидратация глауберовой соли) протекает так медленно, что температура часами остается постоянной. Поэтому эта смесь удобна для получения точно определенной «нормальной комнатной» температуры в сосуде.
Гидросульфат натрия. Кислый сульфат натрия NaHSO4 — бесцветная легкорастворимая соль, образуется при умеренном нагревании поваренной соли с концентрированной серной кислотой
При более сильном нагревании с поваренной солью гидросульфат переходит в нейтральный сульфат
Нагретый гидросульфат отщепляет воду с образованием пиросульфита натрия Na2S2O7; при еще более сильном нагревании последний также разлагается с выделением трехокиси серы
Гидросульфат натрия и пиросульфат натрия применяют в химическом анализе для вскрытия труднорастворимых соединений. Их используют также для очистки платиновых тиглей.
Сульфат калия. K2SO4 кристаллизуется лишь в безводном состоянии в форме ромбических кристаллов. При 587° он превращается в гексагональную модификацию. Удельный вес при 18° равен 2,67, точка плавления 1074°. Растворимость в воде равна от 7,35 г при 0° до 24,1 г при 100° в 100 г воды.
В спирте сульфат калия нерастворим.
В промышленности сульфат калия используют преимущественно для получения стекла и квасцов. Кроме того, он представляет весьма ценное удобрение. Для его технического получения наряду с хлоридом калия в качестве исходного продукта служит встречающийся в месторождениях калийных солей сульфат магния (кизерит), а также его двойные соли.
В водном растворе сульфат магния сначала реагирует с хлоридом калия по уравнению
Получающийся при этом K2SO4 дает с MgSO4 труднорастворимую двойную соль (называемую в технике калийной магнезией)
После фильтрования и промывки последнюю снова обрабатывают раствором хлорида калия; при этом происходит дальнейшее разложение по уравнению
Прежде сульфат калия получали разложением хлорида калия или нитрата калия серной кислотой. Таким способом сульфат калия получал уже Глаубер, и еще в XIV в. было известно получение этой соли при действии нагреваемого железного купороса (который выделяет при этом серную кислоту) на калийную селитру. Сульфат калия относится к одному из первых химических соединений, для которых был установлен состав.
Гидросульфат калия. Кислый сульфат калия KHSO4 получали ранее как побочный продукт при производстве азотной кислоты обработкой селитры концентрированной серной кислотой. В настоящее время его приготовляют растворением нейтрального сульфата калия в избытке разбавленной серной кислоты
Из водного раствора гидросульфат калия кристаллизуется с водой. Безводное соединение плавится около 200°. При более сильном нагревании, так же как соответствующее соединение натрия, он переходит сначала с отщеплением воды в пиросульфат, затем в нейтральный сульфат. Применяется так же, как гидросульфат натрия.
Чистый гидросульфит калия не гигроскопичен. В чистом состоянии его проще всего получить растворением пиросульфата калия K2S2O7 в воде, затем упариванием раствора досуха и нагреванием остатка при 120° до постоянного веса.
Чистый пиросульфат калия в лаборатории удобнее всего получать термическим разложением персульфата калия K2S2O8. Последний при нагревании в течение получаса при 290° отщепляет точно один атом кислорода.
Сульфаты рубидия и цезия. Rb2SO4 и Cs2SO4 образуют ромбические кристаллы, изоморфные K2SO4 (при более высокой температуре, а именно выше 657° Rb2SO4 образует еще другую модификацию). При 20° удельный вес их равен 3,61 и 4,24 соответственно; точки плавления 1074 и 1019° соответственно. Оба соединения отличаются легкостью, с которой они образуют с сульфатом алюминия, сульфатом железа(Ш) и с сульфатами двухвалентных металлов очень хорошо кристаллизующиеся двойные соли (или смешанные соли). Образование цезиевых квасцов CsAl(SO4)2·12Н2О применяется для обнаружения алюминия.
Сульфат лития. Li2SO4 кристаллизуется из горячих растворов без воды в форме, по-видимому, ромбических игл. При обычной температуре кристаллизуется в виде гидрата Li2SO4·H2O в тонких моноклинных табличках. Безводная соль плавится при 859°, удельный вес её 2,21.
Растворимость у сульфата лития весьма значительна (34,5 г в 100 г воды при 20°) , хотя она и не столь велика, как растворимость хлорида и нитрата. Летучесть сульфата лития много меньше, чем летучесть хлорида.
Сульфат лития, как и другие соли лития, не образует смешанных кристаллов с другими солями щелочных металлов. Однако существует целый ряд смешанных и двойных солей.
Сульфит лития Li2SO3 также склонен к образованию подобных двойных солей:
У остальных солей лития склонность к образованию двойных солей с другими солями щелочных металлов далеко не так ясно выражена, как у сульфата лития.
В дальнейшем будет еще сказано о некоторых труднорастворимых солях щелочных металлов, имеющих значение главным образом в аналитической химии.
Труднорастворимые соли щелочных металлов. Из простых солей натрия трудной растворимостью отличается прежде всего гидроксоантимонат натрия (ранее называемый «кислый пироантимонат натрия») Na[Sb(OH)6]. Он выпадает в виде белого, зернистого осадка, состоящего из микроскопических кристалликов характерной формы при добавлении соответствующей соли калия к не слишком разбавленному нейтральному или слабо основному раствору соли натрия
Эту реакцию используют в качественном анализе для определения натрия. Употребляемый для осаждения гидроксоантимонат калия в холодной воде также достаточно плохо растворим, но он легко растворяется при 40—50°, в то время как для растворения 1 ч. этой соли натрия требуется 350 ч. кипящей воды.
Из труднорастворимых солей калия кислый тартрат калия (гидротартрат калия КНС4Н4О6) с давних пор известен под названием винного камня. Растворимость его при 20° равна 0,57 г соли и при 100° 6,9 г соли в 100 г воды. Растворение значительно уменьшается при добавлении спирта. Нейтральный тартрат калия (кристаллизующийся с водой К2С4Н4Ов·0,5Н2О), напротив, легко растворим (1 ч. в 0,66 ч. воды при 20°). Легко растворима также смешанная соль KNa[C4H4O6]·4Н2О (сегнетова соль).
Довольно трудно растворимы калийные соли хлорной и платинохлористоводородной кислот [гексахлороплатино(IV)кислота]. В воде с большим содержанием спирта они практически нерастворимы. Гексахлороплатинат калия K2[PtCl6] образует желтые небольшие правильные октаэдры. При нагревании соль разлагается на хлорид калия и металлическую платину. Растворимость перхлората калия КСlО4 сильно зависит от температуры; она возрастает от 0,70 г в 100 г воды при 0° до 18,7 г при 100°. Еще труднее, чем перечисленные соли калия, растворяются соответствующие соли рубидия и цезия.
Из труднорастворимых солей лития уже упоминались фторид LiF и карбонат Li2CO3. Фосфат лития Li3PO4 образуется в виде труднорастворимого белого, кристаллического осадка при добавлении к растворам солей лития раствора, содержащего ионы РО4 3- ;
Этот осадок не плавится в пламени бунзеновской горелки. Если для осаждения применяют кислые фосфаты, то, чтобы осаждение было полным, добавляется NaOH; иначе образуется кислый фосфат лития LiH2PO4, который растворяется значительно легче. Последний образует с фосфорной кислотой продукт присоединения LiН2РО4·Н3РО4·Н2О в виде больших расплывающихся кристаллов.
Аналитические сведения. Открытие щелочных металлов проще всего осуществляется на основании характеристических спектров. Окраска пламени также дает указание. Однако при этом следует иметь в виду, что желтое натриевое пламя может быть вызвано уже следами натрия. Фиолетовое пламя калия скрыто в присутствии натрия, однако его можно видеть и в этом случае, если смотреть на пламя через кобальтовое стекло (т. е. через стекло, окрашенное окисью кобальта в синий цвет), не пропускающее при достаточной плотности желтый свет.
В качестве реакции, применяемой для определения натрия, служит образование гидр оксоантимоната натрия Na[Sb(OH)6]. Очень хорошо также пользоваться для этой цели образованием двойной соли Na2C2H3O2·[UO2](C2H3O2)2, и хотя она лишь умеренно труднорастворима, однако кристаллизуется в очень характерной форме (желтые микроскопические тетраэдры). Для образования этой соли к одной капле раствора, предварительно досуха упаренной на часовом или предметном стекле, добавляют каплю насыщенного раствора уранилацетата [UO2](C2H3O2)2 в разбавленной уксусной кислоте.
Калий можно определить, осаждая его в виде перхлората КСlО4. Другие упомянутые выше труднорастворимые соли также используют для его определения. Более чувствительна реакция с гексанитрокобалътатом натрия Na3[Co(NO2)6]. В этом случае выпадает желтый кристаллический осадок гексанитрокобалътата калия K3[Co(NO2)6], растворимый в воде в отношении 1 : 1000. При проведении реакций на присутствие калия следует иметь в виду, что большинство из них характерны и для солей аммония (исключая реакцию с надхлорной кислотой).
Соли рубидия и цезия при использовании реакций осаждения с трудом отличаются от солей калия. Для их обнаружения всегда пользуются спектроскопом; равным образом обнаружение лития надежнее и проще всего можно провести спектроскопически.
Для весового определения натрия и калия их большей частью переводят в хлориды или в сульфаты и взвешивают в виде этих солей. Вследствие летучести, особенно хлорида калия, при нагревании следует соблюдать осторожность. Отделение калия от натрия можно провести, осадив калий в виде перхлората. Из фильтрата натрий целесообразно -осадить в форме натриймагнийуранилацетата и взвешивать в виде этой соли. Соли щелочных металлов летучих кислот по Тредвеллу можно легко перевести во фторсиликаты при упаривании с SiO2 и плавиковой кислотой и взвешивать в виде этих солей. Смеси двух солей щелочных металлов можно определить взвешиванием в виде фторсиликатов и титрованием содержания ионов F - . Кели предложил метод колориметрического определения калия в виде пикрата.
Литий отделяют от других щелочных металлов при обработке смеси хлоридов либо амиловым спиртом, либо смесью равных частей абсолютного спирта и эфира, насыщенной хлористым водородом; при этом LiCl переходит в раствор. Для взвешивания его переводят в сульфат.
Щелочные комплексные удобрения
Щелочные комплексные удобрения — это комплексы минералов на основе щелочей. Легко усваиваются растениями, гигроскопичны и прекрасно растворяются в воде. Среди таких удобрений можно отметить наиболее распространенные в России — кальциевая селитра и нитрабор. Особенности щелочных комплексных удобрений способствуют интенсивному росту растений в период вегетации, наименьшей подверженности болезням и наиболее лучшим качествам при хранении и транспортировки.
Кальциевая селитра (нитрат кальция, кальцинит, тропикоут)
5Ca (NO3)2 + NH4NO3 x 10Н2О, (N15, Ca26)
Основные агрохимические особенности кальциевой селитры:
- стимулирует развитие корневой системы (активной зоны корни — корневых волосков), вегетативный рост, развитие сельскохозяйственных и декоративных культур (свекла сахарная, кормовая, столовая, картофель, рапс озимый и яровой, кукуруза зерновая и силосная, соя, капуста, томаты, огурцы, фасоль, петрушка, яблони, земляники, розы, хризантемы, гвоздики);
- улучшает формирование мембран и стенок клеток растений;
- активизирует деятельность ферментов и обмен веществ в растениях;
- улучшает процессы фотосинтеза, транспортировки углеводородов и усвоения азота в растениях;
- повышает устойчивость растений к стресс-факторам окружающей среды, грибковых и бактериальных болезней, возникающих из-за дефицита кальция (сливочная гниль помидоров, перцев, побурение мякоти картофеля, горькость плодов яблок);
- улучшает лёжкость овощей и фруктов при хранении и транспортировке;
- повышает урожайность на 10-15%, улучшает товарный вид и вкусовые качества овощей и фруктов;
- физиологическое щелочное удобрение (0,2 Ц. СаС03 на 1 центнер удобрения), которое эффективно на кислых и солонцеватых почвах.
- Кальциевая селитра также используется для некорневой слоеной подпитки в концентрации 0,5-2,0%, особенно при появлении симптомов дефицита кальция в растениях. Высокая эффективность от внекорневой подкормки кальциевой селитрой наблюдается в регионах с жарким засушливым климатом и высокой солнечной инсоляцией. Рекомендуется применять для удобрения свеклы, овощей, рапса, пшеницы и др.
Нельзя смешивать нитрат кальция с удобрениями, содержащие фосфаты и сульфаты.
Нитрабор
5Ca(NO3)2 + NH4NO3 х 10Н2О + В, (N15, 5 Ca26, B0)

Нитрабор – это уникальное комплексное удобрение, которое представляет собой кальциевую селитру, обогащенную бором, содержит азот в нитратной форме, водорастворимые кальций и бор. Удобрение физиологически щелочное, гранулированное. Нитрабор — специальное удобрение, которое используется для питания культур, требовательных к бору (свекла, рапс, лен, картофель, подсолнечник, кукуруза, бобовые многолетние травы, хмель, овощные, плодовые) и на почвах с низким содержанием доступного бора.
Агрохимические особенности Нитрабора:
- способствует росту, развитию генеративных органов, корневой системы и точек роста у растений;
- повышает устойчивость культур к грибковым и бактериальным болезням;
- предотвращает опадение завязей плодов, появление гнили сердцевины, дуплистость свеклы, растрескивание корнеплодов моркови и другие болезни, которые возникают из-за дефицита бора;
- повышает на 10-15% урожайность культур и улучшает качество их товарной продукции, увеличивает содержание сахарозы в корнеплодах сахарной свеклы и технологический выход сахара на сахарных заводах;
- применяется локально в почву или поверхностно на ранних этапах развития и во второй половине вегетации в зависимости от биологических особенностей сельскохозяйственных культур;
- проявляет высокую эффективность на грунтах и торфяно-грунтовых субстратах с высоким содержанием органического вещества и на почвах, где рН>6,6.
Высокоэффективное удобрение на почвах с содержанием гумуса менее 2% и где содержание бора ниже 0,1 мг/кг почвы. Рекомендуемые нормы внесения — 0,5-3 Ц./1га. Вносится локально в почву для прикорневой подкормки и поверхностно методом разброса. Не рекомендуется применять нитрабор для некорневой подпитки и в системах капельного полива.
рН почвы, удобрения и будущий урожай

Многие сельхозпроизводители мало обращают внимание на рН почвенного раствора. И зря. Ведь этот показатель непосредственно оказывает влияние на рост и развитие сельхозкультур, а также выбор удобрений. А кроме того, активная кислотность, как и активная щелочность почвы, напрямую влияют на урожайность и доход аграриев. Как это происходит – давайте разберемся.
Негативное влияние избыточной кислотности
Активная кислотность почвенного раствора обусловлена повышенной концентрацией в нем ионов водорода и наличием свободных минеральных кислот, таких как угольная кислота и водорастворимых органических кислот, а также кислых солей. Активная щелочность обусловлена содержанием в почвенном растворе щелочных солей таких, как карбонаты и гидрокарбонаты щелочных и щелочноземельных металлов.
Кислотность снижает доступность фосфора растениям, приводит к закупорке сосудов корневой системы и снижает поступление элементов питания. Кроме этого негативного воздействия происходит разрушение структуры почвы, что вызывает ухудшение ее водно-физических свойств, угнетение растений и жизнедеятельности микроорганизмов.
Негативное влияние кислотности на растения проявляется через недостаток кальция и повышенную концентрацию токсичных для растений ионов алюминия, марганца и водорода. При избытке этих элементов продуктивность растений резко снижается за счет нарушения обмена веществ, формирования генеративных органов и оплодотворения; торможения развития корневой системы. Высокая кислотность понижает доступность молибдена.
Кислая среда угнетающе действует на процессы аммонификации, нитрификации, фиксации азота из воздуха, ухудшая азотный режим почвы. Оптимальные условия для развития микрофлоры, определяющей эти процессы, лежат в пределах рН 6,5 – 8,0. Особое внимание на эти показатели должны обращать те сельхозпроизводители, кто выращивает такую маржинальную культуру, как соя.
Кислая среда способствует накоплению патогенной микрофлоры в почве и большему проявлению болезней на растениях: корневых и прикорневых гнилей и листовых пятнистостей. Вместе с коллегами мы выявили зависимость в условиях Саратовской и Волгоградской областей: чем кислее почва, тем больше в ней патогенов (по фитоэкспертизе почв) и тем сильнее развиваются заболевания на озимой и яровой пшенице, ячмене, подсолнечнике. Важно учитывать этот фактор и вовремя защищать свои растения.
Отрицательное воздействие излишней щелочности почв
Высокая щелочность почв неблагоприятна для большинства растений и сельскохозяйственных культур. В условиях щелочной среды в растениях нарушается обмен веществ, снижается растворимость и доступность фосфатов, соединений железа, меди, марганца, бора и цинка. При щелочной реакции в почвенном растворе появляются токсичные для растений вещества, в частности сода и алюминаты натрия. В случае резкого повышения рН корневые волоски растений испытывают щелочной ожог, что негативно отражается на их дальнейшем развитии и может привести к отмиранию. Сильнощелочные почвы характеризуются ярко выраженными отрицательными агрофизическими свойствами, что связано с пептизацией почвенных коллоидов и растворением гумусовых веществ. Такие почвы обесструктуриваются, приобретают высокую липкость, связность во влажном состоянии; отличаются плохой фильтрацией, водопроницаемостью и неудовлетворительным водно-воздушным и питательным режимами. Сильнощелочные почвы малоплодородны. Но щелочность почвы менее вредна, чем кислотность.
Агрономам, конечно, известна общепринятая шкала оценки уровня рН почвы:
- рН >9,0 – слабая щелочь
- 8,6 – 9,0 – сильнощелочная
- 8,0 – 8,6 – щелочная
- 7,2 – 8,0 – слабощелочная
- 6,7 – 7,2 – нейтральная и близкая к ней
- 5,5 – 7,0 – слабокислая
- 4,5 – 5,5 – кислая
- 3,5 – 4,5 - сильнокислая
- < 3,5 – слабая кислота
Лучший диапазон рН для произрастания растений находится в пределах от 6,5 до 7,5. Из своего личного многолетнего опыта (в условиях Саратовской и Волгоградской областей), могу сказать с уверенностью, что при повышении рН выше 8,0 и снижении его же ниже 6,0 урожайность основных сельскохозяйственных культур снижается до 30 %. Это напрямую связано с недоступностью элементов питания из почвы и удобрений (рис. 1).

Рис. 1. Доступность элементов питания в зависимости от реакции среды почвенного раствора
Правила подкормки
Нередко агрономы подкармливают растения, не прислушиваясь ни к растениям, ни к почве. Часто приходится слышать от сельхозпроизводителей: «Да зачем вносить удобрения и кормить растения, если все равно урожай не повышается». В ответ обычно предлагаю подумать о том, как на доступность элементов питания влияет рН среды.
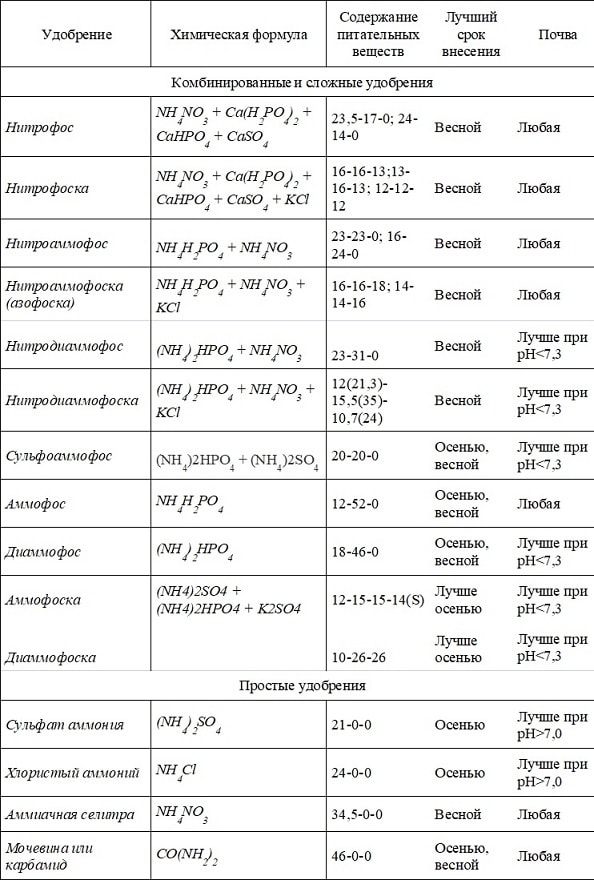
В таблице 1 приведены основные макроудобрения, которые используются в производстве, а также сроки их применения (в зависимости от формы элемента) и почвы, на которых лучше раскроется их потенциал для растений в зависимости от рН среды.
В нитрофосе азот есть в аммонийной и нитратной форме – значит, мы его осенью вносить не можем, так как есть вероятность вымывания нитратного азота. Фосфор здесь одно- и двухзамещенный. В воде растворим только однозамещенный, двухзамещенный растворяется в слабых кислотах. Однако, поскольку фосфор и такой, и такой, то удобрение используют в любой срок и на разных почвах.
Нитрофоска. Если в почве мало калия, то в принципе тоже можно использовать это удобрение в весенний период, на любых почвах.
Нитроаммофос растворим в воде, есть аммонийная и нитратная формы, большая часть – аммонийная, вносится весной и на любых почвах.
Нитроаммофоска (азофоска) тоже вносится весной. А вот используя нитродиаммофос, нужно смотреть, какая почва, и лучше вносить на слабокислых и кислых почвах. То же и нитродиаммофоска.
Сульфоаммофос сейчас активно применяется, но здесь часть фосфора растворима в слабых кислотах, поэтому на щелочных почвах не очень хорошо идет, хотя с осени его применять можно.
Из сложных удобрений мы применяем часто аммофос и диаммофос. Аммофос по содержанию фосфора очень хорош, его можно вносить как осенью, так и весной. В условиях Саратовской области он показал лучшие результаты на почвах по уровню рН близкому к нейтральному.
Сульфат аммоний и хлористый аммоний из простых удобрений особенно уместны на щелочных почвах, поскольку кислотные остатки будут нейтрализовать реакцию среды, азот в аммонийной форме и его лучше вносить осенью.
Аммиачная селитра хороша для весенних подкормок, удобрение можно вносить под предпосевную культивацию.
Карбамид – это амидная форма проходит ряд преобразований, прежде чем пройти сквозь корень, поэтому если мы хотим растение накормить сразу, то лучше аммиачная селитра.
Если агрономы будут учитывать уровень рН почвы при выборе и внесении удобрений под выращиваемые культуры, их расходы на подкормку сторицей окупятся высоким урожаем.
Татьяна Павлова, агроконсультант, к.с-х.наук
Хлориды
Встречающиеся в природе в больших количествах хлориды натрия и калия редко бывают совсем чистыми. Хлористый калий большей частью не только механически загрязнен, но встречается главным образом в виде двойных соединений с солями магния. Однако при растворении в воде они распадаются, так что безразлично, идет ли речь об отделении механических примесей или о выделении из двойных солей,— путь очистки одинаков, а именно фракционированная кристаллизация.
Получение хлоридов рубидия, цезия и лития происходит большей частью путем взаимодействия карбонатов с соляной кислотой.
Так как в случае хлоридов щелочных металлов речь идет о солях сильных оснований и сильных кислот, их водные растворы обладают нейтральной реакцией. Однако, как показал Бринер, хлориды щелочных металлов заметно гидролитически разлагаются перегретым паром.
Хлорид натрия. Поваренная соль — NaCl встречается в природе в морской воде, содержащей в среднем около 2,7% NaCl, и в виде каменной соли в больших залежах мощностью 1000 и более метров. Такие залежи находятся в Северо-Германской низменности и около г. Велички в Польше.
Северо-германские соляные залежи возникли при высыхании большого внутреннего моря, простиравшегося в далеком прошлом (в конце среднего цехштейна) от Урала в глубину теперешней Франции и включающего теперешнее Северное море, которое было тогда отрезано от Атлантического океана. Оно простиралось на юг почти до теперешней долины Дуная. При очень жарком в то время климате, особенно летом, происходило быстрое испарение воды. Это приводило к выделению растворенных в морской воде солей в соответствии с их концентрациями, растворимостью и разницей температур воды летом и зимой. Прежде всего выпадал трудно растворимый в воде карбонат кальция, который лежит поэтому в виде «цехштейновского известняка» под собственно солевыми залежами. Затем выделялись другие соли, а именно летом преимущественно гипс, ангидрит и полигалит, а зимой каменная соль («сезонные слои»). Наконец происходило осаждение калийной соли. Высохшие участки моря вскоре покрывались массами песка, позднее частично снова затоплялись, так что в некоторых местах многие залежи находятся друг над другом. Верхние слои, содержащие калийные соли, были позднее снова смыты. Они сохранялись только в немногих местах благодаря наслоению водонепроницаемой глины и имеют теперь большое значение в качестве залежей калийных солей.
Добыча поваренной соли осуществляется главным образом тремя способами: 1) горнопромышленной разработкой каменной соли, 2) растворением каменной соли под землей и выпариванием полученного рассола, отчасти также выпариванием природных рассолов; 3) из морской воды испарением в так называемых «соляных садках», а в условиях холодного климата — вымораживанием. Применяемую в технике каменную соль добывают главным образом путем горнопромышленной разработки, как правило, в виде побочного продукта при добывании солей калия. Самостоятельная разработка каменной соли становится выгодной только при содержании в ней 98—99% NaCl. Более загрязненную соль не добывают, а оставляют в шахте, где она служит для заполнения выработанных проходов в пластах калийной соли.
Каменная соль бывает загрязнена главным образом сульфатами кальция и магния. Определенная очистка ее достигается уже ручным отбором кусков ангидрита и гипса после грубого измельчения соли. Дальнейшая очистка осуществляется плавлением или обработкой более чистыми рассолами.
Приготовление пищевой соли, к которой в смысле чистоты предъявляются наибольшие требования, производят главным образом выпариванием естественных или искусственно полученных (путем растворения под землей) водных солевых растворов, так называемых рассолов.
Полученная таким путем соль называется выварочной солью. Перед выпариванием, которое ведут в плоских противнях, рассолы доводят до насыщения. Ранее это производили испарением на воздухе. С этой целью рассол заставляли стекать по стене, сложенной из связок хвороста (градирня). Теперь в большинстве случаев в рассоле растворяют до насыщения добытую каменную соль.
Перед выпариванием рассол очищают добавлением хлорида кальция (для удаления сульфатов) и едкой извести (для удаления магния). Выделяющаяся гидроокись магния, действуя как адсорбирующее вещество, увлекает с собой и органические примеси.
Чистый хлорид натрия не гигроскопичен. Известное увлажнение поваренной соли на влажном воздухе объясняется содержанием в ней примесей. Хлорид натрия кристаллизуется в виде бесцветных правильных кубов удельного веса 2,17. При температуре плавления (801°) он уже заметно летуч, однако в меньшей степени, чем хлорид калия. (Давление пара NaCl по данным Хориба при 800° равно 1 мм рт. ст. в то время как у КСl — при 800° давление пара равно 4,5 и при 700° 1,5 мм. рт. ст.). Плотность пара соответствует формуле NaCl.
В природе иногда встречается каменная соль, окрашенная в синий цвет. Эту окраску можно также вызвать искусственно (действием паров натрия или действием катодных лучей или лучей радия с последующим нагреванием). Поэтому считали, что синяя окраска природной каменной соли обусловлена находящимся в коллоидной форме металлическим натрием, который является причиной и искусственного окрашивания. Однако, согласно новейшим исследованиям, природная синяя каменная соль не содержит коллоидно растворенного натрия, ибо изменение, которое вызывается в хлориде щелочного металла облучением (бета-лучи, гамма-лучи, рентгеновские лучи), носит другой характер, чем изменение, которое может быть вызвано действием паров металлического натрия. А именно вызванные в обоих случаях окраски, будучи идентичными в видимой части спектра, различны в ультрафиолетовой части. Окраска, вызванная облучением (а также окраска природной синей каменной соли), обусловлена наличием в кристаллической решетке свободных электронов. Они расположены в определенных свободных (вследствие «нарушений порядка») местах решетки, образуемой ионами галогена.
Растворимость хлорида мало изменяется с температурой. В соответствии с этим (отрицательная) теплота растворения хлорида натрия лишь незначительна (—1,2 ккал/моль). Полученные испарением растворов кристаллы при нагревании растрескиваются в связи с тем, что включенный маточный раствор испаряется и кристаллическая корка лопается. Растрескивание каменной соли из залежей Велички при растворении в воде происходит по другой причине. Это обусловлено выделением заключенных в этой соли сжатых газов (согласно Тамману, главным образом N2 и О2), которые разрывают кристаллическую корку, как только она становится при растворении достаточно тонкой.
Поваренная соль необходима живому организму, особенно при растительном характере пищи. Поэтому ее добавляют в корма для скота. Ее применяют при консервировании мяса и рыбы (соление). В технике хлористый натрий является исходным сырьем для получения почти всех других соединений натрия.
Каменная соль является основным исходным материалом при производстве соляной кислоты и сульфата, получения соды, хлора и едкого натра. Кроме того, она служит для многих других промышленных и промысловых целей, например для высаливания мыла и органических красителей; для «хлорирующего обжига» в некоторых металлургических процессах; в кожевенном производстве для соления кож: для глазурования глиняных изделий, для ускорения таяния снега и приготовления охладительных смесей и т. д.
При низких температурах хлористый натрий кристаллизуется из водных растворов в форме гексагональных табличек состава NaCl·2H2O. При +0,15° как дигидрат, так и безводная соль устойчивы при соприкосновении с насыщенным раствором. Насыщенный раствор хлорида натрия кипит при 109,7° и содержит 40,4 г NaCl на 100 г воды. Растворимость NaCl в воде сильно снижается при добавлении НCl. При 18° 1 н. раствор НCl насыщается хлористым натрием, если последнего содержится 20,6 г на 100 г раствора, а 3 н. раствор НCl насыщается хлористым натрием при содержании его 10,6 г на 100 г раствора.
При взаимодействии органических соединений натрия с хлорсодержащими органическими соединениями в безводном бензольном растворе получается хлорид натрия в коллоидном, состоянии. Он образует с бензолом желтый или желто-красный золь, довольно устойчивый в отсутствие воды. Бромид натрия, но не иодид натрия, может образовать аналогичный, однако менее устойчивый органозоль.
Хлорид калия. KCl встречается в природе (в местах залегания калийных солей) в виде сильвина. Последний является наиболее ценным калиевым минералом, так как после размола его непосредственно можно использовать в качестве удобрения. Однако он часто сильно загрязнен примесями хлористого натрия. Если последний образует главную составную часть, то продукт называют сильвинитом.
Важнейшие залежи калийных солей находятся в Северо-Германской низменности, особенно в окрестностях Стассфурта. Кроме того, месторождения калийных солей имеются в Эльзасе. Эти отложения не являются непосредственно морскими, а возникли они в результате вторичных процессов благодаря растворению первоначальных отложений калийных солей и их последующего выделения.
Главной составной частью месторождений калийных солей и поэтому важнейшим исходным продуктом для получения солей калия является двойная соль хлорида калия и хлорида магния, карналлит KCl·MgCl2·6Н2О.
Наряду с этим еще имеют значение: «твердая соль» (смесь 35—70% NaCl, 10—48% кизерита, MgSO4·H2O, 12—23% КCl с переменным содержанием других солей калия), затем каинит КCl·MgSO4·3Н2О и уже упоминавшийся сильвинит. Эти соли называют «отбросными солями», так как раньше, чтобы достигнуть лежащего под ним слоя каменной соли, их отбрасывали и свозили в отвал. В 1865 г. Либих указал на большую ценность этих солей в качестве удобрений. В настоящее время подавляющее количество солей калия (свыше 95%) применяют для производства удобрений. Для этой цели их часто употребляют уже непосредственно после грубого размола.
Для промышленного получения хлорида калия из карналлита последний растворяют в воде. При этом он распадается на составные части КСl и MgCl2; при упаривании этого раствора вследствие небольшой растворимости первым кристаллизуется хлорид калия.
В технике для растворения применяют не чистую воду, а умеренно концентрированный раствор хлорида магния, так как в этом случае примеси (MgSO4 и NaCl), содержащиеся в сыром карналлите, в основном остаются нерастворенными.
После кристаллизации в основном хлорида калия маточный раствор содержит значительный избыток хлорида магния, из которого на холоду снова выкристаллизовывается двойная соль KCl·MgCl2·6H2O (искусственный карналлит). При обработке водой из него снова можно выделить хлорид калия.
Аналогичным образом производят переработку твердой соли и сильвинита на хлорид калия. Эта переработка основана на том, что при температурах, близких к температуре кипения воды, хлористый калий растворим лучше, чем хлорид натрия, а на холоду, наоборот, менее растворим. Поэтому хлорид калия можно выделить из смеси с хлоридом натрия, действуя на эту смесь горячей водой или еще лучше горячим раствором хлорида натрия (маточный раствор после кристаллизации КСl).
Чистый хлорид калия бесцветен, кристаллизуется в виде правильных кубов (часто в комбинации с октаэдрами). Он начинает заметно улетучиваться уже ниже своей точки плавления (768°). Плотность его пара при 2000° соответствует формуле КСl.
Хлориды рубидия и цезия получают взаимодействием карбонатов с соляной кислотой или прокаливанием хлороплатинатов. Оба хлорида кристаллизуются в виде кубов. Хлорид цезия заметно ядовит. Иодид рубидия применяют в медицине, так как он безвреднее, чем иодид калия. Здесь следует указать, что рубидий и цезий склонны к образованию полигалогенидов.
В аналитической и препаративной химии хлориды рубидия и цезия применяют иногда для получения чистых двойных хлоридов с хлоридами тяжелых металлов; полученные таким образом двойные соли отличаются большей частью плохой растворимостью и способностью хорошо кристаллизоваться.
Хлорид лития LiCl — бесцветная соль, заметно летучая уже при температуре красного каления; при белом калении в струе хлористого водорода может полностью испаряться. В противоположность хлоридам других щелочных металлов расплывается; растворим в спирте, а также в смеси спирта с эфиром. Помимо этилового спирта, растворяется также в метаноле, амиловом спирте и других спиртах, в том числе и в многоатомных, например в глицерине. Он растворяется и в других кислородсодержащих органических растворителях, таких, как альдегиды, ацетон, муравьиная кислота и др. В некоторых случаях он образует с этими растворителями определенные соединения, которые можно выделить. Из водного раствора безводный хлорид лития кристаллизуется только выше 98°, при более низкой температуре он кристаллизуется с водой, причем в зависимости от температуры содержит 1,2 или 3 молекулы Н2О.
Хлорид лития (а также и другие галогениды лития) адсорбирует в растворе и в сухом состоянии аммиак. Сухие соли в зависимости от температуры поглощают 1—4 молекулы NH3. Получены также многочисленные продукты присоединения органических аминов к хлориду лития. Как правило, к хлориду лития присоединяется только до 3 молекул, а иногда только 1 молекула органического амина.
Хлорид лития получают большей частью действием соляной кислоты на карбонат лития, который более доступен в чистом состоянии, чем другие соли:
Испарение воды следует вести нагреванием в струе хлористого водорода, так как иначе произойдет гидролитическое разложение.
Бромид и иодид лития во многом аналогичны хлориду. Они также образуют в твердом состоянии гидраты с 1, 2 или 3 молекулами Н2О.
Фторид лития. Вследствие очень низкой растворимости LiF представляет особый интерес. Он получается в виде зернистого порошка при выпаривании раствора карбоната лития в плавиковой кислоте. При перекристаллизации из расплавленного хлорида калия или бифторида калия образуются правильные октаэдры. Удельный вес его около 2,6. Незначительная растворимость в воде (в 100 г воды при 18° растворяется 0,27 г LiF) еще более уменьшается при добавлении спирта. В плавиковой кислоте он легче растворим вследствие образования бифторида LiHF2, который можно выделить в кристаллическом состоянии. Штокбаргер описал получение больших монокристаллов LiF (до 7 см в диаметре). Так как эти монокристаллы превосходят полевой шпат в отношении пропускания света в дальней ультрафиолетовой области, вакуумные спектрографы, предназначенные для исследований в коротковолновой области спектра, стали снабжать с тех пор линзами и призмами из фтористого лития, заменившего полевой шпат.
Калий
Калий – химический элемент, играющий большую роль в жизни растений. По степени необходимости стоит в одном ряду с азотом и фосфором. Распространен в природе достаточно широко. Встречается только в виде соединений. Является действующим веществом сырых калийных солей и концентрированных калийных удобрений. Применяется под все сельскохозяйственные культуры в качестве основного, припосевного удобрения и подкормки.

Агрохимикаты
Содержание:
Когда-то зола была весьма ценным химическим продуктом, потому что из нее люди получали первое в мире моющее средство, нагревая ее в воде и получая при этом мылкий раствор, используемый при стирке и в других целях. Такая «особая» зола, образующаяся только при сжигании древесины, камыша, соломы или папоротника, даже имела свое название – поташ, или кали. Она содержала карбонат калия, который и придавал ей ценные свойства.
В нашей стране еще в XIвеке производство поташа было довольно совершенным. Люди использовали уже не обыкновенную золу, а выпаренный раствор, образующийся при ее кипячении. Перед выпариванием его фильтровали для отделения частиц чистого угля и других примесей. В результате формировались ломкие кусочки серого цвета, состоящие из карбоната, сульфата, хлорида калия и соды. Несмотря на свою невзрачность, этот результат химических превращений всегда был в ходу и продавался за немалую цену, так как аналогов ему тогда не существовало.
Долгое время люди не догадывались, что основным компонентом средневекового «мыла» был новый химический элемент. И только в 1807 году Гемфри Дэви, проведя электролиз щелочи КОН, выделил из нее металлический калий. Его отнесли к группе щелочных, или, как их еще называли, «яростных» металлов, отличающихся высокой химической активностью. Позже калий был обнаружен и в составе других веществ, а также послужил основой для получения множества соединений, ныне повсеместно используемых человеком. Например, он является составляющей жидкого мыла, которое не идет ни в какое сравнение со средством, используемым несколько веков назад.
Физические и химические свойства
Калий (Kalium), K – химический элемент главной подгруппы I группы периодической системы Менделеева. Атомный номер – 19. Атомная масса – 39,10.
Калий – типичный щелочной металл серебристо-белого цвета. Он быстро окисляется на воздухе и бурно реагирует с водой, загорается при небольшом нагревании. Реакция с водой сопровождается выделением водорода. Энергично взаимодействует с галогенами, особенно с хлором и фтором.
- Температура плавления – 63,5°C,
- Температура кипения – 771°C,
- Плотность – 0,86 г/см 3 .
Содержание в природе
Калий принадлежит к распространенным элементам. Металл входит в состав различных минералов и горных пород силикатного типа. В верхних слоях мощных отложений каменной соли иногда содержатся значительные количества калия, преимущественно в виде хлоридов или двойных солей с магнием и натрием. Однако же большие скопления солей калия промышленного значения встречаются редко. В воде многих озер содержится сода.
Калий присутствует почти во всех тканях и органах растений, часто в неодинаковых количествах. В соломе зерновых культур его больше, чем в зерне. В клубнях картофеля – меньше, чем в ботве. Богаты содержанием калия молодые растения, в которых все клетки энергично делятся. Максимальное накопление калия в растении совпадает с периодом цветения.
Формы доступности калия в почве
Запасы калия там гораздо больше, чем запасы азота и фосфора. Содержание валового калия колеблется от 0,5 до 4 % и зависит от гранулометрического состава почв. Чем больше глинистых частиц в почве, тем больше в ней калийных соединений.
По степени подвижности, а значит, и доступности растениям соединения калия подразделяют на:
Формы калия в почве не постоянны и могут переходить друг в друга.
Валовое содержание калия в почве не всегда способно точно характеризовать обеспеченность растений калием, поскольку в почве может содержаться только около 1 % валовых запасов, доступных растениям. В связи с этим, об обеспеченности калием на разных типах почв судят не по общему (валовому) проценту его содержания, а по соотношению между его формами.
Содержание калия в различных типах почв
Валовое содержание калия в почве определяется и характером материнской породы.
Осадочные горные породы
Тяжелые глинистые почвы
Суглинистые почвы
Бедные песчаные почвы
Дерново-подзолистые почвы
| Примерное содержание калия (K2O) в пахотном слое различных почв согласно: | ||||
| Почвы | Порода и преобладающий тип минерала | Валовое содержание калия, % | , мг/100г почвы | , мг/100г почвы |
| Дерново-подзолистые песчаные и супесчаные | Каолинит | 1,2 | 4 – 9 | 35 – 50 |
| Дерново-подзолистые легкосуглинистые | Монтмориллонит и каолинит | 1,77 | 7 – 12 | 50 – 70 |
| Дерново-подзолистые среднесуглинистые | Монтмориллонит | 2,17 | 15 – 20 | 70 – 130 |
| Дерново-подзолистые тяжелосуглинистые и глинистые | Монтмориллонит | 2,33 | 20 – 25 | 130 – 180 |
| Серые и светло-серые лесные почвы | Лёссовидные суглинки, |
Роль в растении
| Симптомы недостатка калия, согласно данным: | |
| Культура | Симптомы недостатка |
| Общие симптомы | Появление на листьях бурых пятен |
Образование листьев неправильной формы
Краевой ожог листьев
Непрочность и полегание растений
Укороченные междоузлия в верхней части стебля
Листья темно-зеленые, куполообразные, морщинистые
Между жилками, ближе к краям, появляются коричневые мелкие пятнышки, которые придают листьям бронзовый оттенок
Ботва засыхает раньше времени
Края нижних листьев светлеют, начиная с верхушки, затем желтеют, становятся бронзовыми, буреют и отмирают
Пятнышки на краях листьев образуют сплошную каемку
Края листьев буреют
Стебли деревянистые, тонкие
Плоды мелкие, некрепкие
На кожуре и в мякоти плодов темные пятна
Побурение краев межжилочной ткани
Неравномерный рост листовой пластинки Морщинистость листьев
При сильном голодании – краевой ожог охватывает листья среднего яруса
Черешки короткие, сухие, легко ломаются
Краевой ожог старых листьев
На краях листьев – пожелтение в виде каемки.
Края листьев бронзовеют и отмирают
Бронзовость распространяется внутрь листа между жилками
Края листьев краснеют, потом отмирают и коричневеют Ягоды плохого качества
Ягоды окрашены слабо
Листья желтые или красные
Побеги крепкие, потерявшие упругость
Листья сначала красновато-пурпурные, затем появляется каемка, закрученная вниз, коричневой или серо-коричневой окраски
Плоды кислые, мелкие, плотные
Плоды плохо окрашены
Биохимические функции
Ткани и органеллы растений, содержащие калий
Калий необходим абсолютно всем растениям, животным и микроорганизмам на Земле. Попытки заменить этот элемент близкими к нему (литием, натрием, рубидием) потерпели неудачу. Функция калия в тканях и органеллах растений строго специфична.
В растениях калий содержится в ионной форме. Не найдено ни одного органического соединения, в состав которого был бы включен данный элемент. Он поглощается растениями в виде катионов. В такой форме он и остается в клетке, образуя только слабые связи с ее веществами. Именно такой калий выполняет функцию нейтрализации отрицательно заряженных компонентов клетки и создает разность электрических потенциалов между средой и клеткой. Скорее всего, в этом и есть специфичность функционирования данного металла как незаменимого для растений.
Основная масса калия находится в цитоплазме и вакуолях клеток. Установлено, что в пластидах и ядрах клеток калий отсутствует. Почти 80 % калия находится в клеточном соке и легко вымывается водой, особенно из старых листьев.
В клетках растений около 20 % калия удерживается в обменно-поглощенном состоянии коллоидами цитоплазмы и до 1 % его поглощается митохондриями необменно.
Элемент молодости
Калий называют элементом молодости. Действительно, молодые органы растений содержат калия в 3 – 5 раз больше, чем старые, поскольку его гораздо больше именно в тех клетках, где наиболее интенсивно проходят процессы деления и обмена веществ.
Больше всего калия содержит пыльца растений. Например, в золе пыльцы кукурузы его содержится до 35,5 %, тогда как магния, серы, кальция и фосфора вместе только 24,7 %.
Соединения калия отличаются легкой подвижностью в тканях растений, что и обеспечивает его реутилизацию путем перемещения из старых тканей в молодые. В результате этого его содержание в листьях и стеблях возрастает снизу вверх.
Физиологические функции
Калий выполняет в растениях разнообразные физиологические функции:
- Стимулирует течение фотосинтеза.
- Увеличивает отток углеводов из листовой пластинки в другие органы.
- Усиливает синтез сахаров, высокомолекулярных углеводов (целлюлозы, крахмала, пектиновых веществ и пр.).
- Способствует усилению накопления моносахаров в плодовых и овощных культурах.
- Способствует накоплению углеводов в клетках растений. Это приводит к увеличению осмотического давления клеточного сока, что повышает морозостойкость и холодоустойчивость растений.
- Накапливаясь в хлоропластах и митохондриях, калий способствует стабилизации их структуры и образованию АТФ,
- Увеличивает гидрофильность коллоидов протоплазмы. Это снижает транспирацию и помогает растениям выживать в периоды кратковременной засухи.
- Играет не последнюю роль в синтезе белков. Недостаток калия приводит к резкому снижению синтеза новых белковых молекул и распаду старых. Положительное влияние калия на синтез белков объясняется его влиянием на трансформацию и накопление углеводов, а также на деятельность ферментов, участвующих в синтезе белка.
Недостаток (дефицит) калия в растениях
Калиелюбивыми культурами считают сахарную и кормовую свеклу, картофель, овощи, подсолнечник. Они потребляют гораздо больше этого элемента, чем зерновые и зернобобовые культуры, лен и многолетние травы.
Дефицит калия вызывает множественные нарушения обмена веществ у растений: ослабляет деятельность целого ряда ферментов, нарушает белковый и углеводный обмен, повышает затрату углеводов на дыхание.
При этом, репродуктивность растений падает, а качество продукции снижается. При недостатке калия зерновые образуют щуплое зерно, снижается всхожесть и жизнеспособность семян. Ухудшается прочность соломины, что приводит к полеганию хлебов.
Дефицит калия приводит к уменьшению содержания крахмала в картофельных клубнях, сахарозы – в корнеплодах сахарной свеклы, пектина – в ягодах и плодах. Падает урожайность овощных, плодовых и зерновых культур, снижается содержание витаминов. При дефиците калия растения становятся восприимчивы к различным заболеваниям, в том числе, грибковым.
Признаки дефицита калия появляются не только при его низком содержании в почвах, но и при нарушении баланса питательных веществ, избытке азота, повышенной или пониженной влажности почвы, известковании. Резче всего признаки калийного голодания проявляются в сухую и жаркую погоду.
Избыток калия
Избыточное калийное питание приводит к неравномерности созревания культур, их полеганию, снижению сопротивляемости грибковым заболеваниям и неблагоприятным климатическим условиям.
На ранних стадиях при избытке калия наблюдается ослабление роста растений, удлинение междоузлий. Листья приобретают светло-зеленую окраску. На поздних стадиях рост растений замедляется, на листьях появляются пятна, они вянут и опадают.
Содержание калия в различных соединениях
Калийсодержащие минералы промышленного значения
Для производства калийных удобрений используют калийные соли. Добывают их в промышленных месторождениях по всему миру. Однако только небольшая часть из 120 калийсодержащих минералов имеет промышленное значение. К таковым относятся:
Калийные удобрения
Калийные удобрения разделяют на концентрированные (сернокислый калий, хлористый калий, калийную соль, хлористый калий – электролит, калимагнезию, калийно-магниевый концентрат) и сырые (каинит и сильвинит).
Сырые калийные соли
Получаются после дробления и размола природных калийных солей. Для этой цели используют наиболее концентрированные пласты месторождений. Однако применение сырых калийных солей оправдано только вблизи месторождений калийных руд, поскольку содержание оксида калия в них низкое и одновременно много примесей. В них много хлора, что ограничивает их применение.
Сильвинит
– mКСl + nNaCl. Он содержит 12–15 % K2O и 35–40 % Na2O. Вещество розовато-бурого цвета с включением синих кристаллов. Применяется под натриелюбивые культуры.
Каинит
– КСl • MgSO4 • 3H2O с примесью NaCl.В каините содержится 10 % K2O, 6–7 % MgO, 32–35 % Cl, 22–25 % Na2O, 15–17 % SO4. Имеет вид крупных кристаллов розовато-бурого цвета. Влажность – 5 %.
Концентрированные калийные удобрения
Хлористый калий, хлорид калия, КО
Основное калийное удобрение. Его производство занимает 90 % от всего производства калийных удобрений. Химически чистый хлорид содержит 63,1 % K2O. Поставляемый в сельское хозяйство хлорид калия содержит от 57 до 60 % K2O. Мелкокристаллический порошок белого или розового цвета с оттенком серого.
40%-ная калийная соль
КСl + (mKCl + nNaCl). В ней содержится около 40 % K2O, 20 % Na2O и 50 % Cl. Смесь белых, серых, красноватых кристаллов среднего и мелкого размера. Рекомендована к применению для культур, отзывчивых к натрию. К ним относятся сахарная свекла, различные корнеплоды, капуста, томат, злаковые травы, брюква. Для культур, более чувствительных к хлору, она менее пригодна.
Сульфат калия
K2SO4. Высококонцентрированное бесхлорное удобрение. Содержит 46 – 50 % K2O. Имеет вид мелкокристаллического порошка белого цвета с желтым оттенком, влажность – 1,2 %. Обеспечивает прибавки урожая винограда, табака, гречихи и прочих хлорофобных культур. Широко применяется в овощеводстве, в частности, в защищенном грунте. Сера удобрения оказывает положительное влияние на продуктивные бобовые, крестоцветные и другие культуры.
Калимагнезия, сульфат калия-магния (шенит
), K2SO4 • MgSO4. Содержит 29 % K2O и 9 % MgO. Имеет вид белого сильнопылящего порошка с розоватым или сероватым оттенком, а также содержит серовато-розовые гранулы. Используется под культуры, восприимчивые к хлору, и в почвах легкого состава.
Калимаг, калийно-магнезиальный концентрат
K2SO4 • 2MgSO4. Содержит 18–20 % K2O и 8–9 % MgO. Гранулы серого цвета. По эффективности сравнивается с калимагнезией.
Хлоркалий электролит
КСl с примесями NaCl и MgCl2. Побочный продукт производства магния из карлинита. Содержит 34–42 % K2O, по 5 % MgO и Na2O и до 50 % Cl. Это сильнопылящий порошок мелкокристаллического состава с желтым оттенком.
Цементная пыль
Бесхлорное калийное удобрение. Отход производства цемента. Содержит от 10 – 15 до 35 % K2O. В этом удобрении калий содержится также в виде карбонатов, сульфатов, бикарбонатов и в небольшом количестве – силикатов. Присутствуют гипс, оксид кальция, полуторные оксиды и некоторые микроэлементы.
Применяется как основное удобрение, прежде всего, на кислых почвах, а также под хлорофобные растения.
Печная зола
Это удобрение относится к местным калийно-фосфорно-известковым. Калий содержится в нем в виде поташа (К2СO3). Содержание K2O колеблется, в зависимости от источника топлива. В золе лиственных пород – 10–14 % K2O, 7 % P2O5, 36 % СаО, в золе хвойных пород – 3–7 % K2O, 2,0–2,5 % P2O5 и 25–30 % СаО. Установлено, что более молодые деревья дают золу, более богатую содержанием питательных элементов.
Свежий навоз на соломенной подстилке
Способы применения
Применение калийных удобрений, в зависимости от типа почвы
Применение калийных удобрений приносит максимальный эффект на песчаных, супесчаных, дерново-подзолистых, торфяно-болотных и пойменных почвах, а также на красноземах.
Положительно калийные удобрения влияют на урожай в зонах достаточного увлажнения суглинистых дерново-подзолистых, серых лесных почв, выщелоченных и оподзоленных черноземов при средней и низкой обеспеченности калием.
Степные и сухостепные почвы обычно хорошо снабжены калийными соединениями. Кроме того, условия влагообеспечения здесь изменчивы. Из-за этого на черноземах (южных, типичных, обыкновенных), каштановых почвах, сероземах действие калийных удобрений либо совсем слабое, либо не проявляется. Применение в данном случае калийных удобрений рентабельно только под калиелюбивые культуры (подсолнечник, сахарную свеклу, овощные), а также при орошении на сероземах и каштановых почвах.
На солонцах, как правило, богатых калием, данные удобрения не применяют, поскольку они усиливают солонцеватость данных почв и не приносят ожидаемого эффекта.
Взаимодействие с другими удобрениями
Применение навоза, а он сам по себе является хорошим источником калия, обычно снижает действие калийных удобрений.
Максимальная эффективность от применения калийных удобрений достигается при условии их оптимального соотношения с азотными и фосфорными. Одностороннее применение калийных удобрений возможно на осушенных торфяниках и торфяно-болотных типах почв, которые обеспечены другими элементами питания.
Способы внесения
Калийные удобрения вносят как основное, припосевное удобрение и подкормки. Основное удобрение вносится тремя способами: вразброс, локально, а на почвах связного гранулометрического состава в запас на 2 – 3 года.
Читайте также:
