Щелочноземельные металлы и их соединения в современных материалах
Обновлено: 17.05.2024
А) Оксиды щелочноземельных металлов – очень устойчивые вещества, обладают большим сродством к кислороду, плавятся при высоких температурах. Проявляют основные свойства, кроме оксида бериллия, имеющего амфотерный характер. Получают путем обжига карбонатов. Бурно взаимодействует с водой, кроме оксида магния.
Б) Гидроксиды – белые кристаллические вещества, их растворимость в воде увеличивается сверху вниз. Получают путем соответствующего оксида с водой. Все гидроксиды кроме бериллия, вступают в реакции, характерные для сильных оснований.
В)Соли щелочноземельных металлов представляют собой в основном белые кристаллические вещества.Соли сильных кислот в воде не гидролизуются. По группе сверху вниз уменьшается растворимость солей.
Г) Галогениды – белые кристаллические вещества, большинство из них растворимо в воде.
Применение
Магний широко применяют в машиностроении и авиации в сплавах с другими металлами. Магний также является необходимым биоэлементом, играя роль стимулятора обмена веществ. Кальций вводят в сплавы железа для удаления углерода и серы. Кальций имеет важное значение для живых организмов, это материал для постройки костного скелета.
3)К р-элементам относятся элементы, у которых происходит заполнение р-подуровня. К p-элементамотносятся 30 элементов IIIA-VIIIA-групппериодическойсистемы. Атомы элементов на внешнем энергетическом уровне имеют от трех до восьми электронов. Их количество на внешнем энергетическом уровне равно номеру группы. Усиливаютсяметаллическиесвойства p-элементавгруппесувеличениемпорядковогономера. Восстановительные свойства p-элементов в группе сверху вниз усиливаются, а окислительные ослабевают. Характер изменения свойств в группах элементов определяется в основном изменением радиусов атомов. Наряду с этим, необходимо учитывать, что при переходе в группе от одного периода к другому свойства элементов меняются настолько резко, что объяснить это одним лишь изменением радиуса атома нельзя. Поэтому у алюминия металлические свойства проявляются значительно сильнее, чем у бора. Это имеет место в каждой группе - от III А до VII А, за исключением VIII А группы.
4) Инертные газы — группа химических элементов со схожими свойствами: при нормальных условиях они представляют собой одноатомные газы без цвета, запахавкуса, а также не возгораются при нормальных условиях.Инертные газы отличаются химической неактивностью. Тем не менее, в 1962 году Нил Барлетт показал, что все они при определённых условиях могут образовывать соединения. Наиболее «инертны» неон и гелий: чтобы заставить их вступить в реакцию, нужно применить много усилий, искусственно ионизируя каждый атом. Ксенон же, наоборот, слишком активен и реагирует даже при нормальных условиях, демонстрируя чуть ли не все возможные степени окисления (+1, +2, +4, +6, +8). Радон тоже имеет высокую химическую активность, но он радиоактивен и быстро распадается, поэтому подробное изучение его химических свойств осложнено.Инертные газы имеют очень низкие точки кипения и плавления, что позволяет их использовать в качестве холодильного агента в криогенной технике.В небольшом количестве они присутствуют в воздухе и некоторых горных породах, а также в атмосферах некоторых планет-гигантов.
6)Халькогены — химические элементы 16-й группы периодической таблицы химических элементов.При переходе от кислорода к полонию размер атомов и их возможные координационные числа увеличиваются, а энергия ионизации и электроотрицательность уменьшаются. В соединениях серы, селена, теллура с кислородом и галогенами реализуются степени окисления +6, +4 и +2. С большинством других элементов они образуют халькогениды, где находятся в степени окисления -2.В свойствах серы, селена и теллура прослеживается больше аналогий, чем с кислородом и полонием. Так, в соединениях с отрицательными степенями окисления от серы к теллуру увеличиваются восстановительные, а в соединениях с положительными степенями окисления - окислительные свойства.В природе халькогены сосредоточены в рудных месторождениях, где они связаны преимущественно с металлами.
6. Struktura, vlastnosti a chování d prvků
d – prvky (nejdůležitější prvky – železo, měď, zlato, stříbro, rtuť)
charakteristika, výskyt, výroba, použití
6. Строение, свойства и поведение d—элементов d–элементы (самые важные элементы – железо, медь, золото, серебро, ртуть)
характеристика, распространенность, производство, использование
К d-элементамотносятся 32 элементапериодическойсистемы,в электронных конфигурациях которых заполняется d-подуровень.D-элементы принято называть переходными.Все d-элементы в свободном виде являются металлами, обладающими высокой твердостью, прочностью, высокими температурами плавления и кипения, высокими значениями тепло- и электропроводности. Высокая прочность и твердость кристаллических решеток d-металлов объясняется большой долей ковалентных связей.Многие d-элементы растворяются в минеральных кислотах- не окислителях, в ряду стандартных потенциалов стоят до водорода.Но есть и устойчивые металлы, которые с кислотами не реагируют.
1) Железо –металл средней активности, в своих соединениях проявляет степени окисления +2 и +3,также существует степень окисления +6. Температура плавления 1539°С, очень пластичный, обладает способностью намагничиваться и размагничиваться. Ему можно придать большую твердость и плотность методами термического и механического воздействия. Железо взаимодействует с кислотами, кислородом, с галогенами, с неметаллами. Железо восстанавливает металлы, которые в ряду активности стоят правее него, из растворов солей.В промышленности железо получают из железной руды, в основном из гематита и магнетита. Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.В живых организмах железо является важным микроэлементом, катализирующим процессы обмена кислородом (дыхания).
2) Медь -золотисто-розовый пластичный металл, находится в 4-м периоде, в 1 группе, побочной подгруппе, наиболее устойчивые степени окисления +1 и +2. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Медь обладает высокой тепло- и электропроводностью. Медь имеет относительно большой температурный коэффициент сопротивления и в широком диапазоне температур слабо зависит от нее; является диамагнетиком. Медь является слабым восстановителем, не вступает в реакцию с водой и разбавленной соляной кислотой.Окисляется концентрированнымисерной и азотнойкислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидаминеметаллов. Вступает в реакцию при нагревании с галогеноводородами.Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Медь широко применяется в электротехнике для изготовления кабелей, проводов или других проводников. Медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов. В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям.
3) Золото -мягкий металлжёлтого цвета, наиболее устойчивая степень окисления золота в соединениях +3, относительно устойчивы также соединения со степенью окисления +1,существуют соединения золота со степенью окисления −1, называемые ауридами.Золото обладает высокой теплопроводностью и низким электрическим сопротивлением. Очень тяжёлый металл, с высокой плотностью и пластичностью. Температура плавления золота 1064 °C, кипит при 2856. Плотность жидкого золота меньше, чем твёрдого, и составляет 17 г/см 3 при температуре плавления. Жидкое золото довольно летуче, и активно испаряется задолго до температуры кипения. При нормальных условиях оно не взаимодействует с большинством кислот и не образует оксидов, поэтому его относят к благородным металлам. Из чистых кислот золото растворяется только в концентрированной селеновой кислоте при 200 °C, кроме того растворяется в хлорной воде и ртути. Сравнительно легко реагирует с кислородом и другими окислителями при участии комплексообразователей. При нагревании может реагировать с хлором.
Для получения золота используются его основные физические и химические свойства: присутствие в природе в самородном состоянии, способность реагировать лишь с немногими веществами. С развитием современных технологий более популярными становятся химические способы – амальгамация, цианирование и регенерация. Имеющееся в настоящее время в мире золото распределено так: около 10 % — в промышленных изделиях, остальное делится приблизительно поровну между централизованными запасами (в основном, в виде стандартных слитков химически чистого золота), собственностью частных лиц в виде слитков и ювелирными изделиями.
4) Серебро -элемент 11 группы, пятого периода периодической системы химических элементов, с атомным номером 47. Ковкий, пластичныйблагородныйметалл серебристо-белого цвета с температурой плавления — 962 °. Обладает самой высокой тепло- и электропроводностью среди всех известных металлов. Наиболее устойчивой степенью окисления серебра в соединениях является +1.Более высокие степени окисления (+2, +3) серебро проявляет только в соединении с кислородом и фтором. Не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется, растворяется оно также в хлорном железе и в ртути. Не окисляется кислородом даже при высоких температурах, однако может быть окислено кислородной плазмой или озоном в виде тонких пленок. За счет своих свойств, серебро активно применяется в электротехнике, так же серебро используют в качестве ювелирных украшений. Используется как дезинфицирующее вещество, в основном для обеззараживания воды.
5) Ртуть -элемент шестого периода периодической системы химических элементов с атомным номером 80. Переходныйметалл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты. Обладает свойствами диамагнетика, образует со многими металлами жидкие и твёрдые сплавы — амальгамы. Для ртути характерны две степени окисления: +1 и +2.Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке и азотной кислоте. При нагревании до 300 °C ртуть вступает в реакцию с кислородом, при этом образуется оксид ртути(II) красного цвета. Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода. Ртуть также реагирует с галогенами (причём на холоде — медленно). Ртуть можно окислить также щелочнымраствором перманганата калия и различными хлорсодержащими отбеливателями. Ртуть получают обжигомкиновари (сульфида ртути(II)) или металлотермическим методом. Ртуть используется как рабочее тело в ртутных термометрах, Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде.
7. Základy chemické kinetiky a termochemie, chemický rovnovážný stav
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
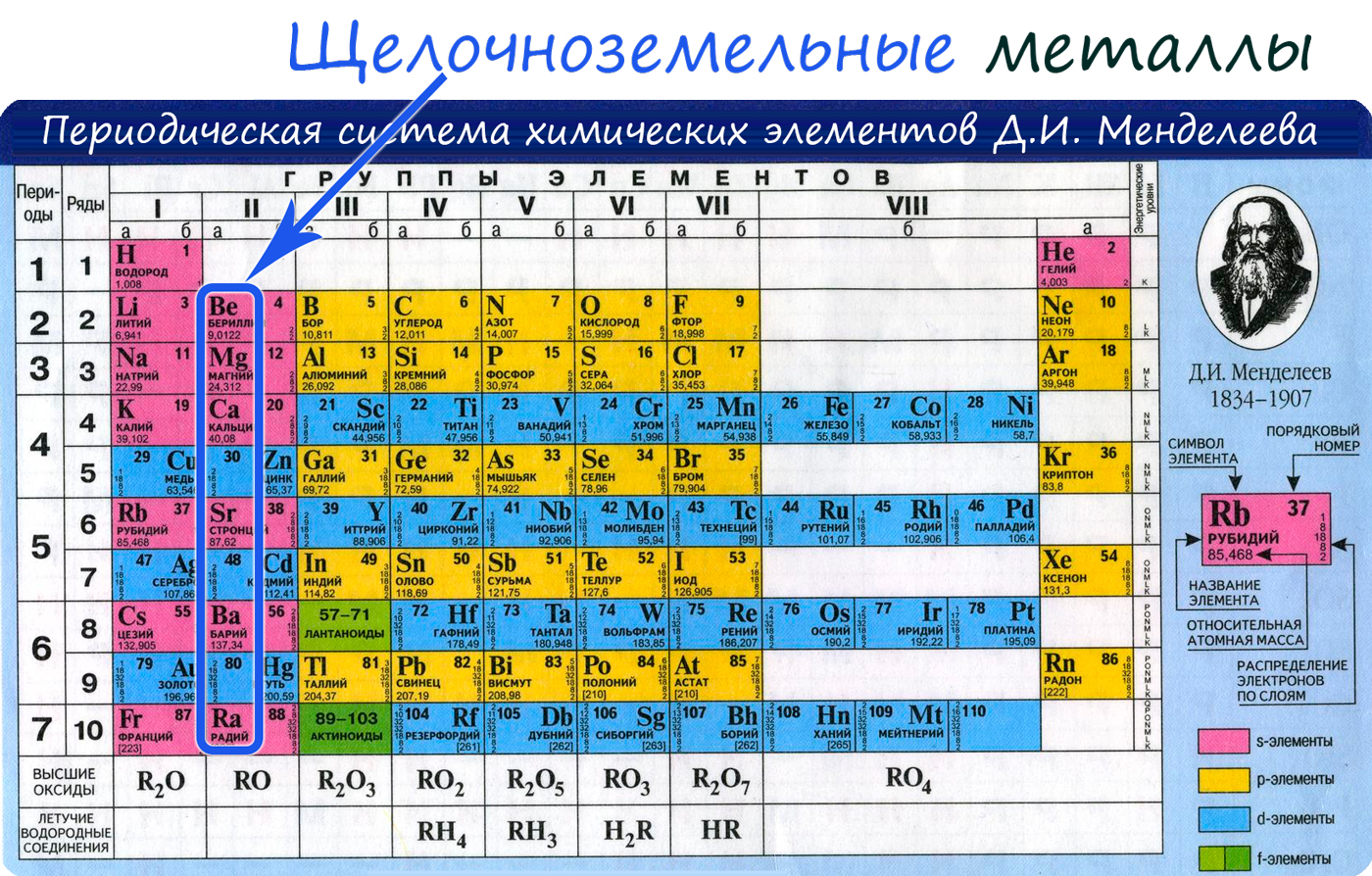
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
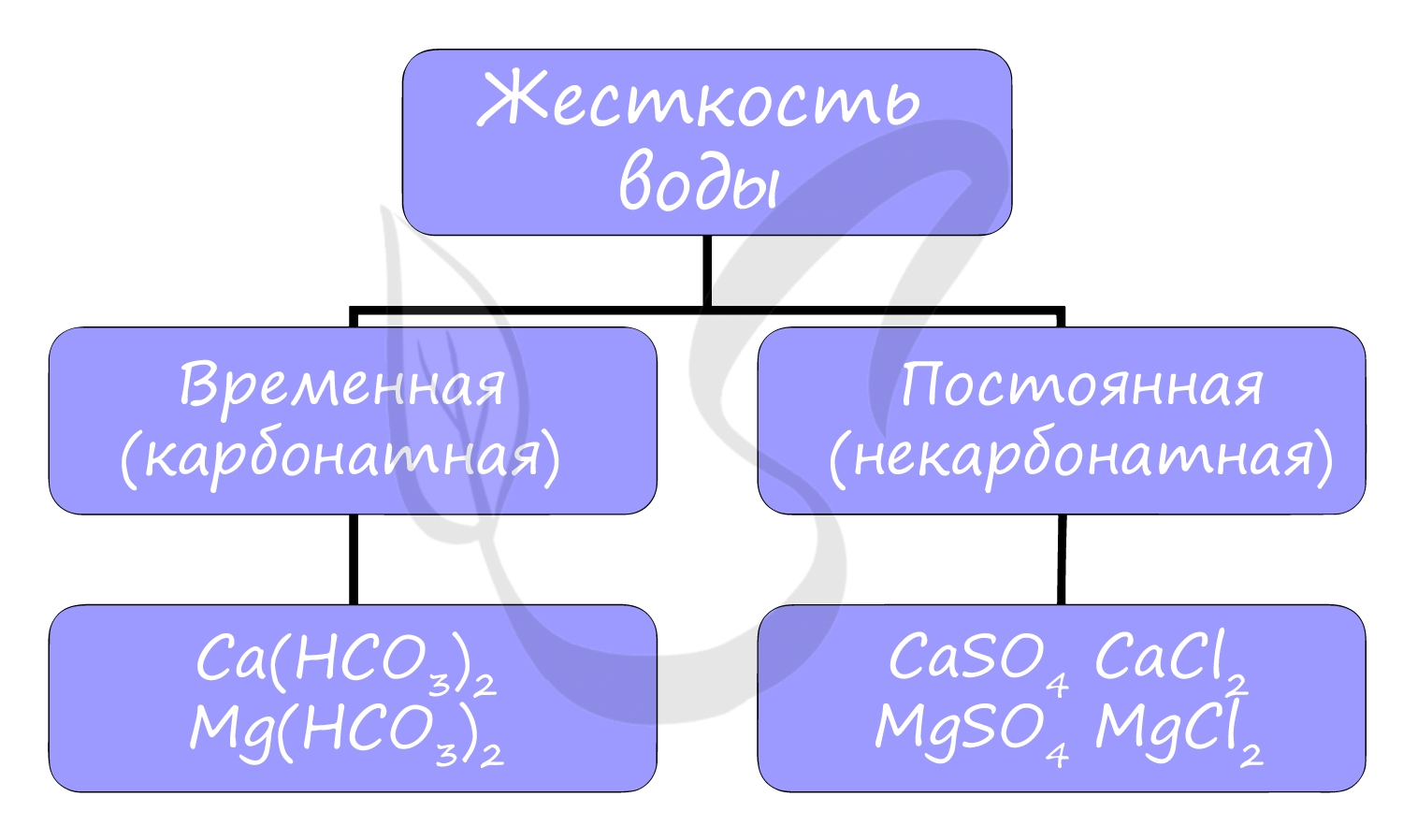
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Применение и биологическая роль щелочноземельных металлов и их соединений
Щелочноземельными металлами называют 4 химических элемента IIA группы Периодической системы Д. И. Менделеева, начиная с кальция:
кальций Ca, стронций Sr, барий Ba, радий Ra.
Электронное строение атомов
На внешнем энергетическом уровне атомы металлов IIA группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления +2.
Этим объясняется сходство их свойств.
Для металлов IIA группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- уменьшение электроотрицательности;
- усиление восстановительных, металлических свойств.
Нахождение в природе
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
Основными источниками кальция являются его карбонаты CaCO3 (мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществ
В твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
Тем не менее, металлы IIA группы имеют разные значения температуры плавления, плотности и других физических свойств.
Химические свойства
Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
Они являются сильными восстановителями.
Щелочноземельные металлы активно реагируют с:
водой, образуя соответствующие гидроксиды и выделяя водород:
Ba+2H2O=Ba(OH)2+H2↑⏐;
кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
Ba+2HCl=BaCl2+H2↑;
с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
2Ca+O2=2CaO,
Ca+H2=CaH2,
Bа+Cl2=BаCl2,
Bа+S=BаS.
Получение
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:
CaCl2=Ca+Cl2↑.
Оксиды и гидроксиды щелочноземельных металлов
Щелочноземельные металлы образуют оксиды общей формулы ЭО:
CaO, SrO, BaO, RaO.
Все оксиды обладают выраженными основными свойствами.
В ряду от оксида кальция к оксиду бария основные свойства усиливаются.
Оксиды щелочно-земельных металлов реагируют с:
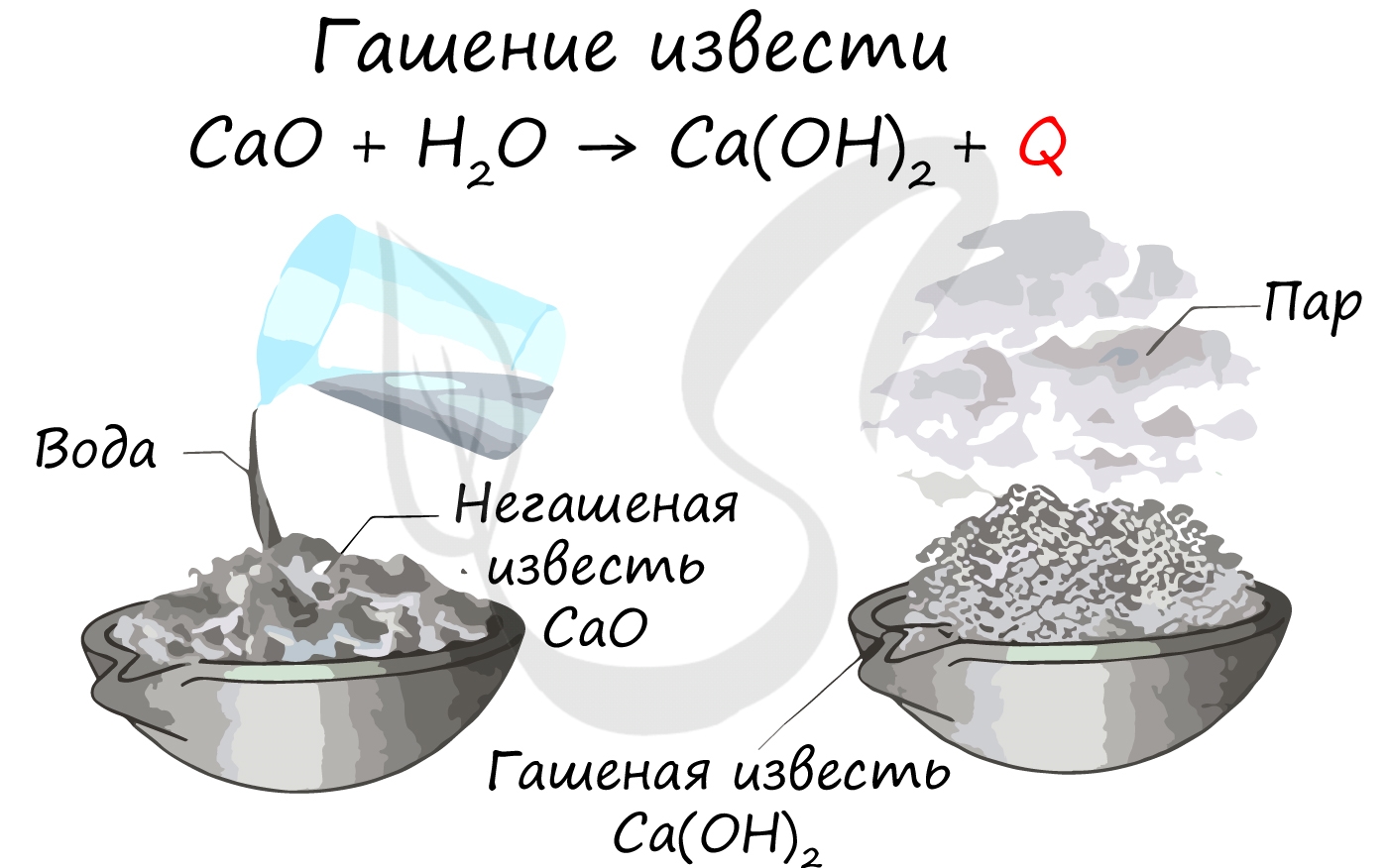
CaO+H2O=Ca(OH)2.
Реакция взаимодействия оксида кальция с водой протекает с выделением большого количества теплоты. Её называют реакцией гашения извести, так как оксид кальция входит в состав негашёной извести, а гидроксид кальция — гашёной извести.
CaO+CO2=CaCO3.
BaO+2HCl=BaCl2+H2O.
Щелочноземельные металлы при их взаимодействии (или их оксидов) с водой образуют основные гидроксиды (основания).
Сила оснований увеличивается в группе сверху вниз.
Гидроксиды щелочноземельных металлов являются сильными основаниями, растворимыми в воде— щелочами.
Гидроксиды щелочноземельных металлов проявляют все характерные свойства оснований, взаимодействуя с кислотными (и амфотерными) оксидами, кислотами (и амфотерными гидроксидами), солями.
При нагревании гидроксиды разлагаются на соответствующий оксид и воду:
Ca(OH)2−→−tCaO+H2O.
Гидроксид кальция является сильным основанием, но малорастворим в воде. Его насыщенный раствор называется известковой водой.
На воздухе раствор постепенно мутнеет, так как поглощает углекислый газ, из которого образуется карбонат кальция:
Ca(OH)2+CO2=CaCO3⏐↓+H2O.
Эта реакция используется как качественная реакция для обнаружения углекислого газа.
Соли щелочноземельных металлов
Соли щелочноземельных металлов можно получить при взаимодействии оксидов или гидроксидов металлов с соответствующими кислотами:
CaO+2HCl=CaCl2+H2O,
Ba(OH)2+2HCl=BaCl2+H2O.
Соли бескислородных кислот образуются при непосредственном взаимодействии простых веществ:
Ca+S=CaS,
2Ba+I2=2BaI2.
Важнейшие соли кальция: его карбонаты и сульфаты.
Карбонат кальция CaCO3 (мел, мрамор, известняк),
гидрокарбонат кальция Ca(HCO3)2,
сульфат кальция CaSO4 и его кристаллогидраты:
CaSO4⋅2H2O (гипс), CaSO4⋅0,5H2O (алебастр).
Соли щелочноземельных металлов реагируют с кислотами, солями.
При нагревании разлагаются:
CaCO3−→−tCaO+CO2.
Качественный анализ
Соединения кальция окрашивают пламя в кирпично-красный цвет.
Ионы бария можно обнаружить в растворе с помощью раствора серной кислоты или её солей. При этом образуется нерастворимый сульфата бария, который выпадает в осадок:

Качественная реакция на ионы бария:
Применение и биологическая роль щелочноземельных металлов и их соединений
Металлический кальций используется в производстве стали, чугуна, для их очистки от кислорода, серы и фосфора, для получения сплавов.
Благодаря химической активности металлический кальций также находит применение в восстановлении некоторых тугоплавких металлов (титан, цирконий и др.) из их оксидов.
В периодической системе элементов металлы в основном располагаются в главных подгруппах I—Ill групп, а также в побочных подгруппах.
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s 1 , во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s 2 . Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s 2 p 1 . Они относятся к p-элементам.
В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.
Оксиды типа R2O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R2O2, которые являются сильными окислителями.
Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.

Физические свойства
В свободном состоянии все металлы – серебристо-белые вещества. Магний и щелочноземельные металлы – ковкие и пластичные, довольно мягкие, хотя тверже щелочных. Бериллий отличается значительной твердостью и хрупкостью, барий при резком ударе раскалывается.
В кристаллическом состоянии при обычных условиях бериллий и магний имеют гексагональную кристаллическую решетку, кальций, стронций – кубическую гранецентрированную кристаллическую решетку, барий – кубическую объемоцентрированную кристаллическую решетку с металлическим типом химической связи, что обуславливает их высокую тепло- и электропроводность.
Металлы имеют температуры плавления и кипения выше, чем у щелочных металлов, причем с увеличением порядкового номера элемента температура плавления металла изменяется немонотонно, что связано с изменением типа кристаллической решетки.
Бериллий и магний покрыты прочной оксидной пленкой и не изменяются на воздухе. Щелочноземельные металлы очень активны, их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Некоторые физические свойства бериллия, магния и щелочно-земельных металлов приведены в таблице.
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см 3 .
Химические свойства щелочных металлов
| Свойство | Be | Mg | Ca | Sr | Ba |
| Плотность, кг/м 3 | |||||
| Температура плавления,°С | |||||
| Температура кипения,°С |
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
4. Взаимодействие с кислотами – сильными окислителями
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности.
| РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ | |
| NaOH | Едкий натр (каустическая сода) |
| NaCl | Поваренная соль |
| NaNO3 | Чилийская селитра |
| Na2SO4∙10H2O | Глауберова соль |
| Na2CO3∙10H2O | Сода кристаллическая |
| KOH | Едкое кали |
| KCl | Хлорид калия (сильвин) |
| KNO3 | Индийская селитра |
| K2CO3 | Поташ |
Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов
Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
Читайте также:
