Щелочные металлы 9 класс габриелян
Обновлено: 04.10.2024
Урок разработан с применением информационных технологий.
Цель урока: Формирование знаний учащихся о щелочных металлах как о представителях типичных металлов.
| Вложение | Размер |
|---|---|
| urok.rar | 321.45 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Тема урока: Щелочные металлы.
Цель урока: Формирование знаний обучающихся о щелочных металлах как о представителях типичных металлов.
Рассмотреть общую характеристику щелочных металлов на основании положения в периодической таблице и строения атомов;
Рассмотреть нахождение щелочных металлов в природе, их физические и химические свойства;
Познакомить со способами качественного распознавания щелочных металлов в соединениях;
Отработать умения записывать уравнения реакций, характеризующие свойства щелочных металлов с точки зрения ОВР и ТЭД;
Познакомить учащихся с историей открытия, распространением и использованием щелочных металлов.
Создать условия для развития у учащихся логического мышления и памяти, умения анализировать, делать выводы, сравнения, выделять главное.
Повышение мотивации к изучению химии;
Воспитание дисциплины, ответственного отношения к делу.
Тип урока : урок изучения новых знаний
компьютер, проектор, интерактивная доска, презентация «Щелочные металлы»;
технологическая карта для каждого ученика
Реактивы для проведения эксперимента: металлический натрий, вода, фенолфталеин.
1. Мотивационно – целевой этап
Актуализация знаний учащихся
Фронтальная беседа по следующим вопросам:
1. Какое положение в периодической системе химических элементов занимают металлы?
2. В чем различие в строении внешнего энергетического уровня у металлов и неметаллов?
3. Какой тип кристаллической решетки характерен для металлов?
4. Какое строение имеет кристаллическая решетка металлов?
5. Что такое металлическая связь?
6. Какие особенности внутреннего строения металлов определяют их тепло- и электропроводность?
7. Какие вам известны способы получения металлов в промышленности?
8. Что означает ряд активности металлов?
9. Почему не все металлы встречаются в природе в чистом виде?
10. Какие металлы образуют 1 группу главную подгруппу? Почему они находятся в одной группе?
Учитель подводит к тому, что учащиеся могут самостоятельно сформулировать тему и цели урока.
План урока во время беседы записывается на доске, затем к нему обязательно нужно вернуться в конце урока при подведении итогов занятия .
1. Щелочные металлы – элементы
Положение в ПСХЭ;
2. Щелочные металлы – простые вещества
Распространение элементов в природе;
II. Операционно-исполнительский этап
Изучение нового материала
Индивидуальная работа учащихся.
Учитель проводит инструктаж по работе с технологической картой.
Задание 1 (слайд 3)
Используя текст параграфа §11 и ПСХЭ, охарактеризуйте положение химических элементов 1 группы главной подгруппы в ПСХЭ, назовите эти элементы, составьте электронные формулы их атомов.
урок по теме "Щелочные металлы"
план-конспект урока по химии (9 класс) по теме
Конспект урока, секция - естественные науки
Урок по химии «Щелочные металлы», 9 класс,
по программе О.С. Габриеляна
( урок изучения и первичного закрепления нового материала)
Учитель химии, БОУ города Омска «Гимназия № 159»
Тип урока: урок изучения и первичного закрепления нового материала с мультимедийной поддержкой. На уроке сочетаются фронтальный, групповой и индивидуальный виды работы учащихся.
Методы урока: проблемные, поисково-исследовательские, самостоятельная работа учащихся.
Оборудование: персональный компьютер с Windows Media Player, мультимедийный проектор, интерактивная доска, программы для запуска презентации на компьютере: MS Office Power Point, фрагменты из коллекции образовательных интернет ресурсов.
- на основе атомного строения металлов, физических и химических свойств, показать черты сходства и различия щелочных металлов;
- проследить межпредметные связи химии с биологией, физикой, медициной, используя области применения основных соединений щелочных металлов;
- раскрыть значение и роль щелочных металлов в жизни человека.
- способствовать дальнейшему развитию логического мышления учащихся: наблюдать, сравнивать химические элементы, высказывать суждения об их свойствах, обобщать, делать выводы;
- продолжить формирование навыков самообразования: умение работать с книгой, инструкцией, тестом.
- воспитание интереса к предмету и таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
План урока и распределение времени урока
I Организационный момент: приветствие, проверка готовности к уроку учащихся (наличие тетрадей, учебников).
II Вводное слово: мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека. На прошлых уроках мы рассмотрели общие сведения о металлах: положение в периодической таблице, особенности строения атомов, изучили общие физические и химические свойства, а также общие способы получения металлов. Сегодня приступаем к изучению наиболее ярких представителей в химическом отношении, самых активных щелочных металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
III Актуализация знаний учащихся в виде беседы по вопросам:
- На какие две большие группы происходит деление химических элементов?
- Где находятся металлы в ПСХЭ Д.И. Менделеева? (слайд №1)
- Каковы особенности строения атомов металлов?
- Как особенности строения атома влияют на физические свойства?
- Как особенности строения металлов влияют на их химические свойства?
- Оформление даты и темы урока в тетрадях (слайд №2)
- Знакомство с планом урока (слайд №3):
- Положение щелочных металлов в ПСХЭ Д.И. Менделеева
- История открытия щелочных металлов
- Строение атомов химических элементов I группы главной подгруппы
- Физические свойства щелочных металлов
- Химические свойства щелочных металлов
- Биологическое значение щелочных металлов
- Подведение итогов: тестирование
- Домашнее задание
VI Работа по плану объясняемой темы:
1. Положение щелочных металлов в ПСХЭ – беседа по вопросам: (слайд №4)
- Где располагаются щелочные металлы в ПСХЭ Д.И. Менделеева?
- Перечислите щелочные металлы.
- Почему данные металлы назвали щелочными?
- 2. История открытия щелочных металлов: заранее подготовленный ученик рассказывает о хронологии открытия щелочных металлов и представляет свою презентацию темы (слайд №5):
- 1807 г. в Англии Гемфри Дэви открыл калий и натрий
- 1817 г. в Швеции Август Арфедсон открыл литий
- 1860 – 1861 г.г. в Германии Роберт Бунзен и Густав Кирхгоф открыли рубидий
- 1939 г. во Франции Маргарита Перей открыла радиоактивный элемент франций, который назвала в честь своей страны - Франции
3. Строение атомов химических элементов I группы главной подгруппы (слайд №6): учащиеся заполняют таблицу: «Общая характеристика химических элементов I группы главной подгруппы» и делают выводы по заполненной таблице (приложение)
Название и символ элемента
Состав атомного ядра
Число валентных электронов
Число энергетических уровней
Характерные степени окисления
Выводы: 1) На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону (слайд №7)
2) В подгруппе от лития к цезию радиусы атомов увеличиваются, так как возрастает число электронных слоев, следовательно, усиливаются и восстановительные свойства
3) Во всех своих соединениях щелочные металлы проявляют степень окисления +1
Упражнение (слайд №8): сравните атомы элементов, поставив знаки >, (приложение)
Б) число электронных слоев
В) число электронов на внешнем уровне
Д) восстановительные свойства
4. Физические свойства щелочных металлов (слайд №9 - 12): щелочные металлы-это простые вещества, для которых также, как и для всех металлов, характерна металлическая связь и металлическая кристаллическая решетка. Металлическая связь возникает за счет отдачи одного электрона атомом металла и образованием иона металла с положительным зарядом: М 0 – 1е → М +1 . Наличие металлической связи и металлической кристаллической решетки обуславливает следующие физические свойства щелочных металлов: серебристо – белые, мягкие, обладают блеском, легкие, их плотность меньше 5 г/см 3 и возрастает от лития к цезию, легкоплавкие, их температура, наоборот, от лития к цезию уменьшается.
5. Химические свойства щелочных металлов (слайды №13): щелочные металлы быстро окисляются на воздухе, поэтому их хранят под слоем керосина, а литий в вазелине, так как из-за своей легкости он в керосине всплывает. Щелочные металлы активно взаимодействуют почти со всеми неметаллами (хлором, водородом, серой, кислородом). При взаимодействии с кислородом лития образуется оксид, а натрий и калий в данном случае образуют пероксиды. Все щелочные металлы активно реагируют с водой. Скорость химических реакций зависит от природы реагирующих веществ: так, скорость реакции взаимодействия лития с водой меньше, чем натрия, и еще меньше, чем калия. Взаимодействие рубидия и цезия с водой протекает так быстро, что происходит. Уравнения же реакций щелочных металлов с растворами кислот и солей записывать не принято (так как они взаимодействуют с водой).
Упражнение (слайды №14): составить уравнения реакций взаимодействия с кислородом (приложение) (работа у доски)
Реакцию Б) рассмотреть как ОВР: определить степени окисления, составить электронный баланс, расставить коэффициенты.
Упражнение (слайд №15): дать характеристику реакции Б) по плану (приложение) (самостоятельно)
План: 1) По числу и составу исходных веществ и продуктов реакции (р.с., р.р., р.з., р.о.
2) По изменению степеней окисления атомов (ОВР и не ОВР)
3) По направлению (обратимые и необратимые)
4) По тепловому эффекту (экзотермические и эндотермические)
5) По агрегатному состоянию (гомогенные и гетерогенные)
6) По использованию катализатора (каталитические и некаталитические)
6. Биологическое значение щелочных металлов (видео)
7) Подведение итогов: тестирование по вариантам
1) Число электронов на внешнем уровне у атомов щелочных металлов:
2) Тип химической связи в простом веществе литии:
Б) ковалентная полярная
В) ковалентная неполярная
3) Распределение электронов по энергетическим уровням в атоме лития:
4) Наименее энергично взаимодействует с водой:
5) Простое вещество с наиболее ярко выраженными металлическими свойствами:
1) Вид химической связи в простом веществе натрии:
2) Радиус атомов элементов I группы главной подгруппы с увеличением заряда ядра:
Презентация по химии на тему "Щелочные металлы." (УМК Габриелян, 9 класс)
презентация к уроку по химии (9 класс) на тему
В презентации отражены важнейшие физические и химические свойства щелочных металлов, показаны закономерности изменения ивойств этих элементов на основании их положения в Периодической системе химических элементов. Также приведены важнейшие соединения щелочных металлов, показаны сферы их применения. Презентация адресована учащимся 9-х классов, изучающих химию по программе Габриеляна, с целью систематизировать и углубить знания в данной теме.
| Вложение | Размер |
|---|---|
| schelochnye-metally.pptx | 827.96 КБ |
Предварительный просмотр:
Подписи к слайдам:
Щелочные металлы Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Барсуков Д. Б г . Кемерово
Строение и свойства атомов Свойство, изменяющееся в пределах подгруппы Число энергетических уровней Увеличивается Число электронов на внешнем уровне Не изменяется, равно номеру группы (1) Электроотрицательность Уменьшается Высшая степень окисления Равна +1 Металлические свойства Увеличиваются Восстановительные свойства Увеличиваются
ЛИТИЙ РУБИДИЙ НАТРИЙ ЦЕЗИЙ КАЛИЙ
Физические свойства металлы цвет Радиус , нм t пл.,С t кип., C плотность г/см3 твердость литий Сереб-ристо - белый 155 179 137 0,53 0,6 натрий тот же 189 97,8 883 0,97 0,4 калий тот же 236 63,7 766 0,86 0,5 рубидий тот же 248 38,7 713 1,52 0,3 цезий золотисто - белый 267 28,5 690 1,87 0,2 франций В природе не существует в таких количествах, которые достаточны для изучения его свойств.
Физические свойства Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать ножом. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
ХИМИЧЕСКИЕ СВОЙСТВА Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту ( Li , Cs ) их хранят под слоем керосина.
1. ВЗАИМОДЕЙСТВИЕ С ВОДОЙ Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий
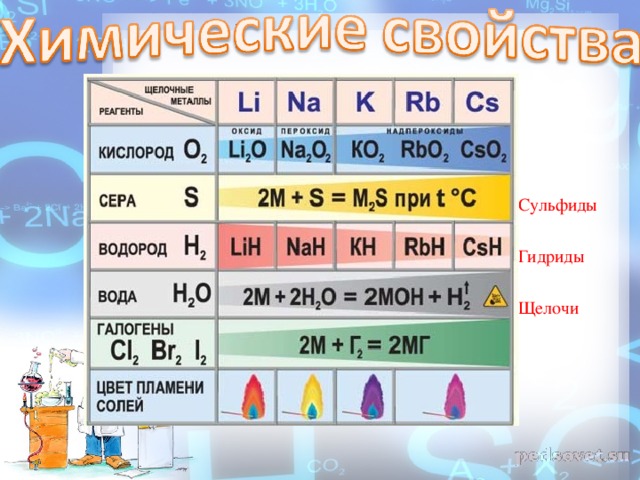
2. С неметаллами С водородом образуют гидриды . Бурно реагируют с хлором и серой.
С кислородом реакция протекает по-разному: Только литий сгорает на воздухе с образованием оксида стехиометрического состава : При горении натрия в основном образуется пероксид натрия В продуктах горения калия , рубидия и цезия содержатся в основном надпероксиды :
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода :
Гидроксиды щелочных металлов Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
Карбонат натрия Карбонат натрия используется в стекольном производстве, мыловарении, в производстве стиральных и чистящих порошков, эмалей, для получения ультрамарина. Гидрокарбонат натрия Na H C O 3 (другие названия: питьевая сода(E-500), пищевая сода, бикарбонат натрия, натрий двууглекислый) — кристаллическая соль, однако чаще всего она встречается в виде порошка тонкого помола белого цвета .
Хлори́д на́трия — химическое соединение NaCl , натриевая соль соляной кислоты, хлористый натрий. Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль). Применяется для получения неорганических веществ, соды, в пищевой промышленности, в производстве мыла. ХЛОРИД НАТРИЯ
Домашнее задание Параграф 11, упр. 1(б), 2 (письменно)
По теме: методические разработки, презентации и конспекты

Презентация по химии "Расчеты по химическим уравнениям"; 8 класс
Данная презентация выполнена с применением тригеров и гиперссылок. Может применяться при изучении новой темы и при повторении изученного материала.

Контрольная работа по химии по теме "Металлы" для 9 класса к учебнику О.С.Габриеляна
Контрольная работа содержит 2 варианта заданий.

Разработка урока с презентацией по химии для 10 классов (общеобразовательная школа, Габриелян) по теме: "Кислородосодержащие вещества - спирты"
Данная тема урока рассматривается после завершения курса тем по изучению органических веществ – углеводородов. Урок проводится после контрольной работы по изученному ранее материалу и не содержи.
§ 14. Щелочные металлы
Строение и свойства атомов. Щелочные металлы — это элементы главной подгруппы I группы (IA группы) Периодической системы Д. И. Менделеева: литий Li, натрий Na, калий К, рубидий Rb, цезий Cs и франций Fr. Франций — редкий радиоактивный элемент.

На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются очень сильными восстановителями. Во всех своих соединениях щелочные металлы проявляют степень окисления +1. Восстановительные свойства их усиливаются при переходе от Li к Cs, что связано с увеличением радиусов их атомов.
Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.
Щелочные металлы — простые вещества. Серебристо-белые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности (рис. 48). Все они лёгкие и легкоплавкие, причём, как правило, плотность их возрастает от лития к цезию, а температура плавления, наоборот, уменьшается (рис. 49).
Щелочные металлы активно взаимодействуют почти со всеми неметаллами. Используя общее обозначение для металлов М, запишем в общем виде уравнения реакций щелочных металлов с неметаллами — водородом, хлором и серой:



При взаимодействии с кислородом натрий образует не оксид, а пероксид:

И только литий образует оксид при взаимодействии с кислородом:

Как вы уже знаете, все щелочные металлы активно взаимодействуют с водой, образуя щёлочи и восстанавливая воду до водорода (рис. 50 и 51):

Скорость взаимодействия щелочного металла с водой будет увеличиваться от лития к цезию (почему?).
Соединения щелочных металлов. В свободном виде в природе щелочные металлы не встречаются из-за своей исключительно высокой химической активности. Некоторые их природные соединения, в частности соли натрия и калия, довольно широко распространены, они содержатся во многих минералах, растениях, природных водах.
Рассмотрим основные соединения щелочных металлов на примере соединений натрия и калия — наиболее важных представителей этой группы элементов.
Оксиды М2O — твёрдые вещества. Имеют ярко выраженные основные свойства: взаимодействуют с водой, кислотами и кислотными оксидами (запишите уравнения соответствующих реакций).
Оксиды натрия Na2O и калия К2O получают, прокаливая пероксиды с соответствующими металлами, например:

Гидроксиды МОН — твёрдые белые вещества. Очень гигроскопичны. Хорошо растворяются в воде с выделением большого количества теплоты. Их относят к щелочам, они проявляют ярко выраженные свойства сильных растворимых оснований: взаимодействуют с кислотами, кислотными оксидами, солями, амфотерными оксидами и гидроксидами (запишите уравнения соответствующих реакций в молекулярной и ионной формах). Гидроксиды щелочных металлов образуются при взаимодействии щелочных металлов или их оксидов с водой (запишите уравнения соответствующих реакций).
Гидроксид натрия NaOH в технике известен под названиями едкий натр, каустическая сода, каустик. Техническое название гидроксида калия КОН — едкое кали.
Оба гидроксида — NaOH и КОН — разъедают ткани и бумагу, поэтому их называют также едкими щелочами.
Едкий натр применяют в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон. Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.
Соли щелочных металлов — твёрдые кристаллические вещества ионного строения. Почти все соли натрия и калия растворимы в воде. Наиболее важные их соли — карбонаты, сульфаты и хлориды.
Na2CO3 — карбонат натрия, образует кристаллогидрат Na2CO3 • 10Н2O, известный под названием кристаллическая сода, которую применяют в производстве стекла, бумаги, мыла. Это средняя соль.
Вам в быту более известна кислая соль — гидрокарбонат натрия NaHCO3 (пищевая сода), которую применяют в пищевой промышленности, в медицине.
К2СO3 — карбонат калия, техническое название — поташ, используют в производстве жидкого мыла и для приготовления тугоплавкого стекла, а также в качестве удобрения.
Na2SO4 • 10H2O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяют для производства соды и стекла и в качестве слабительного средства.
NaCl — хлорид натрия, или поваренная соль, хорошо известен вам из курса 9 класса. Хлорид натрия является важнейшим сырьём в химической промышленности, широко применяется в быту (рис. 52).
Ионы натрия и калия очень важны для живых организмов: Na + — главный внеклеточный ион, содержится в крови и лимфе, а К + — основной внутриклеточный ион. Они выполняют разные функции в организме, но предпочитают «работать» вместе. Соотношение концентраций этих ионов регулирует давление крови в живом организме; обеспечивает перемещение растворов солей из корней в листья растений.
Калий поддерживает работу сердечной мышцы, поэтому нехватка калия в организме отрицательно сказывается на здоровье человека. Калий необходим растениям, при его недостатке снижается интенсивность фотосинтеза.

Взрослый человек должен в сутки потреблять с пищей 3,5 г калия. С помощью соединений калия можно устранять отёки. В этом случае нужно увеличить потребление калия до 5 г в сутки.
Больше всего калия содержат курага, соя, фасоль, зелёный горошек, чернослив, изюм и некоторые другие продукты (рис. 53).
Соли калия широко используют в сельском хозяйстве в качестве калийных удобрений.

Соли натрия, как и сам натрий, окрашивают пламя в жёлтый цвет, а калий и его соли — в розово-фиолетовый. Проведём лабораторный опыт.

Открытие щелочных металлов. Литий был открыт шведским химиком А. Арфведсоном в 1817 г. и по предложению Й. Берцелиуса назван литием (от греч. литое — камень), так как, в отличие от калия, который до тех пор находили только в золе растений, он был обнаружен в камне.
Натрий и калий были впервые получены английским химиком и физиком Г. Дэви в 1807 г. при электролизе едких щелочей. Й. Берцелиус предложил назвать элемент № 11 натрием (от араб, натрун — сода), а элемент № 19 по предложению У. Гилберта получил название «калий» (от араб, алкали — щёлочь).

1. Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.

1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:

2. Вычислите объём водорода (н. у.), который может быть получен при растворении в воде 11,5 г натрия, содержащего 2% примесей, если выход водорода составляет 95% от теоретически возможного.
3. Прочитайте сочинение, написанное ученицей 9 класса 531-й школы Москвы Наташей Фроловой (1991).

В большом семиэтажном доме, в подъезде щелочных металлов, на втором этаже жил Литий — самый лёгкий и беззаботный металл. Он, как и все щелочные металлы, очень активно взаимодействовал с кислородом, неметаллами, водородом и водой. Как и все, защищался от кислорода, но носил не керосиновую, а вазелиновую «шубу», так как был очень лёгким и всплывал в керосине.
Но всё же Литий не был во всех отношениях похожим на своих собратьев: он был добр, щедр и прост. Он с охотой отдавал свои электроны и кислороду, и азоту, и многим другим элементам. Из-за этих-то особенностей Литий страдал, так как другие щелочные металлы, особенно такие хитрые, как Калий и Натрий, не давали ему прохода. Дело было в том, что, когда щелочные металлы горели в кислороде, каждые их два атома отдавали одной молекуле Кислорода два своих электрона — каждому атому по одному. Остальные электроны они припрятывали до поры до времени. Литий же был честен — отдавал молекуле Кислорода в два раза больше электронов, чем остальные металлы: на четыре атома Лития — четыре электрона. Да и с Азотом Литий взаимодействовал спокойно, при обычной температуре, не то что другие — при нагревании.
И решили Натрий и Калий допытаться у Лития: почему он так поступает? Нет ли в его поведении каких-либо скрытых выгод?
Спрашивает Натрий: «Почему ты, брат Литий, все свои электроны Кислороду отдаёшь? Не лучше ли делать так, как мы?» Отвечал Литий: «Я всегда рад помочь другим, не то что вы — жадничаете. Я рад, что в моём оксиде Кислород имеет свою обычную степень окисления —2, не то что -1 в ваших странных, ни на что не похожих пероксидах». Сказал так и ушёл восвояси. Долго стояли Натрий и Калий в раздумье, но так ничего и не поняли. И сейчас с Кислородом продолжают пероксиды образовывать. А оксиды состава М2O дают лишь тогда, когда их силой заставят, т. е. создадут соответствующие условия — нагреют пероксид (Na2O2) с таким же металлом-«жадиной» (Na)».
Какие химические понятия использовала в художественной форме Наташа?
4. Напишите сочинение о щелочных металлах, положив в основу сюжета превращения этих металлов или какой- либо один химический процесс.
5. В 100 г кураги содержится 2,034 г калия. Сколько граммов кураги нужно съесть, чтобы получить суточную норму калия?
Щелочные металлы 9 класс

Презентация к уроку химии в 9 классе для учащихся, которые занимаются по программа Олега Сергеевича Габриеляна. Презентация насыщена красочными слайдами, содержит материалы из истории открытия, строении атома, физические и химические свойства. Является очень важным компонентом урока химии, обеспечивая наглядность
Просмотр содержимого документа
«Щелочные металлы 9 класс »

ТЕМА УРОКА : «Щелочные металлы»
Учитель биологии и химии Соколов А.М.
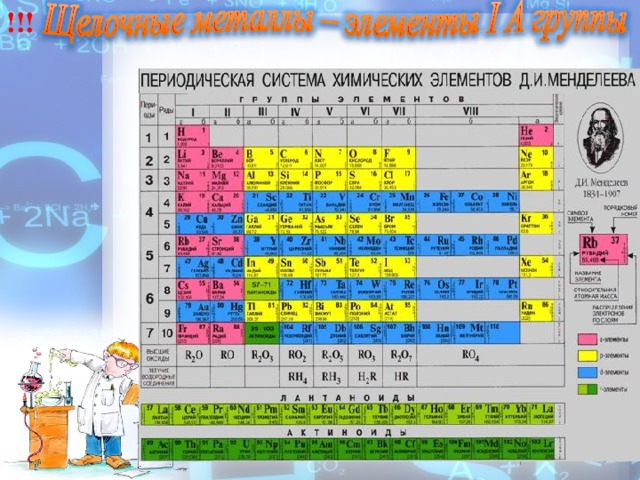
Как изменяются свойства элементов в главных подгруппах сверху вниз?
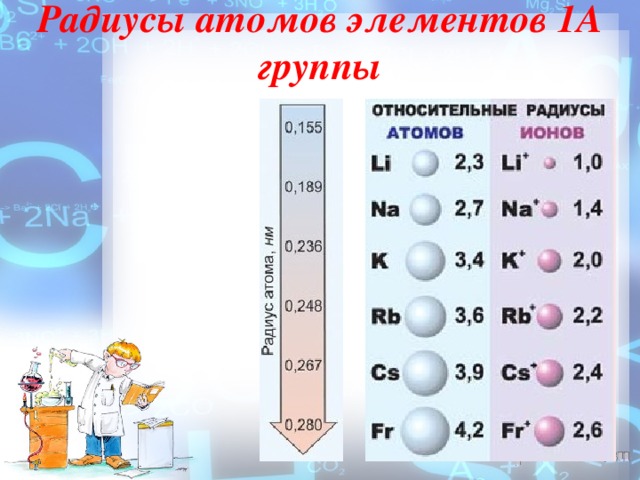
Радиусы атомов элементов 1А группы


А) заряд ядра
Li * Rb ; Na * Al
Б) число электронных слоев
В) число электронов на внешнем уровне
Г) радиус атома
Д) восстановительные свойства
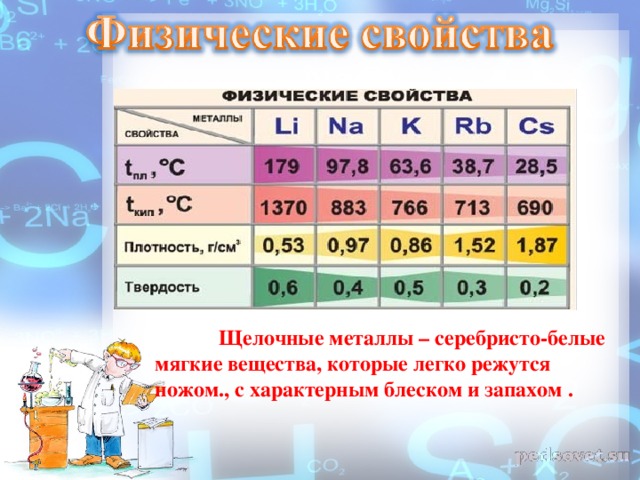
Щелочные металлы – серебристо-белые мягкие вещества, которые легко режутся ножом., с характерным блеском и запахом .
Домашнее задание
П.11 (страница 52-54), записи в тетради учить. Стр. 58 №1(а), №2.
Читайте также:
