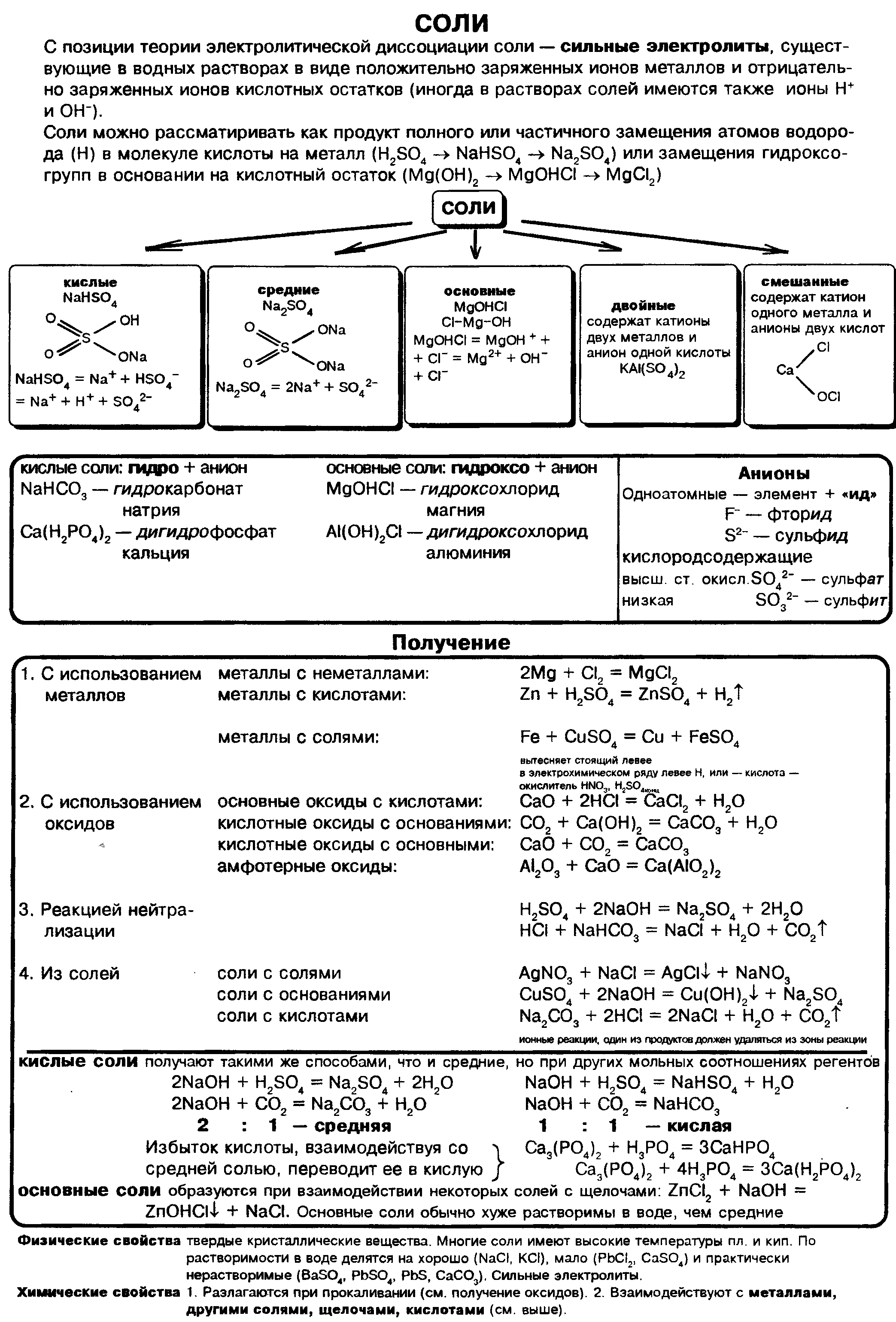
Сложные вещества состоящие из атомов металлов и кислотных остатков
Обновлено: 19.09.2024
`"KNO"_2` - нитрит калия
`"KClO"_4` - перхлорат калия
Способы получения средних солей
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Большинство способов получения солей было разобрано выше.
Способы получения кислых и основных солей
Кислые соли могут быть получены либо неполной нейтрализацией кислот, либо действием избытка кислот на средние соли, щелочи, оксиды или соли:
`"NaOH" + "H"_2"SO"_4 -> "NaHSO"_4 + "H"_2"O"`;
`"Na"_2"SO"_4 + "H"_2"SO"_4 -> 2"NaHSO"_4`;
`"NaCl" + "H"_2"SO"_4 -> "NaHSO"_4 + "HCl"`;
`"CaCO"_3 + "CO"_2 + "H"_2"O" -> "Ca(HCO"_3)_2`.
Основные соли часто получаются при осторожном добавлении небольших количеств щелочей к растворам средних солей металлов, имеющих малорастворимые основания, или при действии солей слабых кислот на средние соли:
`"AlCl"_3 + 2"NaOH" -> "Al(OH)"_2"Cl" + 2"NaCl"`;
В общем виде способы получения кислых или основных солей из средних солей представим в виде следующей схемы:
Химические свойства солей
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются (также см. получение оксидов).
Взаимодействие растворов или расплавов солей менее активных металлов с более активными металлами:
`"Cu" + 2"AgNO"_3 -> 2"Ag"darr + "Cu(NO"_3)_2`.
Взаимодействие соли с кислотой, в результате которого образуется нерастворимое или летучее вещество:
`"AgNO"_3 + "HBr" → "AgBr"↓ + "HNO"_3`;
`"FeS" + 2"HCl" → "H"_2"S"↑ + "FeCl"_2`.
Взаимодействие раствора соли со щелочью, в результате которого образуется нерастворимое вещество:
`"CuCl"_2 + "KOH" → "Cu(OH)"_2 ↓+ 2"KCl"`;
`"Na"_2"CO"_3 + "Ca(OH)"_2 → "CaCO"_3↓ + 2"NaOH"`.
Взаимодействие растворов солей друг с другом, в результате которого образуется нерастворимое вещество:
`"Na"_2"CO"_3 + "Ba(NO"_3)_2 → "BaCO"_3 ↓+ 2"NaNO"_3`.
`2"FeCl"_2 + "Cl"_2 → 2"FeCl"_3`;
`2"NaNO"_2 + "O"_2 → 2"NaNO"_3`;
`"Na"_2"SO"_3 + "H"_2"O" + "Cl"_2 → "Na"_2"SO"_4 + 2"HCl"`.
Гидролиз некоторых солей:
При нагревании многие кислые соли разлагаются:
называется связь между веществами разных классов соединений, основанная на их взаимных превращениях и отражающая единство их происхождения.
Генетическая связь может быть отражена в генетических рядах.
Генетический ряд состоит из веществ, которые образованы одним химическим элементом, принадлежат к разным классам соединений и связаны взаимными превращениями.
В приведённой ниже таблице обобщены рассмотренные выше химические свойства важнейших классов неорганических соединений.
Урок 25. Соли
В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.

Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).

Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.

Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
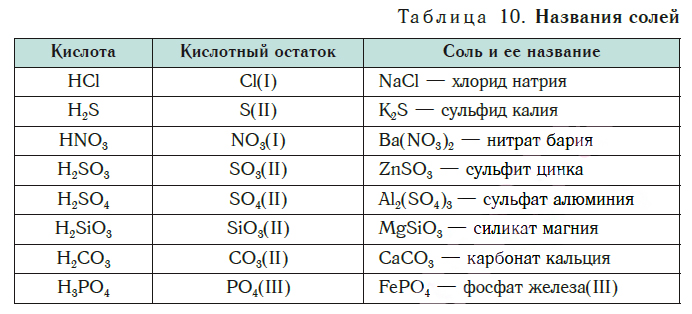
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
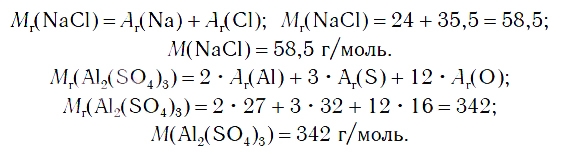
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Урок 29. Понятие об основаниях
В уроке 29 «Понятие об основаниях» из курса «Химия для чайников» познакомимся с новым классом химических веществ — основаниями, а также узнаем о новом типе химических реакций — реакциях обмена.

Как вы уже знаете, при взаимодействии активных металлов и их оксидов с водой образуются основания — соединения, не принадлежащие ни к одному из известных вам до сих пор классов: оксидов, солей или кислот.
Основания как сложные вещества
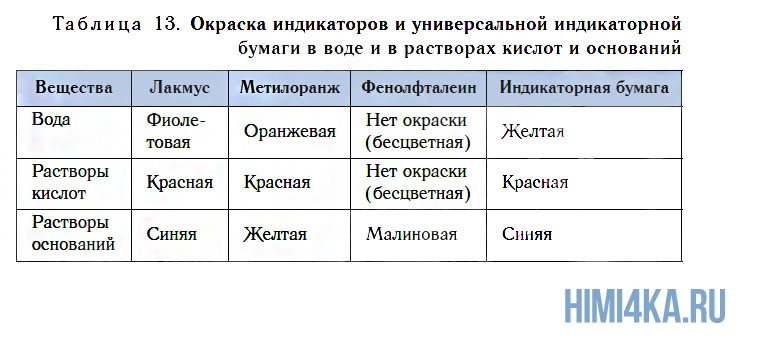
Испытаем с помощью индикатора раствор, полученный в результате реакции оксида кальция CaO с водой. Для этого прибавим к нему 1—2 капли раствора метилового оранжевого. Окраска раствора изменится с оранжевой на желтую (рис. 111).

Это свидетельствует о том, что в полученном растворе присутствует не кислота, а какое-то новое вещество, изменяющее цвет индикатора. Подобно оксиду кальция, с водой реагируют и некоторые другие оксиды, например оксид натрия Na2O:
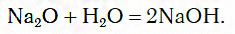
В результате взаимодействия оксидов кальция и натрия с водой образуются вещества Са(ОН)2 и NaОН. Они похожи тем, что в их состав входят атомы металлов и группы ОН, называющиеся гидроксогруппами (от греческого слова «hydor», которое означает «вода»). Такие вещества относятся к классу оснований.
Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
Валентность гидроксогруппы равна единице. Зная это, легко составить формулу любого основания: число групп ОН в формуле основания всегда равно валентности атома металла, например:
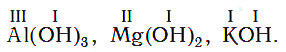
В то же время по формуле основания можно легко определить валентность атомов содержащегося в нем металла — она равна числу гидроксогрупп в формуле данного основания. Например, в формуле основания Fe(OH)2 две гидроксогруппы, следовательно, валентность атома железа в этом веществе равна II, а в основании Cr(OH)3 валентность атомов хрома равна III.
Как же называются основания? Известно, что продукты соединения воды с веществами называются гидратами. Если с водой соединяются оксиды металлов, то образуются гидраты оксидов металлов, или сокращенно гидроксиды металлов. Поэтому вещества Ca(OH)2 и NaOH, образующиеся при взаимодействии оксидов кальция и натрия с водой, называются «гидроксид кальция» и «гидроксид натрия».
По растворимости в воде основания делятся на растворимые и нерастворимые. Растворимые в воде основания называют щелочами. К их числу относятся KOH, NaOH, Ca(OH)2, Ba(OH)2 и некоторые другие.
Обнаружить присутствие растворимых в воде оснований (щелочей) можно по изменению окраски индикаторов. Кроме известных вам лакмуса и метилоранжа, для этих целей можно использовать еще один индикатор — фенолфталеин. Он не имеет окраски в воде и в растворе кислоты, но в присутствии щелочей этот индикатор окрашивается в малиновый цвет (см. рис. 111, табл. 13).
Реакция нейтрализации
Как было показано, растворимые в воде основания — щёлочи — легко обнаружить с помощью индикаторов. Однако если к раствору гидроксида натрия NaOH прибавить фенолфталеин, а затем хлороводородную кислоту, то появившаяся вначале малиновая окраска после добавления кислоты исчезает (рис. 112).

Это свидетельствует о том, что кислота как бы уничтожила, или нейтрализовала, основание. Реакцию между кислотой и основанием, протекающую в этом случае, называют реакцией нейтрализации:
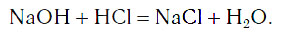
Реакция нейтрализации — это реакция между основанием и кислотой, в результате которой образуются соль и вода.
Реакция нейтрализации не относится ни к одному из известных вам до сих пор типов реакций (разложения, соединения, замещения). Это реакция нового типа — реакция обмена.
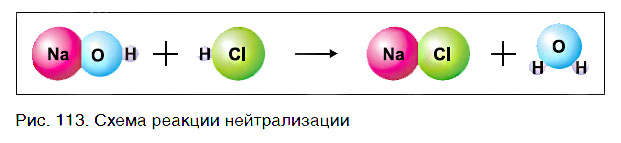
Реакциями обмена называются реакции между сложными веществами, в ходе которых они обмениваются своими составными частями.
Основание состоит из атомов металла и гидроксогрупп, а кислота — из атомов водорода и кислотного остатка. В результате реакции исходные вещества обменялись своими составными частями (рис. 113):
Краткие выводы урока:
- Основания — сложные вещества, состоящие из атомов металлов и гидроксогрупп.
- Реакция между основанием и кислотой, в ходе которой образуются соль и вода, называется реакцией нейтрализации.
- Реакция обмена — реакция между сложными веществами, в результате которой они обмениваются своими составными частями.
Надеюсь урок 29 «Понятие об основаниях» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Сложные вещества состоящие из атомов металлов и кислотных остатков
Генетические ряды металла и неметалла завершает класс солей:
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков. Сoли — это вещества немолекулярного строения. Химическая связь между катионами металлов и анионами кислотных остатков в солях ионная. Формулы солей составляют таким образом, чтобы суммарный заряд ионов металлов и соединенных с ними кислотных остатков был одинаков по величине и противоположен по знаку.
Соли — многочисленный класс соединений. Насколько это понятие применимо для органических соединений?
Лабораторный эксперимент.
Соберите прибор для получения газов и проверьте его герметичность. В пробирку налейте 3—4 мл соляной кислоты и опустите в неё 2—3 небольших кусочка мрамора. Закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в другую пробирку объёмом 20 мл с 5—6 мл известковой воды. Пропускайте через известковую воду полученный оксид углерода(IV). Что наблюдаете? Продолжайте пропускать углекислый газ до растворения осадка.
Полученную жёсткую воду разлейте в три пробирки.
К содержимому первой пробирки добавьте немного раствора мыла, закройте её пробкой и сильно встряхните. Что наблюдаете?
Вторую пробирку закрепите в пробиркодержателе и нагрейте до кипения. Прекратите нагревание и рассмотрите содержимое.
В третью пробирку добавьте раствор стиральной соды. Что наблюдаете?
При выполнении этого эксперимента были исследованы свойства солей двух типов: средних и кислых.
К первым относятся карбонат кальция СаСO3 (он составляет химическую основу мрамора), хлорид кальция СаСl2, карбонат натрия Na2CO3 (или стиральная сода) и стеарат натрия С17Н35СОONa (мыло).
Напомним, что мыла — это натриевые и калиевые соли жирных кислот: RCOONa — твёрдое мыло, RCOOK — жидкое мыло.
В эксперименте вы также использовали кислые соли — гидрокарбонат кальция Са(НСO3)2 и гидрокарбонат натрия NaHCO3. Запишем уравнения проделанных реакций.
1) Получение углекислого газа:
СаСO3 + 2НСl = СаСl2 + СO2↑ + Н2O
2) Взаимодействие углекислого газа с известковой водой с образованием нерастворимого карбоната кальция:
СO2 + Са(ОН)2 = СаСO3↓ + Н2O
3) Превращение нерастворимого карбоната в растворимый гидрокарбонат:
СаСO3 + СO2 + Н2O = Са(НСO3)2
4) Диссоциация растворимого гидрокарбоната кальция, обусловливающего жёсткость воды:
Са(НСO3)2 = Са 2+ + 2НСО3 –
Жёсткость воды и способы её устранения.
Вода называется жёсткой, если содержит катионы кальция, магния и железа. В жёсткой воде хуже мылится мыло, увеличивается расход стирального порошка, образуется накипь в системах отопления и горячего водоснабжения и т. д.
Различают временную (устраняется кипячением) и постоянную (устраняется добавкой соды и другими способами) жёсткость воды.
Эксперимент показал различия в свойствах средних и кислых солей: карбонат кальция нерастворим, а гидрокарбонат — растворим. Переход гидрокарбоната кальция в карбонат наблюдается и в природе: рост сталактитов и сталагмитов в пещерах.
В повседневной жизни различия свойств кислых и средних солей мы наблюдаем при использовании стиральной, или технической, соды Na2CO3 (умягчает воду; применяется при стирке белья) и питьевой, или пищевой, соды NaHCO3 (применяется в хлебопечении, изготовлении шипучих напитков, для устранения изжоги).
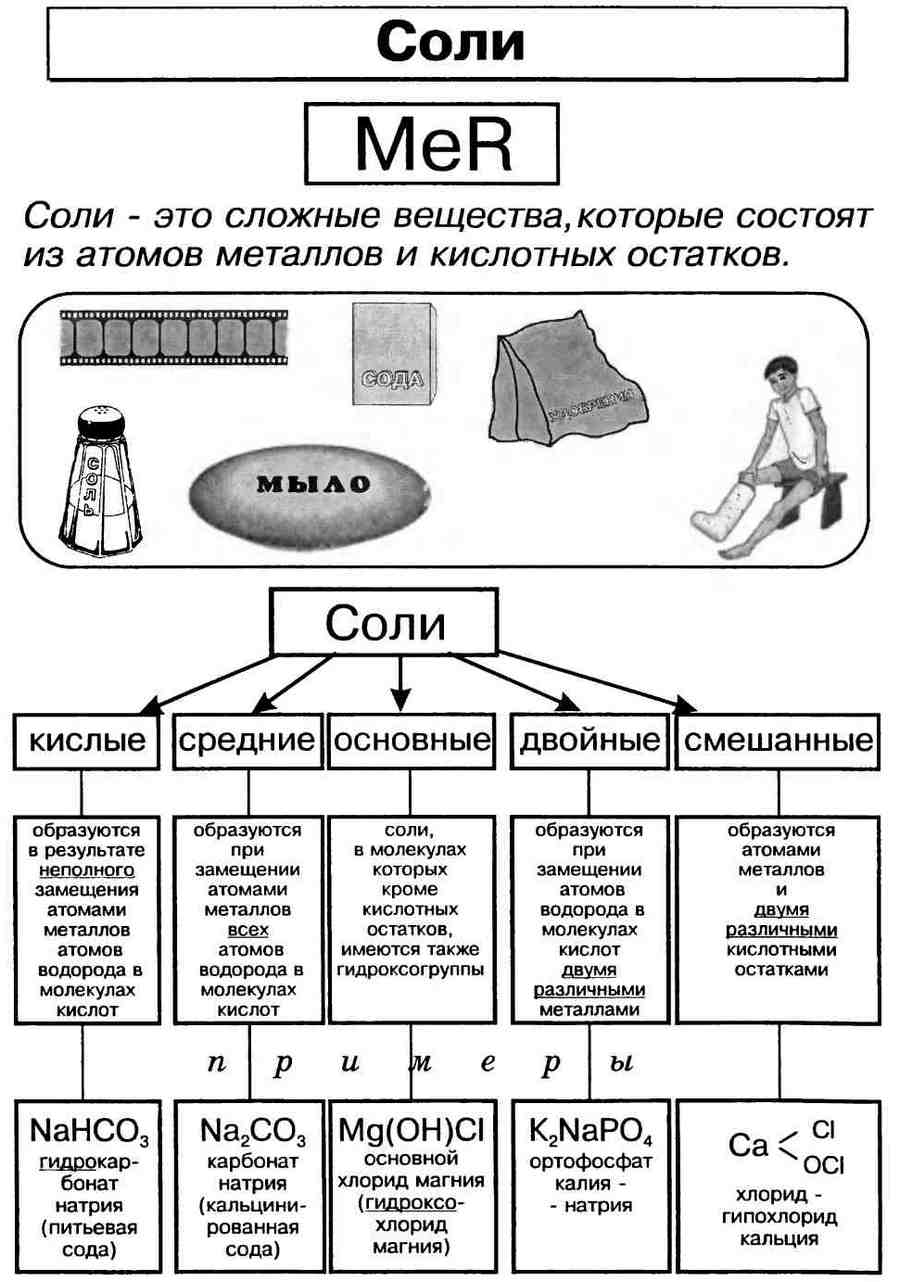
Классификация солей.
Соли могут быть средними (нормальными), основными, кислыми, двойными и смешанными.
Средняя , или нормальная, соль образуется в результате полного замещения катионов водорода в кислоте на катионы металла.
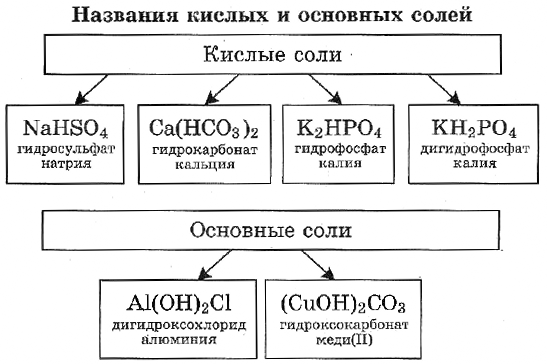
Кислая соль образуется в результате неполного замещения катионов водорода в кислоте на катионы металла.
Однако если в основании, содержащем две или более гидроксогруппы, заменить одну группу на кислотный остаток, получается соль. Такую соль относят к основным солям. Например, гидроксохлорид магния MgOHCl, гидроксобромид цинка ZnOHBr.
Основная соль образуется в результате неполного замещения анионов гидроксогруппы в основании на анионы кислотного остатка.
Самая известная основная соль — гидроксокарбонат меди(II) (СuOН)2СO3, или малахит.
Кислотные остатки солей образуют и амфотерные гидроксиды. Наиболее известная соль такого типа — знаменитая благородная шпинель, венчающая корону Российской империи. Химическую основу этого минерала составляет алюминат магния Mg(AlO2)2, или MgAl2O4.
Несолеобразующие или безразличные оксиды (не образуют солей) — СО, NO, N2O.
Названия солей.
Названия солей складываются из двух слов: латинского названия кислотного остатка и русского названия металла в родительном падеже. Формулы читают справа налево.
Название бинарной соли содержит суффикс «-ид»: ZnS — сульфид цинка, ВаСl2 — хлорид бария.
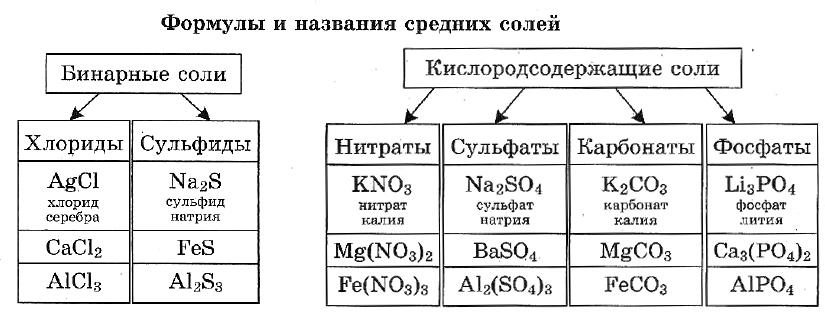
Названия кислородсодержащих солей чаще всего имеют в первом слове суффикс «-ат»: Mn(NO3)2 — нитрат марганца(II), Cr2(SO4)3 — сульфат хрома(III), K2SiO3 — силикат калия.
Названия солей с центральным атомом в промежуточной степени окисления — S +4 , N +3 — содержат суффикс «-ит»: Na2SO3 — сульфит натрия, KNO2 — нитрит калия. Это соли сернистой и азотистой кислот.
Некоторые соли имеют свои традиционные (тривиальные) названия. Так, ряд солей серной кислоты называют купоросами: FeSO4 • 7Н2O — железный купорос, CuSO4 • 5Н2O — медный купорос, ZnSO4 • 7Н2O — цинковый купорос. Общее название нитратов натрия, калия, аммония, кальция и бария — селитры: NaNO3 — натриевая селитра, NH4NO3 — аммонийная селитра. Кроме того, К2СO3 — поташ, AgNO3 — ляпис, РЬСгO4 — желтый крон, Na2SO4 • 10Н2О — глауберова соль, NaCl — поваренная соль, Na2CO3 • 10Н2O — сода кристаллическая, CaSO4 • 2Н2O — гипс.
Общие химические свойства солей
- Соли взаимодействуют с кислотами при соблюдении некоторых условий.
- Соли взаимодействуют со щелочами при соблюдении некоторых условий.
- Растворы солей взаимодействуют с металлами (вспомните электрохимический ряд напряжений металлов и сформулируйте условия протекания таких реакций).
- Соли взаимодействуют с другими солями в растворах при соблюдении ряда условий.
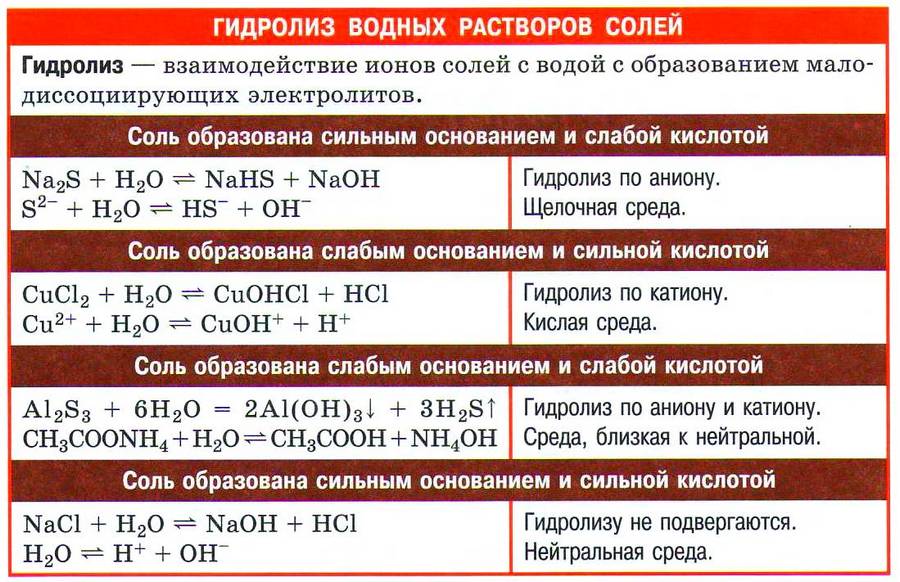
- Соли подвергаются гидролизу (вспомните случаи гидролиза солей).
Всё о соли кратко в одной таблице
Конспект урока по химии «Соли». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Читайте также:
