Соединения бора с металлами
Обновлено: 05.10.2024
Элемент этот принадлежит к числу довольно распространенных: содержание его в земной коре составляет около 5·10 –4 % – Скопления бора встречаются в виде кислородных соединений – борной кислоты (H3 BO3 ), буры (Na2 B4 O7 ·10Н2 О), ашарита (MgHBO3 ) и ряда более сложных минералов. Ежегодная мировая добыча соединений бора достигает 300 тыс. т. Важнейшими из них являются бура и борная кислота.
1) Борная кислота используется при эмалировании железных сосудов (вводится в состав эмалей) и в медицине (дезинфицирующие полоскания и т. д.), а также служит обычным исходным продуктом для получения остальных соединений бор"а. Бура применяется в ряде отраслей промышленности – стекольной, керамической, кожевенной и др. – из медицине.
В свободном состоянии бор может быть получен из борной кислоты. Нагреванием ее переводят в борный ангидрид (В2 О3 ), который затем накаливают с металлическим магнием:
После обработки продуктов реакции соляной кислотой (для удаления MgO) остается элементарный бор В чистом состоянии он имеет черный цвет, плотность 2,3, плавится при 2075°С и кипит при 3960°С.
В обычных условиях бор весьма инертен. Напротив, при высоких температурах он соединяется не только с кислородом, хлором и бромом, но также с серой и азотом. При очень сильном накаливании бор вытесняет свободные элементы даже из таких устойчивых окислов, как Р2 О5 , СО2 и SiO2 , а также из окислов многих металлов. При сплавлении бора с некоторыми из последних образуются бориды этих металлов, например борид магния – Mg3 B2 .
По отношению к воздуху и воде бор вполне устойчив. В обычных кислотах он не растворяется, но горячая концентрированная HNO3 постепенно окисляет его до борной кислоты:
Во всех устойчивых соединениях бор трехвалентен.
Наиболее характерны для бора кислородные соединения. При нагревании на воздухе до 700°С он сгорает по уравнению:
Образующийся борный ангидрид представляет собой бесцветную, довольно тугоплавкую стекловидную массу.
На воздухе В2 О3 притягивает влагу, а в воде растворяется с образованием борной кислоты.
Борная (точнее – ортоборная) кислота представляет собой бесцветные кристаллы. При нагревании она теряет воду и переходит сначала в метаборную кислоту (НВО2 ), затем в тетраборную (Н2 В4 О7 ) и, наконец, в борный ангидрид. Растворение этих веществ в воде сопровождается их переходом в Н3 ВО3 .
Диссоциация гидрата В(ОН)3 в растворе идет по кислотному типу. Однако борная кислота очень слаба и поэтому из растворов своих солей легко выделяется большинством других кислот. Соли ее (борнокислые, или бораты) производятся обычно от различных полиборных кислот общей формулы xВ2 О3 ·yН2 О, чаще всего – тетраборной (х = 2, y = 1). Последняя является кислотой значительно более сильной, чем ортоборная.
Избытком щелочи они могут быть переведены в метабораты: 2NaOH + Na2 B4 O7 = 4NaBO2 + Н2 О
С другой стороны, при действии на тетрабораты (или метабораты) сильных кислот выделяется свободная ортоборная кислота:
В воде из боратов растворимы только соли наиболее активных одновалентных металлов. Вследствие гидролиза растворы их показывают сильнощелочную реакцию. Важнейшим для практики боратом является бура.
Так как безводные бораты чрезвычайно устойчивы по отношению к нагреванию, при высоких температурах борная кислота выделяет большинство других кислот из их солей. В этом отношении (как и по своей слабости) она похожа на кремневую кислоту.
2) Борная кислота (K1 = 6·10 –10 , K2 = 2·10 – 13 , K3 = 2·10 –14 ) окрашивает пламя в зеленый цвет и несколько летуча с водяным паром, Тетраборной кислоте (K1 = 2·10 –4 , K2 = 2·10 –5 ) может быть придана структурная формула:
Из солей различных полиборных кислот многие встречаются в природе и служат исходными продуктами для получения соединений бора.
3) Сульфид бора (B2 S3 ) образуется в виде бесцветной стекловидной массы при накаливании бора в парах серы. Водой он полностью разлагается на борную кислоту и H2 S. С азотом бор соединяется только выше 1200 °С. Нитрид бора (BN) представляет собой белый порошок, плавящийся лишь около 3000 °С (под давлением). По кристаллической структуре BN сходен с графитом.
Карбид бора (В4 С) образуется в виде черных блестящих кристаллов принакаливании смеси бора (или В2 О3 ) с углем в электрической печи. Он отличается тугоплавкостью (т. пл. 2550 °С) и чрезвычайной твердостью (близкой к твердости алмаза). И нитрид и карбид бора характеризуются большой устойчивостью по отношению к различным химическим воздействиям.
Галоидные соединения бора общей формулы ВГ3 могут быть получены путем взаимодействия элементов при нагревании. Они представляют собой бесцветные вещества. При обычных условиях BF3 газообразен, ВСl3 кипит при + 18°С, ВВr3 – жидкость и BJ3 –твердое тело. В водном растворе все они подвергаются гидролизу по схеме:
Для галогенидов бора весьма характерны реакции присоединения к ним молекул различных других веществ. В частности, фтористый бор образует продукт присоединения с HF:
Комплексная борофтористоводородная кислота (HBF4 ) устойчива только в растворе, причем ее кислотные свойства выражены значительно сильнее, чем у HF. Большинство солей HBF4 (фтороборатов) бесцветно и легкорастворимо в воде. Как и в случае кремния, аналогичные производные с другими галоидами не образуются.
4) Строение молекул галогенидов ВГ3 отвечает плоскому треугольнику с атомом В в центре. Некоторые их свойства сопоставлены ниже:
При образовании галогенидами бора комплексов с другими веществами атом В выступает в качестве акцептора (IX § 2 доп. 1). Поэтому присоединяться к молекулам ВГ3 способны только молекулы, содержащие атом с достаточно отчетливо выраженной до норной функцией.
По ряду F–Сl–Br–J склонность молекул ВГз к комплексообразованию довольно быстро уменьшается. Фтористый бор является хорошим катализатором различных органических реакций. Вследствие образования HBF4 гидролиз BF3 идет несколько иначе, чем в случае остальных галогенидов бора, а именно по суммарной схеме: 4BF3 + 3H2 O = 3HBF4 + B(OH)3 .
С водородом бор не соединяется, однако при действии кислот на Mg3 B2 одновременно со свободным Н2 выделяются небольшие количества смеси различных бороводородов (иначе, боранов), среди которых преобладает В4 Н10 . Последний легко распадается на В2 Н6 и ряд других боранов, более бедных водородом.
Бораны бесцветны и по физическим свойствам очень похожи на углеводороды и силаны аналогичного состава, как это видно из приводимого ниже сопоставления:
По химическим свойствам они похожи на силаны. Так же как и последние (и даже в еще большей степени), бораны при обычных условиях неустойчивы. В частности, водой они постепенно разлагаются с выделением водорода по реакции, например
а получаемая при разложении Mg3 B2 кислотами газовая смесь на воздухе самовоспламеняется. Горение боранов сопровождается выделением огромного количества тепла (484 ккал/моль В2 Н6 ), что создает возможность их использования в качестве очень эффективного ракетного топлива.
5) Так как бор трехвалентен, его водородными соединениями должны были бы быть такие молекулы, как ВН3 , В2 Н4 , В3 Н5 и т. д. Между тем бораны подобного состава неизвестны.
Молекулы летучих бороводородов следует, по–видимому, рассматривать как результат сочетания друг с другом приведенных выше валентнонасыщенных структур при посредстве особого рода водородных связей. Так, строение В2 Н6 и В4 Н10 выражается с этой точки зрения следующими схемами:
Лучше других изучены шесть бороводородов, температуры плавления и кипения которых приводятся ниже:
БОРИДЫ
соед. бора с металлами. Известны для большинства элементов подгрупп Ia-IIа и IIIб-VIIIб, а также А1; для нек-рых элементов подгрупп Iб-IIб известны бинарные системы с высоким содержанием В (напр., СuВ 22, ZnB22), к-рые относят не к хим. соединениям, а к твердым р-рам. Один металл может образовывать неск. Б. разного состава. Различают богатые металлом низшие Б. (М 3 В, М 2 В, М 3 В 2, MB, M3B4) и богатые бором высшие Б. (МВ 2, МВ 4, МВ 6, МВ 12 и др.).
Названия Б. включают название металла с приставкой, указывающей число атомов металла в ф-ле, и слово "борид" с обозначением числа атомов В, напр. W2 В 5 -пентаборид дивольфрама.

СВОЙСТВА БОРИДОВ МЕТАЛЛОВ
Взаимод. между атомами металла и бора в Б. относительно слабое, поэтому их структуру рассматривают как две слабо связанные подрешетки. Структура низших Б. определяется металлич. подрешеткой, высших - борной. В соединениях типа М 4 В и М 2 В атомы В изолированы друг от друга, в соединениях типа MB они образуют одинарные зигзагообразные цепи, в М 3 В 4 - сдвоенные цепи. По мере увеличения содержания В структура Б. существенно усложняется. Так, в МВ 2 атомы В образуют плоские сетки, в МВ 4 - гофрированные сетки и каркасы в виде окгаэдрич. группировок, в МВ 6 - октаэдры, в МВ 12 - кубооктаэдры и икосаэдры, в МВ 66 - цепи икосаэдров. Гексаген, кристаллич. решетка характерна для МВ 2 и МВ 4, тетрагональная-для МВ 2, MB и МВ 4, кубическая - для М 2 В, MB, MB6, МВ 12, МВ 66, ромбическая-для М 4 В, MB, M3B4, М 4 В, МВ 12.
В молекулах Б. борные группировки, в к-рых связь ВЧВ ковалентная, электронодефицитны; для их стабилизации необходимо привлечение электронов от атома металла. В результате между металлом и бором осуществляются связи промежут. типа: у Б. элементов III-VIII групп, отдающих более двух электронов, они частично металлические, в остальных случаях - частично ионные. С возрастанием содержания бора в пределах бинарной системы растет доля ковалентных связей ВЧВ и уменьшается взаимод. металл - бор, в результате чего повышаются твердость, т-ра плавления, теплопроводность и электрич. проводимость и уменьшается температурный коэф. линейного расширения. Одновременно возрастает хим. стойкость. Напр., при изменении состава от Nb3B2 до NbB2 т-ра плавления увеличивается от 1860 до 3035
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое "БОРИДЫ" в других словарях:
Бориды — Бориды соединения бора с металлами, образуются при высоких температурах. Бориды характеризуются повышенной твердостью, износоустойчивостью и коррозионной стойкостью … Википедия
бориды — Соединения бора с металлами — большинством элементов подгрупп 1а—На, Ilia—VIHb. Для некоторых элементов подгрупп Ib и lib известны бинарные системы с выс. содержанием бора (напр., CuB22, ZnB22), к рые относятся не к хим.… … Справочник технического переводчика
БОРИДЫ — химические соединения бора с металлами. Кристаллы, очень твердые, тугоплавкие, жаростойкие. Компоненты твердых и жаропрочных сплавов, огнеупорных материалов, износостойких покрытий, катоды электронных приборов … Большой Энциклопедический словарь
БОРИДЫ — БОРИДЫ, ряд химических соединений, образованных реакцией между металлами и неметаллическим элементом БОРОМ. Получают при взаимодействии исходных компонентов при очень высокой температуре. Все они отличаются высокой твердостью и используются как… … Научно-технический энциклопедический словарь
Бориды — [borides] соединения бора с металлами большинством элементов подгрупп Ia IIa, IIIa VIIIb. Для некоторых элементов подгрупп Ib и IIb известны бинарные системы с высоким содержанием бора (например, CuB22, ZnB22), которые относятся не к химическим… … Энциклопедический словарь по металлургии
бориды — химические соединения бора с металлами. Кристаллы, очень твёрдые, тугоплавкие, жаростойкие. Компоненты твёрдых и жаропрочных сплавов, огнеупорных материалов, износостойких покрытий, катоды электронных приборов. * * * БОРИДЫ БОРИДЫ, химические… … Энциклопедический словарь
Бориды рения — Бориды рения неорганические соединения металла рения и бора. Получение Спеканием бора и рения при температурах выше 1750°С получают бориды состава Re3B, Re7B3, ReB2, ReB3. Реакция хлорида рения(III) и диборида магния. Физические свойства… … Википедия
Бориды кобальта — Бориды кобальта бинарные неорганические соединения металла кобальта и бора, серые кристаллы. Свойства боридов кобальта Состав Мол. масса Плотность Тпл. Свойства Получение Co3B 187,61 1180 ферромагнитные ромбические кристаллы Co2B 128,68 7,6 … Википедия
Бориды — соединения бора с металлами. Б. обладают физическими свойствами, характерными для веществ как металлического типа (возрастание коэффициента электрического сопротивления с повышением температуры, высокие значения электропроводности и… … Большая советская энциклопедия
БОРИДЫ — соединения бора с металлами. Наиболее употребимы днбориды и гексабориды. Применяются в качестве компонентов твёрдых и жаропрочных сплавов, высокотемпературных и огнеупорных материалов, высокоизносостойких покрытий и наплавок на деталях,… … Большой энциклопедический политехнический словарь
Бориды — соединения бора с металлами, образуются при высоких температурах. Бориды характеризуются повышенной твердостью, износоустойчивостью и коррозионной стойкостью.
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Дополнить статью (статья слишком короткая либо содержит лишь словарное определение).
Wikimedia Foundation . 2010 .
БОРИДЫ — соед. бора с металлами. Известны для большинства элементов подгрупп Ia IIа и IIIб VIIIб, а также А1; для нек рых элементов подгрупп Iб IIб известны бинарные системы с высоким содержанием В (напр., СuВ 22, ZnB22), к рые относят не к хим.… … Химическая энциклопедия
БОРИДЫ
БОРИДЫ, соед. бора с металлами. Известны для большинства элементов подгрупп Ia-IIа и IIIб-VIIIб, а также А1; для нек-рых элементов подгрупп Iб-IIб известны бинарные системы с высоким содержанием В (напр., СuВ22, ZnB22), к-рые относят не к хим. соединениям, а к твердым р-рам. Один металл может образовывать неск. боридов разного состава. Различают богатые металлом низшие бориды (М3В, М2В, М3В2, MB, M3B4) и богатые бором высшие бориды (МВ2, МВ4, МВ6, МВ12 и др.).
Названия боридов включают название металла с приставкой, указывающей число атомов металла в ф-ле, и слово "борид" с обозначением числа атомов В, напр. W2В5-пентаборид дивольфрама.
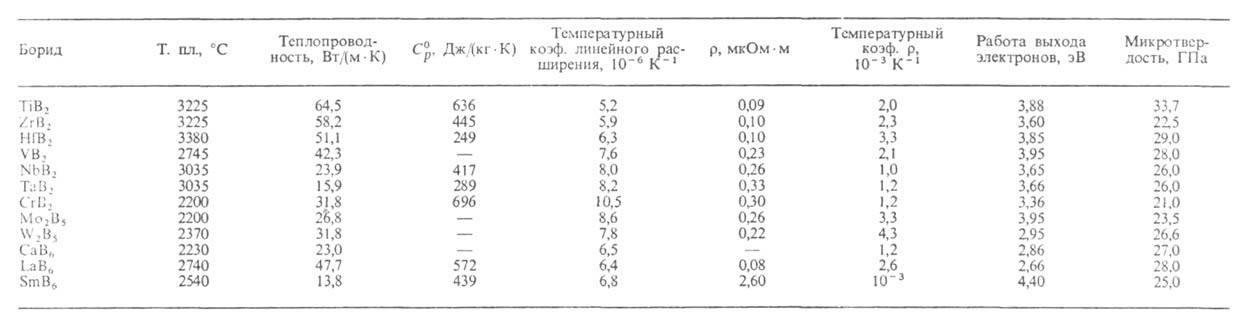
СВОЙСТВА БОРИДОВ МЕТАЛЛОВ
Взаимод. между атомами металла и бора в боридах относительно слабое, поэтому их структуру рассматривают как две слабо связанные подрешетки. Структура низших боридов определяется металлич. подрешеткой, высших - борной. В соединениях типа М4В и М2В атомы В изолированы друг от друга, в соединениях типа MB они образуют одинарные зигзагообразные цепи, в М3В4 - сдвоенные цепи. По мере увеличения содержания В структура боридов существенно усложняется. Так, в МВ2 атомы В образуют плоские сетки, в МВ4 - гофрированные сетки и каркасы в виде окгаэдрич. группировок, в МВ6 - октаэдры, в МВ12 - кубооктаэдры и икосаэдры, в МВ66 - цепи икосаэдров. Гексаген, кристаллич. решетка характерна для МВ2 и МВ4, тетрагональная-для МВ2, MB и МВ4, кубическая - для М2В, MB, MB6, МВ12, МВ66, ромбическая-для М4В, MB, M3B4, М4В, МВ12.
В молекулах боридов борные группировки, в к-рых связь В—В ковалентная, электронодефицитны; для их стабилизации необходимо привлечение электронов от атома металла. В результате между металлом и бором осуществляются связи промежут. типа: у боридов элементов III-VIII групп, отдающих более двух электронов, они частично металлические, в остальных случаях - частично ионные. С возрастанием содержания бора в пределах бинарной системы растет доля ковалентных связей В—В и уменьшается взаимод. металл - бор, в результате чего повышаются твердость, т-ра плавления, теплопроводность и электрич. проводимость и уменьшается температурный коэф. линейного расширения. Одновременно возрастает хим. стойкость. Напр., при изменении состава от Nb3B2 до NbB2 т-ра плавления увеличивается от 1860 до 3035 °С, температурный коэф. линейного расширения уменьшается от 13,8*10 -б до 8,0*10 -6 К -1 .
Бориды устойчивы к действию воды (кроме низших боридов Be и Mg), соляной, фтористоводородной и карбоновых к-т. Легко разлагаются HNO3 и H2SO4 при нагревании. Взаимод. с расплавами щелочей, карбонатов и сульфатов щелочных металлов. При окислении на воздухе образуют оксиды металла и бора, причем на пов-сти боридов формируются пленки пироборатов, обладающие защитными св-вами. Бо-риды Ti и Zr устойчивы к действию расплавов металлов.
Бориды не разлагаются в вакууме при нагревании до их т-р плавления. При испарении диссоциируют на элементы. Бориды металлов I и II групп, а также других в степени окисления + 1 и +2, обладают типично полупроводниковыми св-вами. Бориды металлов в высших степенях окисления по электрич. проводимости, как правило, значительно превосходят соответствующие металлы. Наиб. термич. стабильностью,Осн. способы получения боридов: 1) взаимод. металла с В с использованием внеш. нагрева (спекание, сплавление) либо инициированием внеш. источником тепла с послед. разогревом реагентов благодаря выделению теплоты р-ции (самораспространяющийся высокотемпературный синтез). Образующиеся бориды имеют вид спеков, требующих размола; 2) восстановление оксида металла смесью В и С, карбидом бора или бором при 1500-2000°С в вакууме. Бориды получаются в виде порошков с размером частиц 1-40 мкм; 3) электролиз расплавов боратов и оксидов металлов (лаб. способ). Образуются монокристаллы размером до 1 мм; 4) взаимод. металл- и борсодержащих соед. в условиях низкотемпературной плазмы. Образуются порошки с размером частиц 50-100 нм.
Монокристаллы боридов размером до 5 мм получают кристаллизацией из р-ров бора и металлов в расплавах Al, Zn, крупные монокристаллы диаметром до 20 и длиной до 100 мм - методами зонной плавки, Вернейля.
Изделия из порошков боридов изготавливают спеканием предварительно спрессованных заготовок или горячим прессованием. Покрытия из боридов на разл. подложках получают методом осаждения из газовой фазы при взаимод. галогенидов металлов и бора, плазменного напыления порошков и др.
Ниже описаны важнейшие представители боридов (см. табл.). Диборид титана TiB2 - черные кристаллы с гексагон. решеткой (а = 0,3026 нм, с = 0,3313 нм). Используют для изготовления испарителей для расплавов металлов и футеровки электролизеров, как компонент жаропрочных сплавов, инструментальных материалов, износостойких наплавочных покрытий [в осн. в виде двойного борида - (Ti,Cr)B2].
Диборид циркония ZrB2 - серые кристаллы с гексагон. решеткой (а = 0,1368 нм, с = 0,3528 нм). Устойчив в расплавах цветных и черных металлов, металлургич. шлаков. Характеризуется стабильностью термоэлектрич. св-в (коэф. термоэдс 1,2 мкВ/К). Используют для изготовления защитных чехлов и элементов термопар (в паре с графитом), как нейтронопоглощающий материал для ядерных реакторов и компонент жаропрочных сплавов.
Диборид хрома СгВ2 - серые кристаллы с гексагон. решеткой (а = 0,2970 нм, с = 0,3074 нм). Обладает высокой износостойкостью; компонент износостойких наплавочных покрытий.
Гексаборид лантана LaB6 - фиолетово-пурпурные кристаллы с кубич. решеткой (а = 0,4156 нм). Обладает хорошими термоэмиссионными св-вами. Устойчив к ионной бомбардировке и в агрессивных газовых средах. Применяют в кач-ве эмиттеров в электроннолучевых устройствах средней и высокой мощности.
Гексаборид кальция СаВ6 - черные кристаллы с кубич. решеткой (а = 0,4145 нм). Используют как абразив, нейтронопоглощающий материал.
===
Исп. литература для статьи «БОРИДЫ» : Самсонов Г. В., Серебрякова Т.Н., Неронов В. А., Бориды, М, 1975 (Библ.): Boron and refractory borides, ed. by V. I. Matkovich, B.-[a.o.], 1977. A.H. Пилянкевич, Ю. Б. Падерно.
Соединения бора с металлами



Бор не образует соединения (или они экспериментально не установлены) со щелочными металлами, Ag, Au, Zn, Cd, Hg, Ga, In, Tl, Sn, Ge, Pb, As и Sb. В то же время известно, что в отдельных случаях могут быть получены сплавы, например, щелочных металлов с бором, отвечающие по соотношению компонентов тому или иному гипотетическому соединению. Для остальных металлов известны соединения с бором, обладающие рядом свойств, интересных для новых отраслей науки и техники. Для соединений бора с металлами характерно разнообразие типов срязи — электронная, ковалентная и смешанная.
Известные способы получения в зависимости от свойств исходных компонентов и применяемых восстановителей боридов могут быть классифицированы следующим образом:
- образование боридов при взаимодействии свободных металлов и бора;
- образование боридов при совместном восстановлении бора и металла из смеси их окислов углеродом свободным или карбидным или ме таллами,
- образование боридов при электролитическом восстановлении бора и металла из их соединений в среде подходящего по составу электролита;
- образование боридов при термической диссоциации летучих и термически не стойких соединений бора и нужного металла.
Образование боридов при взаимодействии свободных металлов и бора может проходить в жидкой и твердой фазах. Жидкофазный процесс обычно требует более высокой температуры, и поэтому применим в том случае, когда исходные продукты имеют в требуемом интервале температур низкую упругость паров. Плавка исходных компонентов и образование борида осуществляется в герметических печах, в вакууме или атмосфере инертного газа с электродуговым, электроннолучевым или индукционным нагревом Получаемые плавленые бориды всегда несколько загрязняются элементами футеровочного материала.
Получение боридов при проведении процесса в твердой фазе осуществляется или спеканием тщательно перемешанных порошков исходных компонентов или горячим прессованием с последующим спеканием. Нагрев и спекание спрессованных заготовок из порошков исходных компонентов производят проходящим или индукцированным током. Сплавы, получаемые спеканием в твердой фазе, всегда пористы, но в большинстве случаев отличаются более равномерным распределением компонентов по заготовке, чем это имеет место в плавленых боридах.
Получение боридов при совместном восстановлении бора и металла основано на следующих схематических уравнениях реакции:

Способы, использующие реакцию (1), являются типично металлотермическими и обычно проводятся за счет выделяемого тепла или частично подводимого от внешнего нагревателя. Процесс восстановления осуществляют в открытых аппаратах.
Недостатками способа являются необходимость отделения полученного борида от шлака и загрязнение полученного борида боридом металла-восстановителя.
Неизбежное получение смеси боридов восстанавливаемого металла и металла-восстановителя ограничивает применение металлотермического способа в производстве. Способы, основанные на реакции (2), проводятся при подводе тепла от внешнего источника. Процесс восстановления углеродом проводят в открытых аппаратах, но часто в закрытых (с атмосферой инертного газа) или в вакууме.
Для восстановления в открытых установках характерно, что получаемые бориды сильно загрязнены карбидом и свободным углеродом, кроме того, эти процессы связаны с повышенным расходом борного ангидрида. Осуществление процесса в закрытых аппаратах и в вакууме при непрерывном удалении летучих продуктов реакции приводит к завершению процесса восстановления и последующего образования боридов из шихты с расчетным расходом реагентов. Процесс проводится при температуре 1500—1800°.
Способы, основанные на реакции (3), проводятся в закрытых аппаратах и по сути являются разновидностью углетермического восстановления окислов, рассмотренного выше.
Электрохимические способы производства боридов используют способность бора соединяться с другими металлами в момент их восстановления в электролизной ванне. В качестве электролита используются фториды магния, кальция и лития. Бор и требуемый металл вводят в ванну в виде кислородных соединений. Температура электролита поддерживается обычно 900—1100°.
Бориды получаются в виде мелкокристаллических образований, осаждающихся на дне ванны. При тщательной очистке получаемых кристаллов можно получить относительно чистые бориды. Считают, что электролитический способ получения боридов экономически не эффективен.
Способы получения боридов, основанные на термической диссоциации летучих и термически нестойких соединений бора и требуемого металла, не имеют пока промышленного значения. Однако эти способы крайне интересны и перспективны для борирования поверхностей изделий из металла, работающих в тяжелых условиях.
Многокомпонентные бориды металлов могут быть получены по одному из рассмотренных способов, но в настоящее время получаются преимущественно методами металлокерамики из двойных боридов.
Читайте также:
