Способы разделения и определения благородных металлов
Обновлено: 17.05.2024
Publication number RU2386709C1 RU2386709C1 RU2008129794/02A RU2008129794A RU2386709C1 RU 2386709 C1 RU2386709 C1 RU 2386709C1 RU 2008129794/02 A RU2008129794/02 A RU 2008129794/02A RU 2008129794 A RU2008129794 A RU 2008129794A RU 2386709 C1 RU2386709 C1 RU 2386709C1 Authority RU Russia Prior art keywords metals fraction column hydrochloric acid noble metals Prior art date 2006-01-13 Application number RU2008129794/02A Other languages English ( en ) Other versions RU2008129794A ( ru Inventor Казухиро НИИСАВА (JP) Казухиро НИИСАВА Казуо ШИМИЦУ (JP) Казуо ШИМИЦУ Тадаши НОЗАКИ (JP) Тадаши НОЗАКИ Original Assignee Асака Рикен Ко., Лтд. Казухиро НИИСАВА Priority date (The priority date is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the date listed.) 2006-01-13 Filing date 2007-01-12 Publication date 2010-04-20 2006-01-13 Priority to JPPCT/JP2006/300356 priority Critical 2006-01-13 Priority to PCT/JP2006/300356 priority patent/WO2007080648A1/ja 2007-01-12 Application filed by Асака Рикен Ко., Лтд., Казухиро НИИСАВА filed Critical Асака Рикен Ко., Лтд. 2010-02-20 Publication of RU2008129794A publication Critical patent/RU2008129794A/ru 2010-04-20 Application granted granted Critical 2010-04-20 Publication of RU2386709C1 publication Critical patent/RU2386709C1/ru
Links
Images
Classifications
- C — CHEMISTRY; METALLURGY
- C22 — METALLURGY; FERROUS OR NON-FERROUS ALLOYS; TREATMENT OF ALLOYS OR NON-FERROUS METALS
- C22B — PRODUCTION AND REFINING OF METALS; PRETREATMENT OF RAW MATERIALS
- C22B11/00 — Obtaining noble metals
- C22B11/04 — Obtaining noble metals by wet processes
- B — PERFORMING OPERATIONS; TRANSPORTING
- B01 — PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D — SEPARATION
- B01D15/00 — Separating processes involving the treatment of liquids with solid sorbents; Apparatus therefor
- B01D15/08 — Selective adsorption, e.g. chromatography
- B01D15/26 — Selective adsorption, e.g. chromatography characterised by the separation mechanism
- B01D15/265 — Adsorption chromatography
- B — PERFORMING OPERATIONS; TRANSPORTING
- B01 — PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D — SEPARATION
- B01D15/00 — Separating processes involving the treatment of liquids with solid sorbents; Apparatus therefor
- B01D15/08 — Selective adsorption, e.g. chromatography
- B01D15/42 — Selective adsorption, e.g. chromatography characterised by the development mode, e.g. by displacement or by elution
- B01D15/424 — Elution mode
- B01D15/426 — Specific type of solvent
- B — PERFORMING OPERATIONS; TRANSPORTING
- B01 — PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J — CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J20/00 — Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof
- B01J20/22 — Solid sorbent compositions or filter aid compositions; Sorbents for chromatography; Processes for preparing, regenerating or reactivating thereof comprising organic material
- B01J20/24 — Naturally occurring macromolecular compounds, e.g. humic acids or their derivatives
- C — CHEMISTRY; METALLURGY
- C22 — METALLURGY; FERROUS OR NON-FERROUS ALLOYS; TREATMENT OF ALLOYS OR NON-FERROUS METALS
- C22B — PRODUCTION AND REFINING OF METALS; PRETREATMENT OF RAW MATERIALS
- C22B11/00 — Obtaining noble metals
- C22B11/04 — Obtaining noble metals by wet processes
- C22B11/042 — Recovery of noble metals from waste materials
- C — CHEMISTRY; METALLURGY
- C22 — METALLURGY; FERROUS OR NON-FERROUS ALLOYS; TREATMENT OF ALLOYS OR NON-FERROUS METALS
- C22B — PRODUCTION AND REFINING OF METALS; PRETREATMENT OF RAW MATERIALS
- C22B11/00 — Obtaining noble metals
- C22B11/04 — Obtaining noble metals by wet processes
- C22B11/042 — Recovery of noble metals from waste materials
- C22B11/048 — Recovery of noble metals from waste materials from spent catalysts
- C — CHEMISTRY; METALLURGY
- C22 — METALLURGY; FERROUS OR NON-FERROUS ALLOYS; TREATMENT OF ALLOYS OR NON-FERROUS METALS
- C22B — PRODUCTION AND REFINING OF METALS; PRETREATMENT OF RAW MATERIALS
- C22B11/00 — Obtaining noble metals
- C22B11/06 — Chloridising
- C — CHEMISTRY; METALLURGY
- C22 — METALLURGY; FERROUS OR NON-FERROUS ALLOYS; TREATMENT OF ALLOYS OR NON-FERROUS METALS
- C22B — PRODUCTION AND REFINING OF METALS; PRETREATMENT OF RAW MATERIALS
- C22B3/00 — Extraction of metal compounds from ores or concentrates by wet processes
- C22B3/04 — Extraction of metal compounds from ores or concentrates by wet processes by leaching
- C22B3/06 — Extraction of metal compounds from ores or concentrates by wet processes by leaching in inorganic acid solutions, e.g. with acids generated in situ; in inorganic salt solutions other than ammonium salt solutions
- C22B3/10 — Hydrochloric acid, other halogenated acids or salts thereof
- C — CHEMISTRY; METALLURGY
- C22 — METALLURGY; FERROUS OR NON-FERROUS ALLOYS; TREATMENT OF ALLOYS OR NON-FERROUS METALS
- C22B — PRODUCTION AND REFINING OF METALS; PRETREATMENT OF RAW MATERIALS
- C22B3/00 — Extraction of metal compounds from ores or concentrates by wet processes
- C22B3/20 — Treatment or purification of solutions, e.g. obtained by leaching
- C22B3/22 — Treatment or purification of solutions, e.g. obtained by leaching by physical processes, e.g. by filtration, by magnetic means, or by thermal decomposition
- C22B3/24 — Treatment or purification of solutions, e.g. obtained by leaching by physical processes, e.g. by filtration, by magnetic means, or by thermal decomposition by adsorption on solid substances, e.g. by extraction with solid resins
- B — PERFORMING OPERATIONS; TRANSPORTING
- B01 — PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01D — SEPARATION
- B01D15/00 — Separating processes involving the treatment of liquids with solid sorbents; Apparatus therefor
- B01D15/08 — Selective adsorption, e.g. chromatography
- B01D15/10 — Selective adsorption, e.g. chromatography characterised by constructional or operational features
- B01D15/18 — Selective adsorption, e.g. chromatography characterised by constructional or operational features relating to flow patterns
- B01D15/1864 — Selective adsorption, e.g. chromatography characterised by constructional or operational features relating to flow patterns using two or more columns
- B01D15/1871 — Selective adsorption, e.g. chromatography characterised by constructional or operational features relating to flow patterns using two or more columns placed in series
- B — PERFORMING OPERATIONS; TRANSPORTING
- B01 — PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J — CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2220/00 — Aspects relating to sorbent materials
- B01J2220/40 — Aspects relating to the composition of sorbent or filter aid materials
- B01J2220/48 — Sorbents characterised by the starting material used for their preparation
- B01J2220/4812 — Sorbents characterised by the starting material used for their preparation the starting material being of organic character
- B01J2220/4825 — Polysaccharides or cellulose materials, e.g. starch, chitin, sawdust, wood, straw, cotton
- Y — GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02 — TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P — CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P10/00 — Technologies related to metal processing
- Y02P10/20 — Recycling
Abstract
Изобретение относится к способу разделения и извлечения благородных металлов. Способ включает пропускание солянокислого раствора металлов, по меньшей мере двух видов, выбранных среди металлов платиновой группы и золота, через первую колонку с целлюлозным сорбентом. После пропускания раствора осуществляют элюирование благородных металлов смесью соляной кислоты и 2-пропанона с образованием фракции, содержащей легкие металлы платиновой группы, и фракции, содержащей тяжелые металлы платиновой группы и золото. Затем проводят разделение фракции, содержащей легкие металлы платиновой группы, с помощью вышеуказанной смеси на фракции, содержащие палладий, рутений и родий соответственно. Фракцию, содержащую тяжелые металлы платиновой группы и золото, пропускают через вторую колонку с целлюлозным сорбентом для адсорбирования металлов на целлюлозе. Элюирование указанных металлов из целлюлозы осуществляют при помощи смеси соляной кислоты и 1-бутанола с образованием фракций, содержащих золото, осмий, иридий и платину, и извлекают указанные благородные металлы. Техническим результатом является эффективное разделение благородных металлов и получение их в чистом виде. 6 з.п. ф-лы, 3 табл., 1 ил.
Description
Настоящее изобретение относится к способу разделения и извлечения благородных металлов, в частности к усовершенствованному способу, обеспечивающему выделение и извлечение благородных металлов в чистом виде из материалов, содержащих множество металлов, например, из необогащенной руды благородных металлов или отходов, включая катализаторы для очистки автомобильных выхлопных газов, компоненты электронных устройств и стоматологические материалы, при помощи колонки с целлюлозным сорбентом, а также к повторному многократному использованию колонки с отработанным целлюлозным сорбентом.
Золото и платину применяют для изготовления украшений, в качестве исходных материалов для изготовления электродов, в качестве катализаторов и др. Палладий применяют в качестве катализатора, исходного материала для получения сплавов-накопителей водорода и др.; иридий применяют в качестве исходного материала для изготовления электродов для электролиза, свечей зажигания, полупроводниковых электродов (флэш-память и т.д.), плавильных тиглей и др., а рутений и родий применяют в качестве исходных материалов для изготовления электродов, различных видов керамики, катализаторов для очистки автомобильных выхлопных газов и др. в промышленных масштабах.
Для разделения и извлечения указанных благородных металлов из сырья, содержащего благородные металлы, были предложены различные способы, такие как электролитический способ, способ, основанный на химическом превращении, ионообменный способ, способ, основанный на экстракции растворителем, адсорбционный способ и способ, представляющий собой комбинацию вышеперечисленных способов.
Например, известен способ выделения и извлечения золота из необогащенной руды, включающий растворение руды для отделения золотосодержащих фракций, обработку указанных фракций соляной кислотой и хлором или царской водкой с образованием водного раствора, содержащего соли золота, и электролиз полученного раствора, обеспечивающий выделение и извлечение золота (см. Патентный документ 1, указанный ниже). Также известен способ обработки раствора, содержащего соли золота, с применением ионообменной смолы (см. Патентный документ 2); способ, основанный на экстрагировании растворителем, предусматривающий применение дибутилкарбитола (см. Патентный документ 3); способ извлечения путем экстрагирования растворителем с применением 4-метил-2-пентанона и адсорбции на хелатной смоле (см. Патентный документ 4) и способ извлечения путем адсорбции на торфе (см. Патентный документ 5).
Поскольку в указанных способах золото выделяют в виде золотосодержащей соли, на конечной стадии требуется превращение указанной соли в золото путем восстановления.
Известны следующие способы выделения и извлечения отдельных благородных металлов из сырья, содержащего множество видов благородных металлов: способ, основанный на пропускании солянокислого раствора, содержащего по меньшей мере два благородных металла, через по меньшей мере одну хроматографическую колонку, содержащую твердый адсорбент с Kd более 1, при этом происходит адсорбция благородных металлов на 30 адсорбенте, с последующим элюированием указанных благородных металлов раствором галоидной соли с образованием отдельных фракций, каждая из которых содержит только один благородный металл, выходящих в следующем порядке: Ru, Rh, Pd, Pt, Ir и Cs (см. Патентный документ 6). Также известен способ взаимного разделения благородных металлов, включающий пропускание исходного галоидного раствора, содержащего благородные металлы, через хроматографическую среду с адсорбированием благородных металлов на указанной среде, и элюирование благородных металлов элюентом с образованием отдельных фракций, каждая из которых содержит по меньшей мере один благородный металл, таким образом, что ионы Ir и Ru выделяют в виде трехзарядных ионов (см. Патентный документ 7). Известен способ взаимного разделения иридия из смеси благородных металлов, содержащей иридий и другие благородные металлы, включающий пропускание кислого раствора, содержащего хлорокомплексы иридия и других благородных металлов, через по меньшей мере одну хроматографическую колонку, содержащую твердый адсорбент, элюирование одной или более фракций, содержащих один или более благородный металл; обеспечение нахождения иридия в указанной колонке в состоянии со степенью окисления, равной +4; восстановление находящегося в колонке иридия со степенью окисления +4 до иридия со степенью окисления +3 и отделение хлорокомплекса иридия (III) от хлорокомплексов других благородных металлов (см. Патентный документ 8). Также известен способ взаимного разделения металлов платиновой группы, включающий (а) регулирование кислотности исходного раствора до значения в диапазоне от 5,5 до 6,5 М HCI, (б) регулирование окислительно-восстановительного потенциала исходного раствора до по меньшей мере примерно 500 мВ, (в) пропускание указанного раствора с отрегулированной кислотностью и оксилительно-восстановительным потенциалом через хроматографическую среду, приводящее к взаимодействию неблагородных металлов, других примесных элементов и металлов платиновой группы с хроматографической средой и (г) элюирование по меньшей мере платины и палладия в виде отдельных фракций из указанной среды с использованием элюента (см. Патентный документ 9). Известен способ взаимного разделения благородных металлов из раствора их галогенидов, включающий пропускание указанного раствора через гликольметакрилатную хроматографическую среду, адсорбирование благородных металлов на указанной среде и элюирование каждого из адсорбированных благородных металлов кислым раствором с образованием отдельных фракций (см. Патентный документ 10).
Однако во всех вышеуказанных способах необходимо применять специальные адсорбенты и элюенты, что приводит к увеличению стоимости. Кроме того, операция разделения является сложной, а эффективность разделения - низкой. Таким образом, указанные способы не подходят для разделения благородных металлов в промышленных масштабах.
Таким образом, в данной области существует потребность в способе разделения и извлечения благородных металлов, предусматривающем применение более доступных адсорбентов и элюентов и обеспечивающем выделение благородных металлов при помощи простой операции, который, таким образом, подходил бы для применения в промышленных масштабах.
Целлюлоза представляет собой легкодоступный и дешевый адсорбент, и сообщалось о нескольких примерах разделения благородных металлов с использованием целлюлозы. Например, сообщалось о выделении платины с использованием колонки с целлюлозным сорбентом, о получении хлоридов благородных металлов согласно способу, включающему пропускание концентрированного солянокислого раствора смеси платины, палладия, родия и иридия через колонку с целлюлозным сорбентом, обработку 4-метил-2-пентаноном в качестве подвижной фазы, первичное элюирование платины и иридия с последующим элюированием палладия и последующим элюированием родия, и удаление 4-метил-2-пентанона из указанных элюатов с образованием индивидуальных хлоридов благородных металлов (Непатентные документы 1 и 2).
Однако в данном случае также необходимо применять специальный элюент, сама процедура является сложной, а эффективность разделения - низкой. Таким образом, очевидно, что указанный способ не подходит для промышленного применения.
Таким образом, авторами настоящей заявки были проведены многочисленные исследования, направленные на разработку способа разделения и извлечения индивидуальных благородных металлов из сырья, содержащего множество благородных металлов и неблагородные металлы, при помощи простой процедуры с использованием колонки с целлюлозным сорбентом и легкодоступного растворителя в качестве элюента. В результате проведенных исследований авторами настоящего изобретения предложен способ разделения и извлечения благородных металлов, при этом указанный способ включает растворение исходного материала в соляной кислоте для извлечения множества благородных металлов и неблагородных металлов в виде раствора их хлоридов, пропускание солянокислого раствора, содержащего указанные металлы, через колонку с целлюлозным сорбентом для адсорбирования благородных металлов на указанном сорбенте, последовательное элюирование родия, палладия и др. из колонки с использованием смешанного раствора соляной кислоты и 2-пропанона в качестве первого элюента, а затем элюирование других благородных металлов, таких как золото, платина, иридий и рутений, с использованием смешанного раствора соляной кислоты и 1-бутанола в качестве второго элюента (Патентный документ 11).
Однако, поскольку благородные металлы, адсорбированные на единственной колонке с сорбентом на основе целлюлозы, элюируют последовательно при помощи двух видов элюентов, согласно указанному способу требуется длительное время с момента практически полного завершения элюирования первой группы благородных металлов первым элюентом до проведения элюирования вторым элюентом. Соответственно, проведение указанной операции целиком неизбежно занимает длительное время. Кроме того, в случае повторного использования колонки с целлюлозным сорбентом после завершения элюирования всех благородных металлов, целлюлозу поочередно обрабатывают двумя различными видами элюентов, что приводит к значительному снижению ее механической прочности. Кроме того, ухудшается адсорбционная способность целлюлозы по отношению к благородным металлам, и, таким образом, число повторных применений снижается.
Способы разделения и определения благородных металлов
Пробирный анализ является основным методом определения содержания золота и серебра в твердых материалах (рудах, россыпях, концентратах, хвостах обработки, штейнах, компактном металле и т.д.). Он включает комбинацию различных пиро- и гидрометаллургических операций, позволяющих количественно выделить и сконцентрировать благородные металлы без практических потерь, существенно влияющих на конечные результаты, что позволяет обеспечить воспроизводимость при повторном анализе. Количественная ошибка при пробирном анализе не превышает 1% для материалов, содержащих 150 г/т золота и более, и 5% - для материалов, содержащих золото менее 15г/т. Использование достаточно больших исходных навесок анализируемого материала (до 100 г и больше) позволяет определять содержание благородных металлов даже в очень бедных продуктах.
Основной операцией пробирного анализа является плавление. При этом для извлечения благородных металлов в пробирном анализе используют свойство металлического свинца в расплавленном состоянии количественно растворять золото и серебро с получением легкоплавкого сплава (температура плавления свинца 327 °С). Такие вещества называются коллекторами благородных металлов. Для последующего отделения суммы благородных металлов от коллектора пользуются другим свойством свинца – способностью быстро окисляться кислородом воздуха при повышенной температуре с образованием легкоплавкого оксида свинца - глета Pb O (температура плавления Pb O – 883 °С). Сродство свинца к кислороду (под которым понимается изобарно-изотермический потенциал реакции образования оксида из элементов в стандартном состоянии, отнесенный к одному грамм-атому газа) составляет – 188,5 кДж/моль. Золото и серебро при этом не окисляются. При использовании пористых толстостенных сосудов из окисленного огнеупорного материала, хорошо смачиваемого расплавленным оксидом, но не смачиваемого расплавленным металлом, образующийся в процессе окислительного плавления свинца, глет впитывается в поры этого сосуда, а сплав золота и серебра остается в виде шарообразного королька на его донной поверхности.
Для разделения оставшейся суммы благородных металлов используют свойство серебра растворяться в разбавленной азотной кислоте при полной незатронутости в этом процессе золота (операция разваривания). Величину содержания благородных металлов в анализируемом материале определяют по взвешиванию корольков до и после разваривания. Применяемые для взвешивания корольков благородных металлов специальные пробирные весы имеют точность 0,01 мг.
В общем виде пробирный анализ твердых продуктов на содержание в них золота и серебра состоит из следующих последовательно проводимых операций:
- Отбор пробы анализируемого материала (навески), осуществляемый по особым научно обоснованным правилам;
- Шихтование отобранной исходной навески со специальными химическими реагентами, называемыми пробирными реактивами;,
- Тигельное плавление приготовленной шихты на черновой свинцовый сплав, называемый [Bad link] ;
- Очистительное плавление веркблея ( [Bad link] );
- Окислительное плавление очищенного сплава, называемое [Bad link] ;
- Взвешивание на пробирных весах полученного золотосеребряного королька;
- Подготовка полученного королька к кислотному развариванию, называемая [Bad link] ;
- Кислотное разделение суммы благородных металлов, содержащихся в корольке, после квартования;
- Промывка, сушка, прокаливание твердого золотого остатка, называемого в компактном виде золотой корточкой;
- Взвешивание на пробирных весах полученной золотой корточки.
В ряде случаев перед проведением пробирного анализа необходимо видоизменить вид присутствующих в исходном материале минералов, что, как правило, осуществляется при жестком температурном воздействии. Поэтому в пробирном анализе используются следующие пирометаллургические операции:
- Кальцинирующий обжиг или прокалка, проводящаяся с целью изменения физического или химического состояния вещества и выделения некоторых летучих компонентов (Н2О, СО2 и др.);
- Окислительный обжиг. Проводится для окисления сульфидов и других природных восстановителей и удаления (частичного или полного) серы, мышьяка, сурьмы и других летучих компонентов;
- Восстановительный обжиг. Применяется для восстановления некоторых химических соединений при использовании, как правило, в качестве восстановителя угля. Например, для восстановления высших оксидов железа (2 F е 2 О 3 + С = 4 FeO + СО 2 ; 2 Fe 3 О 4 + С = 6 FeO + СО 2 );
- Окислительное плавление. Служит для разделения металлов на основе их различного сродства к кислороду: легко окисляемые металлы переходят в оксиды, которые могут ошлаковываться и удаляться из процесса.
- Восстановительное плавление. Применяется для восстановления металлов из их оксидов.
- Растворительное или шлакующее плавление. Служит для перевода примесей и пустой породы в шлак.
- Осадителъное плавление. Основано на свойстве железа и щелочей разлагать металлические сульфиды с получением расплава, содержащего FeS , K 2 S , Na 2 S , способного растворяться в сильно основном шлаке.
2. Пробирный анализ: от древнего мира до наших дней. Обзор
Т.И.Маякова, к.х.н. — рекламно-маркетинговый отдел ОАО «Иргиредмет» ( Золотодобыча, №97, Декабрь, 2007)
Первые зачатки пробирного анализа относятся к истории древнего мира. Уже несколько тысяч лет назад был известен процесс купелирования, применяемый для выделения золота и серебра из сплава со свинцом. Тогда уже было открыто избирательное всасывание окислов свинца поверхностью сосуда из костяной золы (аналогичного современной капели). В гробницах египетских фараонов были найдены золотые корольки, полученные в результате купелирования. Кроме того, применяли способ разделения сплавов золота и серебра действием кислот. Развитие методов оценки достоинства золотых сплавов в Египте было тем более важно, что египетским жрецам были известны приемы фальсификации золота сплавами на медной основе.
Первое систематическое изложение пробирного искусства (так назывался, а часто называется и в настоящее время пробирный анализ) приведено в труде итальянского металлурга Ванноччио Берингуччио, впервые опубликованном в 1540 г. Этот трактат, изложенный в десяти книгах, представляет яркий памятник эпохи итальянского возрождения и довольно полно отражает состояние металлургии того времени. В частности, металлургии золота и серебра и пробирного искусства. В последующем этот труд несколько раз переиздавался на протяжении более ста лет.
В дальнейшем описание методов пробирного анализа приводится в знаменитом труде по металлургии «Dе ге Меtаlliса», написанном Агриколой (Георгиусом) в XVI веке, а также в труде его современника Эркера. К XVII веку относятся труды Савота (Париж) и Рейнолдса (Лондон).
Судя по описанию Пеписа в 1666 г., способ разделения металлов, применявшийся на Лондонском монетном дворе в Тауэре, весьма походил на некоторые современные методы пробирного анализа.
Постановка дела в Тауэре была в конце XVII века значительно усовершенствована знаменитым ученым Исааком Ньютоном, который в течение последних 25 лет своей жизни стоял во главе Лондонского монетного двора. Весной 1698 г. с постановкой дела в Тауэре знакомился Петр I, в бумагах которого остались собственноручные записи по пробирному анализу.
Возникновение пробирного анализа в России относится к началу XVIII века. В приходно-расходной книге «Приказа рудных дел» за 1707 г. встречаются записи о покупке реагентов для испытания руд. Первые сведения о постройке в Петербурге «пробирной» лаборатории относятся к 1720 г.
Детальное изложение пробирного искусства можно найти в книге М. В. Ломоносова «Первые основания металлургии или рудных дел», опубликованной в 1763 г., но написанной задолго до этого. В этом труде содержится не только методика опробования руд плавкой на золото, серебро и другие металлы, но также детально описываются устройство и предметы оборудования пробирной лаборатории.
В эпоху, когда аналитической химии в современном понимании не существовало, задачи пробирного искусства были весьма широки и распространялись на многие металлы. Ввиду того, что в этих условиях искусство выполнения анализа преобладало над пониманием существа дела, термин «пробирное искусство» завоевал себе полное право на существование.
В настоящее время пробирный анализ, в связи с развитием учения о физикохимических основах металлургических процессов и в результате усовершенствования методов аналитической химии, далеко ушел вперед в своем развитии по сравнению с методами, которые ранее описывались в курсах «Пробирного искусства». Пробирная плавка основана на физико-химических закономерностях восстановления металлов, шлакообразования и смачивания расплавленными веществами.
В общих чертах пробирный анализ может быть представлен в виде следующих этапов:
· 3.Тигельная плавка на свинцовый сплав
· 4.Сливание свинцового сплава в железные изложницы для охлаждения
· 5.Отделение свинцового сплава (веркблея) от шлака
· 6.Купелирование веркблея (удаление свинца)
· 7.Извлечение королька драгоценных металлов, взвешивание его
· 8.Квартование (добавление серебра, по необходимости)
· 9.Обработка королька разбавленной азотной кислотой (растворение серебра)
· 10.Гравиметрическое (весовое) определение золота и серебра.
Для пробирного анализа берут тонко измельченную пробу. Чем мельче вещество, тем теснее его смесь с флюсами и тем скорее и полнее произойдут разложение и шлакование. Обычно пробу измельчают до 0,1 мм и мельче. Величина навески зависит от содержания золота. В настоящее время масса материала при анализе руды на золото обычно составляет 50 г. Раньше при анализе проб руды с низким содержанием применяли навески 100-150 г и даже больше /1/, что обеспечивало получение золотосеребряного королька достаточного по величине для дальнейших операций.
Шихтование заключается в смешивании пробы руды со специальными добавками (шихтой): флюсом, свинцовым глетом (PbО) и восстановителями.
Компоненты флюса при сравнительно низкой температуре плавятся и образуют жидкий расплав, в котором происходят физические и химические процессы. Свинцовый глет в процесс плавки восстанавливается до металлического свинца и становится «коллекторной фазой», т.е. растворяет в себе благородные металлы.
Приготовление шихты — ответственная операция. Для определения состава шихты нужно знать состав руды. Неоднородность состава шихты может приводить к погрешностям в результатах анализов. Для приготовления шихты используют смесители (рис.5).
После сплавления тигли вынимают из печи, и расплав сливают в железные изложницы. Сплав свинца и благородных металлов, имеющий высокую плотность, стекает на ее дно. После того, как расплав охладится и отвердеет, его вытаскивают из изложницы. При правильном составе шихты после плавки получают два продукта: веркблей и поверх него — шлак (расположенный на конце конуса). Веркблей отбивают молотком от шлака, затем его расплющивают в кубик для удаления остатков налипшего шлака и для облегчения захвата щипцами.
Следующим шагом классического пробирного анализа является купелирование. Этот процесс заключается в извлечении благородных металлов из свинца за счет его окисления и поглощения специальной пористой капелью (рис.9). Капели делают из смеси магнезита и цемента непосредственно в лаборатории или приобретают в специализированных фирмах.
Купелирование производят в муфельных печах при температурах от 950°С до 1000°С. Выпускаются специальные печи для купелирования
При купелировании окисленный свинец в основном адсорбируется в капель, примерно 2% свинца улетучивается. Как и в стадии плавки, процесс купелирования должен проходить под наблюдением. Вид получаемого в конце процесса королька говорит о том, был ли процесс удачным. Осложнения могут возникнуть, например, при наличии теллуридов в пробе, что может привести к образованию многочисленных несферических бисеринок. Трещины в капели или появление окалины указывают на то, что купелирование прошло неудачно и др. Когда процесс завершается успешно, в капели остается маленький блестящий шарик (королек), состоящий из золота и серебра.
В классическом пробирном анализе содержание золота и серебра в корольке определяют гравиметрически, то есть весовым методом. Сначала взвешивают весь золотосеребряный королек. Затем серебро растворяют в разбавленной азотной кислоте и оставшееся золото (золотую корточку) взвешивают повторно. Содержание серебра определяют по разнице в весе.
К весам в пробирном анализе предъявляют особые требования, так как золотосеребряные корольки и золотые корточки обычно имеют очень небольшую массу. В современном пробирном анализе для плавки обычно берут пробу породы массой 50 г. Масса золота в такой пробе при рядовых содержаниях не превышает 1 мг, а чаще измеряется микрограммами (табл.).
Для взвешивания корольков и корточек в настоящее время используют микроаналитические весы фирм «Сарториус», «Меттлер Толедо» и др. Однако даже весьма точные весы (например, SE2) имеют минимальный предел взвешивания — 10 мкг (табл. стр.30). Соответственно с их помощью нельзя взвесить золото, полученное при анализе пробы руды с содержанием 0,2 г/т и менее, так как масса корточки будет ниже предела чувствительности весов. При содержании золота в пробе 1 г/т масса корточек составит 50 мкг, а погрешность взвешивания — ±10 мкг (см. табл. стр.30), т.е. ±20%.
Экстракция драгоценных металлов из производственных растворов
Для решения задач концентрирования драгоценных металлов из различных типов промышленных растворов и получение металлов в чистом виде разработаны технологические схемы, в основе которых лежит экстракционный передел.
Определены наиболее вероятные объекты экстрагирования и химизм реакций, сопровождающих экстракцию, что послужило основой для разработки технологических схем концентрирования и аффинажа драгоценных металлов. Органические сульфиды и сульфоксиды относятся к сравнительно новым типам экстрагентов соединений драгоценных металлов. В основу технологии концентрирования драгоценных металлов из шламов электролиза меди и никеля положен метод жидкофазного хлорного вскрытия шламов в солянокислых средах в присутствии газообразного хлора (вместо соляной кислоты могут быть использованы сернокислые растворы, содержащие хлористый натрий). При оптимальных условиях выщелачивание завершается через 3,0…3,5 часа. При этом расход Cl2 составляет 0,7…0,8 кг/кг шлама, температура 70…80 °С при поддержании остаточной концентрации свободной кислоты 70…80 г/л. При этом в раствор практически полностью переходят платиновые металлы, золото и медь, 50…70 % никеля и 40…75 % железа. Полученные растворы содержат 2,5…4,5 г/л драгоценных металлов и 50…60 г/л цветных металлов и железа.
Первые результаты опробования алифатических сульфидов и сульфооксидов в качестве экстрагентов драгоценных металлов появились во второй половине XX в. Было предложено применить их для извлечения золота из хлоридных, серебра из нитратных, платиновых металлов из хлоридных, нитридных, нитратных и сульфатных сред.
Основным условием, обеспечивающим глубокое извлечение в органическую фазу платины, родия, иридия и рутения из хлоридных, нитридных и сульфатных растворов, является повышение температуры экстракционной системы до 100…160 °С.
Из растворов экстрагировали золото и серебро трибутилфосфатом – ТБФ (50 %-ный раствор в керосине) при соотношении фаз V0:VB=1:10, а рафинаты направляли на выделение палладия экстракцией НС в керосине при соотношении фаз V0:VB=1:10. Экстракцию платины рекомендуется проводить при температуре 85…90 °С, а родия, иридия и рутения – при 135…140 °С при интенсивном перемешивании сопряженных фаз. В случае экстракции палладия продолжительность контакта фаз составляет 50…60 мин, а при экстракции платины и ее спутников – 2 часа.
В целях эффективного использования органического растворителя, а также регулирования скорости экстракции палладия и платины и разделения фаз предусматривается подготовка раствора перед экстракцией платиновых металлов. Она заключается в хлорировании рафината экстракции золота и выделении избыточного окислителя прогреванием раствора при 90…95 °С. В табл. 7 приведены результаты экстракционного фракционирования, свидетельствующие о высоком извлечении металлов в органическую фазу и довольно четком распределении их по продуктам. Достаточно сказать, что суммарная концентрация драгоценных металлов в конечном рафинате не превышает 0,6…0,8 мг/л.
Таблица 7 – Результаты получения платиновых концентратов из шламов
шлама электролиза в
соответствии с ГОСТ
Высокая емкость сульфидов по извлекаемым металлам, составляющая для палладия 50 %, платины – 45…50 %, родия, иридия и рутения – 20…22 %, позволяет использовать для получения концентратов метод отгонки органического растворителя с последующей термической диссоциацией солей. Получены следующие концентраты платиновых металлов: палладиевый, содержащий более 98 % основного металла, платиновый, содержащий 96…98 % платины, и концентрат, содержащий до 70…75 % суммы драгоценных металлов (40…50 % родия, до 20 % рутения, 6…9 % иридия, 4…6 % платины, 0,0…0,3 % палладия, 2…5 % серебра). При извлечении спутников из растворов хлорирования медного шлама, содержащих 5…7 г/л селена, в процессе экстракции (температура 135…140 °С) происходит восстановление шлама и выделение его в осадок). Концентрат содержит до 85 % селена.
Учитывая высокое качество палладиевого экстракта, исследована возможность получения металла требуемой чистоты непосредственно из растворов хлорирования шламов. Для этого вместо отгонки органической фазы используют реэкстракцию металла в аммиачную воду с последующим осаждением дихлородиаминопалладия. Одна перекристаллизация соли дает возможность получить кондиционный по чистоте металл.
Совершенствование экстракционной технологии получения платиновых концентратов возможно в нескольких направлениях. Это, прежде всего, сокращение числа операций, снижение температуры экстракционной системы на переделе извлечения платины и соответственно иридия, родия и рутения, а также изменение условий регенерации органической фазы с целью уменьшения потерь органического раствора.
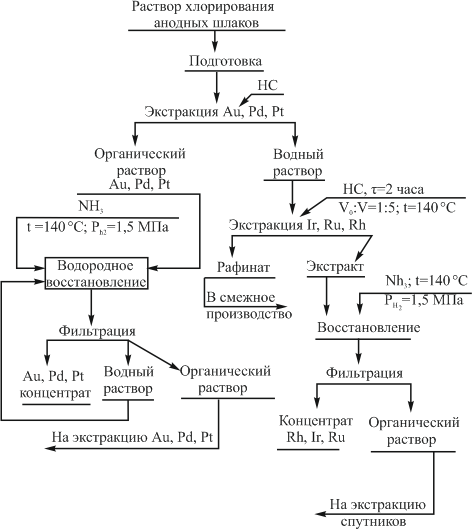
Возможно, получать два концентрата драгоценных металлов вместо четырех. Экстракцию золота, палладия и платины проводить при комнатной температуре в две стадии. На первой — извлекать золото и палладий в раствор нефтяных сульфидов (НС). Далее в систему ввести однохлористую медь (3…5 г/л) и извлечь дополнительно платину. Содержание платины в водном растворе незначительно отличается от содержания родия и рутения. Оставшиеся драгоценные металлы извлекают с использованием высокотемпературной экстракции сульфидами (рис. 50).
![Технологическая схема получения концентратов из растворов хлорирования шламов электролиза меди и никеля]()
Рисунок 50 – Технологическая схема получения концентратов из растворов хлорирования шламов электролиза меди и никеля
Для увеличения скорости восстановления используется трехфазная система органический экстракт — раствор аммиачной воды — водород. Восстановление заканчивается в течение 40 мин, при этом получают легко фильтруемые осадки металлов, а регенерированный органический растворитель практически полностью сохраняет свою активность и может быть использован в экстракции. Концентраты драгоценных металлов, полученные после регенерации экстрактов, имеют высокое качество.
В современную практику получения платиновых концентратов и, в частности концентрата ПК-3, внедрена экстракционная технология с применением в качестве растворителей соединений драгоценных металлов технических аминов. На экстракцию поступают сульфатные растворы из ванн анодного растворения передела обогащения медного и никелевого переделов. Предварительно сульфатные комплексы извлекаемых металлов переводят в хлоридные соединения, более удобные для экстракции. Недостатками технологии являются сравнительно низкое извлечение в органическую фазу иридия (≈ 90%), ведение процесса при высоких температурах (135…140 °С), невысокое качество получаемых концентратов (20…22 %), безвозвратные потери органической фазы.
Было разработано несколько вариантов усовершенствования технологической схемы извлечения металлов из сульфатных и сульфатно-хлоридных электролитов, имеющих целью устранение указанных недостатков с применением органических сульфидов и сульфооксидов. В случае использования сульфидов возможность снижения температуры экстракции ограничена. Однако благодаря избирательности органических реагентов удается качественно изменить состав концентрата, и сумма драгоценных металлов в нем составляет 61 %.
Значительно более перспективным является предложенная экстракция драгоценных металлов сульфооксидами из сульфатнохлоридных электролитов после их соответствующей подготовки — введение в раствор двухлористого олова. Внедрение SnCl -3 групп во внутреннюю сферу хлоридно-сульфатных комплексов осуществляется при продолжительном прогревании растворов. В результате в водной фазе формируются кинетически лабильные к реакциям внутрисферного замещения смешанные соединения, способные к обмену определенного количества лиганда на соответствующее количество молекул сульфооксидов. Экстракция иридия, рутения и родия, ранее лимитировавшаяся химической реакцией, тормозится диффузией. Раствор сернокислого электролита, поступающий на обогащение, содержит, г/л: 70…80 никеля, 1,8…3,5 меди, 11…15 железа, 0,01…0,03 селена, 0,01…0,02 цинка, 0,02…03 свинца, 0,0015 платины, 0,002…0,003 палладия, 0,006…0,008 родия, 0,007…0,009 рутения, 0,012…0,023 иридия, 0,0001 золота, 0,030…0,040 серебра и 75…80 серной кислоты. Драгоценные металлы в растворе присутствуют в виде сульфатных и сульфатогидроксоакво соединений.
Для перевода сульфатных соединений иридия в хлоридные в исходные растворы вводят 90…100 г/л хлористого натрия и прогревают их в течение 4,0…4,5 часа при температуре 103…105°С. Соотношение α=ZnCl2/ΣМПГ = (25…30):1 в растворе является оптимальным и обеспечивает высокую скорость экстракции. Оно получено для синтетических растворов. При подготовке промышленных сульфатнохлоридных растворов требуется выполнение отношения α>1000. Причина значительного расходования SnСl2 связана, прежде всего, с участием его в окислительно-восстановительных реакциях. Олово (II) выступает в качестве восстановителя таких элементов, как селен и теллур до элементарного состояния, меди (II), железа (III) и платиновых — до низших степеней валентности, а SnCl -3 -группы координируются последними.
Предусмотрено выделение из растворов меди, селена, теллура, а также частично платины, палладия, родия и рутения цементацией алюминиевым порошком. Восстановитель (2,0…2,5 г/л Аl) вводят порциями в течение всего времени прогревания растворов. Фильтрат содержит, г/л: 73…76 никеля; 0,03…0,05 меди; 10…12 железа; 0,01…0,02 цинка; 0,003…0,005 свинца; 0,001…0,003 селена; 0,0001 платины; 0,0002 палладия; 0,0001 родия; 0,001…0,003 рутения; 0,012…0,018 иридия; 0,003…0,005 серебра. В условиях цементации иридий практически не восстанавливается. Раствор цементации направляется перед экстракцией на подготовку, суть которой состоит в прогревании в присутствии 2,0…2,5 г/л олова (в виде SnСl2) при температуре 103…105 °С в течение 4,0…4,5 часа.
Экстракцию иридия проводят при 20 °С, перемешивании фаз и соотношении V0:VB=1:10 в течение 30 мин. Используется 25 % раствор НСО в керосине с добавлением 15 % октилового спирта. Содержание суммы платиновых металлов в рафинате после первого и пятидесятого контакта со свежими объемами производственного раствора не превышает 0,8…0,9 мг/л. Для исключения проскока олова с рафинадами предусмотрена его контрольная цементация алюминием при температуре 20 °С и продолжительности перемешивания 15…20 мин. Расход восстановителя 0,4…0,6 г/л. В результате остаточное содержание олова в фильтрате не превышает 0,1…0,3 мг/л. Полученную оловянную губку направляют на приготовление SnСl2.
Иридий и другие металлы платиновой группы, а также олово выделяют из органического раствора цементацией цинковой пылью, расход которой в 30…40 раз больше стехиометрического. При температуре 50…60 °С и активном перемешивании пульпы в течение 30 мин удается восстановить иридий на 84…86 %, другие металлы практически полностью. После разделения фаз и промывки горячим раствором серной кислоты (20…30 г/л) цементный осадок с целью выщелачивания свободного цинка поступает на подготовку следующей порции сульфатного раствора к экстракции. В процессе подготовки электролитов концентрат драгоценных металлов обогащается вследствие перехода олова в раствор. После завершения операции осадок отделяют от раствора фильтрацией. Он содержит до 40 % драгоценных металлов (35 % иридия, 3…4% рутения, 2 % родия, 0,3 % платины и 0,2 % палладия).
Органическую фазу после цементации драгоценных металлов промывают 2М раствором NаОH, после чего она практически полностью восстанавливает свою активность. Это обстоятельство представляется важным с точки зрения экономической эффективности технологической разработки.
Технологическая схема, приведенная на рис. 51, предусматривает глубокое извлечение драгоценных металлов из сульфатных электролитов, а также практически полную регенерацию олова и экстрагента.
Особенностью предложенной технологии является практическое отсутствие незавершенного производства по извлекаемым элементам, что обусловлено объединением промпродуктов с получением единого товарного концентрата драгоценных металлов и основано на использовании в операции обработки растворов вместо двухлористого олова олово-иридиевого цементата, полученного на стадии регенерации органической фазы после предыдущего цикла обогащения.
![Технологическая схема извлечения драгоценных металлов из сульфатных растворов]()
Рисунок 51 – Технологическая схема извлечения драгоценных металлов из сульфатных растворов
На качество обработки раствора не оказывают влияния присутствующие, вновь восстановленные медь, селен, теллур, палладий и др. Полученный концентрат содержит значительное количество меди (примерно в 80…100 раз больше, чем платиновых металлов), и поэтому целесообразно его дополнительное обогащение, которое может быть легко осуществлено известными способами. После выщелачивания меди концентрат содержит 28…30 % драгоценных металлов (16…18 % иридия).
К недостаткам данной технологии следует отнести большую номенклатуру реагентов, использование которых нежелательно по техническим условиям смежных производств и дороговизны.
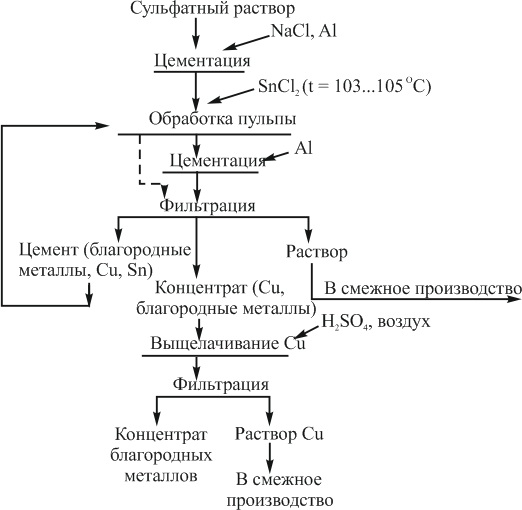
Была разработана технологическая схема, исключающая применение экстракции при извлечении иридия, родия и рутения из сульфатных растворов электролитов. В основу ее положен установленный факт, что обработка растворов SnCl2 обеспечивает образование соединений драгоценных металлов, склонных как к внутри координационным превращениям с участием в молекулах сульфидов и сульфооксидов, так и к окислительно-восстановительным реакциям, в результате протекания, которых образуются осадки восстановленных драгоценных металлов без повышения температуры.
В качестве восстановителя драгоценных металлов, в том числе иридия, используется алюминиевый порошок. Процесс цементации иридия мало зависит от температуры и концентрации свободной серной кислоты и заканчивается через 20…25 мин перемешивания фаз. Остаточное содержание металла в фильтрате составляет 0,8…1,0 мг/л, расход алюминия – 10 г/л.
Следует отметить, что в процессе цементации решаются задачи глубокого осаждения иридия и олова. На полноту цементации олова существенное влияние оказывают концентрация свободной серной кислоты в растворе, температура и расход алюминия. Количественное извлечение олова из раствора достигается через 15…20 мин перемешивания при температуре 20 °С и расходе алюминия 6…8 г/л. Даже при сравнительно низкой концентрации свободной серной кислоты в растворе (15 г/л) увеличение температуры до 60…80 °С приводит к резкому возрастанию расхода алюминия и продолжительности протекания процесса. Условия, обеспечивающие глубокое выделение олова из раствора, следующие: концентрация свободной серной кислоты не более 15…18 г/л, температура 20…40 °С, расход алюминия 6…7 г/л, продолжительность цементации 30…40 мин. Одновременно с оловом в осадок переходит практически весь иридий, присутствующий в растворе. B соответствии с проведенными исследованиями разработана технологическая схема извлечения драгоценных металлов из сульфатных растворов (рис. 52).
![Технология извлечения драгоценных металлов из сульфатных растворов цементацией]()
Рисунок 52 – Технология извлечения драгоценных металлов из сульфатных растворов цементацией
Схема предусматривает следующие технологические операции:
- цементацию сопутствующих иридию компонентов — меди, селена, теллура, платины, палладия, родия, рутения;
- обработку пульпы двухлористым оловом или олово-иридиевым цементитом;
- охлаждение раствора до температуры 20…30 °С;
- цементацию иридия и олова алюминиевым порошком;
- выщелачивание меди из осадка, обогащенного оловом.
Технология не требует использования дорогостоящего автоклавного оборудования, а также органических реагентов. Безвозвратные потери олова за технологический цикл составляют менее 0,01 %, и поэтому не требуется частое восполнение дорогостоящего материала.
Способ разделения металлов при переработке солянокислых растворов, содержащих благородные металлы, сурьму и другие неблагородные металлы
Изобретение относится к гидрометаллургии благородных металлов и может быть использовано для разделения металлов при переработке солянокислых растворов, содержащих металлы платиновой группы, золото, сурьму и другие неблагородные элементы. Способ включает обработку раствора нитритом натрия при нагревании, охлаждение пульпы и отделение осадка неблагородных металлов. Перед обработкой нитритом натрия раствор нейтрализуют щелочью до содержания HCl 50-70 г/л и отфильтровывают образовавшийся осадок, содержащий сурьму. Затем порошком железа снижают окислительно-восстановительный потенциал раствора до 500-550 мВ для извлечения золота в цементат. Осадок, содержащий сурьму, растворяют в соляной кислоте. Полученный раствор фильтруют, обрабатывают окислителем до окислительно-восстановительного потенциала 800-1000 мВ для очистки от взвеси. Затем его разбавляют водой до содержания HCl 80-100 г/л, отделяют образовавшийся сурьмянистый осадок и промывают его водой. Техническим результатом является то, что в голове процесса переработки солянокислых растворов, содержащих благородные и цветные металлы, выделяют сурьму и золото в отдельные продукты с низким содержанием платиновых металлов, а также сокращение расхода нитрита натрия при нитровании растворов.
Изобретение относится к металлургии благородных металлов и может быть использовано при переработке хлоридных растворов, содержащих металлы платиновой группы, золото, сурьму и другие неблагородные металлы.
Известен способ разделения металлов при переработке солянокислых растворов, содержащих благородные металлы, сурьму и другие неблагородные металлы, включающий обработку раствора нитритом натрия при нагревании, охлаждение пульпы и отделение осадка неблагородных металлов (И.Н.Масленицкий, Л.В.Чугаев и др. Металлургия благородных металлов. М., "Металлургия", 1987, с.411.) Способ выбран в качестве прототипа.
При обработке хлоридного раствора нитритом натрия платиновые металлы образуют растворимые нитритные комплексные соединения и остаются в жидкой фазе, а неблагородные элементы выпадают в осадок в виде гидроксидов, теллуритов, селенитов и других нерастворимых соединений.
Недостатком способа является то, что он не позволяет выделить сурьму, одну из основных неблагородных примесей, в отдельный продукт с низким содержанием платиновых металлов.
Другим недостатком способа является то, что при нитровании растворов, содержащих золото, последнее восстанавливается до металла и с неблагородными элементами переходит в осадок. Поэтому требуется повторная переработка этого материала с целью выделения золота.
Техническим результатом, на достижение которого направлено предлагаемое изобретение, является устранение указанных недостатков.
Достижение технического результата обеспечивается способом разделения металлов при переработке солянокислых растворов, содержащих благородные металлы, сурьму и другие неблагородные металлы, включающим обработку раствора нитритом натрия при нагревании, охлаждение пульпы и отделение осадка неблагородных металлов, при этом согласно изобретению перед обработкой нитритом натрия раствор нейтрализуют щелочью до содержания HCl (50-70) г/л и отфильтровывают образовавшийся осадок, содержащий сурьму, порошком железа снижают окислительно-восстановительный потенциал раствора до (500-550) мВ и извлекают золото в цементат, а осадок, содержащий сурьму, растворяют в соляной кислоте, полученный раствор фильтруют, обрабатывают окислителем до окислительно-восстановительного потенциала (800-1000) мВ для очистки от взвеси, разбавляют водой до содержания HCl (80-100) г/л, отделяют образовавшийся сурьмянистый осадок и промывают его водой.
Раствор нейтрализуют щелочью до (50-70) г/л HCl с целью выделения части неблагородных элементов в осадок, создания слабокислой среды, благоприятной для извлечения золота и снижения расхода нитрита натрия при нитровании раствора. При обработке раствора щелочью за счет гидролиза и образования малорастворимых соединений в осадок переходит сурьма. С ней соосаждаются теллур, селен, мышьяк. Если содержание HCl в растворе после нейтрализации меньше 50 г/л, то в осадок переходят благородные металлы, а если больше 70 г/л, то непроизводительно расходуется нитрит натрия при нитровании раствора.
Раствор обрабатывают порошком железа до окислительно-восстановительного потенциала (500-550) мВ с целью извлечения золота в цементат. Из слабокислого раствора золото восстанавливается железом быстро и полно. Если потенциал раствора выше 550 мВ, то не достигается полнота извлечения золота в цементат, а если ниже 500 мВ, то в цементат переходят платиновые металлы.
Далее осадок, содержащий сурьму, растворяют в соляной кислоте, раствор отфильтровываю и обрабатывают окислителем до потенциала (800-1000) мВ с целью очистки материала от взвеси, в первую очередь от коллоидного золота, которое образуется при нейтрализации раствора. В качестве окислителя используют газообразный хлор или хлорат натрия.
Очищенный от взвеси раствор обрабатывают водой с целью осаждения сурьмы. При снижении кислотности раствора до (80-100) г/л НСl сурьма гидролизуется и переходит в осадок (преимущественно в форме оксихлорида). Если в разбавленном растворе содержание НСl больше 100 г/л, то в жидкой фазе остается много сурьмы, а если меньше 80 г/л, то нерационально используется вода (обводняется процесс).
Пример 1. Разделение металлов с использованием известного способа-прототипа.
Взяли солянокислый раствор, содержащий: 8,43 г/л платины, 35,5 г/л палладия, 2,3 г/л родия, 0,49 г/л иридия, 0,74 г/л рутения, 3,32 г/л золота, 0,49 г/л серебра, 23,8 г/л меди, 1,97 г/л никеля, 1,63 г/л железа, 6,54 г/л свинца, 7,09 г/л олова, 21,7 г/л сурьмы, 9,91 г/л селена, 12,3 г/л теллура и 2,42 г/л мышьяка. Концентрация НСl в растворе - 100 г/л.
500 мл раствора обработали нитритом натрия при нагревании, пульпу прогрели до прекращения выделения оксидов азота, охладили, отфильтровали, полученный осадок (гидроксиды нитрования) промыли водой и все продукты проанализировали.
На нитрование раствора израсходовано 240 г нитрита натрия. Выход гидроксидов нитрования составил 67 г (по сухой массе). Осадок содержал: 0,01% родия, 0,03% рутения, 2,48% золота, 17,6% меди, 0,3% никеля, 1,19% железа, 3,71% свинца, 5,22% олова, 16,1% сурьмы, 6,44% селена, 9,09% теллура и 1,63% мышьяка. Извлечение металлов в этот продукт составило: родия - 0,58%, рутения - 5,4%, золота - 100%, меди - 99%, никеля - 20,4%, железа - 97,8%, свинца - 76%, олова - 98,7%, сурьмы - 99,4%, селена - 87,1%, теллура - 99%, мышьяка - 90,3%.
Пример 2. Разделение металлов с использованием предлагаемого способа.
500 мл вышеуказанного раствора (пример 1) нейтрализовали щелочью до содержания HCl 50 г/л, отделили образовавшийся осадок, содержащий сурьму, раствор обработали порошком железа до ОВП 500 мВ, отфильтровали цементат, фильтрат обработали нитритом натрия при нагревании, пульпу прогрели до прекращения выделения оксидов азота, охладили, отфильтровали осадок гидроксидов нитрования и промыли его водой.
Осадок, содержащий сурьму, растворили в соляной кислоте, раствор отфильтровали, обработали хлором до потенциала 1000 мВ, затем разбавили водой до содержания HCl 90 г/л, отделили сурьмянистый осадок, промыли его водой и все продукты проанализировали.
После нейтрализации раствора и переработки выделенного твердого продукта получено 19,7 г сурьмянистого осадка. Он содержал: 53,5% сурьмы, 7,31% теллура, 2,8% селена, 1,12% мышьяка, 1,6% олова, 0,71% свинца. Концентрация благородных металлов в осадке ниже чувствительности их определения рентгеноспектральным методом. Извлечение металлов в целевой продукт составило: сурьмы - 97%, теллура - 23,4%, селена - 11%, мышьяка - 18,2%, олова - 8,89%.
При обработке нейтрализованного раствора порошком железа до окислительно-восстановительного потенциала 500 мВ получено 2,05 г цементата. Он содержал: 0,4% платины, 3,31% палладия, 80,9% золота, 4,9% меди, 4,0% железа, 4,2% селена и 0,71% теллура. Извлечение металлов в цементат составило: платины - 0,2%, палладия - 0,4%, золота - 100%, меди - 0,8%, селена - 1,7%, теллура - 0,3%.
На нитрование обеззолоченного раствора израсходовано 170 г NaNO2. Выход гидроксидов нитрования составил 47 г. Осадок содержал: 24,8% меди, 0,53% никеля, 1,44% железа, 5,37% свинца, 6,82% олова, 0,6% сурьмы, 7,72% селена, 9,81% теллура и 1,88% мышьяка. Содержание благородных металлов в осадке ниже чувствительности их определения рентгеноспектральным методом. Извлечение металлов в этот продукт составило: меди - 97,9%, никеля - 25%, свинца - 77%, олова - 90,5%, сурьмы - 2,6%, селена - 73%, теллура - 75%, мышьяка - 73%.
Опыты показали, что предлагаемый способ позволяет в голове процесса переработки хлоридных растворов, содержащих благородные и цветные металлы, выделить сурьму и золото в отдельные продукты с низким содержанием платиновых металлов, сократить расход нитрита натрия при нитровании растворов.
Способ разделения металлов при переработке солянокислых растворов, содержащих благородные металлы, сурьму и другие неблагородные металлы, включающий обработку раствора нитритом натрия при нагревании, охлаждение пульпы и отделение осадка неблагородных металлов, отличающийся тем, что перед обработкой нитритом натрия раствор нейтрализуют щелочью до содержания HCl 50-70 г/л и отфильтровывают образовавшийся осадок, содержащий сурьму, порошком железа снижают окислительно-восстановительный потенциал раствора до 500-550 мВ для извлечения золота в цементат, а осадок, содержащий сурьму, растворяют в соляной кислоте, полученный раствор фильтруют, обрабатывают окислителем до окислительно-восстановительного потенциала 800-1000 мВ для очистки от взвеси, разбавляют водой до содержания HCl 80-100 г/л, отделяют образовавшийся сурьмянистый осадок и промывают его водой.
Читайте также: