Способы защиты от коррозии металлов сообщение
Обновлено: 05.07.2024
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.

Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
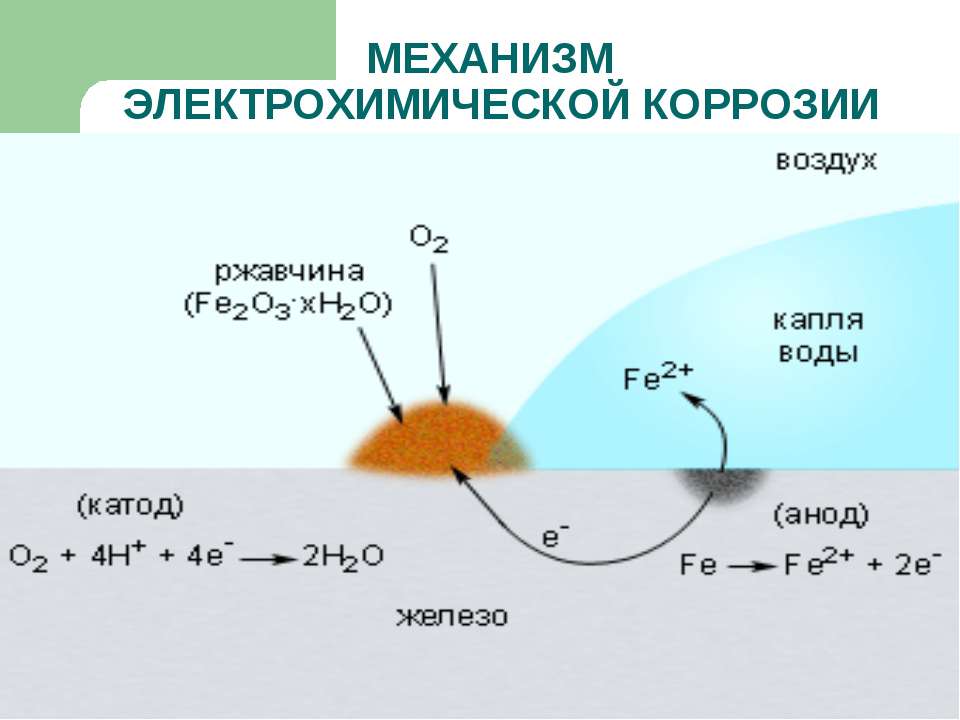
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.

Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.

Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.

Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования - защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них - закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
4.1 Основные способы защиты металлов от коррозии …………. 8
Коррозия — это самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды.
Коррозия металлов — разрушение металлов вследствие физико-химического воздействия внешней среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства.
В тех случаях, когда окисление металла необходимо для осуществления какого-либо технологического процесса, термин “коррозия” употреблять не следует. Например, нельзя говорить о коррозии растворимого анода в гальванической ванне, поскольку анод должен окислятся, посылая свои ионы в раствор, чтобы протекал нужный процесс. Нельзя также говорить о коррозии алюминия при осуществлении аллюмотермического процесса. Но физико-химическая сущность изменений, происходящих с металлом во всех подобных случаях, одинакова: металл окисляется.
Типы коррозии
Различают 4 основных вида коррозии, например: электрохимическая коррозия, водородная, кислородная коррозия и химическая.
· Электрохимическая коррозии
Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов-называют электрохимической коррозией. Не следует путать с электрохимической коррозией коррозию однородного материала, например, ржавление железа или т. п. При электрохимической коррозии всегда требуется наличие электролита, с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается.
Водородная коррозия - повреждение стали и ее страновление более хрупкой под влиянием длительного воздействия водородной среды при повышенных (gt; 200 °С) температурах эксплуатации в результате физико-химического взаимодействия водорода с отдельными компонентами и/или фазами сплава.
Водородное повреждение при повышенных температурах связано с образованием продуктов реакции между водородом и углеродом по типу: В углеродистой стали суммарная химическая реакция между углеродом, связанным в карбидах железа, и водородом может быть представлена в виде
образующийся в результате реакции метан покидает металл и/или образует внутренние полости и трещины, наполненные газообразным метаном под высоким давлением. В поверхностных слоях металла формируются обезуглероженные зоны. Водородная коррозия может протекать во всех сталях, если они содержат углерод в доступной для реакции форме и он достаточно подвижен, чтобы вступать в реакцию с водородом.
Восприимчивость стали к водородной коррозии зависит от легирующих элементов, которые воздействуют на активность углерода. Скорость водородной коррозии зависит от давления водорода и температуры, а также от размера зерен, состава их границ, степени наклепа стали и других факторов.
Кислородная коррозия возникает при питании парогенератора водой, содержащей кислород. Проявляется эта коррозия в виде язвин и питтингов на трубах. Причиной питтинговой коррозии является двойственное влияние кислорода на коррозионный процесс. С одной стороны, кислород является активным деполяризатором и ускоряет катодный процесс и коррозию в целом. С другой стороны, окисляя металл и образуя окислы, кислород играет роль пассиватора, снижающего скорость коррозии. В результате в присутствии кислорода уменьшается число анодных участков и возрастает площадь катодных участков. Коррозия становится местной, интенсивность её возрастает, разрушения идут, вглубь образуя язвы. Язвенный характер кислородной коррозии делает её особенно опасной.Наблюдается кислородная коррозия главным образом в экономайзерах. При значительном содержании кислорода в питательной воде (более 0,3 мг/кг) кислородная коррозия может протекать в пароводяном коллекторе и отпускных трубах парогенераторов с естественной циркуляцией.
Величина кислородной коррозии пропорциональна содержанию кислорода в питательной воде.
Подъёмные парообразующие трубы также могут разрушаться вследствие кислородной коррозии. Однако коррозионный процесс в них протекает менее интенсивно и практически мало зависит от содержания кислорода. Это обстоятельство связано с деаэрирующией способностью пара при кипении воды в подъёмных трубах.
Повышение давления и температуры при неизменном содержании кислорода приводит к усилению коррозии. Это связано с возрастанием скорости диффузии кислорода к катодным участкам.
Скорость кислородной коррозии зависит от плотности теплового потока, скорости циркуляции, наличия в воде солей. Если в питательной воде наряду с О2 содержаться хлориды, то коррозия усиливается Химическая коррозия
Химическая коррозия — самопроизвольное взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Как и любая химическая реакция, этот вид коррозии носит временной характер. Окислителями (корродирующими агентами) могут быть сухие газы (О2, СО2, SО2, HC1, оксиды азота и др.), перегретый водяной пар, жидкости, не являющиеся электролитами, а также расплавы органических и неорганических веществ, в том числе металлов. Наиболее часто химической коррозии подвергается металлургическое оборудование, сопла реактивных двигателей, детали газовых турбин и двигателей внутреннего сгорания, оболочки ракет и космических кораблей, т. е. изделия, работающие при высоких температурах.
Скорость коррозии
Скорость коррозии металлов и металлических покрытий в атмосферных условиях определяется комплексным воздействием ряда факторов: наличием на поверхности фазовых и адсорбционных пленок влаги, загрязненностью воздуха коррозионно-агрессивными веществами, изменением температуры воздуха и металла, образованием продуктов коррозии и так далее.
Оценка и расчет скорости коррозии должны основываться на учете продолжительности и материальном коррозионном эффекте действия на металл наиболее агрессивных факторов.
В зависимости от факторов, влияющих на скорость коррозии, целесообразно следующее подразделение условий эксплуатации металлов, подвергаемых атмосферной коррозии:
Закрытые помещения с внутренними источниками тепла и влаги (отапливаемые помещения);
Закрытые помещения без внутренних источников тепла и влаги (неотапливаемые помещения);
Открытая атмосфера.
Классификация коррозионных процессов по типу разрушений
Наиболее часто встречаются следующие виды коррозии металлов:
1. Равномерная – охватывает всю поверхность равномерно
4. Местная пятнами – корродируют отдельные участки поверхности
5. Язвенная (или питтинг)
7. Межкристаллитная – распространяется вдоль границ кристалла металла
Защита от коррозии
Основные способы защиты металлов от коррозии
Для защиты металлов от коррозии применяются различные способы, которые условно можно разделить на следующие основные направления: легирование металлов; защитные покрытия; электрохимическая защита; изменение свойств коррозионной среды; рациональное конструирование изделий.
Легирование металлов. Это эффективный метод повышения коррозионной стойкости металлов. При легировании в состав сплава или металла вводят легирующие элементы (хром, никель, молибден и др.), вызывающие пассивность металла. Пассивацией называют процесс перехода металла или сплава в состояние его повышенной коррозионной устойчивости, вызванное торможением анодного процесса. Пассивное состояние металла объясняется образованием на его поверхности совершенной по структуре оксидной пленки (оксидная пленка обладает защитными свойствами при условии максимального сходства кристаллических решеток металла и образующегося оксида).
Широкое применение нашло легирование для защиты от газовой коррозии. Легированию подвергаются железо, алюминий, медь, магний, цинк, а также сплавы на их основе. В результате чего получаются сплавы с более высокой коррозионной стойкостью, чем сами металлы. Эти сплавы обладают одновременно жаростойкостью и жаропрочностью.
Жаростойкость – стойкость по отношению к газовой коррозии при высоких температурах. Жаропрочность – свойства конструкционного материала сохранять высокую механическую прочность при значительном повышении температуры. Жаростойкость обычно обеспечивается легированием металлов и сплавов, например, стали хромом, алюминием и кремнием. Эти элементы при высоких температурах окисляются энергичнее, чем железо, и образуют при этом плотные защитные пленки оксидов.
Легирование также используется с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода. К коррозионностойким сплавам, например, относятся нержавеющие стали, в которых легирующими компонентами служат хром, никель и другие металлы.
Защитные покрытия. Слои, искусственно создаваемые на поверхности металлических изделий для защиты их коррозии, называются защитными покрытиями. Нанесение защитных покрытий – самый распространенный метод борьбы с коррозией. Защитные покрытия не только предохраняют изделия от коррозии, но и придают поверхностям ряд ценных физико-химических свойств. Они подразделяются на металлические и неметаллические. Общими требованиями для всех видов защитных покрытий являются высокая адгезионная способность, сплошность и стойкость в агрессивной среде.
Металлические покрытия. Металлические покрытия занимают особое положение, так как их действие имеет двойственный характер. До тех пор, пока целостность слоя покрытия не нарушена, его защитное действие сводится к изоляции поверхности защищаемого металла от окружающей среды. Это не отличается от действия любого механического защитного слоя (окраска, оксидная пленка и т.д.). Металлические покрытия должны быть непроницаемы для коррозионных агентов.
При повреждении покрытия образуется гальванический элемент. Характер коррозионного разрушения основного металла определяется электрохимическими характеристиками обоих металлов. Защитные антикоррозионные покрытия могут быть катодными и анодными. К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. Анодные покрытия имеют наиболее отрицательный потенциал, чем потенциал основного металла.
При повреждении никелевого покрытия на анодных участках происходит процесс окисления железа вследствие возникновения микрокоррозионных гальванических элементов. На катодных участках - восстановление водорода. Следовательно, катодные покрытия могут защищать металл от коррозии лишь при отсутствии пор и повреждения покрытия.
Местное повреждение защитного цинкового слоя ведет к дальнейшему его разрушению, при этом поверхность железа защищена от коррозии. На анодных участках происходит процесс окисления цинка. На катодных участках - восстановление водорода.
Электродные потенциалы металлов зависят от состава растворов, поэтому при изменении состава раствора может меняться и характер покрытия.
Для получения металлических защитных покрытий применяются различные способы:электрохимический(гальванические покрытия);погружение в расплавленный металл(горячее цинкование, лужение);металлизация(нанесение расплавленного металла на защищаемую поверхность с помощью струи сжатого воздуха);химический(получение металлических покрытий с помощью восстановителей, например гидразина).
Методы защита от коррозии
На скорость коррозии влияют как внутренние факторы (наличие дефектов кристаллической решетки металла, механические напряжения и др.), так и внешние: температура, природа и состав электролита. С повышением температуры скорость коррозии, как и большинства химических реакций, возрастает. Усиливают коррозию содержащаяся в атмосфере промышленных городов пыль, SO2, СO2 и другие газы. Поэтому в городах коррозия протекает в 5-10 раз быстрее, чем в сельской местности. Ионы присутствующие в морской воде, являются катализаторами коррозии железа и его сплавов, так как адсорбируясь на поверхности металла, разрушают или препятствуют образованию на нем защитных слоев. Кроме того, скорость коррозии двух контактирующих металлов будет тем больше, чем больше разность потенциалов этих металлов. Полностью предотвратить процессы коррозии металлов практически не удается, однако существуют способы защиты металлов от коррозии.
1. Изменение коррозионной среды - этот метод пригоден для тех случаев, когда защищаемые изделия эксплуатируются в небольшом объеме. Суть метода состоит в удалении из электролита растворенного кислорода или добавлении к этому раствору веществ, замедляющих коррозию - ингибиторов.
2. Легирование металлов. Это введение в состав сплавов компонентов, повышающих химическую стойкость. Наибольшее применение находят нержавеющие стали, в состав которых входит хром , до 15 % и никель, до 10 %. Кроме того, в качестве легирующих компонентов используют марганец, кремний, вольфрам, молибден, титан и другие металлы.
3. Неметаллические покрытия . Механически защищают металлы от коррозии, изолируя их от влияния внешней среды. Неметаллические покрытия делятся на неорганические и органические. Из неорганических покрытий наиболее распространены оксидные и фосфатные пленки. Так, при кипячении железа в растворе солей фосфорной кислоты получают фосфатные пленки, хорошо защищающие от коррозии в атмосфере. Среди органических, покрытий наиболее распространенными являются масляные краски, лаки, полимерные пленки. Лакокрасочные покрытия - самый дешевый метод защиты от коррозии.
4. Металлические покрытия. По характеру защитного действия различают анодные и катодные покрытия. Аноднымявляется покрытие металлом, электродный потенциал которого меньше, чем у защищаемого металла. Покрытие из металла менее активного (с большим электродным потенциалом), чем защищаемый металл, называется катодным.Если покрытие не нарушено и полностью изолирует основной металл от воздействия окружающей среды, принципиального различия между анодными и катодными покрытиями нет. При нарушении слоя защищающего металла возникают коррозионные гальванические элементы, в которых защищаемый металл может играть роль или инертного катода, или активного анода.
5. Электрохимическая защита:
а) катодная защита. Защищаемую конструкцию присоединяют к катоду внешнего источника тока, в результате она становится катодом, не окисляется, на ней идет восстановление компонентов среды. В качестве анода применяют любой металлический лом, который присоединяют к аноду внешнего источника тока. Таким способом защищают, например, подземные трубопроводы;
б) протекторная защита. Защищаемый металл соединяют с более активным металлом, имеющим меньший электродный потенциал. Последний служит анодом, растворяется и защищает основной металл.
Для более активной защиты металлических конструкций можно совмещать несколько способов защиты от коррозии, например, покрытие и катодную электрозащиту.
Заключение
Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошло на рубеже XVIII-XIX. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Начало практического использования человеком железа относят к IX веку до нашей эры. Именно в этот период человечество перешло из бронзового века в век железный.
В XXI веке высокие темпы развития промышленности, интенсификация производственных процессов, повышение основных технологических параметров (температура, давление, концентрация реагирующих средств и др.) предъявляют высокие требования к надежной эксплуатации технологического оборудования и строительных конструкций. Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов.
Необходимость осуществления мероприятий по защите от коррозии диктуется тем обстоятельством, что потери от коррозии приносят чрезвычайно большой ущерб. По имеющимся данным, около 10% ежегодной добычи металла расходуется на покрытие безвозвратных потерь вследствие коррозии и последующего распыления. Основной ущерб от коррозии металла связан не только с потерей больших количеств металла, но и с порчей или выходом из строя самих металлических конструкций, т.к. вследствие коррозии они теряют необходимую прочность, пластичность, герметичность, тепло- и электропроводность, отражательную способность и другие необходимые качества. К потерям, которые терпит народное хозяйство от коррозии, должны быть отнесены также громадные затраты на всякого рода защитные антикоррозионные мероприятия, ущерб от ухудшения качества выпускаемой продукции, выход из строя оборудования, аварий в производстве и так далее.
Защита от коррозии является одной из важнейших проблем, имеющей большое значение для народного хозяйства.
Коррозия является физико-химическим процессом, защита же от коррозии металлов – проблема химии в чистом виде.
Коррозия металлов. Виды коррозии металлов
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная

Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O2 + 4H + + 4e — = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Способы борьбы с коррозией металлов

Коррозией металла называется нарушение его структуры в результате химических или электрохимических реакций. Это может приводить к разрушению деталей, конструкций, приводить к выходу из строя узлов автомобилей, станков, другого производственного оборудования, инструментов, трубопроводов и иных металлических изделий. Каждый год коррозия разрушает около 13 миллионов тонн металла.
Предотвратить и замедлить этот негативный процесс призваны меры антикоррозийной защиты металла. На это в мире тратится ежегодно более 2,5 триллионов долларов США, по данным NACE International. Как показывает практика, металлические изделия просто не способны служить без специальных защитных мер в течение длительного времени
Причины коррозии металлов
Основными «виновниками» коррозии являются воздействие природных факторов – воды и повышенной влажности, высокой температуры, кислых веществ с содержанием сульфатов и хлоридов, взвешенных в воздухе частиц различных веществ, солей, промышленных смазочных составов.
В зависимости от того, какие именно реакции протекают на границе металла с окружающей средой, выделяют три основных вида коррозии.
- Химическая развивается, когда металл соприкасается с солями или сухими газообразными соединениями. Яркий пример – контакт днища кузова автомобиля с солью, которой зимой в России посыпают автодороги. На деталях машин образуется слой из солей натрия и калия, разъедающих сталь и любой другой металл.
- Электрохимическая происходит при соприкосновении с водой. Встречается чаще других видов.
- Биологическая (биокоррозия) заключается в том, что поверхность металла разрушают микроорганизмы или радиоактивное излучение.
В соответствии с формой поражения коррозия может быть точечной, когда появляются узкие глубокие отверстия внутри металла с сохранением целостности поверхности. Она чаще наблюдается в изделиях из алюминиевых сплавов и нержавеющей стали.
Второй тип – равномерная коррозия, проявляющаяся на поверхности металла в виде равномерного слоя отложений. Третий – щелевая, захватывает участки с небольшими углублениями, где накапливается влага. Четвертый – межкристаллическая, развивается в зернистой структуре металла, приводя к локальным повреждениям. Выделяют также коррозионное растрескивание, когда под действием агрессивной среды в сочетании с постоянной или периодической высокой нагрузкой в металле появляются трещины.
Способы борьбы с коррозией
Сегодня применяются различные способы защиты металлов от коррозии. Выбор определяется условиями эксплуатации металлических изделий, в том числе климатом региона, характеристиками самой металлической конструкции, а также совместимостью антикоррозийного состава и обрабатываемого материала, другими факторами.
Все виды борьбы с коррозией металла можно разделить на три основных, направленных на изменение одного из факторов:
- свойств самого металла;
- свойств окружающей среды;
- характера взаимодействия металлического изделия и среды на границе контакта.
Изменение свойств металла для предотвращения коррозии
В эту группу методов включаются легирование, поверхностная и термическая обработка. Первые два можно отнести к химическим методам. Третий – к технологическим методам.
Легирование предполагает включение в состав металла в процессе его производства химических элементов, которые наименее склонны вступать в химическую реакцию с кислородом. Эти компоненты по возрастанию химической эффективности располагаются в следующем порядке: хром, медь, цинк, серебро, алюминий, платина.
Другой способ – металлизация (гальванический метод), когда поверхность изделия покрывается более устойчивым к действию кислорода металлом. Он подается в мелкодисперсном виде в форме ионизированного потока. Сюда относятся холодное цинкование и горячее цинкование.
Для защиты от коррозии могут также применяться фосфатирование или оксалатирование – обработка поверхности металла фосфатными солями марганца и цинка, либо щавелевой кислоты.
Термическая обработка означает нагрев металла до температуры выше +900◦С. Как правило, применяется в сочетании с насыщением поверхности заготовки хромом, азотом, алюминием, кремнием и другими элементами, повышающими сопротивляемость металла коррозии.
Перечисленные выше методы защиты относят к активным. Сюда же можно причислить и преобразование структуры двойного электрического слоя - анодирование. На металлическую поверхность воздействуют постоянным электрическим полем с заданными параметрами напряжения, которые подбираются в соответствии со свойствами металла. Это увеличивает его электродный потенциал и повышает устойчивость к коррозии верхнего слоя. Такой способ обычно используют для создания антикоррозийной защиты алюминия.
Изменение свойств окружающей среды
Параметры окружающей металлическое изделие среды можно менять с помощью ее ингибирования, обескислороживания, осушения воздушной смеси и устранения агрессивных веществ – солей, кислот и других.
Если объект небольшой, вокруг него может создаваться вакуум: в воздухе практически не остается кислорода, соответственно, риск появления коррозии минимизируется.
Другой метод – заполнение пространства вокруг металлической детали или конструкции инертным газом (неоном, ксеноном, аргоном). Этот способ дает высокий эффект, но довольно сложен в применении: необходимо обустройство защитной камеры, а также наличие специальных защитных костюмов для людей, обслуживающих оборудование из металла. Его используют обычно в научно-исследовательских лабораториях и на опытных производственных участках, где требуется поддерживать особый микроклимат.
Изменение характера взаимодействия металла со средой
Это антикоррозийная обработка металла, для которой применяется большое разнообразие способов.
- Защитные покрытия – лаков и красок, масел, смазок и так далее.
- Устранение катодной поляризации в форме защиты от коррозии контактного типа, электродренажа, удаления блуждающих токов и так далее.
- Грамотное проектирование металлических конструкций, при котором подбирается наиболее устойчивый к действию факторов конкретной среды металл, устраняются зазоры, застойные зоны, соприкосновения разнородных металлов, и так далее.
Для борьбы с коррозией металлов широко распространены лакокрасочные покрытия. На сегодняшний день этот вариант применяется особенно часто. Используются специальные органические ЛКМ, компоненты которых не вступают в реакцию с кислородом, в также составы с алюминием. Первые перекрывают доступ О₂. Вторые не допускают коррозионного разрушения стали за счет наличия в составе химически инертного элемента – алюминия. Кроме того, используют защитные пленки и жидкий пластик – относительно новое решение.
На эффективность такой защиты влияют качество подготовки металлической поверхности к нанесению покрытия, равномерность его нанесения, толщина и прочность слоя, исключение образования воздушных полостей и другие факторы.
Этот способ отличается простотой реализации и низкими финансовыми затратами. Однако эффект недолговечен: со временем происходит механическое разрушение покрытия. Важно также понимать, что ЛКМ и пленки препятствуют появлению коррозии, но не способны его предотвратить, что дает основания называть данный способом защиты от коррозии пассивным. Можно покрыть ржавый металл специальной краской, которая трансформирует ржавчину и создаст антикоррозийный защитный слой.
К необычным способам относится высоковязкая технологическая смазка из окислов железа – закиси-окиси Fe3O4. Температура образования данного вещества составляет +250-500◦С. Им можно обработать металл, чтобы не ржавел. Образуя на поверхности плотную пленку, Fe3O4 не дает кислороду проникать к металлу, не позволяя развиваться трибохимической коррозии. Данный метод применяется на металлургических предприятиях в процессе скоростной высадки сплавов и металлов труднодеформируемых типов.
Способы удаления коррозии
Если ржавчина на металле уже появилась, риск разрушения деталей или конструкций резко возрастает. Необходимо удалить коррозию, для чего предлагается использовать один из способов.
- Ручная механическая очистка – традиционный вариант. Поверхность изделия обрабатывается металлической щеткой, наждачной бумагой либо абразивным кругом. Можно делать это вручную или с помощью дрели с соответствующей насадкой, либо углошлифовальной машины. Метод требует больших усилий и много времени.
- Специальные химические составы, вступающие в реакцию с оксидом железа. Данный вариант актуален для изделий, форма которых сложная, поверхность рифленая. Однако применять этот метод на изделиях с неметаллическими компонентами нельзя. Кроме того, работа с такими средствами требует особой осторожности, поскольку они могут нанести вред здоровью человека.
- Электрохимический способ. Металлическое изделие опускают в раствор электролита, подключив к источнику электротоку. Ток, проходящий через электролит и деталь, заставляет слой ржавчины отделяться от ее поверхности. Но этот вариант подходит не для всех изделий из металла.
- Пескоструйная и дробеструйная обработка, ультразвук очищают металл от оксида железа, отбивая его от поверхности.
- Сухой лед (криобластинг) – очищение с помощью струи из гранул сухого льда. При ударе о металл происходит испарение частичек льда. Высвобождается углекислый газ: мгновенно расширяясь, он захватывает и удаляет ржавчину.
Вложения в защиту металла от коррозии позволяют продлить срок службы деталей и конструкций, а, значит, увеличить периодичность их замены.
Максимальный эффект дает сочетание нескольких методов. Например, для сохранения металлических элементов, находящихся под водой, применяют комбинацию катодной защиты и ЛКМ. Антикоррозийная защита направляющих насадок гребных винтов включает применение коррозионностойкой стали, электроразъединение разнородных материалов, катодную защиту и ЛКМ.
Читайте также:
