Строение атома у металлов
Обновлено: 27.09.2024
1. Особенности строения атомов металлов. Положение металлов в ПС.
2. Строение простых веществ-металлов. Металлическая связь и металлическая кристаллическая решетка.
3. Физические свойства металлов.
4. Химические свойства металлов.
5. Нахождение в природе и общие способы получения металлов.
6. Понятие про коррозию.
1. Внешний электронный уровень элементов, которые относят к металлам заполнен электронами менее чем наполовину (обычно 1-2). Обычно это s-электроны. К типичным металлам (т.е. проявляющим металлические свойства в максимальной степени) относят s-элементы (элементы 1 и 2 группы, главных подгрупп), т.е. те у которых только начинается заполнение нового слоя. Причем металлические свойства усиливаются с увеличением радиуса атомов (числа электронных слоев). К металлам относят также все d элементы (т.е. те у которых идет заполнение d-подуровня предпоследнего слоя), они расположены в побочных подгруппах во всех группах. d элементы называют переходными металлами, нетипичными. К металлам относятся и f- элементы (лантаноиды и актиноиды, которые располагают обычно отдельными строками внизу таблицы
2. Металлы имеют кристаллическое, т.е. упорядоченное строение. Часть атомов в кристаллической решетке ионизирована, т.е. потеряла электроны внешнего электронного слоя и свободные электроны равномерно распределены по всему кристаллу. Они присоединяются к ионам металла и те превращаются в атомы, а другие атомы металла в это время теряют свои электроны и превращаются в ионы. Т.е. происходит своеобразный обмен электронами. Валентные электроны находятся одновременно во владении всех атомов и ионов металла (т.е. притягиваются к ним) и называются «электронным газом. Такая связь между атомами в кристалле металла называется металлической. И кристаллическая решетка металлов тоже называется металлической. Металлы имеют немолекулярное строение. Металлическая связь нелокализована между определенными атомами.
3. Общие физические свойства металлов обусловлены сходством в строении кристаллической решетки и одинаковом типе химической связи.
Эта связь достаточно прочная, поэтому металлы при н.у. находятся в твердом агрегатном состоянии. Исключение – ртуть Hg с температурой плавления (-39металлы легкоплавкие (менее 100 ) и другие щелочные металлы, магний, алюминий… Есть и тугоплавкие(более 100 ), а также хром, молибден, медь, титан, железо…
Металлическая кристаллическая решетка плотная и поэтому все металлы непрозрачные и отражают падающий свет (белый цвет, металлический блеск). Исключением являются золото и медь, которые поглощают часть спектра и имеют желтый цвет.
Все металлы могут проводить электрический ток. Это свойство обусловлено наличием подвижных электронов в кристаллической решетке. При обычных условиях самой высокой электропроводностью обладают металлы подгруппы меди: Ag, Cu, Au и алюминий. Эти металлы используются как проводники в электротехнике и радиоэлектронике. Высокое сопротивление имеют вольфрам, никель, хром. Из них изготавливают нагревательные элементы электроприборов.
Металлы проводят не только электрический ток, но и тепло. Металлы, хорошо проводящие электрический ток, имеют высокую теплопроводность. Это тоже связано с возможностью электронов перемещаться и переносить тепловую энергию.
Все металлы в той или другой степени пластичны (т.е. они необратимо деформируются при механических нагрузках), их можно ковать. Самым пластичным является золото, из него можно получить нить в 500 раз тоньше человеческого волоса, т.е. практически невидимую. Мягкими являются также и щелочные металлы. Очень твердыми металлами считаются хром и вольфрам. А сурьма при комнатной температуре настолько хрупкая, что ее можно растереть в порошок. Пластическая деформация объясняется тем, что у металлов не происходит разрыва химических связей в металлической кристаллической решетке, ионы и атомы просто смещаются относительно друг друга.
Все металлы не растворимы в воде, но растворяются друг в друге. Такие растворы называют сплавами.
По плотности металлы делят на легкие (меньше 5 г/см 3 ) и тяжелые. К легким металлам относятся щелочные и щелочноземельные металлы, титан, алюминий. К тяжелым относятся цинк, железо, медь, ртуть, свинец, золото. Самым тяжелым является осмий (22,6 г/см 3 ).
4. Общие химические свойства металлов тоже определяются общими чертами в их строении. Все они завершают внешний электронный слой отдавая валентные электроны. Следовательно, в химических реакциях простые вещества - металлы всегда являются восстановителями.
Чем легче атомы отдают электроны, тем более сильным восстановителем является металл. Но надо помнить, что ионы металлов способны принимать электроны, т.е. проявлять окислительную способность. Причем чем легче атом теряет электроны, тем хуже принимает их соответствующий ион. Т.е. например, натрий активный восстановитель, но ион натрия окислительной активности не проявляет. Малоактивный атом меди неохотно теряет свои электроны, а ион меди является достаточно сильным окислителем.
Окислителями металлов могут выступать разные вещества, но в природе и технике важнейшими считают газообразный кислород и ион водорода, который присутствует в воде и растворах кислот. Рассмотрите внимательно таблицу.
| Li | K | Ca | Na | Mg | Al | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H2 | Cu | Hg | Ag | Pt | Au | |
| Восстановительная способность металлов в свободном состоянии | |||||||||||||||||||
| Взаимодействие с кислородом воздуха | Быстро окисляется при обычной температуре | Медленно окисляется при обычной температуре или при нагревании | Не окисляются | ||||||||||||||||
| Взаимодействие с водой | При обычной температуре выделяется H2 и образуется гидроксид | При нагревании выделяется водород, и образуются оксиды | Не вытесняют водород из воды | ||||||||||||||||
| Взаимодействие с кислотами | Вытесняют водород из разбавленных кислот ( кроме HNO3) | Не вытесняют водород из разбавленных кислот | |||||||||||||||||
| Реагируют с HNO3 и конц. H2SO4 | Растворяются только в «царской водке» | ||||||||||||||||||
| Нахождение в природе | Только в соединениях | В соединениях и в свободном виде | Главным образом в свободном виде | ||||||||||||||||
| Способы получения | Электролиз расплавов | Восстановление углём, СО, активными металлами, электролиз водных растворов | |||||||||||||||||
| Окислительная способность ионов металлов | Li | K | Ca | Na | Mg | Al 3 | Mn | Zn | Cr | Fe | Ni | Sn | Pb | H | Cu | H Hg | Ag | Pt | Au |
Окисление металлов: Zn + O2 → ZnO
Взаимодействие активных металлов с водой: K + H2O → KOH + H2
Взаимодействие металлов с кислотами: Mn + HCl → MnCl2+ H2
Взаимодействие металлов с другими окислителями: Fe + CuSO4 → FeSO4 + Cu
5. Те металлы, которые могут окисляться ионами водорода из природной воды (обычно подкисленной взаимодействием с различными кислотными оксидами) или кислородом воздуха в свободном виде, т.е. в виде простого вещества в природе не могут существовать. Значит, в свободном состоянии обычно встречаются «благородные металлы» золото, серебро и платина. Некоторые малоактивные металлы тоже могут встречаться, но такие месторождения – редкие, и к настоящему времени хозяйственного значения не имеют. Но именно это было причиной, по которой первыми металлами известными человечеству были медь, ртуть, свинец, олово… Неблагородные металлы в природе встречаются в виде соединений. Для активных металлов это соли: хлориды, сульфаты, фосфаты, карбонаты. Причем, чем ниже растворимость этих соединений, тем больше вероятность их встретить. Менее активные металлы встречаются в виде оксидов или в виде сульфидов. Причем до железа – преимущественно оксиды, а после – преимущественно сульфиды.
Естественно, что и способы получения металлов тоже зависят от их активности. Получение благородных металлов обычно заключается в отделении их от пустой породы. Существует много методов для этого, они описаны в художественной и специальной литературе. Получение металлов из их соединений можно назвать одним словом: «восстановление». Т.е. химическая суть этих процессов – заставить ионы металла принять электроны. Что можно использовать как восстановитель? Какие вещества легко расстаются со своими электронами? Правильно, металлы! Значит активные металлы можно использовать для получения менее активных из их оксидов. Например:
Mg + SnO2 → MgO + Sn
Такие способы получения металлов в зависимости от восстановителя называются магнийтермия, кальцийтермия, натрийтермия…
Хорошим восстановителем является и водород:
Но у этих восстановителей (и водорода и активных металлов) есть существенный недостаток – высокая стоимость. Ведь в природе они в свободном виде не встречаются, а их получение требует больших затрат. Поэтому такие восстановители используют только если это экономически обосновано, т.е. для получения редких и дорогих металлов. А металлы, которые надо получать в очень большом количестве (железо), восстанавливают более дешевыми восстановителем – углеродом. Его применяют в виде кокса, а ранее использовали древесный уголь.
А если металл находится в природе не в виде оксида, а в виде сульфида, то руду предварительно подвергают обжигу, а уже потом восстанавливают образовавшийся оксид. Например:
А как восстанавливают самые активные металлы? Где найти такой сильный восстановитель? Таким активным восстановителем будет электрический ток. Процесс называют электролизом. Оксид металла или его хлорид расплавляют и через расплав пропускают электрический ток. Например:
Строение атомов металлов и их особенности
Если провести в Периодической таблице Д.И. Менделеева символическую линию из верхнего левого угла в нижний правый угол, то все элементы, находящиеся ниже этой линии, будут металлами.
Металлы можно охарактеризовать при помощи нескольких свойств, которые будут общими для всех элементов. К таким характеристикам следует отнести высокую электрическую проводимость и теплопроводность, пластичность, благодаря которой металлы можно подвергать ковке, прокатке, штамповке или вытягиванию в проволоку, металлический блеск и непрозрачность.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип> 1000 o С) и легкоплавкие (Tкип< 1000 o С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Электронное строение металлов и их особенности
Атомы металлов, также как, и неметаллов состоят из положительно заряженного ядра внутри которого находятся протоны и нейтроны, а по орбитам вокруг него движутся электроны. Однако, по сравнению с неметаллами, атомные радиусы металлов намного больше. Это связано с тем, что валентные электроны атомов металлов (электроны внешнего энергетического уровня) расположены на значительном удалении от ядра и, как следствие, связаны с ним слабее. По этой причине металлы характеризуются низкими потенциалами ионизации и легко отдают электроны (являются восстановителями в ОВР) при образовании химической связи.
Все металлы за исключением ртути представляют собой твердые вещества с атомной кристаллической решеткой. Рассмотрим строение металлов в кристаллическом состоянии. В атомах металлов имеются «свободные» электроны (электронный газ), которые могут перемещаться по кристаллу даже под действием слабых электрических полей, что обусловливает высокую электропроводимость металлов.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Запишем уравнение реакции растворения металла в воде. Поскольку металл двухвалентен, его реакция с водой будет описываться уравнением следующего вида: |
Согласно уравнению реакции:
N (Ме) =n (Н2) = 3,36/22,4 = 0,15 моль.
Найдем относительную атомную массу металла:
Ar(Ме) = m / n= 6,0/0,15 = 40 г/моль
Следовательно, этот металл — кальций.
| Задание | При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н.у.). Определить массовые доли металлов в смеси. |
| Решение | Известно, что медь не растворяется в соляной кислоте, поскольку стоит в ряду активности металлов после водорода, т.е. выделение водорода происходит только в результате взаимодействия хлороводородной кислоты с железом. |
Запишем уравнение реакции:
Найдем количество вещества водорода:
Согласно уравнению реакции n(H2) : n(Fe) = 1:1, т.е.n(H2) = n(Fe) = 0,25 моль. Тогда масса железа будет равна (молярная масса – 56 г/моль):
Строение атома
Многообразие химических соединений обусловлено различным сочетанием атомов химических элементов в молекулы и немолекулярные вещества. Способность же атома вступать в химические соединения, его химические и физические свойства определяются структурой атома. В связи с этим для химии первостепенное значение имеет внутреннее строение атома и в первую очередь структура его электронной оболочки.
Модели строения атома
В начале XIX века Д. Дальтон возродил атомистическую теорию, опираясь на известные к тому времени основополагающие законы химии (постоянства состава, кратных отношений и эквивалентов). Были проведены первые эксперименты по изучению строения вещества. Однако, несмотря на сделанные открытия (атомы одного и того же элементы обладают одними и теми же свойствами, а атомы других элементов – иными свойствами, введено понятие атомной массы), атом считали неделимым.
После получения экспериментальных доказательств (конец XIX начало XX века) сложности строения атома (фотоэффект, катодные и рентгеновские лучи, радиоактивность) было установлено, что атом состоит из отрицательно и положительно заряженных частиц, которые взаимодействуют между собой.
Эти открытия дали толчок к созданию первых моделей строения атома. Одна из перых моделей была предложена Дж. Томсоном (1904) (рис. 1): атом представлялся как «море положительного электричества» с колеблющимися в нем электронами.
После опытов с α-частицами, в 1911г. Резерфорд предложил так называемую планетарную модель строения атома (рис. 1), похожую на строение солнечной системы. Согласно планеетарной модели, в центре атома находится очень маленькое ядро с зарядом Zе, размеры которого приблизительно в 1000000 раз меньше размеров самого атома. Ядро заключает в себе практически всю массу атома и имеет положительный заряд. Вокруг ядра по орбитам движутся электроны, число которых определяется зарядом ядра. Внешняя траектория движения электронов определяет внешние размеры атома. Диаметр атома составляет 10 -8 см, в то время, как диаметр ядра много меньше -10 -12 см.
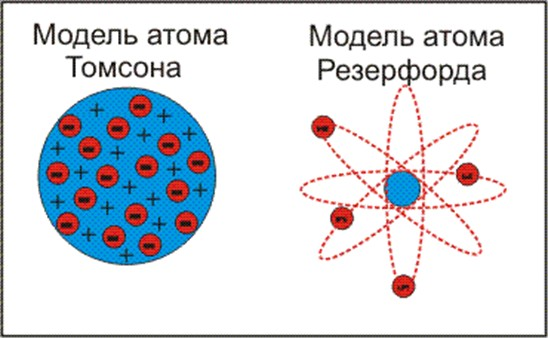
Рис. 1 Модели строения атома по Томсону и Резерфорду
Опыты по изучению атомных спектров показали несовершенство планетарной модели строения атома, поскольку эта модель противоречит линейчатой структуре атомных спектров. На основании модели Резерфорда, учении Энштейна о световых квантах и квантовой теории излучения планка Нильс Бор (1913) сформулировал постулаты, в которых заключается теория строения атома (рис. 2): электрон может вращаться вокруг ядра не по любым, а только по некоторым определенным орбитам (стационарным), двигаясь по такой орбите он не излучает электромагнитной энергии, излучение (поглощение или испускание кванта электромагнитной энергии) происходит при переходе (скачкообразном) электрона с одной орбиты на другую.
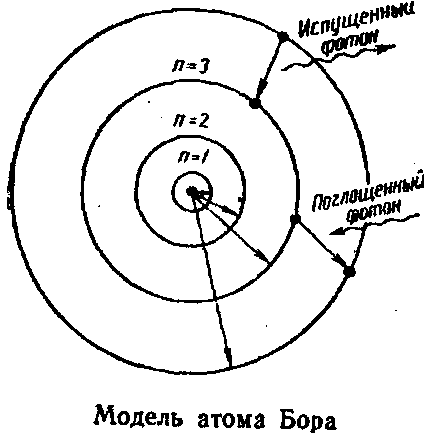
Рис. 2. Модель строения атома по Н. Бору
Накопленный экспериментальный материал, характеризующий строение атома, показал, что свойства электронов, а также других микрообъектов не могут быть описаны на основе представлений классической механики. Микрочастицы подчиняются законам квантовой механики, которая стала основой для создания современной модели строения атома.
Главные тезисы квантовой механики:
— энергия испускается и поглощается телами отдельными порциями – квантами, следовательно, энергия частиц изменяется скачкообразно;
— электроны и другие микрочастицы имеют двойственную природу – проявляет свойства и частицы, и волны (корпускулярно-волновой дуализм);
— квантовая механика отрицает наличие определенных орбит у микрочастиц (для движущихся электронов невозможно определить точное положение, т.к. они движутся в пространстве вблизи ядра, можно лишь определить вероятность нахождения электрона в различных частях пространства).
Пространство вблизи ядра, в котором достаточно велика вероятность нахождения электрона (90%), называется орбиталью.
Квантовые числа. Принцип Паули. Правила Клечковского
Состояние электрона в атоме можно описать с помощью четырех квантовых чисел.
n – главное квантовое число. Характеризует общий запас энергии электрона в атоме и номер энергетического уровня. n приобретает целочисленные значения от 1 до ∞. Наименьшей энергией электрон обладает при n=1; с увеличением n – энергия возрастает. Состояние атома, когда его электроны находятся на таких энергетических уровнях, что их суммарная энергия минимальна, называется основным. Состояния с более высокими значениями называются возбужденными. Энергетические уровни обозначаются арабскими цифрами в соответствии со значением n. Электроны можно расположить по семи уровням, поэтому, реально n существует от 1 до 7. Главное квантовое число определяет размеры электронного облака и определяет средний радиус нахождения электрона в атоме.
l – орбитальное квантовое число. Характеризует запас энергии электронов в подуровне и форму орбитали (табл. 1). Принимает целочисленные значения от 0 до n-1. l зависит от n. Если n=1,то l=0, что говорит о том, что на 1-м уровне 1-н подуровень.
Таблица 1. Формы орбиталей
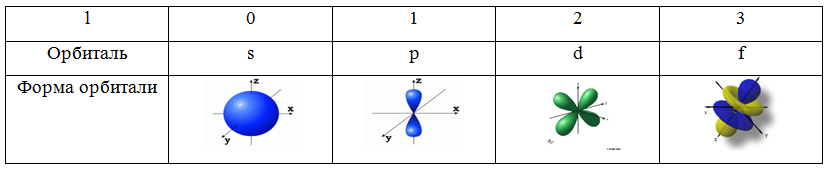
me – магнитное квантовое число. Характеризует ориентацию орбитали в пространстве. Принимает целочисленные значения от –l через 0 до +l. Так, при l=1 (p-орбиталь), me принимает значения -1, 0, 1 и ориентация орбитали может быть различной (рис. 3).
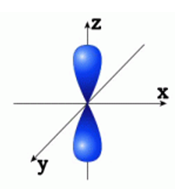
Рис. 3. Одна из возможных ориентаций в пространстве p-орбитали
s – спиновое квантовое число. Характеризует собственное вращение электрона вокруг оси. Принимает значения -1/2(↓) и +1/2 (↑). Два электрона на одной орбитали обладают антипараллельными спинами.
Состояние электронов в атомах определяется принципом Паули: в атоме не может быть двух электронов с одинаковым набором всех квантовых чисел. Последовательность заполнения орбиталей электронами определяется правилами Клечковского: орбитали заполняются электронами в порядке возрастания суммы (n+l) для этих орбиталей, если сумма (n+l) одинакова, то первой заполняется орбиталь с меньшим значением n.
Однако, в атоме обычно присутствуют не один, а несколько электронов и, чтобы учесть их взаимодействие друг с другом используют понятие эффективного заряда ядра – на электрон внешнего уровня действует заряд, меньший заряда ядра, вследствие чего внутренние электроны экранируют внешние.
Основные характеристики атома: атомный радиус (ковалентный, металлический, ван-дер-ваальсов, ионный), сродство к электрону, потенциал ионизации, магнитный момент.
Электронные формулы атомов
Все электроны атома образуют его электронную оболочку. Строение электронной оболочки изображается электронной формулой, которая показывает распределение электронов по энергетическим уровням и подуровням. Число электронов на подуровне обозначается цифрой, которая записывается справа вверху от буквы, показывающей подуровень. Например, атом водорода имеет один электрон, который расположен на s-подуровне 1-го энергетического уровня: 1s 1 . Электронная формула гелия, содержащего два электрона записывается так: 1s 2 .
5B 1s 2 2s 2 2p 1
У атомов некоторых элементов, наблюдается явление «проскока» электрона с внешнего энергетического уровня на предпоследний. Проскок электрона происходит у атомов меди, хрома, палладия и некоторых других элементов. Например:
24Cr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
Связь электронного строения атома с положением элемента в Периодической системе
Номер группы для элементов главных подгрупп равен числу электронов на внешнем энергетическом уровне, такие электроны называют валентными (они участвуют в образовании химической связи). Валентными электронами у элементов побочных подгрупп могут быть электроны внешнего энергетического уровня и d-подуровня предпоследнего уровня. Номер группы элементов побочных подгрупп III-VII групп, а также у Fe, Ru, Os соответствует общему числу электронов на s-подуровне внешнего энергетического уровня и d-подуровне предпоследнего уровня
Задания:
Изобразите электронные формулы атомов фосфора, рубидия и циркония. Укажите валентные электроны.
Ответ:
15P 1s 2 2s 2 2p 6 3s 2 3p 3 Валентные электроны 3s 2 3p 3
37Rb 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 5s 1 Валентные электроны 5s 1
40Zr 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 2 5s 2 Валентные электроны 4d 2 5s 2
Кристаллическое строение металлов

Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
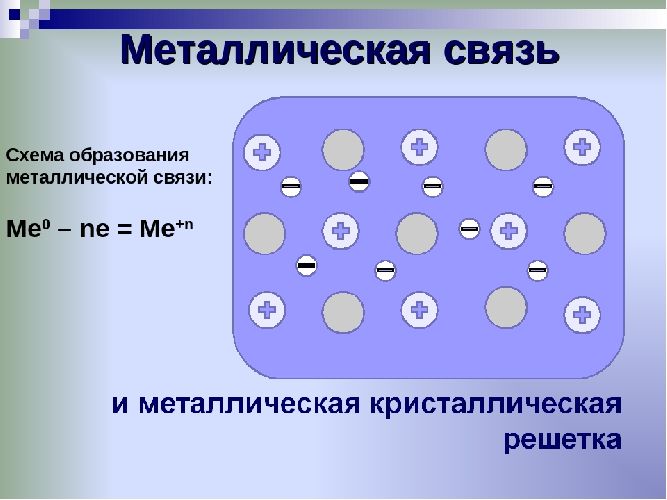
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
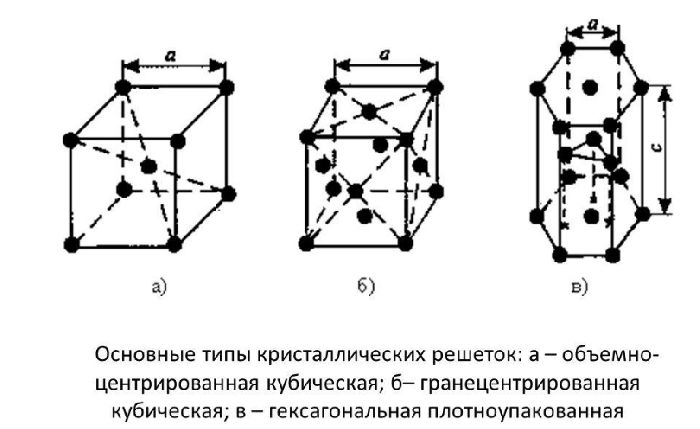
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
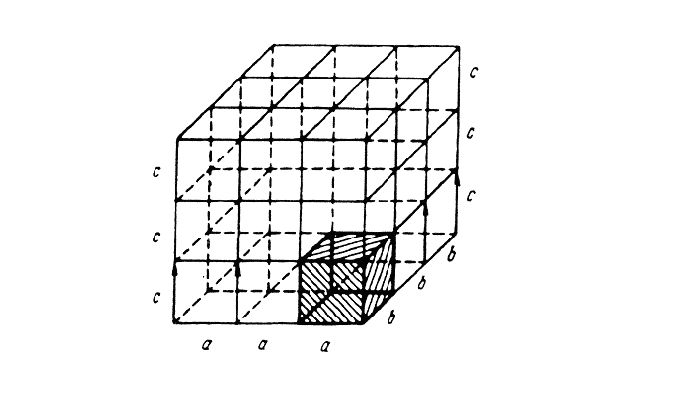
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Строение атомов металлов.
Таким образом, металлы в химических реакциях являются восстановителями – они приобретают положительную степень окисления. В этом заключается их принципиальное отличие от элементов-неметаллов.
Определение
Способность атома элемента смещать на себя электроны химической связи называют электроотрицательностью.
Вследствие низких значений электроотрицательности металлы легче отдают электроны, чем притягивают их, и, следовательно, проявляют восстановительные свойства.
Слова «металл» и «неметалл» применимы не только к химическим элементам, но и к простым веществам. Например, говоря, что простое вещество является металлом, мы подразумеваем не только что оно состоит из атомов элемента-металла, но и определенную общность физических (металлический блеск, пластичность) и химических (восстановитель) свойств. Металлические свойства простых веществ убывают при движении по периоду слева направо, а по группе - снизу вверх. В наибольшей степени металлические свойства выражены у элементов главной подгруппы I группы Периодической системы – щелочных металлов. Их атомы настолько легко отдают валентный электрон, что в природе эти элементы встречаются исключительно в виде соединений.
Металлы имеют металлическую кристаллическую решетку, в узлах которой расположены отдельные атомы. Они слабо удерживают валентные электроны, которые по этой причине свободно перемещаются по всему объему металла, формируя единое электронное облако и в равной степени притягиваются всеми атомами. Такая связь называется металлической.
Металлическая связь– вид химической связи между положительно заряженными ионами (катионами) в кристаллической решётке металлов, осуществляемая за счёт притяжения подвижных электронов. Металлической связью обладают металлы, сплавы и расплавы в аморфном состоянии.
Чем больше в металле свободных электронов и чем сильнее колебания атомов, находящихся в узлах решетки, тем быстрее происходит выравнивание температуры во всем куске металла, то есть тем больше его теплопроводность. Поэтому относительные значения тепло- и электропроводности для многих металлов близки.
Положение металлов в периодической системе. Особенности строения их атомов. Химические свойства металлов: их взаимодействие с НЕметаллами, водой, растворами щелочей, (в том числе щелочное сплавление для d-элементов).
Химические св-ва:
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом:
2Al + 3/2 O2 = Al2O3 (оксид алюминия)
2Na + Cl2 = 2NaCl (хлорид натрия)
6Li + N2 = 2Li3N (азид лития)
2Li+2C = Li2C2 (карбид лития)
2K +S = K2S (сульфид калия)
2Na + H2 = NaH (гидрид натрия)
3Ca + 2P = Ca3P2 (фосфид кальция)
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
Щелочные и некоторые щелочноземельные металлы (Ca, Sr, Ba) взаимодействуют с водой с образованием гидроксидов:
Ba + 2H2O = Ba(OH)2 + H2↑
2Na + 2H2O = 2NaOH + H2↑
В ОВР металлы являются восстановителями – отдают валентные электроны и превращаются в катионы. Восстановительная способность металла — его положение в электрохимическом ряду напряжений металлов. Так, чем левее в ряду напряжений стоит металл, тем более сильные восстановительные свойства он проявляет.
Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
2Al + 6HCl = 2AlCl3 + 3 H2↑
Zn + 2HCl = ZnCl2 + 2H2↑
Fe + H2SO4 = FeSO4 + H2↑
Отношение металлов к концентрированной серной и разбавленной азотной кислотам (показать схемы, написать по одному уравнению реакции для каждой кислоты с металлами разной активности).
Соляная кислота
Образующиеся в этом процессе ионы водорода H+ выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H2↑
При этом соль представляет собой хлорид металла (NiCl2, CaCl2, AlCl3), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
2 Al + 6 HCl → 2 AlCl3 + 3 H2↑
Соляная кислота пассивирует свинец (Pb). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца (II), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl2↓ + H2↑
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н(+) выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
Ме + H2SO4(разб.) → соль + H2↑
2 Al + 3 H2SO4(разб.) → Al2(SO4)3 + 3 H2↑
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Свинец (Pb) не растворяется в серной кислоте (если ее концентрация ниже 80%), так как образующаяся соль PbSO4 нерастворима и создает на поверхности металла защитную пленку.
Читайте также:
