Строение атомов металлов побочных подгрупп
Обновлено: 19.05.2024
Цель: Повторить и обобщить знания о металлах на примере металлов представителей побочных подгрупп (меди, железа, хрома); углубить знания об их свойствах и применении.
Образовательная : Изучить строение, свойства и применение металлов побочных подгрупп
Развивающие : 1. Создать условия для развития логического мышления через сравнение и установление взаимосвязи строения и свойств веществ с учетом зоны ближайшего развития 2. Формирование умений переносить полученные знания в новую ситуацию
Воспитательные: 1. Формирование научного мировоззрения через познаваемость химических явлений 2. Формирование умений осуществлять самоконтроль хода и результатов своего труда 3. Развитие коммуникативности личности
Планируемые результаты:
Знать строение атома, физические и химические свойства, получение и применение металлов побочных подгрупп.
Уметь составлять электронные формулы атомов металлов побочных подгрупп на примере меди, железа, хрома; записывать уравнения реакций, характеризующих химические свойства, способы получения.
Тип урока: изучение нового материала
Оборудование: компьютер, мультимедийный проектор, карточки с тестами, коллекция «Металлы», периодическая система химических элементов.
I .Организационный момент.
II .Актуализация опорных знаний
Устный опрос по пройденному материалу:
Прежде, чем мы приступим к изучению нового материала вспомним материал прошлого занятия. Постарайтесь ответить на вопросы.
- В какой части Периодической системы в основном расположены металлы?
Ответ: в левой нижней части таблицы
- Что общего в физических свойствах всех металлов?
Ответ: высокая электрическая проводимость, теплопроводность, ковкость, пластичность
- По каким характерным физическим свойствам металлы в значительной степени отличаются друг от друга?
Ответ: по плотности, твердости, температуре плавления
- Назовите самый легкий и самый тяжелый металл
Ответ: самый легкий литий, тяжелый осмий
- У какого из металлов самая низкая и самая высокая температура плавления?
Ответ: ртуть –38,9 ; вольфрам 3390
- Какие металлы мы изучали на последнем занятии?
Ответ: металлы главных подгрупп
- Назовите несколько металлов главных подгрупп
Ответ: литий, натрий, калий, магний, кальций и др.
- Назовите общее химическое свойство металлов главных подгрупп
Ответ: это их способность легко отдавать валентные электроны вследствие гораздо большего атомного радиуса по сравнению с неметаллическими элементами, поэтому являются восстановителями
III .Самоопределение к деятельности
- На сегодняшнем занятии мы познакомимся с еще одной группой металлов, среди которых наибольшее практическое значение имеют: медь, цинк, титан и железо
- Возникает вопрос, почему эти металлы изучаются отдельно?
Чтобы ответить на этот вопрос – выясните в чем отличие в расположении этих элементов в таблице Менделеева от ранее изученных металлов?
Ответ: эти металлы находятся в побочных подгруппах
Ответ: «Металлы побочных подгрупп»
- Какие цели вы ставите перед собой на уроке?
Ответ: узнать, изучить строение, свойства и применение металлов побочных подгрупп
- Давайте вместе обсудим план работы на сегодняшнем занятии. Предложите свои пункты плана по которому можно будет достичь вашей цели на уроке.
Ответ: предлагают изучить строение, физические, химические свойства и т.д
1) Исторические данные
2) Строение атома
3) Физические свойства
4) Химические свойства
В течении урока, вам необходимо будет сделать краткий конспект - записать необходимые данные, которые вы узнаете на занятии.
- Ответьте на вопрос: «Для чего, где вам пригодятся знания полученные на сегодняшнем уроке?»
IV. Изучение нового материала
б) Строение атома
– Электронное строение атомов меди, железа, хрома
Эти элементы занимают переходное положение между электроположительными s-элементами и электроотрицательными p-элементами. d-Элементы образуют три переходных ряда — в 4-м, 5-м и 6-м периодах соответственно.
Хром и медь имеют на 4s-орбиталях всего по одному электрону. Дело в том, что полузаполненные или заполненные d-подоболочки обладают большей устойчивостью, чем частично заполненные. В атоме хрома на каждой из пяти 3d-орбиталей, образующих 3d-подоболочку, имеется по одному электрону. Такая подоболочка является полузаполненной. В атоме меди на каждой из пяти 3d-орбиталей находится по паре электронов (аналогичным образом объясняется аномалия серебра).

в) Физические свойства меди, железа, хрома
Все d-элементы являются металлами. Большинство из них имеет характерный металлический блеск. По сравнению с s-металлами их прочность в целом значительно выше. В частности, для них характерны свойства: высокий предел прочности на разрыв; тягучесть; ковкость (их можно расплющить ударами в листы).
d-Элементы характеризуются также более высокой плотностью по сравнению с другими металлами. Это объясняется сравнительно малыми радиусами их атомов. Атомные радиусы этих металлов мало изменяются в этом ряду.
d-Элементы — хорошие проводники электрического тока, особенно те из них, в атомах которых имеется только один внешний s-электрон сверх полузаполненной или заполненной d-оболочки. Например, медь.
Медь — довольно мягкий металл красно-желтого цвета, ковкий, пластичный, обладает высокой тепло - и электропроводностью . Tплавл= 10830С. ρ = 8,96г/см3. СО: 0,+1,+2
Железо – сравнительно мягкий ковкий металл серебристого цвета, пластичный, намагничивается. Tплавл=15390С. ρ = 7,87г/см3.
СО: +2 – со слабыми окислителями – растворы кислот, солей, неметаллы, кроме кислорода и галогенов
+3 – с сильными окислителями – концентрированные кислоты, кислород, галогены.
Хром — твердый, голубовато-белый металл. ρ = 7,2г/см3, tплавл= 18570С
г) Химические свойства меди, железа, хрома
Химические свойства меди
I. Взаимодействие с простыми веществами.
1. При высокой температуре взаимодействует с кислородом: 2Cu + O2 2CuO
2. Взаимодействует с неметаллами при высоких температурах: Cu + Cl2 CuCl2
II. Взаимодействие со сложными веществами.
Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях:
3Cu + 8HNO3( разб .) → 3Cu(NO3)2 + 2NO↑ + 2H2O
Cu + 4HNO3( конц .) → Cu(NO3)2 + 2NO2↑+ 2H2O
Cu + 2H2SO4( конц .) → CuSO4 + SO2↑+2H2O
Химические свойства железа
1. Горит в кислороде, образуя окалину - оксид железа (II, III): 3Fe + 2O2 → Fe3O4
2. Железо реагирует с неметаллами при нагревании:
2Fe + 3Br2 2FeBr3
1. При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O Fe3O4 + 4H2 ↑
2. На воздухе в присутствии влаги ржавеет: 4Fе + 3O2 + 6Н2О → 4Fе(ОН)3.
3. Железо легко растворяется в соляной и разбавленной серной кислотах, проявляя СО +2:
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4( разб .) → FeSO4 + H2↑
4. В концентрированных кислотах–окислителях железо растворяется только при нагревании, проявляя СО +3:
2Fe + 6H2SO4( конц .) Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3( конц .) Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
5. Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu↓
Химические свойства хрома
1. При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом , кремнием, бором, серой, фосфором.
4Cr + 3O2 2Cr2O3
2Cr + 3Cl2 2CrCl3
1. В раскалённом состоянии реагирует с парами воды:
2Cr + 3H2O Cr2O3 + 3H2
2. Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4). В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
3. Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к холодным концентрированным кислотам – окислителям. Однако при сильном нагревании эти кислоты растворяют хром:
2 Сr + 6 Н2SО4(конц) Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr + 6 НNО3(конц) Сr(NО3)3 + 3 NO2↑ + 3 Н2О
Получение меди
1. Восстановлением из оксидов углём или оксидом углерода (II): CuO + C Cu + CO
CuO + CO Cu + CO2
2. При электролизе солей меди: 2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
Получение железа
1. Восстановлением из оксидов углём или оксидом углерода (II)
Fe2O3 + 3CO 2Fe + 3CO2
Получение хрома
1. Алюминотермия: Cr2O3 + 2Al Al2O3 + 2Cr
2. Восстановлением оксидов хрома оксидом углерода (II), водородом :
CrO + Н2 Cr + H2O
е) Применение меди, железа, хрома
V .Закрепление
– Напишите электронное строение атома меди
– Допишите уравнения реакций:
а) Fe + O 2 ® б) Cr + H 2 SO 4 ® в) Cu + Cl 2 ®
Тест по теме урока
1) Электронная формула 1s 2 2s2 2p6 3s2 3p6 3d2 4s2 принадлежит:
а) Zn б) Ti в) Cu г) Fe
2) Определите металл по следующим данным: светло-розовый цвет, тягучий, вязкий, легко прокатывается. Температура плавления 1083 o С. По проводимости электрического тока уступает лишь серебру.
3) Степень окисления железа в формуле Fe2O3:
а) –2 б) + 4 в) + 2 г) + 3
4) Металлические свойства в ряду Ti ® Cr ® Fe:
а) уменьшаются б) увеличиваются в) не изменяются г) изменяются периодически
5) В схеме превращений Cr → CrCl 3 → Cr ( OH )3
веществами x и y могут быть соответственно
а) Cl 2 , H 2 O б) Cl 2 , NaOH в) NaCl , KOH г) HCl , KOH
VI .Итог урока.
VII .Рефлексия.
Какая цель была на уроке _________________
Достиг ли ты поставленной цели ____________
Что тебе помогло достичь цели? _______________
Я узнал на уроке _____________
Я не согласен _____________
На уроке столкнулся со следующими трудностями ___________
Поставьте себе оценку за урок _______
VIII . Домашнее задание: изучить § 28
Выполните одно из трех заданий по своим возможностям
«3» - Допишите уравнения: а) Fe+ Cl2 ® б) Ti(IV) + O2 ® в) Zn + HNO3 ®
«4» – Напишите уравнения реакций по схеме: Zn ® ZnO ® ZnSO4 ® Zn(NO3)2
«5» – Напишите уравнения реакций по схеме, заменив «X» и «Y» соответствующей формулой: Fe(III) ® «X» ® «Y» ® Fe2O3
Положение в ПСХЭ. Электронное строение атомов
Находясь только в больших периодах (IV, V, VI), d-элементы образуют «вставные декады» (по 10 элементов) между s- и р- элементами, поэтому имеют общее название - переходные элементы.
Кроме этих 30 d-элементов, имеющих стабильные изотопы, искусственно синтезированы несколько радиоактивных d- элементов, занимающих свои места внезавершенном VII периоде.
В атомах d-элементов содержится от 1 до 10 электронов на d-подуровне предвнешнего электронного слоя и 2 (или 1 в случае проскока е-) электрона на s-подуровне внешнего электронного слоя. Общая формула электронной конфигурации валентных подуровней в атомах d -элементов.

Сравнение d -металлов с щел. Me и щел.-зем. Me
В каждом большом периоде d-элементы располагаются после двух s-элементов, которые являются щелочным и щелочноземельным металлами:
Радиусы атомов уменьшаются
Заряды ядер атомов увеличиваются
Поэтому d-металлы являются менее активными, чем щелочные и щелочноземельные металлы.
Возможные валентности и степени окисления
Вотличие от щелочных и щелочноземельных Me, большинство d-металлов имеют переменную валентность и переменную степень окисления. Это объясняется тем, что валентными в атомах d-элементовявляются не только s-электроны внешнего слоя, но и все или некоторые d -электроны предвнешнего слоя.
Положение в ПСЭ. Электронное строение атомов
Для d-металлов III - VII групп высшая Ви высшая С.О. равны номеру группы, т. е. суммарному числу е - на (n -1)d и ns-подуровнях; например у d -элементов четвертого периода:
Высшая степень окисления
Для d-металлов VIII группы высшая В и высшая с о., как правило, меньше суммарного числа е - на (n - 1)d и ns -подуровнях;
d-Металлы II группы, атомы которых имеют завершенную структуру d-подуровня (n -1)d10, проявляют в своих соединениях постоянную В = II и постоянную с.о. = +2.
Наиболее характерными валентностями и степенями окисления для d-металлов I группы являются: Сu - II и +2; Ag - I и +1; Au - III и +3.
Способность к комплексообразованию
Важной особенностью атомов d-металлов является наличие свободных орбиталей (на (n - 1)d -, ns - образованию и nр-подуровнях), что позволяет им образовывать донорно-акцепторные (координационные) связи с различными донорами неподеленных электронных пар (молекулы NH3, Н2O, ионы ОН - , CN - и др.).
Вследствие этого d-металлы образуют многочисленные и разнообразные комплексные соединения; например:
В свободном состоянии d -металлы (как и вообще все металлы) являются восстановителями. Восстановительная активность различных d - металлов изменяется в широких пределах: среди них есть металлы средней активности, находящиеся в ряду напряжений до водорода (Fe, Cr , Zn , Mn и др.); малоактивные металлы (Сu, Нg и др.) и благородные металлы (Au , Pt и др.), располагающиеся в ряду напряжений после водорода.
Окислительно-восстановительные свойства d-металлов и их соединений
Соединения d-элементов могут выполнять как восстановительные, так и окислительные функции. Соединения с невысокими степенями окисления являются восстановителями, а соединения с высокими степенями окисления - окислителями;
Кислотно-основные свойства оксидов и гидроксидов d-металлов
При увеличении степени окисления металла основной характер оксидов и гидроксидов ослабляется, а кислотный характер усиливается:
Построение структурно-электронной формулы элементов B-подгрупп
Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
Количество электронов на внешнем уровне
Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds
Все остальные элементы B-подгрупп, кроме палладия.
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
3s 2 3p 6 3d 5 4s 1
3s 2 3p 6 3d 6 4s 2
3s 2 3p 6 3d 5 4s 2
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s 2 3p 6 4s 2 3d 5 . s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns 2 (n-1) d 10
Решение задания:
Для начала разберемся со страшной формулой ns 2 (n-1) d 10 . Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s 2 (4-1)d 10 или 4s 2 3d 10 . Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d 10 4s 2 . Получившаяся формула приблизительна, вместо нее может быть 4d 10 5s 2 или 5d 10 6s 2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s 2 5p 3 , что соответствует структурно-электронной формуле:
Элемент имеет три неспаренных p-электрона.
Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
Особенности строения атомов металлов побочных подгрупп



Последний Элементы вторичной подгруппы 4-го цикла-электроны Zn по уровню энергии распределяются следующим образом: + 3озн 2, 8, 18, 2 Среди металлов подгруппы Cr является наиболее важным. Местоположение хрома в периодической системе и строение его атомов. Хром лидирует в боковой подгруппе группы VI. энергетические уровни атомов хрома и расположение электронов по орбиталям являются: + 2 * Cg2ë,8ё,13ё,1ëIs2 2s22рб3s2Зр6__3d5bs1 24Cg(W [Y1ShSCH ISHShBZHSh
Согласно закону, регулирующему заполнение энергетического уровня и подуровня (орбитали), атому хрома на 4-м энергетическом уровне (подуровне s) требуется 2 электрона. Однако 2 из 1 электрона перемещаются на 3-й энергетический уровень по незаполненной D-орбите. Это явление наблюдается в атомах многих элементов и называется»провалом»электронов.
Атомы хрома имеют 6 неспаренных электронов (см. Рисунок).Это объясняет, что хром может показать степень окисления от+1 до+6. Наиболее важными являются соединения хрома со степенями окисления+ 2,+ 3 и+ 6. Ответьте на вопросы 1 и 2 (стр. 121). Быть внутри nature. In в нашей стране наиболее распространенной хромовой рудой является хромовая железная руда, или железная хромовая железная руда FeO * Cr203.
Оксид хрома (III) Cr203 и некоторые другие соединения хрома также присутствуют в природе. Мы получили ваши отзывы. Когда хромовая железная руда сильно нагревается углем, хром и железо уменьшаются. «2 +3 ’0 0 0 +2 FeO * Cr203 + 4C 4«2Cg + Fe + 4C В результате этой реакции образуется сплав хрома и железа-феррохром. formed.
- To получают чистый хром, его восстанавливают из оксида алюминия. О Компании Tz / + Cr2Os + равен 2ai-я А1203 + 2Cg Физические характеристики. Хром-это серовато-белый металл, блестящий на вид, похожий на железо. Его плотность составляет 7,19 г / см3, а температура плавления-1890°С. Отличительной особенностью хрома является его высокая твердость(с. 87).
Это объясняется тем, что в металлической сетке имеется 1, 6 относительно свободных электронов на электрон, которые относительно малы по отношению к ионам хрома. Металлический хром может «резать» стекло. Химическое свойство. Поверхность хрома покрыта очень тонким (и поэтому прозрачным) оксидом film.
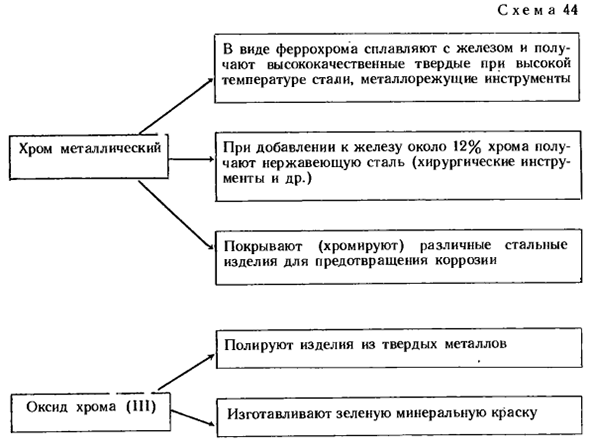
Благодаря этой пленке хром является одним из самых коррозионно-стойких металлов. Даже при высокой влажности она не меняется совсем. Соляная и серная кислоты, разбавленные хромом, начинают реагировать через некоторое время (после разрушения пленки). Cr + H2S04 -» — CrS04 + * H, f Азотная кислота пассивирует хром(иммобилизирует оксидную пленку). Применение хрома показано на схеме 44. Вопросы 3 и 4 (стр. 122), задача 1(стр. 122).
Образовательный сайт для студентов и школьников
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Металлы их положение в периодической системе химических элементов Д.И.Менделеева, строение их атомов, металлическая связь. Общие химические свойства металлов.
Известно, что от периода к периоду число металлов, составляющих главные подгруппы, увеличивается. Это связано с тем, что от периода к периоду радиус атома, как правило, увеличивается, поэтому внешние электроны становятся более свободными. Это в значительной степени и определяет, будет элемент металлом или нет. Например, во втором периоде имеется только два металла – литий и бериллий; в состав третьего периода входят три металла – натрий, магний и алюминий. Эту закономерность среди элементов главных подгрупп можно продолжить.
Кроме того, все элементы побочных подгрупп – металлы, они имеют на внешнем слое, как правило, 1-2 электрона, это во многом определяет их свойства.
У металлов главных подгрупп, как правило, на внешнем слое может быть от одного до трёх электронов, однако некоторые из них могут иметь существенно большее число электронов. Например, элемент полоний на внешнем слое имеет шесть электронов. Но этот элемент принадлежит (IV) периоду. Поэтому свойства простого вещества полония сильно отличаются от свойств, например, кислорода или серы, хотя они представители одной подгруппы.
Лёгкость выхода внешних электронов из атомов металлов определяет их свойства как восстановителей. Восстановители – это элементы, повышающие свою степень окисления в процессе реакции. Это происходит, в следствие отдачи электронов окислителям.
Восстановительные свойства металлов проявляются в следующих реакциях:
а) с неметаллами
в данной реакции металл Fe восстановитель, а катион Cu 2+ окислитель.
Электрохимический ряд напряжения металлов. Вытеснение металлов из растворов солей другими металлами.
- Общие свойства металлов как восстановителей.
- Характеристика активности металлов.
- Вытеснение металлов из растворов солей.
Общим свойством металлов является их способность к окислению: Ме 0 -ne - →Me n + . Способность отдавать электроны у металлов проявляется по-разному: наиболее активные щелочные металлы и кальций, они восстанавливают водород даже из воды:
К 0 -1е - →К +1 восстановитель
2Н +1 +2е - →Н2 0 окислитель
Менее активные восстановители – магний, алюминий, цинк и др., ещё менее активны железо, свинец: эти металлы восстанавливают водород из водных растворов кислот, а из растворов солей менее активных металлов – металл.
Zn 0 -2e - →Zn +2 восстановитель
Fe 0 -3e - →Fe +3 восстановитель.
Русский химик Н.Н.Бекетов расположил металлы в порядке убывания их восстановительной активности в водных растворах и назвал его электрохимический ряд напряжения металлов (приложение 5). При этом следует помнить следующее правила: каждый левее стоящий металл может вытеснять все последующие из водных растворов их солей, а сам вытесняется предыдущими металлами. В этом ряде следует обратить внимание на водород как единственный неметалл, имеющий с металлами общее свойство – способность образовывать положительно заряженные ионы. Поэтому водород может замещать некоторые металлы и сам замещаться активными металлами из водных растворов кислот и воды.
Вытеснение менее активных металлов из растворов их солей более активными металлами происходит в соответствии с рядом напряжения. Можно привести дополнительные примеры взаимодействия щелочных металлов с водой.
Читайте также:
