Свойства металлов и их соединений практическая работа
Обновлено: 05.10.2024
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Практическая работа №2
По теме: «Общие свойства металлов и их соединений».
Цель работы: изучение химических свойств металлов и их соединений.
- Закрепить знания о химических свойствах металлов: взаимодействие металлов с растворами кислот и солей.
- Экспериментальным путем убедиться в различной химической активности металлов, доказать, что более активные металлы восстанавливают менее химически активные из водных растворов их солей.
- Изучить общие свойства амфотерных гидроксидов.
- Изучить общие свойства нерастворимых оснований.
- Отработать навыки экспериментальной работы согласно правилам техники безопасности.
Краткие теоретические сведения.
Металлы в периодической системе находятся в I, II, III группах, в побочных подгруппах всех групп. Кроме того, металлами являются наиболее тяжелые элементы IV, V, VI и VII групп.
Особенностью строения атомов металлов является небольшое число электронов во внешнем электронном уровне, как правило, не превышающее трёх. Атомы металлов легко отдают электроны и являются хорошими восстановителями.
Металлы по их активности расположены в ряд, называемый электрохимическим рядом напряжений металлов.
Li Rb K Cs Ba Sr Ca Na Mg Be Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Au
Металлы, стоящие в электрохимическом ряду напряжений металлов до водорода, могут вытеснять его из растворов кислот, а всякий металл, стоящий ближе к началу ряда, может вытеснять (восстанавливать) последующие из растворов их солей.
1.Металлы, расположенные в начале ряда - от лития до магния –восстанавливают водород из воды с образованием щелочи:
2Na + 2HOH 2NaOH + H 2 ↑.
2. Металлы менее активные (от марганца до железа), восстанавливая из воды водород, образуют оксиды:
3Fe + 4H 2 O Fe 3 O 4 + 4H 2 ↑.
3.Металлы реагируют с кислотами. Взаимодействие металлов зависит от их активности (см. электрохимическим рядом напряжений металлов) и от концентрации кислоты:
а) кислоты HCl, H 3 PO 4 , H 2 SO 4(разб.) реагируют со всеми металлами (кроме Pb), которые стоят в ряду напряжений до водорода, при этом выделяется водород;
Zn + 2HCl ZnCl 2 + H 2 ↑.
б) концентрированная H 2 SO 4 при нагревании реагирует со всеми металлами (кроме Pt и Au), при этом водород не выделяется; с тяжелыми (плотность > 5 г/ см 3 ) металлами образует газ SO 2 (оксид серы (IV)); с более активными легкими (плотность 3 ) металлами выделяется H 2 S (сероводород):
Cu +2H 2 SO 4 (конц) CuSO 4 + 2H 2 O + SO 2 ↑.
в) концентрированная НNO 3 c щелочными и щелочноземельными металлами образует газ N 2 O – оксид азота (IV), с другими тяжелыми металлами – оксид азота (IV) NO 2 :
Ca + 10HNO 3(конц.) → Ca(NO 3 ) 2 + N 2 O + 5 H 2 O
Cu + 4HNO 3(конц.) → Cu(NO 3 ) 2 + NO 2 + 2 H 2 O
г) разбавленная НNO 3 взаимодействует c щелочными и щелоч-ноземельными металлами, а также с Zn, Fe, Sn, при этом выделяется газ NH 3 (аммиак) или образуется соль аммония (NH 3 + НNO 3 =NH 4 NO 3 ), при реакции с остальными металлами (плотность > 5 г/ см 3 ) образуется оксид азота (II) NO:
Ca + 10HNO 3(разб.) → 4Ca(NO 3 ) 2 + NH 4 NO 3 + 3 H 2 O
Cu + 4HNO 3(разб.) → 3Cu(NO 3 ) 2 + 2NO + 4H 2 O
д) кислоты H 2 CO 3 ,H 2 SO 3 , CH 3 COOH – слабые, взаимодействуют с активными металлами:
2 CH 3 COOH + 2Na → 2CH 3 COONa + H 2
4. Каждый последующий металл может быть восстановлен из раствора соли предыдущим металлом: Fe + CuSO 4 FeSO 4 + Cu.
Переходные металлы расположены в Периодической системе с 4 по 7 период. Переходные металлы, символы которых расположены в самой таблице, называют d-элементами, а те элементы, символы которых расположены в нижней части Периодической системы, называют лантаноидами и актиноидами или f-элементами.
Амфотерные оксиды - оксиды переходных металлов.
1. Амфотерные оксиды не растворяются в воде.
2. Амфотерные оксиды, реагируя с основными и с кислотными оксидами, дают соли:
Al 2 O 3 + K 2 O 2KAlO 2 ,
Al 2 O 3 + 3SO 3 Al 2 (SO 4 ) 3 .
3. Амфотерные оксиды, реагируя с основными или кислотными гидроксидами, дают соли:
ZnO + 2KOH K 2 ZnO 2 + H 2 O,
ZnO + H 2 SO 4 ZnSO 4 + H 2 O
4. Соответствующие амфотерным оксидам гидроксиды обладают амфотерными свойствами:
Zn(OH) 2 Zn 2+ + 2OH - - как основание
H 2 ZnO 2 2H + + ZnO 2 2- - как кислота
Амфотерные гидроксиды - это такие гидроксиды, где растворенная в воде часть, диссоциирует на катионы водорода, металла и анионы гидроксида и кислотного остатка.
Zn(OH) 2 ⇆ Zn 2+ + 2OH - , H 2 ZnO 2 ⇆ 2H + + ZnO 2 2-
1.Взаимодействием переходных металлов (после удаления оксидной пленки) с водой:
2Al + 6H2O = 2Al(OH) 3 + 3H 2 ↑
2.Взаимодействие солей со щелочами:
ZnCl 2 + 2KOH Zn(OH) 2 + 2KCl
3. Взаимодействием солей с кислотами:
Na[Al(OH) 4 ] + HCl Al(OH) 3 + NaCl + H 2 O
1. Диссоциирует на ионы растворенная в воде часть амфотерного гидроксида: Zn(OH) 2 ⇆ Zn(OH) + + OH - ⇆ Zn 2+ + 2OH -
H 2 ZnO 2 ⇆ HZnO 2- + H + ⇆ZnO 2 2- + 2H +
2. Взаимодействие с кислотными оксидами, кислотами и кислыми солями:
2Cr(OH) 3 + 3SO 3 Cr 2 (SO 4 ) 3 + 3H 2 O
Al(OH) 3 + 3HBr AlBr 3 + 3H 2 O
Zn(OH) 2 + 2NaHSO 4 ZnSO 4 + Na 2 SO 4 + 2H 2 O
3. Взаимодействуют с основными оксидами, основаниями и основными солями:
Zn(OH) 2 + Li 2 O Li 2 ZnO 2 + H 2 O
Zn(OH) 2 + Ba(OH) 2 BaZnO 2 + 2H 2 O
4. Подвергаются разложению при нагревании:
2Al(OH) 3 Al 2 O 3 + 3H 2 O
Приборы и реактивы:
- штатив с пробирками, пипетка, держатель для пробирок, спиртовки, спички, стеклянная палочка.
- растворы: серной кислоты, гидроксида натрия; растворы солей: сульфат меди (II),хлорид цинка, сульфат алюминия, сульфат натрия; кусочки: цинка, меди.
Порядок выполнения работы.
Опыт № 1. Взаимодействие металлов с растворами кислот.
Ход работы: В три пробирки положить: в первую кусочек магния, во вторую – гранулу цинка, в третью – медь (кусочек проволоки). Прилить во все пробирки 1 мл раствора серной кислоты.
Записать наблюдения в таблицу «Оформление отчета». Сравнить скорость происходящих реакций. Почему в одной из пробирок реакция не идёт? Дать объяснение. Записать уравнения реакций в молекулярном и ионном видах.
Опыт № 2. Взаимодействие металлов с солями.
Ход работы: В одну пробирку положить одну гранулу цинка и прилить раствор медного купороса, во вторую – кусочек медной проволоки и прилить раствор сульфата натрия.
Записать наблюдения в таблицу «Оформление отчета». Составить схему электронного баланса в окислительно–восстановительных реакциях.
Опыт № 3. Получение гидроксида цинка и испытание его амфотерных свойств.
Ход работы: В две пробирки налить по 5-6 капель раствора соли цинка и очень аккуратно по каплям добавить в них раствор щелочи до появления осадка.
Затем в одну пробирку добавить 2-3 капли раствора серной кислоты.
В другую пробирку добавить избыточное количество щелочи (до растворения осадка).
Записать наблюдения в таблицу «Оформление отчета». Составить уравнения реакций в молекулярном и ионном виде.
Опыт № 4. Получение гидроксида меди и изучение его свойств
Ход работы: Из имеющихся реактивов получить гидроксид меди (II). Указать цвет осадка. Нагреть полученное вещество.
Записать наблюдения в таблицу «Оформление отчета». Что произойдет с осадком при нагревании?
ГДЗ по химии за 9 класс к учебнику Рудзитиса. Ответы, решения онлайн

§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на ее скорость. (стр. 16-17):
§11. Практическая работа 2. Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”. (стр. 41-42):
Проверка домашнего задания по химии за 9 класс Рудзитиса из ГДЗ
По мере углубления в химию, как в науку и учебный предмет, современные школьники сталкиваются с более сложными темами. Особенно это становится заметным в процессе изучения теоретического материала и на практических занятиях в старших классах. Ответы к упражнениям из учебника Рудзитиса за 9 класс помогают самостоятельно разбираться с трудными задачами, и всегда находить правильное решение, быстро сделать домашнюю работу, готовиться к контрольным, тестовым заданиям, получать качественные знания во время удаленного обучения.
Общее описание решебника
Последнее издание решебника по химии 9 класс Рудзитиса представляет собой подробное пособие с ответами к задачам в учебнике с пошаговым описанием их решения, и это очень важный нюанс. Рассматривая данные алгоритмы, ребенок не будет бездумно списывать. Он начнет обретать понимание предмета. В дальнейшем сможет справляться с упражнениями или вопросом по теме любой главы или параграфа без помощи преподавателя, и в этом смысле ГДЗ является хорошим подспорьем к учебе в школе.
Усилиями авторов в методичке проработана каждая страница. Особое внимание они уделили основным темам, изучаемым на протяжении учебного года в классе. Таким, к примеру, как окислительные и восстановительные реакции, а также использование органических соединений, классификация химических элементов.
Изучая ГДЗ Рудзитиса, девятиклассники научатся выполнять непростые уравнения. Осваивать в короткий срок много полезного материала, получать необходимые знания в полном объеме.
Польза ГДЗ для родителей и учителей
Так как подобного рода пособия содержат готовые ответы на задания, которые ученики решают на уроках и дома, а значит, могут быть полезны родителям и педагогам. Больше не нужно тратить огромное количество времени, чтобы вникать в ту или иную задачу, решить уравнение, чтобы проверить уровень подготовки сына или дочери.
Достаточно скачать ГДЗ по химии 9 класс Рудзитис на ноутбук, декстоптное устройство и пользоваться им по мере необходимости или зайти на сайт онлайн. Таким образом можно осуществлять контроль успеваемости своего ребенка, не углубляясь в содержащуюся в учебниках информацию.
Учителям ГДЗ помогает готовиться к предстоящим занятиям, прорабатывать новые методики обучения, выбирать оптимальные варианты решения уравнений для разбора их на уроке, а так же проверять рабочие тетради. Относительно последнего, можно добавить, что только педагогу известно, сколько доставляет проблем и отнимает времени рутинная работа по проверке письменных контрольных, домашних, тестов, и т.д. Разработанное Гудзитисом Г.Е. и Фельдманом Ф.Г пособие в этом плане, однозначно лучший выход.
Важность науки
Важность этой науки переоценить невозможно. Без знания свойств химических веществ и их соединений сегодня не обходится ни одно производство или промышленность. Будь то газовые, нефтеперерабатывающие комплексы, фармакология или сельское хозяйство.
Предмет обширен и глубок, и что самое главное, важен. Именно по этой причине преподавание его начинается в общеобразовательном учебном заведении, и здесь важно не упустить момент, и вовлечь учащегося в процесс обучения. Увлечь его интересными теориями, теоремами и формулами, при этом дать понять, что при должном старании освоить его не так уж и сложно. Особенно, если это делать с подобными данному решебнику Рудзитиса сборниками, наполненными важной и полезной информацией.
Химия. Практическая работа по теме "Получение и свойства соединений металлов"

Данный документ содержит описание практической работы в виде таблице. Оформление индивидуально. В таблице красным цветом дан ответ. При подготовке таблицы необходимо содержимое двух колонок не выводить на печать. учащиеся сами должны заполнить данные колонки.
Просмотр содержимого документа
«Химия. Практическая работа по теме "Получение и свойства соединений металлов"»
Тема: Получение и свойства соединений металлов.
Инструктаж по Т.Б.
Цель работы: повторить основные вопросы химии металлов. На практике закрепить знания об основных свойствах металлов, качественные реакции по металлам.
Оборудование: наборы химических реактивов и оборудование к практической работе
1)В пробирку с раствором хлорида алюминия добавим по каплям раствор щелочи
2) В другую пробирку с раствором щелочи добавим раствор
Только, после добавления избытка А1С13 выпадет осадок А1(ОН)3.
3)Докажем амфотерный характер А1(ОН)3. Для этого, полученный осадок А1(ОН)3 разделим на 2 пробирки. В одну из пробирок добавим раствор любой сильной кислоты, в другую — раствор щелочи (избыток).
Наблюдаем образование белого осадка гидроксида алюминия.
В данном случае, щелочь присутствует в избытке, поэтому А1(ОН)3 в начале не образуется, идет образование алюмината натрия
В обоих случаях наблюдаем растворение осадка гидроксида алюминия;
Гидроксид алюминия растворяется, как в кислотах, так и в щелочах, поэтому он амфотерен
А1С13 + 3NaOH(недостаток) = 3NaCl + Al(OH)3↓
Al 3+ + 3Сl- + 3Na + + 3ОН - = А1(ОН)3↓ + 3Na + + 3Сl -
А1 3+ + 3ОН - = Al(OH)3↓
А1С13 + 4NaOH(избыток) = NaA1О2 + 3NaCl + 2Н2О
А1 3+ + 3Сl - + 4Na + + 40Н - = Na + +А1О2 - + 3Na + + 3Сl - + 2Н 2 О
А1(ОН)3 +3Н + +3Сl - = А1 3+ +3Сl - + 3Н2О
2. Для доказательства качественного состава СаС12 проведем реакции, характерные для катиона кальция и хлорид-аниона.
Для этого раствор СаС12 разольем на 2 пробирки.
В одну из них добавим раствор карбоната натрия,
В другую пробирку прильем раствор нитрата серебра
Наблюдаем выделение белого
осадка карбоната кальция СаСО3
Наблюдаем выделение белого творожистого осадка.
2Na + + СО3 2- + Са 2+ + 2Сl - = СаСО3↓ + Na + + 2Сl -
Са 2+ + 2Сl - + 2Ag + + 2NО3 - = Ca 2+ + 2NО3 - + 2AgCl↓
3. Необходимо осуществить следующие превращения:Fe → FeCI2 → FeCl3
В пробирку с железными опилками добавим раствор соляной кислоты.
Качественная реакция на ион железа (II):
Качественные реакции на ион железа (III):
а) Прильем к пробирке раствор желтой кровяной соли:
Наблюдаем растворение железа и выделение газообразного водорода
Наблюдаем, образование темно-синего осадка, следовательно, ионы Fe 2+ получены.
Наблюдаем, образование темно-синего осадка берлинской лазури, значит, в растворе присутствуют ионы железа (III).
Fe 0 + 2Н + С1 = Fe 2+ Cl2 + Н2 0 ↑
Fe 0 - 2е = Fe 2+ 2 1 восстановитель
2Н + +2е = Н2 0 2 1 окислитель
красная кровяная соль
3К + +[Fe(CN)6] 3- +Fe 2+ +2Сl - =KFe [Fe(CN)6]↓+2K + + 3Сl -
желтая кровяная соль берлинская лазурь
4К + + Fe 3+ +3Сl - +[Fe(CN)6] 4- =KFe [Fe(CN)6]↓+3K + + 3Сl -
Необходимо получить FeSO4 тремя различными способами:
В пробирку с железными опилками прильем разбавленный раствор серной кислоты.
В пробирку с раствором медного купороса добавим железо.
Наблюдаем растворение железа и выделение водорода
В результате реакции образуется сульфат железа.
Наблюдаем, изменение окраски раствора, из голубого раствор становится светло-зеленым, который быстро желтеет и мутнеет. В результате реакции выделяется красная медь.
Cu 2+ SO4 + Fe° = Fe +2 SO4 + Cu 0 ↓
Голубой светло-зеленый красный
Fe° -2е= Fe 2+ восстановитель
4. Для получения FeSО4 осуществим следующие превращения: FeCl2→ Fe(OH)2 → FeSО4
К раствору хлорида железа прильем раствор щелочи:
К полученному, в предыдущем опыте осадку Fe(OH)2 добавим раствор серной кислоты
В результате реакции образуется осадок гидроксида железа (II) белого цвета.
Fe 2+ + 2Сl - + 2Na + + 2ОH - = 2Na + + 2Сl - + Fe(OH)2↓
5. Для доказательства качественного состава FeSО4 разольем раствор сульфата железа в 2 пробирки.
В одну из них добавим раствор красной кровяной соли:
В другую пробирку, добавим раствор хлорида бария:
Наблюдаем, образование темно-синего осадка, значит, в растворе присутствуют ионы железа — Fe2+.
Наблюдаем, выделение белого осадка сульфата бария BaSО4, значит, в растворе присутствуют сульфат-ионы SО4 2- .
Практическая работа № 2. Получение и свойства соединений металлов
В пробирку с железными опилками добавляется раствор соляной кислоты.
Уравнения реакций. Вывод.
Добавим к полученному хлориду железа (II) щелочи.
Оставим осадок на несколько минут.
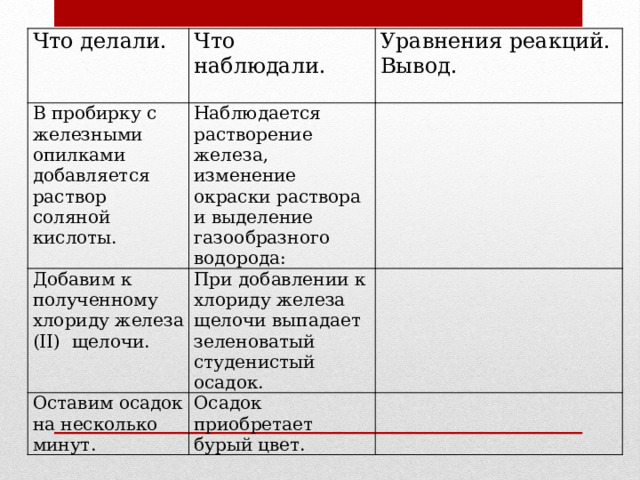
Наблюдается растворение железа, изменение окраски раствора и выделение газообразного водорода:
При добавлении к хлориду железа щелочи выпадает зеленоватый студенистый осадок.
Осадок приобретает бурый цвет.
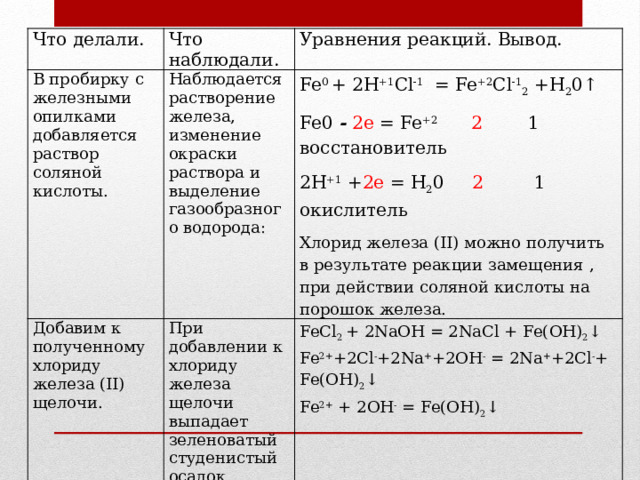
Fe 0 + 2Н +1 Сl -1 = Fe +2 Cl -1 2 +Н 2 0↑
Fe0 - 2е = Fe +2 2 1 восстановитель
FeCl 2 + 2NaOH = 2NaCl + Fe(OH) 2 ↓
2Н +1 + 2е = Н 2 0 2 1 окислитель
Fe 2+ +2Сl - +2Na + +2ОH - = 2Na + +2Сl - + Fe(OH) 2 ↓
На воздухе гидроксид железа (II) превращается в гидроксид железа(III).
Хлорид железа (II) можно получить в результате реакции замещения , при действии соляной кислоты на порошок железа.
Fe 2+ + 2ОH - = Fe(ОH) 2 ↓
4Fe(OH) 2 + 2Н 2 О + О 2 = 4Fe(OH) 3
СаСI 2
Задание 2 ( 8 минут) Проведите реакции, подтверждающие качественный состав хлорида кальция. Запишите уравнения реакций в молекулярной и ионной формах.


Определение ионов кальция

Качественная реакция на хлорид - ионы
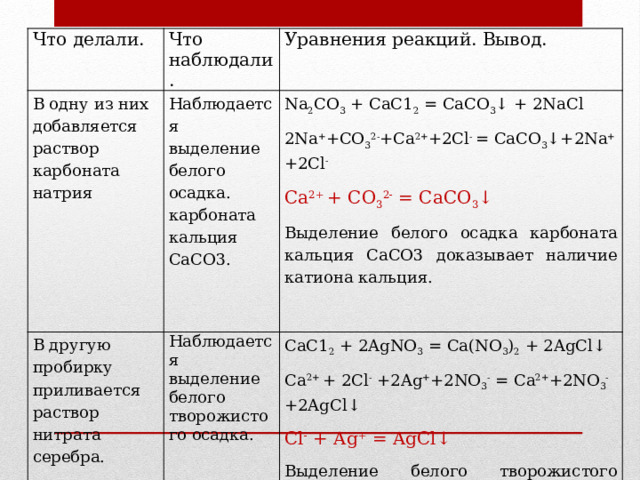
В одну из них добавляется раствор карбоната натрия
Наблюдается выделение белого осадка. карбоната кальция СаСО3.
В другую пробирку приливается раствор нитрата серебра.
Na 2 CО 3 + СаС1 2 = CaCО 3 ↓ + 2NaCl
Наблюдается выделение белого творожистого осадка.
2Na + +СО 3 2- +Са 2+ +2Сl - = СаСО 3 ↓+2Na + +2Сl -
СаС1 2 + 2AgNО 3 = Ca(NО 3 ) 2 + 2AgCl↓
Са 2+ + СО 3 2- = CaCО 3 ↓
Са 2+ + 2Сl - +2Ag + +2NО 3 - = Ca 2+ +2NО 3 - +2AgCl↓
Выделение белого осадка карбоната кальция СаСО3 доказывает наличие катиона кальция.
Выделение белого творожистого осадка – это качественная реакция на хлорид-анион .

Задание 3 (8 минут) Получите сульфат железа (II) не менее чем тремя способами. Уравнения реакций ионного обмена запишите в молекулярной и ионной формах, а реакции замещения рассмотрите с точки зрения окисления-восстановления.
Чтобы осуществить эти превращения надо знать химические свойства веществ.
Что соли получаются соли:
- при взаимодействии металла с неметаллом;
- оксида металла с кислотой,;
- основания с кислотой;
- соли с кислотой;
- основания с солью ;
- соли с металлом).
Проделайте соответствующие заданию реакции. Каждый способ получения должен проходить в одну стадию. При необходимости воспользуйтесь нагреванием. Твердые вещества берите в небольших количествах.

Взаимодействие серной кислоты с железом

Взаимодействие сульфата меди с железом

Получение гидроксида железа II и изучение его свойств

1 . В пробирку с железными опилками приливается разбавленный раствор H 2 SО 4
Наблюдается растворение железа, окрашивание раствора и выделение водорода.
2 . В пробирку с раствором медного купороса добавляется железо.
Fe° + H 2 +1 S0 4 =Fe +2 S0 4 + H 2 °↑
3 . В пробирку с гидроксидом железа добавляется H 2 SО 4 .
Наблюдается изменение окраски, из голубого раствор становится светло-зеленым. Порошок становится красным.
Fe 0 - 2е = Fe +2 2 1 восстановитель
Происходит изменение окраски раствора – становится слегка зеленоватым.
- Cu +2 SO 4 + Fe 0 = Fe +2 SO 4 + Cu 0
- Fe 0 - 2е = Fe +2 восстановитель
- Cu +2 +2е = Cu 0 окислитель
- В результате реакции образуется сульфат железа и медь.
2Н +1 +2е = Н 2 0 2 1 окислитель
- Fe(ОН) 2 + H 2 SО 4 = FeSО 4 + H 2 О
- В результате реакции образуется сульфат железа.
- Возможен вариант получения сульфата железа(II) действием на карбонат железа(II) серной кислоты.
Описание опыта:

Учебник химии Габиелян О.С. 9 класс.Просвещение Дрофа.
Литература и интернет ресурсы:

-82%

Читайте также:
