Свойства оксидов и гидроксидов металлов
Обновлено: 04.10.2024

презентация к уроку по теме "Оксиды и гидроксиды металлов". Урок-обобщение. Сравниваются свойства металлов 1,2,3 групп главных подгрупп и их кислородных соединений.
Просмотр содержимого документа
«Оксиды и гидроксиды металлов»
или = водород + основание (если основание не растворимо в воде)
Реакция протекает только в том случае, если
металл находится в ряду активности до водорода.
Основание – сложное вещество, в котором каждый атом металла связан с одной или несколькими гидроксогруппами.
в степенях окисления +1 и +2 проявляют основные свойства ,
Заполнить таблицу: Сравнительная характеристика оксидов и гидроксидов
металлов главных подгрупп I - III групп
Вопросы для сравнения
I группа
II группа
Степень окисления Ме в оксиде.
2. Физические свойства.
III группа
3. Химические свойства (сравнить).
4. Способы получения оксидов.
Взаимодействие:
б) с кислотами
в) с кислотными оксидами
г) с амфотерными оксидами
д) со щелочами
5. Формула гидроксида.
Степень окисления Ме в гидроксиде.
6. Физические свойства
7. Химические свойства (сравнить).
8. Способы получения гидроксидов.
а) действие на индикаторы
г) с растворами солей
д) с неметаллами
е) со щелочами
ж) с амфотерными оксидами и гидроксидами
з) отношение к нагреванию

Свойства оксидов и гидроксидов в периоде изменяются от основных через амфотерные к кислотным, т.к. увеличивается положительная степень окисления элементов.
Na 2 O , Mg +2 O , Al 2 O 3
основные амфотерный
Na +1 O Н , Mg +2 (O Н ) 2 , Al +3 (O Н ) 3
щелочь Слабое Амфотерный
основание гидроксид
В главных подгруппах основные свойства оксидов и гидроксидов возрастают сверху вниз .

Соединения металлов I А группы
Оксиды щелочных металлов
Общая формула Ме 2 О
Физические свойства: Твердые, кристаллические вещества, хорошо растворимые в воде.
Li 2 O , Na 2 O – бесцветные, К 2 О, Rb 2 O – желтые, Cs 2 О – оранжевый.
Способы получения:
Окислением металла получается только оксид лития
4 Li + O 2 → 2 Li 2 O
(в остальных случаях получаются пероксиды или надпероксиды).
Все оксиды (кроме Li 2 O ) получают при нагревании смеси пероксида (или надпероксида) с избытком металла:
Na 2 O 2 + 2Na → 2Na 2 O
KO 2 + 3K → 2K 2 O
Химические свойства
Типичные основные оксиды:
Взаимодействуют с водой, образуя щелочи: Na 2 О + H 2 O →
2. Взаимодействуют с кислотами, образуя соль и воду: Na 2 О + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: Na 2 О + SO 3 →
4. Взаимодействуют с амфотерными оксидами, образуя соли: Na 2 О + ZnO → Na 2 ZnO 2

Гидроксиды щелочных металлов
Общая формула – МеОН
Физические свойства: Белые кристаллические вещества, гигроскопичны, хорошо растворимы в воде (с выделением тепла). Растворы мылкие на ощупь, очень едкие.
NaOH – едкий натр
КОН – едкое кали
Сильные основания - Щелочи. Основные свойства усиливаются в ряду:
LiOH → NaOH → KOH → RbOH → CsOH
1. Электролиз растворов хлоридов:
2NaCl + 2H 2 O → 2NaOH + H 2 + Cl 2
2. Обменные реакции между солью и основанием:
K 2 CO 3 + Ca(OH) 2 → CaCO 3 + 2KOH
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
2 Li + 2 H 2 O → 2 LiOH + H 2
Li 2 O + H 2 O → 2 LiOH
Na 2 O 2 + 2 H 2 O → 2 NaOH + H 2 O 2
![Химические свойства 1. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют со всеми кислотами. NaOH + HCl → NaCl + H 2 O 3. Взаимодействуют с кислотными оксидами. 2NaOH + SO 3 → Na 2 SO 4 + H 2 O 4. Взаимодействуют с растворами солей, если образуется газ или осадок. 2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4 5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором) 2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑ 6. Взаимодействуют с амфотерными оксидами и гидроксидами 2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ] 2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ] 7. При нагревании не разлагаются, кроме LiOH .](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img11.jpg)
1. Изменяют цвет индикаторов:
Лакмус – на синий
Фенолфталеин – на малиновый
Метил-оранж – на желтый
2. Взаимодействуют со всеми кислотами.
NaOH + HCl → NaCl + H 2 O
3. Взаимодействуют с кислотными оксидами.
2NaOH + SO 3 → Na 2 SO 4 + H 2 O
4. Взаимодействуют с растворами солей, если образуется газ или осадок.
2 NaOH + CuSO 4 → Cu(OH) 2 ↓ + Na 2 SO 4
5. Взаимодействуют с некоторыми неметаллами (серой, кремнием, фосфором)
2 NaOH +Si + H 2 O → Na 2 SiO 3 + 2H 2 ↑
6. Взаимодействуют с амфотерными оксидами и гидроксидами
2 NaOH + Zn О + H 2 O → Na 2 [ Zn ( OH ) 4 ]
2 NaOH + Zn (ОН) 2 → Na 2 [ Zn ( OH ) 4 ]
7. При нагревании не разлагаются, кроме LiOH .
![Соединения металлов главной подгруппы II группы Оксиды металлов II А группы Общая формула МеО Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде. Способы получения: Окисление металлов (кроме Ba , который образует пероксид) 2Са + О 2 → 2СаО 2) Термическое разложение нитратов или карбонатов CaCO 3 → CaO + CO 2 2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2 Химические свойства ВеО – амфотерный оксид Оксиды Mg , Ca , Sr , Ba – основные оксиды Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание): СаО + H 2 O → 2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl → 3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 → 4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img12.jpg)
Соединения металлов главной подгруппы II группы
Оксиды металлов II А группы
Общая формула МеО
Физические свойства: Твердые, кристаллические вещества белого цвета, малорастворимые в воде.
Окисление металлов (кроме Ba , который образует пероксид)
2) Термическое разложение нитратов или карбонатов
CaCO 3 → CaO + CO 2
2Mg(NO 3 ) 2 → 2MgO + 4NO 2 + O 2
ВеО – амфотерный оксид
Оксиды Mg , Ca , Sr , Ba – основные оксиды
Взаимодействуют с водой(кроме ВеО), образуя щелочи( Mg ( OH ) 2 – слабое основание):
2. Взаимодействуют с кислотами, образуя соль и воду: СаО + Н Cl →
3. Взаимодействуют с кислотными оксидами, образуя соли: СаО + SO 3 →
4. ВеО взаимодействует со щелочами: ВеО + 2 NaOH + H 2 O → Na 2 [Ве( OH ) 4 ]

Гидроксиды металлов II А группы
Общая формула – Ме(ОН) 2
Физические свойства: Белые кристаллические вещества, в воде растворимы хуже, чем гидроксиды щелочных металлов. Ве(ОН) 2 – в воде нерастворим.
Основные свойства усиливаются в ряду:
Ве(ОН) 2 → Mg (ОН) 2 → Ca (ОН) 2 → Sr (ОН) 2 → В a (ОН) 2
Реакции щелочноземельных металлов или их оксидов с водой:
Ba + 2 H 2 O → Ba ( OH ) 2 + H 2
CaO (негашеная известь) + H 2 O → Ca ( OH ) 2 (гашеная известь)
![Химические свойства Ве(ОН) 2 – амфотерный гидроксид Mg (ОН) 2 – слабое основание Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи. Изменяют цвет индикаторов: Лакмус – на синий Фенолфталеин – на малиновый Метил-оранж – на желтый 2. Взаимодействуют с кислотами, образуя соль и воду: Ве(ОН) 2 + Н 2 SO 4 → 3. Взаимодействуют с кислотными оксидами: Са(ОН) 2 + SO 3 → 4. Взаимодействуют с растворами солей, если образуется газ или осадок: Ва(ОН) 2 + K 2 SO 4 → Гидроксид бериллия взаимодействует со щелочами: Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ] При нагревании разлагаются: Са(ОН) 2 →](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img14.jpg)
Ве(ОН) 2 – амфотерный гидроксид
Mg (ОН) 2 – слабое основание
Са(ОН) 2 , Sr (ОН) 2, Ва(ОН) 2 – сильные основания – щелочи.
Изменяют цвет индикаторов:
2. Взаимодействуют с кислотами, образуя соль и воду:
Ве(ОН) 2 + Н 2 SO 4 →
3. Взаимодействуют с кислотными оксидами:
4. Взаимодействуют с растворами солей, если образуется газ или осадок:
Ва(ОН) 2 + K 2 SO 4 →
Гидроксид бериллия взаимодействует со щелочами:
Ве(ОН) 2 + 2 NaOH → Na 2 [Ве( OH ) 4 ]
При нагревании разлагаются: Са(ОН) 2 →

Соединения металлов главной подгруппы III группы
Соединения алюминия
Оксид алюминия
Al 2 O 3
O = Al – O – Al = O
Физические свойства: Глинозем, корунд, окрашенный – рубин (красный), сапфир (синий).
Твердое тугоплавкое ( t° пл.=2050 ° С) вещество; существует в нескольких кристаллических модификациях.
Сжигание порошка алюминия: 4 Al + 3 O 2 → 2 Al 2 O 3
Разложение гидроксида алюминия: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O
![Химические свойства Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует. 1) Реагирует с кислотами и растворами щелочей: Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ] 2) Сплавляется со щелочами или карбонатами щелочных металлов: Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2 Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img16.jpg)
Al 2 O 3 - амфотерный оксид с преобладанием основных свойств; с водой не реагирует.
1) Реагирует с кислотами и растворами щелочей:
Как основной оксид: Al 2 O 3 + 6 HCl → 2 AlCl 3 + 3 H 2 O
Как кислотный оксид: Al 2 O 3 + 2 NaOH + 3 H 2 O → 2 Na [ Al ( OH ) 4 ]
2) Сплавляется со щелочами или карбонатами щелочных металлов:
Al 2 O 3 + Na 2 CO 3 → 2 NaAlO 2 (алюминат натрия) + CO 2
Al 2 O 3 + 2 NaOH → 2 NaAlO 2 + H 2 O
![Гидроксид алюминия Al ( OH ) 3 Физические свойства: белое кристаллическое вещество, нерастворимое в воде. Способы получения: 1) Осаждением из растворов солей щелочами или гидроксидом аммония: AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4 Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый) 2) Слабым подкислением растворов алюминатов: Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3 Химические свойства Al ( OH ) 3 - а мфотерный гидроксид : 1) Реагирует с кислотами и растворами щелочей: Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ] (тетрагидроксоалюминат натрия) При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O](https://fhd.multiurok.ru/7/1/9/71916e172d6e8014fda6fe596c61f1a968dc3906/img17.jpg)
Гидроксид алюминия Al ( OH ) 3
Физические свойства: белое кристаллическое вещество,
нерастворимое в воде.
1) Осаждением из растворов солей щелочами или гидроксидом аммония:
AlCl 3 + 3NaOH → Al(OH) 3 + 3NaCl
Al 2 (SO 4 ) 3 + 6NH 4 OH → 2Al(OH) 3 + 3(NH 4 ) 2 SO 4
Al 3+ + 3 OH ¯ → Al ( OH ) 3 (белый студенистый)
2) Слабым подкислением растворов алюминатов:
Na[Al(OH) 4 ] + CO 2 → Al(OH) 3 + NaHCO 3
Al ( OH ) 3 - а мфотерный гидроксид :
Как основание Al ( OH ) 3 + 3 HCl → AlCl 3 + 3 H 2 O
Как кислота Al ( OH ) 3 + NaOH → Na [ Al ( OH ) 4 ]
При нагревании разлагается: 2 Al ( OH ) 3 → Al 2 O 3 + 3 H 2 O

Оксиды и гидроксиды металлов


-82%
Характеристика ХЭ по кислотно-основным свойствам. Амфотерные оксиды и гидроксиды

В этом видеофрагменте профессор Колбочкин рассказывает о способности некоторых оксидов и гидроксидов проявлять амфотерные свойства. А разобраться с этим поможет рассказ о двуличном Алюминии. Кроме этого, профессор разъяснит, как определить, какими свойствами будет обладать тот или иной оксид или гидроксид: кислотными, основными или амфотерными. Он покажет опыт, иллюстрирующий свойства гидроксида цинка, составит соответствующие уравнения реакций и покажет элементы в Периодической системе, соединения которых проявляют амфотерные свойства.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Характеристика ХЭ по кислотно-основным свойствам. Амфотерные оксиды и гидроксиды"
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Как же определить: кислотными или основными свойствами будет обладать то или иное соединение? Это совсем несложно, достаточно просто посмотреть Периодическую систему химических элементов Д.И. Менделеева.



А что же такое амфотерные оксиды и гидроксиды. Это слово, наверняка, вы слышали, но этому понятию ранее не придавалось никакого значения. Попробуйте сами догадаться, а для этого мы проведем опыт по получению гидроксида цинка (Zn(OH)2) и исследованию его свойств. Для этого, в две пробирки нальем раствора соли хлорида цинка (ZnCl2) и добавим в каждую несколько капель раствора гидроксида натрия (NaOH). При этом можно наблюдать выпадение осадка белого цвета. Таким образом, мы получили гидроксид цинка реакцией обмена между хлоридом цинка и гидроксидом натрия.

Исследуем свойства гидроксида цинка. Для этого, в одну пробирку мы прильем соляной кислоты (HCl), и что же мы наблюдаем, осадок начинает растворяться. Во вторую пробирку прильем раствора гидроксида натрия (NaOH), и в этом случае осадок тоже растворяется.
Какой же все-таки двуличный этот гидроксид цинка: он вступает в реакции и с кислотами, и с основаниями. Значит, все гидроксиды, которые реагируют и с основаниями, и с кислотами называются амфотерными. Они могут вести себя как кислоты в реакциях со щелочами и как основания в реакциях с кислотами. Т.е. в зависимости от условий они могут проявлять как кислотные свойства, так и основные. Значит, и записать химическую формулу гидроксида цинка можно по-разному: в виде кислоты H2ZnO2 и в виде основания Zn(OH)2.
Давайте запишем уравнения этих реакций:

В первой реакции образуется соль хлорид цинка (ZnCl2), а во второй комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]).
И цинк, и его оксид будут тоже амфотерными соединениями.
Например, цинк реагирует с кислотами: если в пробирку с цинком прилить серной кислоты (H2SO4), то будет выделяться газ. В результате этой реакции образуется соль – сульфат цинка (ZnSO4) и выделяется газ – водород (H2).
Zn 0 + 2H + = Zn 2+ + H2↑
Цинк будет реагировать и со щелочами. Запомните, если реакция протекает в растворе, то образуется комплексная соль тетрагидроксоцинкат натрия (Na2[Zn(OH)4]), при сплавлении образуется соль – цинкат натрия (Na2ZnO2), но водород выделяется в обоих случаях.
Аналогично ведет себя и оксид цинка, т.е. он реагирует с кислотами и с основаниями.
Например, в реакции оксида цинка (ZnO) с соляной кислотой образуется соль – хлорид цинка, в реакции оксида цинка с раствором гидроксида натрия образуется опять комплексная соль – тетрагидроксоцинкат натрия, а при сплавлении с гидроксидом натрия – цинкат натрия.
ZnO + 2H + = Zn 2+ + H2O
А сейчас послушайте историю про двуличного Алюминия.
Жил да был на свете хитрец-наглец по имени Алюминий. Его владения находились между двумя могущественными королевствами. Одним королевством правил молодой жизнерадостный король Натрий. Все в его королевстве было голубым: чистое голубое небо, глубокие прозрачные голубые озера и реки, голубые цветы благоухали на голубых полях. И жили в королевстве голубоглазые веселые и добрые люди. Работалось и жилось в королевстве легко, свободно, радостно. А это вызывало сильную зависть у правительницы другого королевства – Серы. Она вся пожелтела от зависти и злобы, порой даже начинала плавиться от внутреннего жара или гореть лиловым пламенем. Наконец ее терпение лопнуло после одного пышного празднества, устроенного Натрием в честь рождения сына, и Сера объявила войну Натрию.
Натрий, никогда и никому не желавший зла, по характеру мягкий, как воск, хоть ножом его режь, не был готов к войне. Он обратился к Алюминию: «Помоги, ведь мы с тобой из одного семейства – металлов». Алюминий согласился, но решил устроить так, чтобы оба войска перебили друг друга и он завладел бы и тем, и другим королевством.
Войска Натрия и Серы сражались, не жалея сил, выделяя огромное количество теплоты. А Алюминий со своим войском все выгадывал удобную позицию: если побеждало войско Натрия, он стремился быть в его гуще, если одерживало верх войско Серы, он перекидывался на его сторону. Наконец и Натрий, и Сера поняли хитрость и двойственность замыслов Алюминия. Оба послали самых сильных воинов с приказом уничтожить негодяя и предателя.
Алюминий увидел, что с двух сторон к нему стремительно приближаются два всадника. Вскоре два копья с силой вонзились в его безвольное тело.
Как видите, алюминий тоже проявляет двойственность свойств, т.е. он тоже является амфотерным, значит, его оксид и гидроксид тоже будут амфотерными.
Алюминий, как и цинк, реагирует с кислотами. Например, в реакции с серной кислотой (H2SO4) он также образует соль – сульфат алюминия (Al2(SO4)3) и при этом выделяется газ – водород (H2).
Алюминий реагирует и со щелочами: если реакция алюминия с гидроксидом натрия (NaOH) протекает в растворе, то в этом случае, как и в случае с цинком, образуется комплексная соль тетрагидроксоалюминат натрия (2Na[Al(OH)4])

Оксид алюминия и его гидроксид ведет себя тоже двойственно. При реакции оксида алюминия (Al2O3) с соляной кислотой (HCl), он ведет себя, как основный оксид, при этом образуется соль – хлорид алюминия (AlCl3). А при взаимодействии с раствором щелочи, этот же оксид ведет себя как кислота, при этом образуется комплексная соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]), или гексагидроксоалюминат натрия (Na3[Al(OH)6]), что будет верно в любом случае. А вот при сплавлении со щелочью, образуется соль – метаалюминат натрия (NaAlO2).
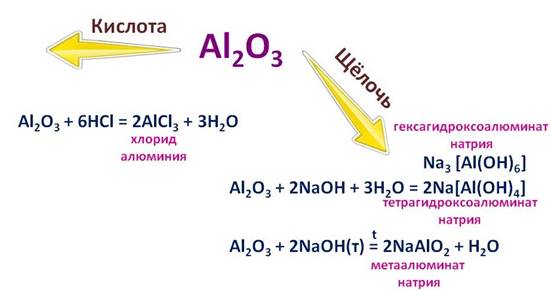
Гидроксид алюминия (Al(OH)3)тоже является амфотерным, поэтому он реагирует с кислотами и с основаниями.
Например, в реакции соляной кислотой (HCl), он себя ведет, как основание, при этом образуется соль – хлорид алюминия (AlCl3) и вода (H2O) , а вот в реакции с гидроксидом натрия (NaOH), он ведет себя, как кислота. Если реакция протекает в растворе, то образуется комплексная соль – тетрагидроксоалюминат натрия (Na[Al(OH)4]), или гексагидроксоалюминат натрия (Na3[Al(OH)6]), а при сплавлении другая соль – метаалюминат натрия (NaAlO2).
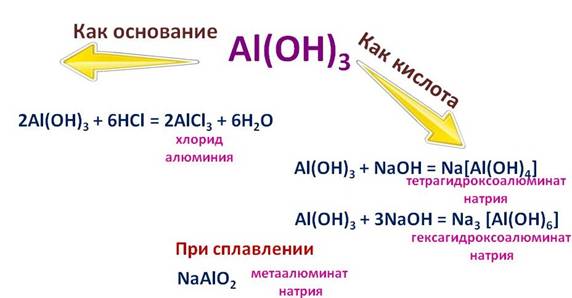
Будьте внимательны, посмотрите амфотерные элементы в периодической таблице. Интересно, что элементы побочных подгрупп, в промежуточной степени окисления также могут проявлять амфотерные свойства, эти элементы еще называют переходными элементами или переходными металлами.

К амфотерным элементам относятся: Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po, Cr, Mn, Fe, Zn, Cd, Au и др.
Видеоурок содержит материал об основных оксидах и гидроксидах металлов, их физических и химических свойствах.

Конспект урока "Оксиды и гидроксиды металлов"
Для всех металлов известны их оксиды и гидроксиды, а у d-элементов различные степени окисления, поэтому они образуют множество оксидов и гидроксидов. Свойства этих оксидов и гидроксидов зависят от положения металла в периодической системе, от его активности и степени окисления металла. Таким образом, все металлы образуют солеобразующие оксиды.
Известно, что чем ярче выражены металлические свойства, тем сильнее основные свойства оксидов и гидроксидов.
Для s- и p-элементов слева направо по периоду уменьшаются металлические свойства, а значит и основные свойства оксидов и гидроксидов металлов. В IA группе сверху вниз увеличиваются радиусы атомов, при отдаче электронов с внешнего уровня образуются катионы. Естественно, что степень окисления у этих элементов не изменяется, а основный характер оксидов усиливается.

Если рассмотреть изменение свойств оксидов элементов по периоду на примере элементов 3 периода, то следует отметить, что в атомах этих элементов количество энергетических уровней одинаковое, но степень окисления изменяется, то есть она возрастает, а радиус иона уменьшается, поэтому характер оксидов изменяется от основного через амфотерные к кислотному.

Например, оксиды и гидроксиды щелочных и щелочноземельных металлов проявляют ярко выраженные основные свойства, а уже оксид алюминия проявляют амфотерные свойства.
Так, оксид натрия – это основный оксид, поэтому он будет реагировать с кислотными и амфотерными оксидами, с кислотами. Например, в реакции оксида натрия с оксидом углерода (IV) образуется соль – карбонат натрия, в реакции оксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.

По группе сверху вниз металлические свойства s- и p-элементов усиливаются, поэтому усиливаются и основные свойства их оксидов.

Например, в группе II A оксид бериллия проявляет амфотерные свойства, поэтому он легко растворяется в растворах кислот и щелочей. Например, в реакции оксида бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции оксида бериллия с раствором гидроксида натрия образуется комплексная соль – тетрагидроксобериллат натрия.

Соединения бария и радия имеют уже ярко выраженные основные свойства, поэтому они будут реагировать с кислотными и амфотерными оксидами, а также с кислотами. Так, в реакции оксида бария с азотной кислотой образуется соль – нитрат бария и вода.

Характер гидроксида зависит также от степени окисления и радиуса иона. Чем больше степень окисления, тем меньше радиус иона.

Поэтому в ряду от гидроксида натрия до гидроксида алюминия идёт ослабление основных свойств и усиление кислотных, так как возрастает степень окисления и уменьшается радиус иона.

Например, в I A группе сверху вниз увеличивается радиус иона, степень окисления не изменяется, поэтому усиливаются основные свойства. В ряду от гидроксида лития до гидроксида цезия основные свойства будут усиливаться.

Переходные элементы, расположенные в малых периодах – это Be, Al образуют оксиды и гидроксиды, проявляющие амфотерные свойства.
Получим гидроксид алюминия и исследуем его свойства. Сначала в растворимую соль алюминия добавим щелочь, в результате у нас образуется осадок – это гидроксид алюминия.

Затем разделим этот осадок на две части: к первой части добавим соляную кислоту, осадок растворяется из-за образования растворимой соли – хлорида алюминия. Ко второй части осадка добавим гидроксид калия – осадок также растворяется, потому что образуется растворимая соль – тетрагидроксоалюминат калия.
Амфотерные оксиды и гидроксиды вступают в реакции не только с растворами щелочей, но и с твёрдыми основаниями при сплавлении.
Например, при сплавлении гидроксида хрома (III) с гидроксидом калия образуется соль – метахромит калия и вода, при сплавлении гидроксида хрома (III) с оксидом калия образуется метахромит калия и вода, при сплавлении гидроксида хрома (III) с карбонатом калия также образуется соль метахромит калия, вода и углекислый газ.

Аналогично оксид и гидроксид алюминия ведёт себя: при сплавлении оксида алюминия и гидроксида калия образуется соль – металюминат калия и вода, при сплавлении гидроксида алюминия и гидроксида калия образуется соль – метаалюминат калия и вода.
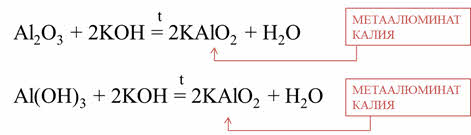
Оксид и гидроксид бериллия также проявляет амфотерные свойства, потому что они реагирует с кислотами, щелочами. Так, в реакции оксида бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции гидроксида бериллия и серной кислоты образуется соль – сульфат бериллия и вода.

Большое влияние на кислотно-основные свойства оксидов и гидроксидов d-элементов оказывает степень окисления металла, поэтому с увеличением степени окисления металла кислотные свойства соответствующего оксида и гидроксида усиливаются. Например, хром образует оксиды и гидроксиды, в которых атомы хрома проявляют степени окисления +2, +3 и +6.
В оксиде CrO и гидроксиде Cr(OH)2 степень окисления хрома +2, поэтому этот оксид и гидроксид будут проявлять основные свойства. В оксиде Cr2O3 и гидроксиде Cr(OH)3 окисления хрома +3, поэтому оксид и гидроксид в этой степени окисления будут проявлять амфотерные свойства, в оксиде CrO3 и гидроксиде H2CrO4 степень окисления хрома +6 – это высшая степень окисления для атома хрома, поэтому этот оксид и гидроксид проявляют кислотные свойства.


Таким образом, с увеличением степени окисления металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основных через амфотерные к кислотным.
Читайте также:
