Свойства веществ с металлической кристаллической решеткой
Обновлено: 19.05.2024
Тип урока: Комбинированный.
Цель урока: Создать условия для формирования умения учащихся устанавливать причинно-следственную зависимость физических свойств веществ от вида химической связи и типа кристаллической решетки, предсказывать тип кристаллической решетки на основе физических свойств вещества.
Задачи урока:
- Сформировать понятия о кристаллическом и аморфном состоянии твердых тел, ознакомить учащихся с различными типами кристаллических решеток, установить зависимость физических свойств кристалла от характера химической связи в кристалле и типа кристаллической решетки, дать учащимся основные представления о влиянии природы химической связи и типов кристаллических решеток на свойства вещества.
- Продолжить формирование мировоззрения учащихся, рассмотреть взаимное влияние компонентов целого-структурных частиц веществ, в результате которого появляются новые свойства, воспитывать умения организовать свой учебный труд, соблюдать правила работы в коллективе.
- Развивать познавательный интерес школьников, используя проблемные ситуации;
Оборудование: Периодическая система Д.И. Менделеева, коллекция «Металлы», неметаллы: сера, графит, красный фосфор, кристаллический кремний, йод; Презентация «Типы кристаллических решёток», модели кристаллических решеток разных типов (поваренной соли, алмаза и графита, углекислого газа и йода, металлов), образцы пластмасс и изделий из них, стекло, пластилин, компьютер, проектор.
Ход урока
1. Организационный момент.
Учитель приветствует учеников, фиксирует отсутствующих.
2. Проверка знаний по темам” Химическая связь. Степень окисления”.
Самостоятельная работа (15 минут)
3. Изучение нового материала.
Учитель озвучивает тему урока и цель урока. (Слайд 1,2)
Учащиеся записывают в тетради дату, тему урок.
Актуализация знаний.
Учитель задаёт вопросы классу:
- Какие виды частиц вы знаете? Имеют ли заряды ионы, атомы и молекулы?
- Какие виды химических связей вы знаете?
- Какие вам известны агрегатные состояния веществ?
Учитель: «Любое вещество может быть газом, жидкостью и твёрдым веществом. Например, вода. При обычных условиях – это жидкость, но она может быть паром и льдом. Или кислород при обычных условиях представляет собой газ, при температуре -1940 C он превращается в жидкость голубого цвета, а при температуре -218,8°C затвердевает в снегообразную массу, состоящую из кристаллов синего цвета. На этом уроке мы рассмотрим твёрдое состояние веществ: аморфное и кристаллическое». (Слайд 3)
Учитель: аморфные вещества не имеют чёткой температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. К аморфным веществам относят, например шоколад, который тает и в руках и во рту; жевательную резинку, пластилин, воск, пластмассы (показываются примеры таких веществ). (Слайд 7)
Кристаллические вещества имеют чёткую температуру плавления и, главное, характеризуются правильным расположением частиц в строго определенных точках пространства. (Слайды 5,6) При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решёткой. Точки, в которых размещены частицы кристалла, называют узлами решётки.
Учащиеся записывают в тетрадь определение: «Кристаллической решёткой называют совокупность точек пространства, в которых располагаются частицы, образующие кристалл. Точки, в которых размещаются частицы кристалла, называют узлами решётки».
В зависимости от того, какие виды частиц находятся в узлах этой решётки, различают 4 типа решёток. (Слайд 8) Если в узлах кристаллической решётки находятся ионы, то такая решётка называется ионной.
Учитель задаёт учащимся вопросы:
– Как будут называться кристаллические решётки, в узлах которых находятся атомы, молекулы?
Но есть кристаллические решётки, в узлах которых находятся и атомы, и ионы. Такие решётки называются металлическими.
Сейчас мы будем заполнять таблицу: «Кристаллические решётки, вид связи и свойства веществ». В ходе заполнения таблицы мы будем устанавливать взаимосвязь между типом решётки, видом связи между частицами и физическими свойствами твёрдых веществ.
Далее на экране появляется таблица. (Слайд 9). Её заполнение идёт в ходе диалога учителя с учащимися.
Рассмотрим 1-й тип кристаллической решётки, которая называется ионной. (Слайд 9)
– Какие частицы располагаются в узлах этой решётки?
– Какая химическая связь в этих веществах?
Посмотрите на ионную кристаллическую решётку (показывается модель такой решётки). В её узлах находятся положительно и отрицательно заряженные ионы. Например, кристалл хлорида натрия построен из положительных ионов натрия и отрицательных хлорид-ионов, образующих решётку в форме куба. К веществам с ионной кристаллической решёткой относятся соли, оксиды и гидроксиды типичных металлов. Вещества с ионной кристаллической решёткой обладают высокой твёрдостью и прочностью, они тугоплавкие и нелетучие.
Учитель: Физические свойства веществ с атомной кристаллической решёткой те же, что и у веществ с ионной кристаллической решёткой, но часто в превосходной степени – очень твёрдые, очень прочные. Алмаз, у которого атомная кристаллическая решётка – самое твёрдое вещество из всех природных веществ. Он служит эталоном твёрдости, которая по 10-бальной системе оценивается высшим баллом 10.(Слайд 10). По этому типу кристаллической решётки вы сами внесёте необходимые сведения в таблицу, самостоятельно поработав с учебником.
Учитель: Рассмотрим 3-й тип кристаллической решётки, которая называется металлической. (Слайды 11,12) В узлах такой решётки находятся атомы и ионы, между которыми свободно перемещаются электроны, связывая их в единое целое.
Далее учащиеся по учебнику рассматривают модель металлической кристаллической решётки.
Такое внутреннее строение металлов и определяет их характерные физические свойства.
Учитель: Какие физические свойства металлов вы знаете? (ковкость, пластичность, электро- и теплопроводность, металлический блеск).
Учитель: На какие группы делятся все вещества по строению? (Слайд 12)
Рассмотрим тип кристаллической решётки, которой обладают такие хорошо известные нам вещества как вода, углекислый газ, кислород, азот и другие. Она называется молекулярной. (Слайд14)
Далее учащиеся по учебнику рассматривают модель молекулярной кристаллической решётки.
Химическая связь в молекулах, которые находятся в узлах решётки, может быть и ковалентная полярная, и ковалентная неполярная. Несмотря на то, что атомы внутри молекулы связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярной кристаллической решёткой имеют малую твердость, низкие температуры плавления и летучие. Когда газообразные или жидкие вещества при особых условиях превращаются в твёрдые, тогда у них появляется молекулярная кристаллическая решётка. Примерами таких веществ может быть твёрдая вода – лёд, твёрдый углекислый газ – сухой лёд. Такую решётку имеет нафталин, который применяют для защиты шерстяных изделий от моли.
– Какими свойствами молекулярной кристаллической решётки обусловлено применение нафталина? (летучестью). Как видим, молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, H2,O2, N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза,сахар).
В узлах решеток находятся неполярные или полярные молекулы. Несмотря на то, что атомы внутри молекул связаны прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного взаимодействия.
Вывод: Вещества непрочные, имеют малую твердость, низкую температуру плавления, летучи.
Вопрос: Какой процесс называется возгонкой или сублимацией?
Ответ: Переход вещества из твердого агрегатного состояния сразу в газообразное, минуя жидкое, называется возгонкой или сублимацией.
Демонстрация опыта: возгонка йода
Потом учащиеся по очереди называют сведения, которые они записали в таблицу.
Кристаллические решетки, вид связи и свойства веществ.
| Тип решетки | Виды частиц в узлах решетки | Вид связи между частицами | Примеры веществ | Физические свойства веществ |
| Ионная | Ионы | Ионная – связь прочная | Соли, галогениды (IA, IIA),оксиды и гидроксиды типичных металлов | Твердые, прочные, нелетучие, хрупкие, тугоплавкие, многие растворимы в воде, расплавы проводят электрический ток |
| Атомная | Атомы | 1. Ковалентная не полярная – связь очень прочная 2. Ковалентная полярная – связь очень прочная | Простые вещества: алмаз (C), графит (C) , бор (B), кремний (Si). Сложные вещества: оксид алюминия (Al2O3), оксид кремния (IV) – SiO2 | Очень твердые, очень тугоплавкие, прочные, нелетучие, не растворимы в воде |
| Молекулярная | Молекулы | Между молекулами – слабые силы межмолекулярного притяжения, а вот внутри молекул – прочная ковалентная связь | Твердые вещества при особых условиях, которые при обычных – газы или жидкости (О2, Н2, Cl2, N2, Br2, H2O, CO2, HCl); сера, белый фос фор, йод; органические вещества | Непрочные, летучие, легкоплавкие, способны к возгонке, имеют небольшую твердость |
| Металлическая | Атом-ионы | Металлическая – разной прочности | Металлы и сплавы | Ковкие, обладают блеском, пластичностью, тепло- и электропроводны |
Учитель: Какой мы можем сделать вывод из проделанной работы по таблице?
Вывод 1: От типа кристаллической решётки зависят физические свойства веществ. Состав вещества → Вид химической связи → Тип кристаллической решетки → Свойства веществ. (Слайд 18).
Вопрос: Какой тип кристаллической решетки из рассмотренных выше не встречается в простых веществах?
Ответ: Ионные кристаллические решетки.
Вопрос: Какие кристаллические решетки характерны для простых веществ?
Ответ: Для простых веществ – металлов – металлическая кристаллическая решетка; для неметаллов – атомная или молекулярная.
Работа с Периодической системой Д.И. Менделеева.
Вопрос: Где в Периодической системе находятся элементы-металлы и почему? Элементы-неметаллы и почему?
Ответ: Если провести диагональ от бора до астата, то в нижнем левом углу от этой диагонали будут находиться элементы-металлы, т.к. на последнем энергетическом уровне они содержат от одного до трех электронов. Это элементы I A, II A, III A (кроме бора), а также олово и свинец, сурьма и все элементы побочных подгрупп.
Элементы-неметаллы находятся в верхнем правом углу от этой диагонали, т.к. на последнем энергетическом уровне содержат от четырех до восьми электронов. Это элементы IV A,V A, VI A, VII A, VIII A и бор.
Учитель: Давайте найдем элементы неметаллы, у которых простые вещества имеют атомную кристаллическую решетку (Ответ: С, В, Si) и молекулярную (Ответ: N, S, O, галогены и благородные газы)
Учитель: Сформулируйте вывод, как можно определить тип кристаллической решетки простого вещества в зависимости от положения элементов в Периодической системе Д.И.Менделеева.
Ответ: Для элементов-металлов, которые находятся в I A, II A, IIIA(кроме бора), а также олова и свинца, и всех элементов побочных подгрупп в простом веществе тип решетки-металлическая.
Для элементов-неметаллов IV A и бора в простом веществе кристаллическая решетка атомная; а у элементов V A, VI A, VII A, VIII A в простых веществах кристаллическая решетка молекулярная.
Продолжаем работать с заполненной таблицей.
Учитель: Посмотрите внимательно на таблицу. Какая закономерность прослеживается?
Внимательно слушаем ответы учеников, после чего вместе с классом делаем вывод. Вывод 2 (слайд 17)
4. Закрепление материала.
Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a)Тугоплавки и хорошо растворимы в воде
б) Легкоплавки и летучи
в) Тверды и электропроводны
г) Теплопроводны и пластичны
Понятия «молекула» не применимо по отношению к структурной единице вещества:
a) Вода
б) Кислород
в) Алмаз
г) Озон
Атомная кристаллическая решётка характерна для:
a) Алюминия и графита
б) Серы и йода
в) Оксида кремния и хлорида натрия
г) Алмаза и бора
Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
а) Молекулярная
б) Атомная
в) Ионная
г) Металлическая
5. Рефлексия.
6. Домашнее задание.
Охарактеризуйте каждый вид кристаллической решётки по плану: Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры .
По формулам приведённых веществ: SiC, CS2, NaBr, C2H2 – определите тип кристаллической решётки(ионная, молекулярная) каждого соединения и на основе этого опишите предполагаемые физические свойства каждого из четырёх веществ.
Кристаллические решетки. Строение вещества
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом .
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости .
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом .
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 о С она замерзает – переходит из жидкого состояния в твердое, и при 100 о С закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.

Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.

Пластичность – это способность вещества деформироваться без разрушения.

Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.

В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным . Примеры аморфных веществ – уголь, слюдяное стекло.

Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом , а саму структуру – кристаллической решеткой . Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку , различают атомную, молекулярную, ионную и металлическую кристаллическую структуру .
Атомная кристаллическая решетка

Атомная кристаллическая решетка образуется, когда в узлах кристалла расположены атомы . Атомы соединены между собой прочными ковалентными химическими связями. Соответственно, такая кристаллическая решетка будет очень прочной, разрушить ее непросто. Атомную кристаллическую решетку могут образовывать атомы с высокой валентностью, т.е. с большим числом связей с соседними атомами (4 или больше). Как правило, это неметаллы: простые вещества — кремния, бора, углерода (аллотропные модификации алмаз, графит), и их соединения (бороуглерод, оксид кремния (IV) и др.). Поскольку между неметаллами возникает преимущественно ковалентная химическая связь, свободных электронов (как и других заряженных частиц) в веществах с атомной кристаллической решеткой в большинстве случаев нет. Следовательно, такие вещества, как правило, очень плохо проводят электрический ток, т.е. являются диэлектриками. Это общие закономерности, из которых есть ряд исключений.

Связь между частицами в атомных кристаллах: ковалентная полярная или неполярная.
В узлах кристалла с атомной кристаллической структурой расположены атомы.
Фазовое состояние атомных кристаллов при нормальных условиях: как правило, твердые вещества.
Вещества , образующие в твердом состоянии атомные кристаллы:
- Простые веществас высокой валентностью (расположены в середине таблицы Менделеева): бор, углерод, кремний, и др.
- Сложные вещества, образованные этими неметаллами: кремнезем (оксид кремния, кварцевый песок) SiO2; карбид кремния (карборунд) SiC; карбид бора, нитрид бора и др.
Физические свойства веществ с атомной кристаллической решеткой:
— прочность;
— тугоплавкость (высокая температура плавления);
— низкая электропроводность;
— низкая теплопроводность;
— химическая инертность (неактивные вещества);
— нерастворимость в растворителях.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества , образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы(O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями(кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптони др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Ионная кристаллическая решетка

В случае, если в узлах кристалла находятся заряженные частицы – ионы, мы можем говорить о ионной кристаллической решетке . Как правило, с ионных кристаллах чередуются положительные ионы (катионы) и отрицательные ионы (анионы), поэтому частицы в кристалле удерживаются силами электростатического притяжения . В зависимости от типа кристалла и типа ионов, образующих кристалл, такие вещества могут быть довольно прочными и тугоплавкими. В твердом состоянии подвижных заряженных частиц в ионных кристаллах, как правило, нет. Зато при растворении или расплавлении кристалла ионы высвобождаются и могут двигаться под действием внешнего электрического поля. Т.е. проводят ток только растворы или расплавы ионных кристаллов. Ионная кристаллическая решетка характерна для веществ с ионной химической связью. Примеры таких веществ – поваренная соль NaCl, карбонат кальция – CaCO3 и др. Ионную кристаллическую решетку, как правило, в твердой фазе образуют соли, основания, а также оксиды металлов и бинарные соединения металлов и неметаллов.
Связь между частицами в ионных кристаллах: ионная химическая связь.
В узлах кристалла с ионной решеткой расположены ионы.
Фазовое состояние ионных кристаллов при нормальных условиях: как правило, твердые вещества.
Химические вещества с ионной кристаллической решеткой:
- Соли (органические и неорганические), в том числе соли аммония (например, хлорид аммония NH4Cl);
- Основания;
- Оксиды металлов;
- Бинарные соединения, в составе которых есть металлы и неметаллы.
Физические свойства веществ с ионной кристаллической структурой:
— высокая температура плавления (тугоплавкость);
— растворы и расплавы ионных кристаллов – проводники тока;
— большинство соединений растворимы в полярных растворителях (вода);
— твердое фазовое состояние у большинства соединений при нормальных условиях.
Металлическая кристаллическая решетка

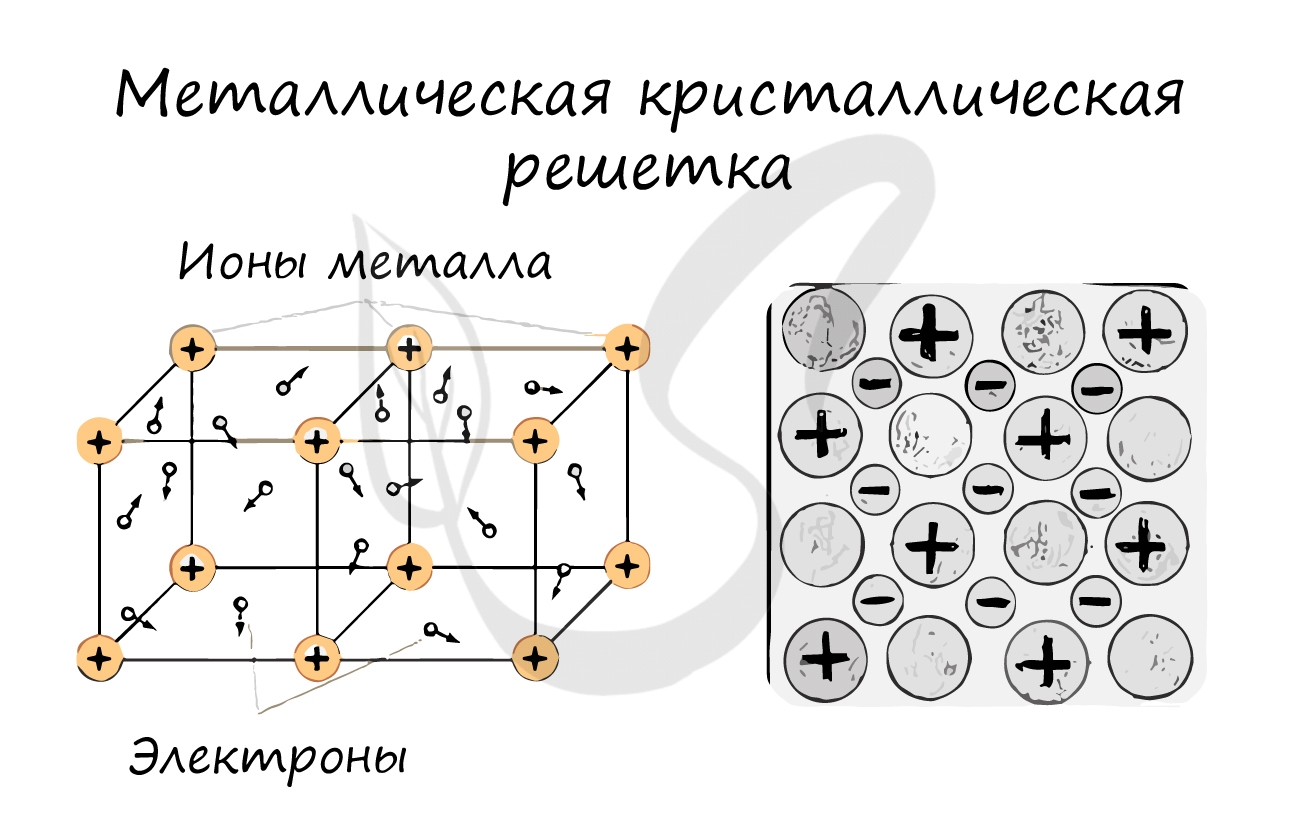
И, наконец, металлы характеризуются особым видом пространственной структуры – металлической кристаллической решеткой, которая обусловлена металлической химической связью . Атомы металлов довольно слабо удерживают валентные электроны. В кристалле, образованном металлом, происходят одновременно следующие процессы: часть атомов отдает электроны и становится положительно заряженными ионами; эти электроны хаотично перемещаются в кристалле; часть электронов притягивается к ионам. Эти процессы происходят одновременно и хаотично. Таким образом, возникают ионы , как при образовании ионной связи, и образуются общие электроны , как при образовании ковалентной связи. Свободные электроны перемещаются хаотично и непрерывно по всему объему кристалла, как газ. Поэтому иногда их называют « электронным газом ». Из-за наличия большого числа подвижных заряженных частиц металлы проводят ток, тепло. Температура плавления металлов сильно варьируется. Металлы также характеризуются своеобразным металлическим блеском, ковкостью, т.е. способностью изменять форму без разрушения при сильном механическом воздействии, т.к. химические связи при этом не разрушаются.

Связь между частицами : металлическая химическая связь.
В узлах кристалла с металлической решеткой расположены ионы металлов и атомы.
Фазовое состояние металлов при обычных условиях: как правило, твердые вещества (исключение — ртуть, жидкость при обычных условиях).
Химические вещества с металлической кристаллической решеткой — простые вещества-металлы.
Физические свойства веществ с металлической кристаллической решеткой:
— высокая тепло- и электропроводность;
— ковкость и пластичность;
— металлический блеск;
— металлы, как правило, нерастворимы в растворителях;
— большинство металлов – твердые вещества при нормальных условиях.
Сравнение свойств веществ с различными кристаллическими решетками
Тип кристаллической решетки (или отсутствие кристаллической решетки) позволяет оценить основные физические свойства вещества. Для примерного сравнения типичных физических свойств соединений с разными кристаллическими решетками очень удобно использовать химические вещества с характерными свойствами. Для молекулярной решетки это, например, углекислый газ, для атомной кристаллической решетки — алмаз, для металлической — медь, и для ионной кристаллической решетки — поваренная соль, хлорид натрия NaCl.
Сводная таблица по структурам простых веществ, образованных химическими элементами из главных подгрупп таблицы Менделеева (элементы побочных подгрупп являются металлами, следовательно, имеют металлическую кристаллическую решетку).
Типы кристаллических решеток и свойства веществ
По характеру структуры кристаллические решетки всех веществ относят к одному из четырех основных типов:
а) молекулярная решетка,
В основу этой классификации положен род структурных частиц (молекулы-атомы-ионы), находящихся в узлах кристаллической решетки.
Молекулярная решетка
В узлах молекулярной решетки находятся полярные или неполярные молекулы, связанные между собой слабыми силами межмолекулярного взаимодействия (силами Ван-дер-Ваальса). Молекулы в кристалле способны совершать незначительные колебания различного характера. Вещества с молекулярным типом решетки, например, органические вещества, кристаллы инертных газов и большинства неметаллов, сухой лед (СО2 тверд.) обладают малой твердостью, низкими температурами плавления и кипения. Эти характеристики объясняются тем, что при приложении незначительной энергии межмолекулярные связи разрываются и кристалл разрушается с образованием отдельных молекул, что и наблюдается при плавлении и при испарении кристаллов. Внутри отдельных молекул атомы связаны значительно более прочными связями (ковалентными полярными или неполярными). Эти связи разрушаются при более высокой температуре, и молекулы распадаются на составляющие их атомы (происходит термическая диссоциация).
Атомная решетка
В узлах атомной кристаллической решетки находятся атомы. Роль сил межмолекулярного взаимодействия здесь играют достаточно прочные ковалентные связи. Выделить из общей массы атомов один невозможно. Вещества с атомным типом кристаллической решетки (алмаз, бор, кремний, карборунд SiC, нитрид алюминия и другие) характеризуются очень большой твердостью, иногда сочетающейся с хрупкостью, нерастворимостью в обычных растворителях, очень высокими температурами плавления и кипения. Все связи в кристалле равноценны. При разрыве этих связей, достигаемом лишь при высокой температуре, кристалл диссоциирует на отдельные атомы: плавление, кипение и термическая диссоциация практически совпадают.
Ионная (координационная) решетка
В узлах ионной кристаллической решетки находятся чередующиеся положительные и отрицательные ионы, связанные между собой силами кулоновского взаимодействия. Особенностью этих сил является их ненасыщаемость. Это приводит к тому, что отдельный ион координирует вокруг себя несколько ионов противоположного заряда. Ионы в кристаллах совершают упорядоченные колебания. Энергия связей между противоположно заряженными ионами очень велика, и такие кристаллы, казалось бы, должны обладать наиболее высокой твердостью и высокими температурами плавления и кипения. На самом деле эти свойства у них ниже, чем у кристаллов с атомной структурой. Причина заключается в том, что наряду с силами притяжения в кристалле действуют силы отталкивания между одноименно заряженными ионами, причем соотношение этих сил приводит к определенному равновесному состоянию. Вещества с ионной решеткой растворимы в той или иной степени в полярных растворителях.
Металлическая решетка
В узлах металлической решетки находятся положительно заряженные ионы металлов, окруженные электронами. Эти электроны, связанные отчасти с ионами силами электростатического взаимодействия, являются «полусвободными», иначе говоря «не прикреплены» к отдельным ионам, а более или менее свободно перемещаются между ними. Этот «электронный газ» обусловливает типичные для металлов свойства: тепло- и электропроводность, серовато-серебристый (у большинства металлов) цвет, металлический блеск (отражательную способность), способность отражать радиоволны, пластичность, ковкость и в то же время достаточную прочность (результат обволакивания ионов «электронным газом»). Подходя к катиону металла, электроны образуют с ним на мгновение электронейтральную частицу, которая быстро разрушается и через мгновение такой же непрочный «атом» образуется с этим или другим электроном и другим ионом металла. Между «атомами» возникают мгновенные ковалентные связи. Это и приводит к возникновению особой металлической связи, промежуточной по характеру между ионной и ковалентной, качественно отличающейся от той и другой и наблюдаемой лишь в куске металла. Энергия электронов в металле недостаточна, чтобы они могли «оторваться» от катионов металла и самопроизвольно покинуть металлическую решетку. Но при подведении энергии извне выход электронов наблюдается: фотоэлектрический эффект, термоэлектронная эмиссия. Прочность и температуры плавления и кипения у металлов не всегда имеют промежуточные значения между этими же свойствами у веществ с атомными и ионными решетками. Это зависит от природы металла. Интересно, что заряд ионов в металлах не всегда отвечает номеру группы периодической системы, в которой металл находится. Например, в кристаллической решетке алюминия ионы имеют средний заряд +2. Это можно объяснить двумя способами:
а) все атомы алюминия отдали по два электрона в «электронный газ»;
б) все атомы отдали по три электрона, но в среднем одна треть образовавшихся ионов Al +3 снова образует «атомы», поэтому средний заряд всех структурных частиц +2.
Таким образом, металлическое состояние в упрощенном представлении подобно атомарному ввиду его суммарной электронейтральности; это сосуществование и взаимосвязь «атомов»-ионов-электронов.
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
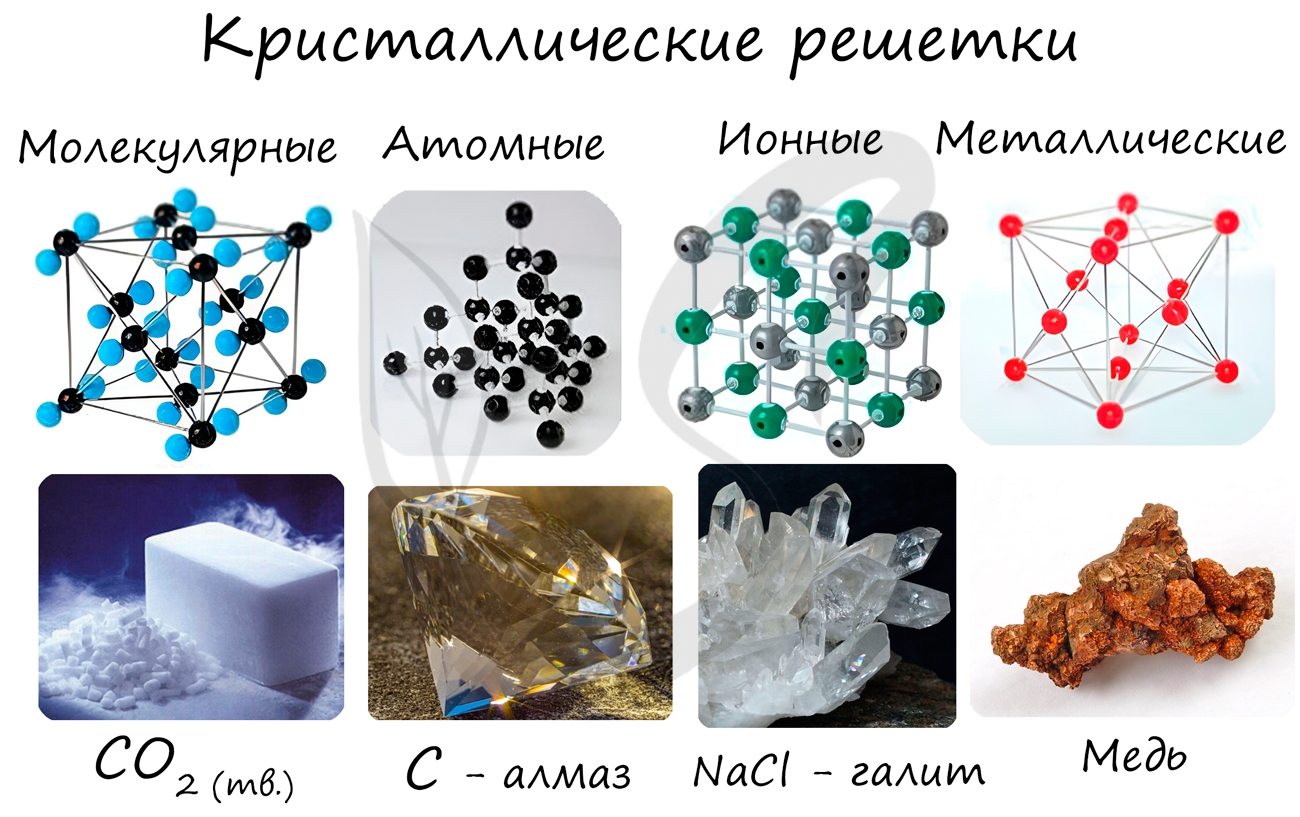
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
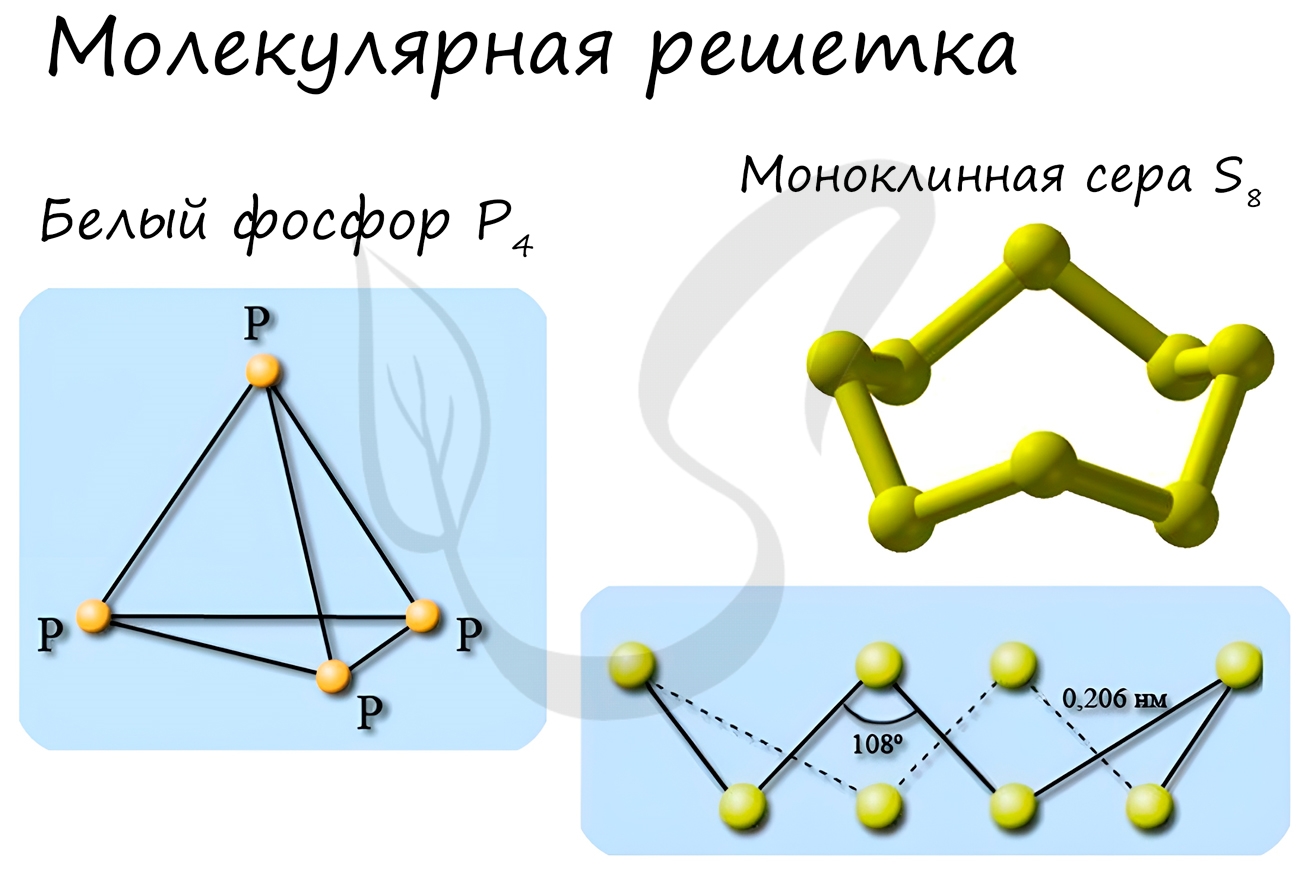
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью - NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Основная цель урока: Дать учащимся конкретные представления об аморфных и кристаллических веществах, типах кристаллических решеток, установить взаимосвязь между строением и свойствами веществ.
Образовательная: сформировать понятия о кристаллическом и аморфном состоянии твердых тел, ознакомить учащихся с различными типами кристаллических решеток, установить зависимость физических свойств кристалла от характера химической связи в кристалле и типа кристаллической решетки, дать учащимся основные представления о влиянии природы химической связи и типов кристаллических решеток на свойства вещества, дать учащимся представление о законе постоянства состава.
Воспитательная: продолжить формирование мировоззрения учащихся, рассмотреть взаимное влияние компонентов целого- структурных частиц веществ, в результате которого появляются новые свойства, воспитывать умения организовать свой учебный труд, соблюдать правила работы в коллективе.
Развивающая: развивать познавательный интерес школьников, используя проблемные ситуации; совершенствовать умения учащихся устанавливать причинно-следственную зависимость физических свойств веществ от химической связи и типа кристаллической решетки, предсказывать тип кристаллической решетки на основе физических свойств вещества.
Оборудование: Периодическая система Д.И.Менделеева, коллекция “Металлы”, неметаллы: сера, графит, красный фосфор, кислород; Презентация “Кристаллические решетки”, модели кристаллических решеток разных типов (поваренной соли, алмаза и графита, углекислого газа и йода, металлов), образцы пластмасс и изделий из них, стекло, пластилин, смолы, воск, жевательная резинка, шоколад, компьютер, мультимедийная установка, видеопыт “Возгонка бензойной кислоты”.
1. Организационный момент.
Затем сообщает тему урока и цель урока. Учащиеся записывают тему урока в тетрадь. (Cлайд 1, 2).
2. Проверка домашнего задания
(2 ученика у доски: Определить вид химической связи для веществ с формулами:
1) NaCl, CO2, I2 ; 2) Na, NaOH, H2S (записывают ответ на доске и включаются в опрос).
3. Анализ ситуации.
Учитель: Что изучает химия? Ответ: Химия - это наука о веществах, их свойствах и превращениях веществ.
Учитель: Что же такое вещество? Ответ: Вещество - это то, из чего состоит физическое тело. (Cлайд 3).
Учитель: Какие агрегатные состояния веществ вы знаете?
Ответ: Существует три агрегатных состояния: твердое, жидкое и газообразное. (Cлайд 4).
Учитель: Приведите примеры веществ, которые при различных температурах могут существовать во всех трех агрегатных состояниях.
Ответ: Вода. При обычных условиях вода находится в жидком состоянии, при понижении температуры ниже 0 0 С вода переходит в твердое состояние - лед, а при повышении температуры до 100 0 С мы получим водяной пар (газообразное состояние).
Учитель (дополнение): Любое вещество можно получить в твердом, жидком и газообразном виде. Кроме воды – это металлы, которые при нормальных условиях находятся в твердом состоянии, при нагревании начинают размягчаться, и при определенной температуре(tпл) переходят в жидкое состояние - плавятся. При дальнейшем нагревании, до температуры кипения, металлы начинают испаряться, т.е. переходить в газообразное состояние. Любой газ можно перевести в жидкое и твердое состояние, понижая температуру: например, кислород, который при температуре (-194 0 С) превращается в жидкость голубого цвета, а при температуре (-218,8 0 С) затвердевает в снегообразную массу, состоящую из кристаллов синего цвета. Сегодня на уроке мы будем рассматривать твердое состояние вещества.
Учитель: Назовите, какие твердые вещества находятся у вас на столах.
Ответ: Металлы, пластилин, поваренная соль: NaCl, графит.
Учитель: Как вы думаете? Какое из этих веществ лишнее?
Делаются предположения. Если ученики затрудняются, то с помощью учителя приходят к выводу, что пластилин в отличие от металлов и хлорида натрия не имеет определенной температуры плавления - он (пластилин) постепенно размягчается и переходит в текучее состояние. Таков, например, шоколад, который тает во рту, или жевательная резинка, а также стекло, пластмассы, смолы, воск (при объяснении учитель демонстрирует классу образцы этих веществ). Такие вещества называют аморфными. (слайд 5), а металлы и хлорид натрия - кристаллические. (Cлайд 6).
Таким образом, различают два вида твердых веществ: аморфные и кристаллические. (слайд7).
1) У аморфных веществ нет определенной температуры плавления и расположение частиц в них строго не упорядочено.
Кристаллические вещества имеют строго определенную температуру плавления и, главное, характеризуются правильным расположением частиц, из которых они построены: атомов, молекул и ионов. Эти частицы расположены в строго определенных точках пространства, и, если эти узлы соединить прямыми линиями, то образуется пространственный каркас - кристаллическая решетка.
Учитель задает проблемные вопросы
Как объяснить существование твердых веществ со столь различными свойствами?
2) Почему кристаллические вещества при ударе раскалываются в определенных плоскостях, а аморфные вещества этим свойством не обладают?
Выслушать ответы учеников и подвести их к выводу:
Свойства веществ в твердом состоянии зависят от типа кристаллической решетки (прежде всего от того, какие частицы находятся в ее узлах), что, в свою очередь, обусловлено типом химической связи в данном веществе.
Проверка домашнего задания:
1) NaCl – ионная связь,
СО2 – ковалентная полярная связь
I2 – ковалентная неполярная связь
2) Na – металлическая связь
NаОН - ионная связь между Na + иОН - (О и Н ковалентная)
Н2S - ковалентная полярная
- Какая связь называется ионной?
- Какая связь называется ковалентной?
- Какая связь называется ковалентной полярной? неполярной?
- Что называется электроотрицательностью?
Вывод: Прослеживается логическая последовательность, взаимосвязь явлений в природе: Строение атома—>ЭО—>Виды химической связи—>Тип кристаллической решетки—>Свойства веществ. (слайд 10).
Учитель: В зависимости от вида частиц и от характера связи между ними различают четыре типа кристаллических решеток: ионные, молекулярные, атомные и металлические. (Cлайд 11).
Далее идет рассмотрение типов кристаллических решеток. Особое внимание уделяется взаимосвязи типа кристаллической решетки, вида химической связи и свойств твердых веществ.
Результаты оформляются в следующую таблицу-образец таблицы у учеников на парте. (см. Приложение 1). (Cлайд 12).
Ионные кристаллические решетки
Учитель: Как вы думаете? Для веществ с каким видом химической связи будет характерен такой вид решетки?
Ответ: Для веществ с ионной химической связью будет характерна ионная решетка.
Учитель: Какие частицы будут находиться в узлах решетки?
Учитель: Какие частицы называются ионами?
Ответ: Ионы-это частицы, имеющие положительный или отрицательный заряд.
Учитель: Какие ионы бывают по составу?
Ответ: Простые и сложные.
Демонстрация - модель кристаллической решетки хлорида натрия (NaCl).
Объяснение учителя: В узлах кристаллической решетки хлорида натрия находятся ионы натрия и хлора.
В кристаллах NaCl отдельных молекул хлорида натрия не существует. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na + и Cl - , NanCln, где n – большое число.
Связи между ионами в таком кристалле очень прочные. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки, нелетучи, хрупки. Расплавы их проводят электрический ток (Почему?), легко растворяются в воде.
Ионные соединения - это бинарные соединения металлов (I А и II A), соли, щелочи.
Атомные кристаллические решетки
Демонстрация кристаллических решеток алмаза и графита.
У учеников на столе образцы графита.
Учитель: Какие частицы будут находиться в узлах атомной кристаллической решетки?
Ответ: В узлах атомной кристаллической решетки находятся отдельные атомы.
Учитель: Какая химическая связь между атомами будет возникать?
Ответ: Ковалентная химическая связь.
Действительно, в узлах атомных кристаллических решеток находятся отдельные атомы, связанные между собой ковалентными связями. Так как атомы, подобно ионам, могут по-разному располагаться в пространстве, то образуются кристаллы разной формы.
Атомная кристаллическая решетка алмаза
В данных решетках молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Примером веществ с таким типом кристаллических решеток могут служить аллотропные модификации углерода: алмаз, графит; а также бор, кремний, красный фосфор, германий. Вопрос: Какие эти вещества по составу? Ответ: Простые по составу.
Атомные кристаллические решетки имеют не только простые, но и сложные. Например, оксид алюминия, оксид кремния. Все эти вещества имеют очень высокие температуры плавления (у алмаза свыше 3500 0 С), прочны и тверды, нелетучи, практически нерастворимы в жидкостях.
Металлические кристаллические решетки
Учитель: Ребята, у вас на столах коллекция металлов, рассмотрим эти образцы.
Вопрос: Какая химическая связь характерна для металлов?
Ответ: Металлическая. Связь в металлах между положительными ионами посредством обобществленных электронов.
Вопрос: Какие общие физические свойства для металлов характерны?
Ответ: Блеск, электропроводность, теплопроводность, пластичность.
Вопрос: Объясните, в чем причина того, что у такого числа разнообразных веществ одинаковые физические свойства?
Ответ: Металлы имеют единое строение.
Демонстрация моделей кристаллических решеток металлов.
Вещества с металлической связью имеют металлические кристаллические решетки
В узлах таких решеток находятся атомы и положительные ионы металлов, а в объеме кристалла свободно перемещаются валентные электроны. Электроны электростатически притягивают положительные ионы металлов. Этим объясняется стабильность решетки.
Молекулярные кристаллические решетки
Учитель демонстрирует и называет вещества: йод, сера.
Вопрос: Что объединяет эти вещества?
Ответ: Эти вещества являются неметаллами. Простые по составу.
Вопрос: Какая химическая связь внутри молекул?
Ответ: Химическая связь внутри молекул ковалентная неполярная.
Вопрос: Какие физические свойства для них характерны?
Ответ: Летучие, легкоплавкие, малорастворимые в воде.
Учитель: Давайте сравним свойства металлов и неметаллов. Ученики отвечают, что свойства принципиально отличаются.
Вопрос: Почему свойства неметаллов сильно отличаются от свойств металлов?
Ответ: У металлов связь металлическая, а у неметаллов ковалентная неполярная.
Учитель: Следовательно, и тип решетки другой. Молекулярная.
Вопрос: Какие частицы находятся в узлах решетки?
Демонстрация кристаллических решеток углекислого газа и йода.
Молекулярная кристаллическая решетка
Как видим, молекулярную кристаллическую решетку могут иметь не только твердые простые вещества: благородные газы, H2,O2,N2, I2, O3, белый фосфор Р4, но и сложные: твердая вода, твердые хлороводород и сероводород. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
Вывод: Вещества непрочные, имеют малую твердость, низкую температуру плавления, летучи, способны к возгонке.
Вопрос: Какой процесс называется возгонкой или сублимацией?
Ответ: Переход вещества из твердого агрегатного состояния сразу в газообразное, минуя жидкое, называется возгонкой или сублимацией.
Демонстрация опыта: возгонка бензойной кислоты (видеоопыт).
Работа с заполненной таблицей.
Приложение 1. (Слайд 17)
Кристаллические решетки, вид связи и свойства веществ
Вопрос: Какой тип кристаллической решетки из рассмотренных выше не встречается в простых веществах?
Ответ: Ионные кристаллические решетки.
Вопрос: Какие кристаллические решетки характерны для простых веществ?
Ответ: Для простых веществ-металлов- металлическая кристаллическая решетка; для неметаллов - атомная или молекулярная.
Работа с Периодической системой Д.И.Менделеева.
Вопрос: Где в Периодической системе находятся элементы-металлы и почему? Элементы-неметаллы и почему?
Ответ: Если провести диагональ от бора до астата, то в нижнем левом углу от этой диагонали будут находиться элементы-металлы, т.к. на последнем энергетическом уровне они содержат от одного до трех электронов. Это элементы I A, II A, III A (кроме бора), а также олово и свинец, сурьма и все элементы побочных подгрупп.
Элементы-неметаллы находятся в верхнем правом углу от этой диагонали, т.к. на последнем энергетическом уровне содержат от четырех до восьми электронов. Это элементы IY A,Y A, YI A, YII A, YIII A и бор.
Учитель: Давайте найдем элементы неметаллы, у которых простые вещества имеют атомную кристаллическую решетку (Ответ: С, В, Si) и молекулярную (Ответ: N, S, O, галогены и благородные газы).
Ответ: Для элементов-металлов, которые находятся в I A, II A, IIIA (кроме бора), а также олова и свинца, и всех элементов побочных подгрупп в простом веществе тип решетки-металлическая.
Для элементов-неметаллов IY A и бора в простом веществе кристаллическая решетка атомная; а у элементов Y A, YI A, YII A, YIII A в простых веществах кристаллическая решетка молекулярная.
Внимательно слушаем ответы учеников, после чего вместе с классом делаем вывод:
Существует следующая закономерность: если известно строение веществ, то можно предсказать их свойства, или наоборот: если известны свойства веществ, то можно определить строение. (Cлайд 18).
Учитель: Посмотрите внимательно на таблицу. Какую еще классификацию веществ вы можете предложить?
Если ученики затрудняются, то учитель объясняет, что вещества можно разделить на вещества молекулярного и немолекулярного строения. (Cлайд 19).
Вещества молекулярного строения состоят из молекул.
Вещества немолекулярного строения состоят из атомов, ионов.
Закон постоянства состава
Учитель: Сегодня мы познакомимся с одним из основных законом химии. Это закон постоянства состава, который был открыт французским химиком Ж.Л.Прустом. Закон справедлив только для веществ молекулярного строения. В настоящее время закон читается так:”Молекулярные химические соединения независимо от способа их получения имеют постоянный состав и свойства”. Но для веществ с немолекулярным строением этот закон не всегда справедлив.
Теоретическое и практическое значение закона состоит в том, что на его основе состав веществ можно выразить с помощью химических формул(для многих веществ немолекулярного строения химическая формула показывает состав не реально существующей, а условной молекулы).
Вывод: химическая формула вещества заключает в себе большую информацию. (Cлайд 21)
1. Конкретное вещество - серный газ, или оксид серы (YI).
2.Тип вещества - сложное; класс - оксид.
3. Качественный состав - состоит из двух элементов: серы и кислорода.
4. Количественный состав - молекула состоит из1 атома серы и 3 атомов кислорода.
5.Относительная молекулярная масса - Mr(SO3)= 32 + 3 * 16 = 80.
6. Молярная масса - М(SO3) = 80 г/моль.
7. Много другой информации.
Закрепление и применение полученных знаний
Игра в крестики-нолики: зачеркните по вертикали, горизонтали, диагонали вещества, имеющие одинаковую кристаллическую решетку.
Читайте также:
