Связь в металлах и сплавах
Обновлено: 04.10.2024
В конце XVIII века Уильям Хиггинс опубликовал научную работу, в которой описал предположение о существовании неких связей между частицами всех веществ. Эта теория стала предвестником теории о валентности, которая на тот момент воспринималась как «соединительная сила» веществ.
Такие представления существовали в мире химии до открытия электрона. С момента возникновения теории о химических связях понятие валентности было вытеснено из научного толкования, а сам термин стал претерпевать значительные изменения.
Теория химических связей смогла более точно объяснить связь частиц тех веществ, с которыми сталкивался человек. Определение химической связи звучит следующим образом:
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами или их перехода от одного атома к другому.
Благодаря стремлению веществ к более стабильным и устойчивым состояниям с минимальным расходом энергии появляются различные химические соединения.
Основными характеристиками химической связи являются:
- прочность;
- длина;
- полярность.
Процесс образования химических связей не может происходить бесследно для вещества. Он всегда сопровождается выделением энергии химической связи.
Большую роль в процессе формирования химической связи играют валентные электроны, находящиеся на внешнем энергетическом уровне (электронном слое) атома. Они вступают во взаимодействие с другими атомами, образуя новые химические соединения.
Способность притягивать электроны — электроотрицательность — играет важную роль при образовании химической связи и определяет ее вид. По правилу октета завершенным считается внешний энергетический уровень, содержащий 8 электронов у большинства веществ и 2 электрона у гелия.
Современная химия различает несколько видов связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Основные теории и представления
До открытия электрона представления о химической связи заключались в теории валентности — способности атомов образовывать химические связи в определенном количестве, ограниченном числом неспаренных электронов.
Точное и полное понимание теории сложилось к 1852 году, когда свой труд о соединительной силе атомов опубликовал химик Эдуард Франкленд. Он переосмыслил все знания о валентности, существовавшие до него и объединил их в одну теорию, согласно которой появилось учение о валентности.
В 1861 году в теорию внес свой вклад А. М. Бутлеров, который показал четкое различие между изолированным и входящим в состав соединение атомом. Эти знания позволили получить наглядное изображение атома в виде первых молекулярных моделей.
Дальнейшие основные теории химической связи делятся на:
К электронным теориям относятся электронная теория химической связи и Боровская модель.
Электронная теория сформировалась в 1912-16 годах американским физиком и химиком Г. Н. Льюисом. Она стала основой классической теории строения в органической части химических исследований. Согласно этой теории атомы, вступающие в связь при ковалентном соединении, имеют общую электронную плотность, которая делится между ними.
Это мнение шло в противовес господствовавшей тогда теории о положительном и отрицательном заряде атомов, которые несут разные атомы. Также концепция Льюиса включала формулирование правило октета.
Боровская модель была опубликована в 1913 году Нильсом Бором в статье «Системы, содержащие несколько ядер». Согласно модели, электроны атомов образовывают кольцо, которое вращается перпендикулярно оси молекулы. Однако эта система требовала усовершенствования и доработки, а все попытки их осуществления приводили к неудачам.
Квантовые теории химической связи включают в себя теорию валентных связей и теорию молекулярных орбиталей.
В 1927 году В. Гайтлером и Ф. Лондоном была заложена теория валентных связей, основанная на том, что каждая пара атомов в молекуле удерживается при помощи общих электронных пар.
Молекулу как целый объект рассматривает теория молекулярных орбиталей. Согласно ей молекула является сложной системой, и поэтому должна рассматриваться как целое и не разбиваться при исследованиях на более мелкие частицы, иначе они теряют свои свойства. Данная теория описывает свойства отдельных молекул и дает понимание о распределении плотности вероятности обнаружения электрона в заданном пространстве.
Виды химических связей в неорганических, органических и комплексных соединениях
Химические соединения имеют сложную структуру. Одна молекула может иметь сразу несколько видов химической связи.
Химия выделяет 4 основных вида химической связи. Это:
- ковалентная;
- ионная;
- металлическая;
- межмолекулярная.
Ковалентная связь при взаимодействии атомов бывает двух видов: полярная и неполярная. Атомы объединяются по типу обменного механизма или по донорно-акцепторному механизму. В таком соединении важна электроотрицательность атомов.
Электроотрицательность (ЭО) — способность атома в молекуле притягивать электронные пары в свою сторону.
Неполярная ковалентная связь образуется между двумя атомами с одинаковой электроотрицательностью. Обычно это молекулы одного химического элемента, например, хлор C l 2 , азот N 2 , кислород O 2 и другие. Полюс + или – в такой связи отсутствует, а электронная плотность распределяется равномерно.
Полярная ковалентная связь образуется между атомами с разной электроотрицательностью, то есть с атомами разных химических элементов. В таких соединениях полюс + или – смещается к одному из элементов, более электроотрицательному. К таким соединениям относятся йодистый водород H I , вода H 2 O , хлористый водород H C l .
Обменный механизм образования ковалентной связи предполагает, что каждый атом предоставляет по одному неспаренному электрону для создания общей электронной пары, располагающейся между ядрами взаимодействующих атомов. Эта общая электронная пара и является одинарной ковалентной связью.
При донорно-акцепторном механизме один атом становится донором своей неподеленной пары, а второй не отдавая электроны вовсе, лишь предоставляет место для них на своей пустой (свободной или вакантной) орбитали.
Ковалентная связь характерна как для неорганических, так и органических соединений. Образуется преимущественно между атомами неметаллов.
Ионная связь образуется между атомами веществ, электроотрицательность которых сильно отличается (чаще всего между атомами металла и неметалла). При такой связи электрон атома с меньшей ЭО практически полностью переходит к электрону атома с бОльшей ЭО, превращая первый атом в катион, а второй — в анион. Соединения, имеющие ионные связи, как правило, состоят из ионов и являются электролитами.
Ионы — частицы, имеющие заряд, но образующиеся из нейтральных частиц.
По строению ионная связь имеет сходство с ковалентной и даже считается крайней формой полярной ковалентной связи. Примерами веществ с ионной связью являются: соединения оксид натрия N a 2 O , хлорид калия K C l , гидрооксид кальция C a ( O Н ) 2 , серная кислота H 2 S O 4 и многие другие. Ионная связь характерна для соединений металлов с неметаллами.
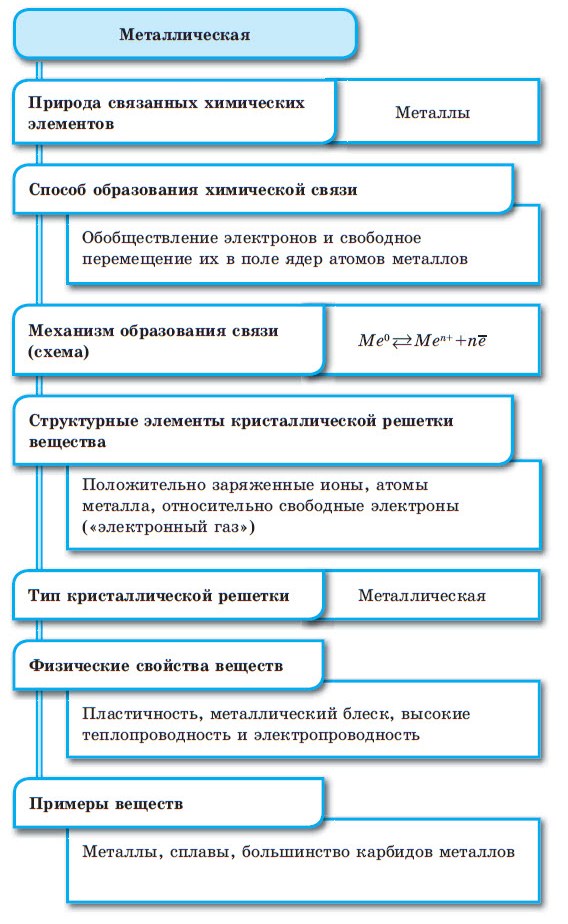
Атомы металла вместе удерживает металлическая связь. По природе эта связь близка и к ковалентной и к ионной связям, но отличается от нее наличием высокой концентрации в металлах электронов проводимости (электронный газ). Металлическая связь образуется в простых веществах: металлах и их сплавах. Относится к одному из трех основных типов химических связей.
Соединения неметаллов с водородом имеют удивительные свойства, объясняющиеся возникновением межмолекулярных связей. Это заметили химики еще до появления современной теории о химических связях.
Водородная связь образуется между атомом водорода, принадлежащим одной молекуле, и атомом другой молекулы, имеющим большее значение ЭО: например, фтористый водород H F , этанол C 2 H 5 O H , аммиак N H 3 .
Водородные связи могут образовываться как между отдельными молекулами, так и внутри одной из них (внутримолекулярная водородная связь).
Как определить тип, свойства
Каждому веществу свойственен свой тип связи и определенные свойства.
Вид химической связи определяется следующим образом:
- Определение элементов в соединении.
- Определение ЭО.
- Металл и неметалл вступают в ионную связь.
- Два металла вступают в металлическую связь.
- Два неметалла вступают в ковалентную связь.
- Два равных по ЭО элемента вступают в неполярную ковалентную связь.
- Два неравных по ЭО элемента вступают в полярную ковалентную связь.
- Водород и атом с бОльшей ЭО, относящиеся к разным молекулам или группам, образуют особый тип межмолекулярной связи - водородную связь.
Химические связи проходят сравнение по разным количественным характеристикам, среди которых:
- порядок связей или кратность химической связи;
- полярность;
- энергия;
- длина.
Порядок связей включает в себя описание количества электронных пар, которые вступили в связь. Он описывает количество электронов, вступивших в химическую связь.
Полярность связи показывает смещение электронной плотности к атомам — электроотрицательность элемента.
Энергия определяет прочность химической связи, от которой зависит насколько сложно разъединить атомы.
Длина связи определяет расстояние между атомами, связанными химической связью. Она не может быть определена точно, поэтому определяется экспериментально.
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
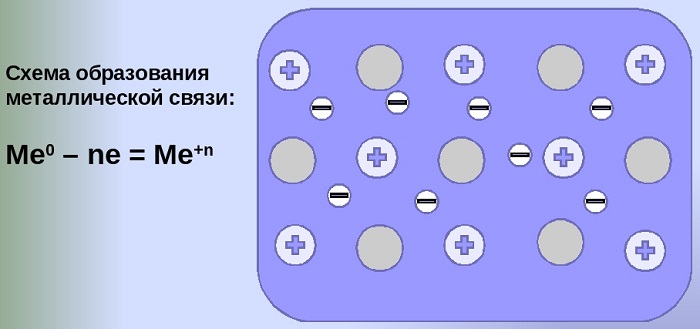
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
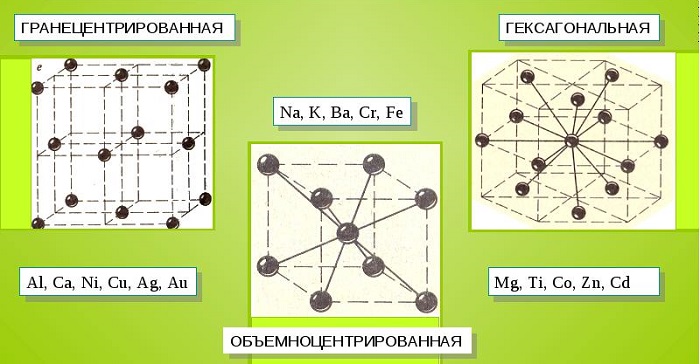
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
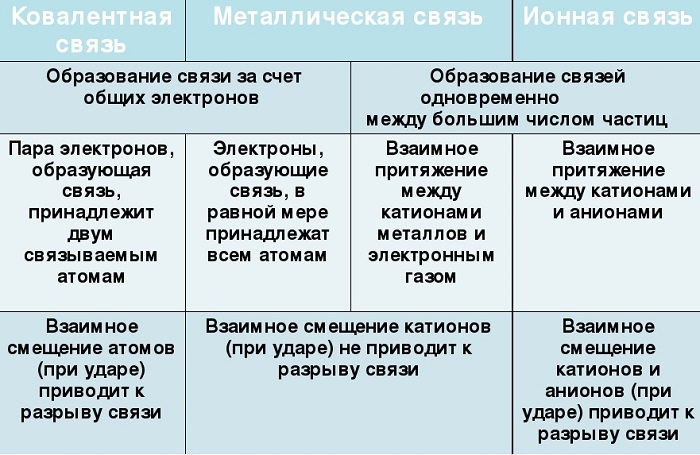
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Связь в металлах и сплавах
Ключевые слова конспекта: Металлическая химическая связь: ион-атомы и электронный газ. Физические свойства металлов и их применение на основе этих свойств. Чёрные и цветные металлы. Сплавы.
Подавляющее число химических элементов периодической системы Д. И. Менделеева относятся к металлам:
- все s-элементы, кроме водорода и гелия;
- все d-элементы;
- p-элементы IIIА-группы, кроме бора;
- некоторые p-элементы IVA- (олово и свинец) и VA- (сурьма и висмут) групп, а также p-элемент VIIА-группы — полоний.
Анализ положения металлов в периодической системе и учёт особенностей строения их атомов позволяет сделать следующие выводы: атомы этих элементов содержат небольшое число электронов на внешнем слое (1—3), имеют сравнительно большой радиус атома и много свободных орбиталей, которые могут легко перекрываться. Поэтому валентные электроны свободно перемещаются от одних атомов, превращая их в ионы, к другим, связывая их.
В простых веществах-металлах осуществляется бесконечный процесс превращения атомов в ионы и обратно, который можно отразить с помощью схемы:Эти же процессы происходят и в металлических сплавах.
Металлическая связь определяет и особое кристаллическое строение металлов и сплавов — металлическую кристаллическую решётку, в узлах которой расположены ион–атомы. Обобществлённые подвижные электроны не принадлежат какому–то определённому атому и способны перемещаться по всему объёму металла. В отсутствие в нём электрического поля эти электроны хаотически движутся и сталкиваются, чаще всего с ионами кристаллической решётки. В 1900 г. немецкий физик Пауль Друде предложил называть совокупность этих электронов электронным газом. Этот электронный газ прочно соединяет, как бы склеивает ионный остов металла. При механических нагрузках или нагреве газ не допускает разрыва металлической решётки, связывая положительные ионы. Поэтому при обработке металлов изменение их формы происходит без разрушения кристаллической решётки, так как её слои легко скользят один по другому.
Металлы электропроводны, потому что под действием электрического поля валентные электроны начинают направленное движение — возникает электрический ток. Металлы — это проводники первого рода, в отличие от растворов электролитов, которые относятся к проводникам второго рода.
Мы вряд ли представляем себе жизнь без электричества, которое поступает в каждый дом, в каждую квартиру по сети электрических проводов своеобразной кровеносной системе современной технической цивилизации. Лучше всего проводят электрический ток серебро, медь, золото, алюминий. Серебро и золото — дорогие металлы. Медь также недешёвый металл. Поэтому кабели линий электропередачи (ЛЭП) делают главным образом из алюминия.
Кстати, прочная опора линии электропередачи тоже металлическая. Прочность — одно из основных свойств большинства металлов, позволяющее использовать их в качестве конструкционных материалов. Один из наиболее прочных и в то же время лёгких металлов — титан. Этот металл и сплавы на его основе — незаменимые конструкционные материалы в самолётостроении и космической технике.
Все металлы теплопроводны. Это свойство, как и нетоксичность некоторых металлов, лежит в основе их применения для производства кухонной посуды: кастрюль, сковородок, противней. Батареи центрального отопления должны быстро нагреваться поступающей в них водой и эффективно отдавать теплоту окружающему воздуху, поэтому их тоже изготавливают из металла.
Самыми теплопроводными металлами являются те, которые хорошо проводят электрический ток: серебро, медь, золото, алюминий.
Металлы обладают металлическим блеском. Блестят они потому, что отражают лучи света, а не пропускают их, как стекло, и не поглощают, как сажа. Окраска большинства металлов серебристо–белая, так как они в равной степени отражают все лучи видимой части спектра. Золото и медь частично поглощают коротковолновое излучение, поэтому обладают окраской от жёлтой до красно–коричневой. Самые блестящие металлы — ртуть, палладий, серебро и алюминий, поэтому отражатели прожекторов, автомобильных фар и фонарей покрывают тонким слоем палладия, алюминия или хрома. Почти все измельчённые в порошок металлы, кроме магния и алюминия, теряют блеск и превращаются в серые или чёрные порошки.
Пластичность металлов в сочетании с блеском делают их незаменимым материалом для художников. Самым пластичным по праву считается золото. Из одного грамма этого металла можно вытянуть нить длиной 2 км или раскатать фольгу толщиной 0,00008 мм. Такой тонкий листочек даже в руки взять невозможно: он сразу прилипнет к коже. Это свойство находит своё применение: тонкими золотыми листочками покрывают купола церквей, скульптуры, деревянную резьбу.
Современная техника и промышленность нуждаются в металлических материалах с самыми разнообразными и трудно сочетаемыми свойствами, которых нет у чистых металлов. На помощь технологам приходят сплавы.
Например, из железосодержащих руд выплавляют чугун — сплав железа с углеродом, в котором массовая доля углерода составляет от 2 до 4%. Чугун — хрупкий материал, изделия из которого получают не ковкой, а литьём, как из пластмасс. Из чугуна изготавливают различные массивные конструкции: корпуса станков, турбин, детали двигателей, ограждения. Настоящее произведение искусства — ограды мостов и решётки парков Санкт–Петербурга.
Если из чугуна удалить излишек углерода и довести его содержание до 1—2%, получится сталь. В отличие от чугуна, она пластична, ковка, имеет гладкую блестящую поверхность. Сталь можно прокатать в тонкий лист или железнодорожный рельс, вытянуть в проволоку, согнуть уголком.
Для придания стали специфических свойств в неё добавляют другие металлы — так называемые легирующие добавки. Используя их, выплавляют сотни разных сортов стали. Нержавеющая сталь содержит хром и никель. В жаропрочную сталь добавляют вольфрам. Молибден придаёт стали твёрдость. Алюминий добавляют в сталь, идущую на изготовление кузовов автомобилей.
Сплав меди с оловом, бронза, обладает хорошими литейными свойствами. Из неё отливают не только колокола и художественные изделия, но и подшипники, вентили, клапаны и детали машин.
Сплав меди с цинком называют латунью. Она прочнее меди, устойчива к атмосферной коррозии. Из латуни изготавливают трубки, шестерни, армейские знаки отличия, химическое оборудование.
Нарядные столовые приборы, посуду, недорогие украшения изготавливают из мельхиора — сплава меди с никелем. Несмотря на то, что никеля в этом сплаве всего 20%, мельхиор лишён медного цвета и по внешнему виду напоминает серебро.
Сплав алюминия с медью, магнием и марганцем называют дуралюмин (дюраль) и используют в самолёто-, судо- и машиностроении.
Конспект урока по химии «Металлическая химическая связь». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
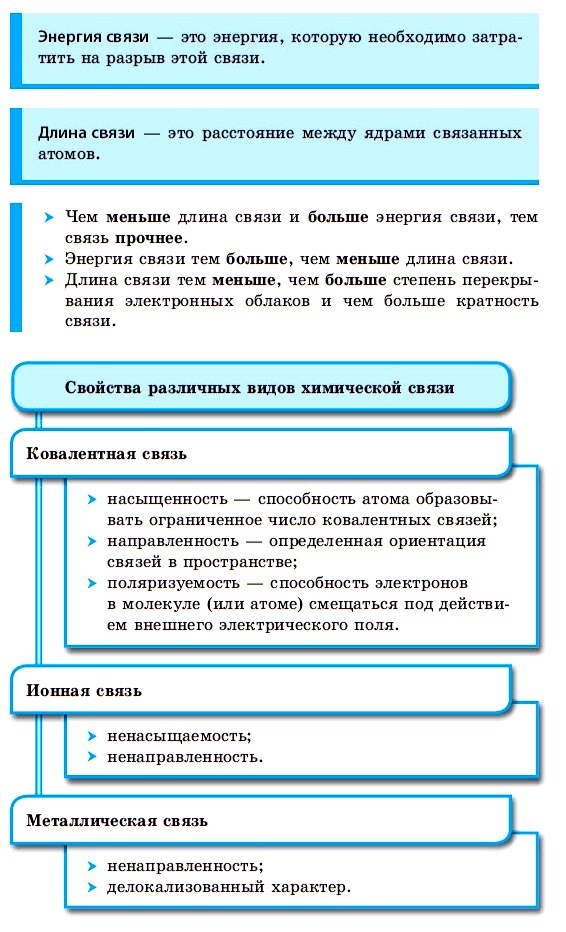
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s 1 . Ее графический вариант:Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:

Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.

Электронная формула атома хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 . Графическая формула:
Электронная формула атома азота: 1s 2 2s 2 2p 3 . Графическая формула:
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.

При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:

В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.

В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион:Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.

Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl – , Н + , Na + , так и сложными (многоатомными): NH4 – . Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов: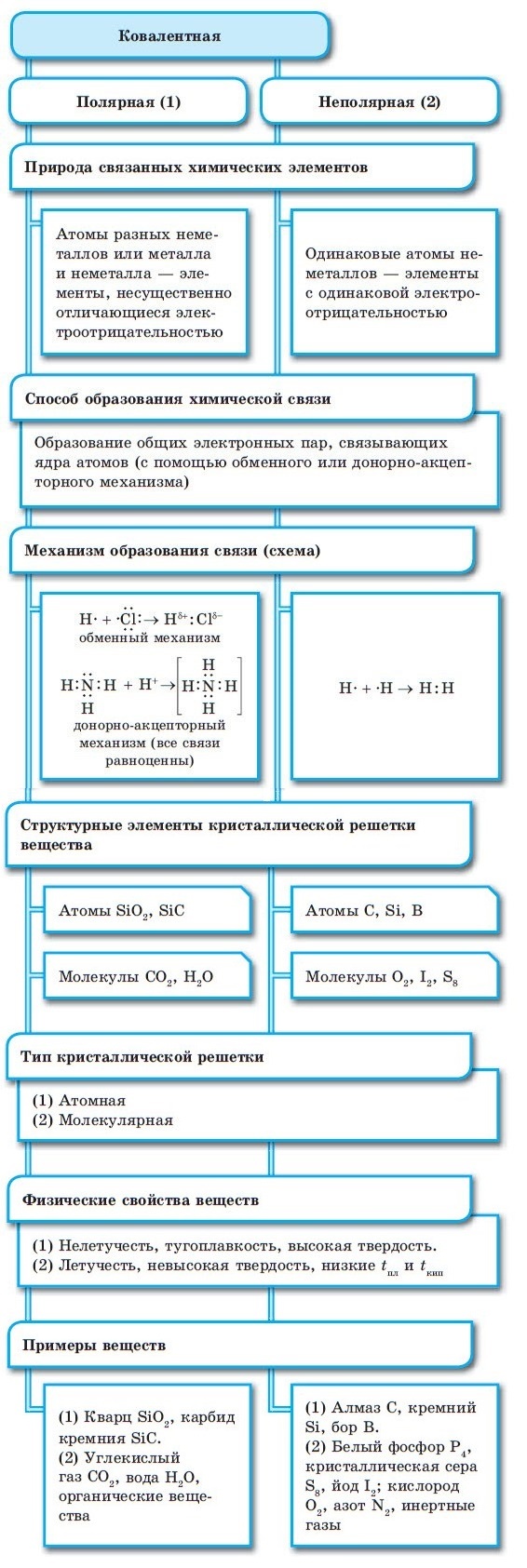

Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Виды металлических связей и как они образуются
Все вещества во Вселенной имеют свою структуру строения, а следовательно — и свои свойства. Об особой связи частиц веществ впервые написал Уильям Хиггинс в XVIII веке. Тогда в своем научном труде ученый описал «особую соединительную силу», которая стала основой для возникновения теории о валентности, а позже — теории о химических связях.
Современная химия описывает существование нескольких типов химических связей:
Атомы металлов между собой объединяются в вещества с появлением новых свойств. При этом связь между атомами-металлами отличается свойствами от ковалентной и ионной связей.
Металлическая связь — особый вид химической связи, возникающий между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов. Металлическая связь встречается в простых веществах металлах и их сплавах.
Металлическая связь формируется за счет частиц двух видов:
- ионизированных атомов металлов, которые в процессе формирования отдают электроны, а значит получают положительный заряд;
- свободных электронов, называемых «электронным газом», имеющих отрицательный заряд по своей природе происхождения.
Вещества с металлической связью чаще всего представляют собой чистые соединения и сплавы различных металлов, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Атомы металлов имеют ряд особенностей:
- небольшое количество электронов на внешнем электронном уровне;
- большие радиусы.
Благодаря данным характеристикам соединения металлов легко отдают внешние электроны, что позволяет им становиться ионами с положительным зарядом.
По природе происхождения металлическая связь близка к ковалентной, а также к ионным соединениям, но в силу ряда отличий представляет собой отдельный тип химических связей.
Сходства и отличия металлической химической связи от ионной и ковалентной
Все виды связи переплетаются между собой и имеют сходные черты. Более того, некоторые соединения могут иметь сразу несколько видов связи в одной молекуле.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию катионов металлов.
Обобществление отрицательно заряженных электронов по системе частично перекрывающихся орбиталей металлов приводит к формированию прочной химической связи, что напоминает по механизму образования ковалентную связь.
Каждый из видов связи имеет свои особенности построения решеток, взаимодействия частиц, а также характерные свойства.
Несмотря на схожесть металлической связи с ковалентной и ионной, каждая из них имеет ряд характерных черт, благодаря которым можно легко определить вид связи в соединении.
Металлическая связь в отличие от ковалентной имеет высокую концентрацию электронов проводимости в атомах металлов. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
В отличие от ковалентной связи металлическая:
- ненасыщаема— объединяет большое количество атомов;
- ненаправлена и делокализирована и электроны в связи обобществляются всеми атомами соединения.
В отличие от ионной связи металлическая образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному атомному ядру, а свободно движутся по кристаллической решетке.
Виды, особенности образования, как происходит, схема
Металлическая связь не может существовать между отдельными соединенными между собой атомами. Она появляется только в веществах.
При этом связи в этих веществах не отличаются постоянством. Электроны, отделившиеся от атомов металлов, превращаются в «электронный газ», благодаря чему они могут спокойно путешествовать по кристаллической решетке.
Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
Характерные кристаллические решетки
Кристаллическая решетка в веществах с металлической связью является основой, неким каркасом кристалла, в узлах которой находятся ионы металла, а между ними в виде «электронного газа» перемещаются отрицательно заряженные электроны, периодически присоединяющиеся к ионам металлов, превращая их в атомы.
Форма кристаллической решетки отличается в зависимости от группы, к которой относится металл:
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелочноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдрическую решетку.
Физические свойства металлов
Почти все металлы и их сплавы имеют сходные физические свойства:
Читайте также:
