Теннесси металл или неметалл
Обновлено: 01.06.2024
Теннесин – новый химический элемент, который был открыт в 2020 году. Его отличительная особенности — высокая радиоактивность, поэтому в природе в свободном виде элемент не существует, и добыть его можно только в лабораторных условиях. По классификации Теннессин относится к 17 группе и обладает зарядовым числом 117.
Формально его принято относить к галогенам, но эта информация еще не получила официального подтверждения, так как свойства элемента пока изучены не до конца.
Как появилось официальное название?
Изначально новый химический элемент назвали унунсептий. Это своего рода аббревиатура, которая в переводе с латинского означает «одно-одно-седьмой». Когда открытие элемента получило официальное подтверждение, ему присвоили постоянное название Теннессин.
Интерес представляет история создания названия. Еще в 2016 году известный химик и блогер Кей Дей предложил назвать новый элемент Октарином, в честь цвета магии из книг «Плоский мир». Но в том же году сотрудники Международного союза теоретической и прикладной химии (ИЮПАК) предложили назвать элемент в честь американского штата Теннеси, ведь именно местные ученые внесли огромный вклад в изучение элемента. Научная общественность обсуждала это предложение почти пять месяцев, и в ноябре 2016 года новый элемент получил официальное название.
Для обозначения элемента в таблице был выбран символ Ts, хотя эта аббревиатура уже существует. В органической химии ею обозначают радикал тозил, но ученые считают, что путаницы в формулах не возникнет.
Как был получен элемент
Впервые Теннесин был получен в российском городе Дубна в 2009 году. Достижение ученых опубликовали в научном журнале Physical Review Letters в 2010 году.
Для подтверждения открытия экспериментальное получение элемента повторили в 2012 году в России, и в 2014 – в Германии.
Физические свойства элемента
Поскольку Теннесин был открыт совсем недавно, его точные физические свойства все еще являются предметом активных обсуждений. Номинально элемент принято относить к галогенам, хотя его исследования продолжаются. В результате было зафиксировано шесть ядер нового элемента — пять 293 Ts и одно 294 Ts.
Ученым удалось установить, что Теннессин, вероятнее всего, относится металлоидам. Соответственно, его металлические свойства превышают неметаллические. При комнатной температуре элемент твердый, а температура плавления находится в пределах 300-500 градусов. Температура кипения, по разным данным, достигает 550-610 градусов. Однако, более поздние исследования показали, что эти показатели сильно завышены. Ученые установили, что Теннессин начинает кипеть уже при 345 градусах. Такие низкие показатели связаны с тем, что, в отличие от других галогенов, Теннессин может быть одноатомным.
Химические свойства
Все галогены, в том числе и Теннессин, в определенной степени проявляют свойства окислителей, причем окислительная способность постепенно уменьшается (от фтора к астату). Поскольку Теннессин стоит в ряду после астата, окислительные свойства у него практически не проявляются, поскольку электроны существенно удалены от ядра. Ученые предполагают, что этот элемент станет единственным среди галогенов, у которого восстановительная способность превысит окислительную.
Химические свойства Теннессина пока изучают, но предполагается, что степень окисления -1 возможна только с сильными восстановителями. При этом сам элемент не будет образовывать устойчивых солей. Существует предположение, что вторая по распространенности степень окисления +3. Возможна и степень +5, но лишь в жестких условиях.
Теннессин

Теннессин (новолат. и англ. Tennessine ), ранее фигурировал под временными названиями унунсептий (лат. Ununseptium , Uus) или э́ка-аста́т — химический элемент семнадцатой группы (по устаревшей классификации — главной подгруппы седьмой группы), седьмого периода периодической системы химических элементов, обозначаемый символом Ts и обладающий зарядовым числом 117. Чрезвычайно радиоактивен. Период полураспада более устойчивого из двух известных изотопов, 294 Ts, составляет около 78 миллисекунд , атомная масса этого изотопа равна 294,210(5) а.е.м. . Формально относится к галогенам, однако его химические свойства ещё не изучены и могут отличаться от свойств, характерных для этой группы элементов. Унунсептий был открыт последним из элементов седьмого периода таблицы Менделеева.
Содержание
- 1 Происхождение названия
- 2 Нахождение в природе
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
Происхождение названия
После открытия элементу было присвоено временное название «унунсептий», данное элементу по правилам Международного союза теоретической и прикладной химии (ИЮПАК), образованное из корней латинских числительных и буквально обозначающее что-то наподобие «одно-одно-седьмой» (латинское числительное «117-й» пишется совсем иначе: centesimus septimus decimus ). В дальнейшем, после подтверждения открытия, название было изменено на постоянное «теннессин».
30 декабря 2015 года ИЮПАК официально признал открытие 117-го элемента и приоритет в этом учёных из Объединённого института ядерных исследований (ОИЯИ) и Ливерморской национальной лаборатории.
7 января 2016 года химик и блогер Кей Дей опубликовал петицию, в которой просил назвать новый элемент «Октарином» в честь цвета волшебства из серии книг Терри Пратчетта «Плоский мир».
8 июня 2016 года ИЮПАК рекомендовал дать элементу название «теннессин» (Ts) в знак признания вклада штата Теннесси, в том числе Национальной лаборатории Ок-Ридж, Университета Вандербильта и Университета Теннесси в Ноксвилле, в изучение сверхтяжёлых элементов, включая производство и химическое разделение изотопов актиноидов для синтеза сверхтяжёлых элементов в Высокопоточном изотопном реакторе и Центре развития радиохимической инженерии НЛОР. Название «теннессин» было представлено научной общественности для 5-месячного обсуждения с 8 июня по 8 ноября 2016 года.
28 ноября 2016 года ИЮПАК утвердил название «теннессин» для 117-го элемента.
Название Tennessine дано в формате, принятом для названий галогенов в английском языке. При этом в большинстве других языков (русском, немецком, французском и т. д. ) в названиях галогенов суффикс «-ин» не используется, хотя, например, в русскоязычной литературе до 1962 года использовалось название «астатин», а не «астат». Поскольку языком международной химической номенклатуры и рабочим языком ИЮПАК является английский, эта организация не представляет латинские названия элементов. Поэтому латинское название теннессина остаётся неопределённым — это может быть традиционное Tennessium или на английский манер Tennessinum . Учтя особенности других языков, ИЮПАК в своих рекомендациях указал, что английская традиция наименования галогенов не является примером для других языков и название tennessine может быть переведено, преобразовано или адаптировано в других языках для удобства использования и обеспечения единообразия названий галогенов. Через несколько дней после этого организация, ответственная за испанскую химическую терминологию, решила использовать название teneso , отбросив суффикс -ine, как и в других испанских названиях галогенов. Вслед за этим Комиссия по обогащению французского языка, следуя традиции, рекомендовала для использования во французском языке название tennesse . Затем аналогичное решение — использовать название tenness — приняли и немецкие эксперты.
Интересен тот факт, что другой галоген, астат, после неподтвердившегося открытия в 1932 году некоторое время носил название «алабамий» (лат. Alabamium , англ. Alabamine ), данное в честь другого американского штата.
В качестве обозначения для теннессина был выбран символ Ts, который уже используется в органической химии для обозначения радикала тозила. Так, например, формула TsOH соответствует как тозиловой кислоте , так и гипотетической теннессиноватистой кислоте, хотя формула последней традиционно должна записываться как HTsO. Но первооткрыватели считают, что такое совпадение вряд ли вызовет путаницу, поскольку для обозначения радикалов пропила и ацила (или ацетила) уже используются символы Pr и Ac, которые идентичны символам празеодима и актиния. Другой вариант обозначения — Tn был отвергнут, поскольку этот символ, принятый в 1923 году для обозначения торона (ториевой эманации) — одного из изотопов радона — продолжает регулярно использоваться в ряде областей науки.
Нахождение в природе
Теннессин не встречается в природе в свободном виде ввиду своей чрезвычайно высокой радиоактивности.
Получение
Теннессин (унунсептий, эка-астат) был впервые получен ОИЯИ в Дубне (Россия) в 2009 году. Для синтеза 117-го элемента мишень из изотопа 97-го элемента, берклия-249, полученного в Окриджской национальной лаборатории (США), обстреливали ионами кальция-48 на ускорителе У-400 Лаборатории ядерных реакций ОИЯИ. Для синтеза элемента использовались реакции:
Ca20 48 + 97 249 Bk → Ts117 297 ∗ → Ts117 294 + 30 1 n Ca20 48 + 97 249 Bk → Ts117 297 ∗ → Ts117 293 + 40 1 n
В результате было зафиксировано шесть ядер нового элемента — пять 293
Ts и одно 294
Ts .
5 апреля 2010 года научная статья, описывающая обнаружение нового химического элемента с атомным номером 117, была принята для публикации в журнал Physical Review Letters .
В июне 2012 года эксперимент был повторён. Было зафиксировано пять ядер 293
Ts .
В 2014 году существование 117-го элемента подтвердила международная группа физиков-ядерщиков, работающая в Центре по изучению тяжёлых ионов им. Гельмгольца (Дармштадт, Германия).
Физические свойства
Теннессин номинально относится к галогенам, следуя после йода и астата. Точные свойства теннессина остаются предметом обсуждения.
Теннессин, по наиболее вероятной модели, является металлоидом (или полуметаллом), с преимуществом металлических свойств над неметаллическими.
Его плотность ожидается в диапазоне 7,1—7,3 г/см³ , то есть несколько больше, чем плотность его гомолога астата, равная 6,3—6,5 г/см³ (вследствие того, что астат очень сильно радиоактивен, его плотность также рассчитана теоретически).
При комнатной температуре теннессин должен быть твёрдым, в ранних работах его температура плавления предсказывалась в интервале 300—500 °C, кипения — 550 °C, по одним расчётам, и даже 610 °C, следуя тенденции роста температуры плавления с ростом атомного номера в группе галогенов.
Однако более поздние расчёты дают намного меньшие значения, предсказывая, что теннессин будет кипеть при температуре всего лишь 345 °C или даже ещё меньшей — вплоть до 230 °C, что ниже температуры кипения астата, которая составляет 309 °C.
Столь низкие ожидаемые температуры кипения могут быть связаны с тем, что, в отличие от остальных галогенов, теннессин может быть одноатомным, не образовывая или почти не образовывая двухатомных молекул Ts2.
Все галогены в той или иной степени проявляют свойства окислителей, причём окислительная способность уменьшается от фтора к астату. Теннессин, следуя в ряду галогенов после астата, почти не сможет проявлять окислительную способность ввиду большого удаления электронов от ядра, и, вероятно, станет первым из галогенов, восстановительная способность которого будет сильнее окислительной. Предполагается, что в отличие от остальных галогенов наиболее устойчивой степенью окисления теннессина будет +1. Эта степень окисления будет особенно устойчивой, как и устойчивость иона At + , только у теннессина её стабильность будет ещё выше.
Степень окисления −1, как и у остальных галогенов, вероятно, возможна, однако предполагается, что у теннессина она возникает только с сильными восстановителями и что теннессин, в отличие от остальных галогенов, не может образовывать устойчивых солей в степени окисления −1 (такие соли могут называться теннессинидами). Они смогут окисляться даже кислородом воздуха до степени окисления +1 — гипотеннессинитов, аналогов гипохлоритов.
Самым простым соединением теннессина является его соединение с водородом, TsH, или (по аналогии с названиями других галогенов) теннессиноводород. Длина молекулы должна составлять приблизительно 195 пм , следуя тенденции увеличения длины по мере роста порядкового номера галогена. Теннессиноводород будет продолжать большинство тенденций для галогенводородов .
Оганесон

Оганесон (лат. Oganesson , Og), ранее был известен под временными названиями унуноктий (лат. Ununoctium , Uuo) или э́ка-радо́н — химический элемент восемнадцатой группы (по устаревшей классификации — главной подгруппы восьмой группы), седьмого периода периодической системы химических элементов, атомный номер — 118. Наиболее стабильным (и единственным известным на 2016 год) является нуклид 294 Og, чей период полураспада оценивается в 1 мс , а атомная масса равна 294,214(5) а. е. м. Искусственно синтезированный радиоактивный элемент, в природе не встречается. Синтез ядер оганесона был впервые осуществлён в 2002 и 2005 годах в Объединённом институте ядерных исследований (Дубна) в сотрудничестве с Ливерморской национальной лабораторией. Результаты этих экспериментов были опубликованы в 2006 году. 28 ноября 2016 года временное систематическое название «унуноктий» и временное обозначение Uuo после формального подтверждения открытия элемента были заменены на постоянное название «оганесон» и обозначение Og (в честь академика Юрия Цолаковича Оганесяна), предложенные первооткрывателями и утверждённые ИЮПАК.
Номинально элемент относится к инертным газам, однако его физические и, возможно, химические свойства, вероятно, могут сильно отличаться от остальных представителей группы. Оганесон завершает седьмой период таблицы Менделеева, хотя на момент его открытия ещё оставалась незаполненной предыдущая, 117-я клетка таблицы (теннессин).
- 1 Происхождение названия
- 2 История открытия
- 3 Получение
- 4 Физические свойства
- 5 Химические свойства
- 6 Известные изотопы
История открытия
Первое заявление об открытии элементов 116 и 118 в 1999 году в Беркли (США) оказалось ошибочным и даже фальсифицированным. Использовалась реакция холодного слияния ядер свинца и криптона:
Синтез по объявленной методике не был подтверждён в российском, немецком и японском центрах ядерных исследований, а затем и в США.
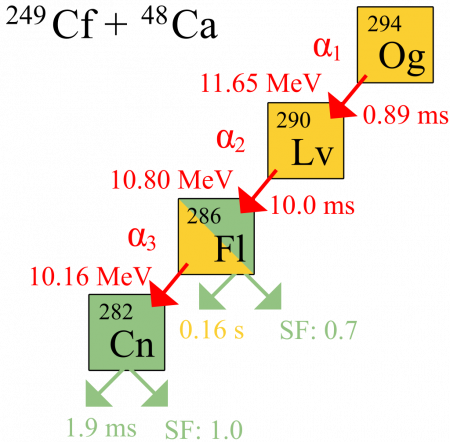
Схематическая диаграмма альфа-распада оганесона-294 с периодом полураспада T1/2 = 0,89 мс и энергией распада Eα = 11,65 МэВ . Дочерний нуклид ливерморий-290 испытывает альфа-распад, T1/2 = 10,0 мс , Eα = 10,80 МэВ , с образованием ядра флеровия-286. Последний с вероятностью 30 % путём альфа-распада ( T1/2 = 0,16 с , Eα = 10,16 МэВ ) превращается в коперниций-282 и с вероятностью 70 % испытывает спонтанное деление. Коперниций-282 распадается путём спонтанного деления с периодом полураспада 1,9 мс
Оганесон был получен в результате ядерной реакции
Оганесон, в отличие от более лёгких аналогов, будет первым инертным газом в твёрдом состоянии при нормальных условиях, что придаёт ему совершенно иные физические свойства.
Поэтому он, хоть номинально принадлежит к группе инертных газов, не будет газом. При небольшом нагревании он легко будет плавиться и испаряться, его ожидаемая расчётная температура кипения составляет 80 ± 30 °C (довольно широкий диапазон вследствие вариации влияния релятивистских эффектов). Температура плавления его неизвестна, однако (по аналогии с более лёгкими элементами) ожидается, что она будет лишь немного ниже температуры кипения. Примерно такую же температуру плавления, как оганесон, имеет воск.
Столь значительное повышение температур плавления и кипения у оганесона по сравнению с радоном вызывают релятивистские эффекты 7 p -оболочки, помимо простого увеличения атомной массы, которое усиливает межмолекулярное взаимодействие. Впрочем, оганесон предполагается одноатомным, хотя тенденция к образованию двухатомных молекул у него сильнее, чем у радона.
Расчётная плотность в твёрдом состоянии у оганесона при температуре плавления составляет около 5 г/см 3 . Это немного выше плотности радона в сжиженном состоянии (при −62 °C), которая составляет 4,4 г/см 3 . В газообразном состоянии оганесон будет похож на радон: представлять собой тяжёлый бесцветный газ, немного выше по плотности самого радона.
Оганесон принадлежит к инертным газам, имея завершённую 7 p -электронную оболочку и завершённую электронную конфигурацию, что означает его химическую инертность и нулевую по умолчанию степень окисления. Однако соединения тяжёлых благородных газов (начиная с криптона) с сильным окислителями (например, фтором или кислородом) всё же существуют, причём по мере роста порядкового номера электроны удаляются от ядра, поэтому лёгкость окисления инертного газа сильными окислителями от криптона к радону возрастает. Теоретически предполагается, что оганесон будет несколько активнее радона. Его ожидаемая энергия ионизации первого электрона составляет 840 кДж/моль , что существенно ниже радона ( 1036 кДж/моль ) и ксенона ( 1170 кДж/моль ).
Довольно низкая энергия ионизации оганесона и его иные физические свойства предполагают, что оганесон, хотя и будет химически малоактивным по сравнению с большинством других элементов, но по сравнению с предыдущими инертными газами будет весьма химически активен.
Если более лёгкие аналоги — ксенон или криптон — требовали для окисления чрезвычайно жёстких условий и применения фтора, то оганесон должен окисляться гораздо легче. Он будет даже более активен, чем флеровий и коперниций — самые малоактивные элементы среди сверхтяжёлых элементов.
Электроотрицательными элементами оганесон сможет относительно легко окисляться до двух степеней окисления — +2 и +4, причём со фтором оганесон будет образовывать скорее ионные, чем ковалентные соединения (например, OgF4). Оганесон сможет образовать, в отличие от более лёгких аналогов, относительно стабильные соединения и с менее электроотрицательными элементами, например, хлором, азотом или, возможно, и другими элементами. Вероятно, он сможет относительно легко окисляться и кислородом. Возможна теоретически также и степень окисления +1. Возможно, сильные кислоты-окислители также смогут окислять оганесон до оксидов или даже переводить его в состав катиона, подобно металлу.
Степень окисления +6 для оганесона будет также возможна, но она будет значительно менее стабильна и требовать жёстких условий для разрушения всего 7 p -подуровня. Оганесон сможет, вероятно, образовывать, оганесонистую кислоту H2OgO4 (подобно ксенону, образующему ксенонистую кислоту H2XeO4) и соли оганесаты, а все соединения его в степени окисления +6 будут очень сильными окислителями.
В отличие от ксенона, высшая теоретическая степень окисления оганесона +8 будет невозможна из-за требуемой крайне высокой энергии на распаривание 7 s -электронов (как и у других 7 p -элементов). Поэтому +6 будет высшей степенью окисления оганесона.
Оганесон также будет проявлять не только восстановительные свойства, но и сам служить окислителем для сильных восстановителей, проявляя степень окисления −1 за счёт релятивистских эффектов подоболочек. Теоретически инертные газы не могут выступать в качестве окислителей, поскольку у них все электронные оболочки завершены, однако на практике оганесон сможет образовывать соли с активными металлами — оганесониды (например, оганесонид цезия CsOg), выступая в качестве окислителя, в этом проявляя некоторое сходство с галогенами.
Нихоний

Нихоний (лат. Nihonium , Nh), который ранее фигурировал под временными наименованиями унунтрий (лат. Ununtrium , Uut) или эка-таллий, — химический элемент 13-й группы (по устаревшей классификации — главной подгруппы III группы) 7-го периода периодической системы. Атомный номер — 113. Атомная масса наиболее устойчивого из известных изотопов, 286 Nh, с периодом полураспада 20 с, составляет 286,182(5) а. е. м. . Радиоактивен.
- 1 История открытия
- 2 Название
- 3 Получение
- 4 Известные изотопы
- 5 Физические и химические свойства
В феврале 2004 года были опубликованы результаты экспериментов, проводившихся с 14 июля по 10 августа 2003 года, в результате которых был получен 113-й элемент. Исследования проводились в Объединённом институте ядерных исследований (Дубна, Россия) на циклотроне У-400 с использованием дубненского газонаполненного сепаратора ядер отдачи (DGFRS) совместно с Ливерморской национальной лабораторией (США). В этих экспериментах в результате бомбардировки мишени из америция ионами кальция были синтезированы изотопы элемента 115 (в настоящее время получившего название «московий», Mc): три ядра 288 Mc и одно ядро 287 Mc. Все четыре ядра в результате альфа-распада превратились в изотопы элемента 113 ( 284 Nh и 283 Nh). Ядра элемента 113 претерпели дальнейший альфа-распад, превратившись в изотопы элемента 111 (рентгений). Цепочка последовательных альфа-распадов привела в результате к спонтанно делящимся ядрам элемента 105 (дубний).
В 2004 и 2005 годах в ОИЯИ (в сотрудничестве с Ливерморской национальной лабораторией) были проведены эксперименты по химической идентификации конечного продукта распада цепочки 288 115 → 284 113 → 280 111 → 276 109 → 272 107 → 268 105, долгоживущего (около 28 часов) изотопа 268 Db. Эксперименты, в которых было исследовано ещё 20 событий, подтвердили синтез 115-го и 113-го элементов.
В сентябре 2004 года о синтезе изотопа 113-го элемента 278 Nh в количестве одного атома объявила группа из института RIKEN (Япония). Они использовали реакцию слияния ядер цинка и висмута. В итоге за 8 лет японским учёным удалось зарегистрировать три события рождения атомов нихония: 23 июля 2004-го, 2 апреля 2005-го и 12 августа 2012 годов.
Два атома ещё одного изотопа — 282 Nh — были получены в ОИЯИ в 2007 году в реакции 237 Np + 48 Ca → 282 Nh+ 3 1 n.
Ещё два изотопа — 285 Nh и 286 Nh были получены в ОИЯИ в 2010 году как продукты двух последовательных альфа-распадов теннессина.
В 2013 году атомы нихония были получены группой из Лундского университета в Институте тяжёлых ионов в ходе экспериментов, подтвердивших производство нихония по методике, использованной российско-американской группой в Дубне. В 2015 году такой же способ получения успешно повторили в Национальной лаборатории имени Лоуренса в Беркли.
Получение методом холодного слияния, использованного японскими учёными, ни одна лаборатория пока не проводила в виду её низкой эффективности.
В августе 2015 года на съезде IUPAC в Пусане было объявлено, что доклад об элементах под номерами 113, 115, 117 и 118 уже подготовлен. Однако никакой подробной информации обнародовано не было. В декабре 2015 года было объявлено, что окончательное решение о приоритете открытия и названии химического элемента № 113 будет принято в январе 2016 года на заседании Международного союза теоретической и прикладной химии. При этом уже тогда сообщалось, что приоритет будет отдан команде исследователей RIKEN. И 30 декабря 2015 года ИЮПАК официально признал открытие 113-го элемента и приоритет в этом учёных из RIKEN. Таким образом, 113-й стал первым элементом, открытым в Японии и вообще в азиатской стране.
Метод горячего слияния, использованный учёными из ОИЯИ, оказался намного эффективнее метода холодного слияния, использованного учёными из RIKEN, позволив получить несколько десятков атомов нихония против трёх у японцев. Кроме того, российско-американские эксперименты были успешно воспроизведены в Дармштадте и Беркли. Тем не менее рабочая группа IUPAC/IUPAP признала приоритет японских учёных в открытии, поскольку полученные ими лёгкие изотопы нихония в ходе своего распада превращались в хорошо изученные изотопы, в частности 266
107 Bh, а распады тяжёлых изотопов нихония, получаемых методом горячего слияния, происходят через новые, никогда ранее не наблюдавшиеся изотопы. Также у рабочей группы возникли сомнения в возможности химически отличить дубний от резерфордия методом, использованным учёными ОИЯИ при анализе продуктов распада изотопов нихония и московия.
Название
Первоначально для 113-го элемента использовалось систематическое название унунтрий (лат. Ununtrium ), составленное из корней латинских числительных, соответствующих порядковому номеру: Ununtrium — дословно «одно-одно-третий»).
Синтезировавшие элемент учёные из российского наукограда Дубна предлагали назвать его беккерелием (Becquerelium, Bq) в честь открывателя радиоактивности Анри Беккереля (ранее этим же названием предлагалось назвать 110-й элемент, который стал дармштадтием). Учёные из Японии предложили назвать элемент японием (Japonium, Jp), нисинанием (Nishinanium, Nh) — в честь физика Ёсио Нисина), или рикением (Rikenium, Rk) — в честь института RIKEN.
8 июня 2016 года ИЮПАК рекомендовал дать элементу название «нихоний» (Nihonium, Nh) по одному из двух вариантов самоназвания Японии — Нихон, что переводится как «Страна восходящего солнца». Название «нихоний» было представлено научной общественности для пятимесячного обсуждения с 8 июня по 8 ноября 2016 года, после чего оно должно было быть формально утверждено на ближайшем конгрессе ИЮПАК, назначенном на июль 2017 года.
28 ноября 2016 года ИЮПАК утвердил для 113-го элемента название «нихоний».
Изотопы нихония были получены в результате α-распада изотопов московия:
Mc115 288 → Nh113 284 + 2 4 He , Mc115 287 → Nh113 283 + 2 4 He , Mc115 289 → Nh113 285 + 2 4 He , Mc115 290 → Nh113 286 + 2 4 He ,
а также в результате ядерных реакций
Известные изотопы
Физические и химические свойства
Нихоний принадлежит к подгруппе бора, следуя в ней после таллия. Нихоний предположительно является тяжёлым (с расчётной плотностью 16 г/см 3 ) непереходным металлом.
Как и все металлы подгруппы бора (начиная с алюминия), он должен быть весьма легкоплавок. Расчётная температура плавления нихония 430 °C (немного выше таллия, который плавится при 304 °C).
Расчётные химические свойства нихония предполагаются очень интересными. Ожидается, что нихоний будет существенно менее реакционноспособным, чем таллий (свойства которого ближе к щелочным металлам), и будет больше похож не на него, а на металлы побочной подгруппы I группы — медь или серебро. Причиной этого служат релятивистские эффекты взаимодействия одного 7p-электрона с двумя 7s 2 электронами, которые повышают энергию ионизации нихония до 704,9 кДж/моль , что гораздо выше энергии ионизации таллия ( 589,4 кДж/моль ).
Нихоний обладает самым сильным сродством к электрону среди всей подгруппы бора ( 0,64 эВ ). Поэтому он может быть и окислителем, в отличие от всех предыдущих элементов. Присоединяя один электрон, нихоний приобретает стабильную электронную конфигурацию флеровия, поэтому он может проявлять некоторое сходство с галогенами, давая нихониды — соли, где имеется анион Nh − . Такие соли, впрочем, будут проявлять довольно сильные восстановительные свойства, однако гипотетическое соединение NhTs с теннессином будет на самом деле иметь вид TsNh — нихоний будет окислителем, а теннессин восстановителем.
Степень окисления нихония +1 возможна и, как и у таллия, будет наиболее устойчивой степенью окисления; однако отличия от химии таллия весьма значительны. Так, ожидается, что гидроксид нихония, в отличие от гидроксида таллия, будет слабым основанием, легко разлагающимся до Nh2O (возможно, он и вовсе не будет существовать, как гидроксид серебра). Моногалогениды нихония(I), подобно галогенидам таллия(I) и серебра(I) (кроме фторидов), в воде будут малорастворимыми либо вовсе нерастворимыми.
Кроме степеней окисления −1 и +1, нихоний сможет проявлять степени окисления +2, +3 и даже +5, что противоречит порядку группы. Однако дальнейшее окисление нихония осуществляется не с помощью 7s 2 электронов, на разбиение пары которых требуется слишком много энергии, а за счёт 6d-электронной оболочки. Поэтому соединения нихония в степени окисления +3 не будут похожи на соединения более лёгких аналогов в этой степени окисления. С учётом тенденции, эта степень окисления нихония будет относительно малоустойчивой, и нихоний сможет образовывать её, как правило, с сильными электроотрицательными элементами (фтор, хлор, кислород). Форма молекулы будет Т-образной, а не треугольной, как соли других элементов подгруппы бора в степени окисления +3.
Высшая степень окисления +5 теоретически возможна, но только со фтором и в жёстких условиях, подобно фториду золота(V), и, вероятно, она будет нестабильна. Однако предполагается существование аниона NhF6 - , который будет стабилен в составе гипотетических солей фторнихониевой кислоты.
Теннессин, свойства атома, химические и физические свойства
Теннессин, свойства атома, химические и физические свойства.


Ts 117 Теннессин
294 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 5f 14 6s 2 6p 6 6d 10 7s 2 7p 5
Теннессин — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 117. Расположен в 17-й группе (по старой классификации — главной подгруппе седьмой группы), седьмом периоде периодической системы.
Общие сведения
Свойства атома
Химические свойства
Физические свойства
теннессин атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле теннессин теннессина
сколько электронов в атоме свойства металлические неметаллические термодинамические
Мировая экономика
Справочники
Востребованные технологии
- Концепция инновационного развития общественного производства – осуществления Второй индустриализации России на период 2017-2022 гг. (107 240)
- Экономика Второй индустриализации России (103 688)
- Этилен (этен), получение, свойства, химические реакции (30 343)
- Программа искусственного интеллекта ЭЛИС (30 335)
- Метан, получение, свойства, химические реакции (27 148)
- Крахмал, свойства, получение и применение (26 880)
- Природный газ, свойства, химический состав, добыча и применение (25 805)
- Целлюлоза, свойства, получение и применение (25 506)
- Пропилен (пропен), получение, свойства, химические реакции (24 242)
- Прямоугольный треугольник, свойства, признаки и формулы (24 177)
Поиск технологий
О чём данный сайт?
Настоящий сайт посвящен авторским научным разработкам в области экономики и научной идее осуществления Второй индустриализации России.
Он включает в себя:
– экономику Второй индустриализации России,
– теорию, методологию и инструментарий инновационного развития – осуществления Второй индустриализации России,
– организационный механизм осуществления Второй индустриализации России,
– справочник прорывных технологий.
Мы не продаем товары, технологии и пр. производителей и изобретателей! Необходимо обращаться к ним напрямую!
Мы проводим переговоры с производителями и изобретателями отечественных прорывных технологий и даем рекомендации по их использованию.
О Второй индустриализации
Осуществление Второй индустриализации России базируется на качественно новой научной основе (теории, методологии и инструментарии), разработанной авторами сайта.
Конечным результатом Второй индустриализации России является повышение благосостояния каждого члена общества: рядового человека, предприятия и государства.
Вторая индустриализация России есть совокупность научно-технических и иных инновационных идей, проектов и разработок, имеющих возможность быть широко реализованными в практике хозяйственной деятельности в короткие сроки (3-5 лет), которые обеспечат качественно новое прогрессивное развитие общества в предстоящие 50-75 лет.
Та из стран, которая первой осуществит этот комплексный прорыв – Россия, станет лидером в мировом сообществе и останется недосягаемой для других стран на века.
Читайте также:
