Тест 20 металлы химические свойства способы получения
Обновлено: 04.07.2024
Тест можно использовать для проверки знаний учащихся 9 класса по теме "Химические свойства металлов". Тест включает задания разноуровневые. Часть А включает задания с выбором ответа, а часть В задания, где нужно найти соответствие. Ученики первого варианта отвечают на нечётные вопросы, а ученики второго варианта на чётные вопросы.
| Вложение | Размер |
|---|---|
| test_po_him_svoystva.docx | 19.82 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Химические свойства металлов
А1.Проявляет только восстановительные свойства 1) O 2 2) S 3) Na 4) CL 2
А2.Легко взаимодействует с кислородом при обычных условиях 1) Fe 2)Au 3) Zn 4) Ca
А3. Взаимодействует с кислородом только при нагревании 1) Ag 2) Li 3) Cu 4) Na
А4.Не взаимодействует с кислородом 1) Pt 2) Ca 3) Cu 4) K
А5. В реакции 2K+2HOH=2KOH+H 2 атом калия
- Отдаёт два электрона 3) отдаёт один электрон
- Принимает два электрона 4) принимает один электрон
А6. Наиболее активный металл 1) AL 2) Mg 3) Fe 4) Zn
A7. При горении железа образуется 1) FeOH 2) Fe(OH) 3 3) FeO 2 4) Fe 3 O 4
А8.Укажите верное суждение: А) все металлы легко реагируют с водой, образуя щелочи;
Б) Щелочные и щелочно – земельные металлы легко реагируют с водой, образуя щелочи.
- Верно только А 3) верны оба суждения
- Верно только Б 4) Оба суждения неверны
А9. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) AL,Mg,N 2) Zn,AL,Fe 3) Cu,Pb,Ag 4) Ni,Sn,P
А10. Цинк взаимодействует с каждым из трёх веществ:
1)HgCL 2 ,FeSO 4 ,HCL 2)NaOH,NaCL,NiCL 2 3)HCL,CL 2 ,MgCL 2 4)AL 2 (SO 4 ) 3 ,H 2 SO 4 ,HNO 3
А11. Медь взаимодействует с каждым из трёх веществ:
- HCL,Hg 2 CL 2 3) FeSO 4 ,Hg(NO 3 ) 2 ,H 2 SO 4 (конц.)
- H 2 O,O 2 ,Fe 4) Hg(NO 3)2 ,H 2 SO 4 ( конц .),HNO 3
А12.Укажите окислитель в следующей реакции:Fe +CuSO4=FeSO4 +Cu
А13. Методом электронного баланса поставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO 3 =Mg(NO 3 ) 2 +NH 4 NO 3 +H 2 O. Ответ дайте в виде коэффициента перед окислителем.
1) 4 2) 6 3) 8 4) 10
А14. При взаимодействии паров воды на раскалённое железо образовалось 200 л (н.у.) водорода. Определите массу вступившего в реакцию железа, если реакция получения водорода шла с выходом 80%.
1) 469 2) 479 3) 489 4) 499
А15. Определите объём воздуха (н.у.), необходимого для сгорания 100 г железа до железной окалины, если объёмная доля кислорода в воздухе равна 0,21. 1) 107 л 2) 117 л 3) 127 л 4)137 л
В1. Установите соответствие между уравнением реакции и числом электронов, отданных металлом. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Уравнение реакции Число электронов
А) 2Cu+O 2 =2CuO 1) 1
Б) 4Na+O 2 =2Na 2 O 2) 2
В) 4AL+3O 2 =2AL 2 O 3 3) 3
Г) Fe+H 2 SO 4 =FeSO 4 4) 4
В2. Установите соответствие между металлом и его способностью реагировать с кислородом. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Металл Способность к реакции с кислородом
А) K 1) Реагирует легко, при комнатной температуре
Б) Ag 2) Реагирует при нагревании
В) Zn 3) Не реагирует
Г) Fe
В3. Установите соответствие между металлом и его способностью реагировать с водой. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Металл Способность к реакции с водой
А) Mg 1) Реагирует легко, при комнатной температуре
Б) Na 2) Реагирует при нагревании
В) Ca 3) Не реагирует
Г) Fe
В4. Реагирует с соляной кислотой с вытеснением водорода: 1) Na,2) Sn 3) Li 4) Cu 5) AL 6) Hg 7)Au . Ответ дайте в виде последовательности цифр в порядке возрастания.
В5. Расположите металлы в порядке усиления восстановительных свойств:1)Fe 2)Mg 3)Hg 4)K 5) Zn . Ответ дайте в виде последовательности цифр.
По теме: методические разработки, презентации и конспекты
Уравнения по теме "Химические свойства металлов"
Большое количество уравнений, требующих детальной проработки теоретического материала.
Урок по теме "Химические свойства металлов"
Урок химии в 9 классе по теме "Химические свойства металлов".

Тест по теме "Химические свойства и получение алканов"
Данный материал представляет собой тестовые задания, состоящие из 4-х вариантов для учащихся 10 класса по теме "Химические свойства и получение алканов".
План-конспект урока химии для 11 класса по теме "Химические свойства металлов"
План-конспект урока по химии для 11 класса по теме "Химические свойства металлов".
Тест по теме «Физические свойства металлов». Тест по теме: "Сплавы"
Тесты включают все вопросы, ответы на которые можно найти в учебнике химия 9 класс, автор учебника О.С. Габриелян. Очень удобно проверить знания учащихся по теме "Физические свойства металлов", "Сплав.
Тест по химии Химические свойства металлов 9 класс
Тест по химии Химические свойства металлов 9 класс с ответами. Тест содержит 2 части. В части 1 — 15 заданий базового уровня. В части 2 — 3 задания повышенного уровня.
Часть 1
1. Проявляет только восстановительные свойства
2. Легко взаимодействует с кислородом при обычных условиях
1) Fe
2) Au
3) Zn
4) Са
3. Взаимодействует с кислородом только при нагревании
1) Ag
2) Li
3) Cu
4) Na
4. Не взаимодействует с кислородом
5. В реакции 2К + 2НОН = 2КОН + Н2 атом калия
1) отдает два электрона
2) принимает два электрона
3) отдает один электрон
4) принимает один электрон
6. Наиболее активный металл
1) Al
2) Mg
3) Fe
4) Zn
7. При горении железа образуется
8. Верны ли следующие суждения?
А. Все металлы легко реагируют с водой, образуя щелочи.
Б. Щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
9. В каком ряду химические элементы расположены в порядке усиления металлических свойств?
1) Al, Mg, Na
2) Zn, Al, Fe
3) Cu, Рb, Ag
4) Ni, Sn, Рb
10. Цинк взаимодействует с каждым из трех веществ:
11. Медь взаимодействует с каждым из трех веществ
12. Укажите окислитель в реакции
1) Cu 0
2) Cu +2
3) Fe +2
4) Fe 0
13. Методом электронного баланса поставьте коэффициенты в уравнении реакции по схеме:
Ответ дайте в виде коэффициента перед окислителем.
14. При действии паров воды на раскаленное железо образовалось 200 л (н.у.) водорода. Определите массу вступившего в реакцию железа, если реакция получения водорода шла с выходом 80% .
1) 469 г
2) 479 г
3) 489 г
4) 499 г
15. Определите объем воздуха (н.у.), необходимый для сгорания 100 г железа до железной окалины, если объемная доля кислорода в воздухе равна 0,21.
1) 107 л
2) 117 л
3) 127 л
4) 137 л
Часть 2
1. Установите соответствие между металлом и его способностью реагировать с кислородом. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
Металл
Способность к реакции с кислородом
1) реагирует легко, при комнатной температуре
2) реагирует при нагревании
3) не реагирует
2. Реагируют с соляной кислотой с вытеснением водорода:
1) Ва
2) Cs
3) Cu
4) Al
5) Hg
6) Au
Ответ дайте в виде последовательности цифр в порядке возрастания.
3. Железо реагирует с горячей азотной кислотой. Используя Интернет, расположите следующие газообразные продукты в порядке их появления при уменьшении концентрации кислоты от концентрированной до очень разбавленной:
Ответ дайте в виде последовательности цифр.
Тест 20 металлы химические свойства способы получения
Тесты по химии 11 класс. Тема: "Металлы"
Правильный вариант ответа отмечен знаком +
1. В какой группе находится металл полоний:
2. К четвертой группе относится элемент:
3. Как проходит условная граница между между металлическими и неметаллическими элементами:
4. Металлургический процесс включает в себя:
+ восстановление ионов металла
- окисление ионов неметалла
- восстановление ионов неметалла
5. Пирометаллургией является:
+ процесс получения металлов из их соединений при высокой температуре
- процесс получения неметаллов из их соединений при низкой температуре
- процесс получения неметаллов из их соединений при высокой температуре
6. В пирометаллургии используются:
- как восстановители, так и окислители
7. При алюмотермии используют металл:
8. В гидрометаллургии получают:
+ металлы из растворов их соединений
- неметаллы из растворов их соединений
- воду из растворов их соединений
9. В электрометаллургии используется процесс:
- обработка при предельно высокой температуре
- реакция замещения и соединения
тест 10. При электролизе восстановителем является:
11. Чем определяются физические свойства металлов:
+ типом кристаллической решетки
- количеством протонов, электронов, нейтронов
- расположением в определенной группе или подгруппе
12. Отличием атомов металлов от неметаллов можно назвать:
+ содержат небольшое количество электронов на внешнем уровне, большой радиус и низкая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, маленький радиус и высокая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, большой радиус и высокая электроотрицательность
13. Металлической является связь:
+ между ионами металлов
- между ионами неметаллов
- между ионами металла и неметалла
14. Для какого агрегатного состояния не характерна металлическая связь:
- для жидкого состояния
- для твердого состояния
15. Чем обусловлена электропроводность металлов?
+ наличием свободных электронов
- наличием свободных нейтронов
- наличием свободных протонов
16. С повышением температуры электропроводность:
- может как повышаться, так и понижаться
17. Электропроводность увеличивается от:
+ ртути к серебру
- алюминия к цинку
18. Максимальной теплопроводностью обладает:
19. Наиболее пластичным металлом называют:
тест-20. Твердым веществом при нормальных условиях не является:
21. Самым твердым металлом является:
- щелочно – земельные металлы
22. Самым тяжелым металлом является:
23. Самым тугоплавким металлом является:
24. К черным металлам можно отнести:
25. Какие степени окисления имеют металлы:
- как положительные, так и отрицательные
26. Металлы в соединениях проявляют свойства:
- окислительно – восстановительные свойства
27. Какая закономерность уменьшения восстановительных свойств металлов:
+ слева направо, снизу-вверх
- справа налево, сверху вниз
28. На данном изображении представлена:
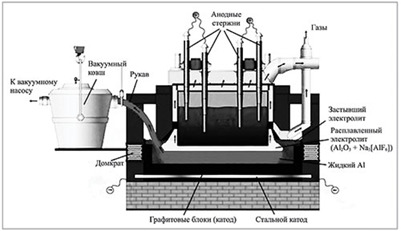
+ схема получения алюминия электролизом
- схема получения железа электролизом
- схема получения гидроксида алюминия электролизом
29. Чем левее находится металл в ряду, тем:
+ больше его восстановительная способность
- меньше его восстановительная способность
- больше его окислительная способность
тест_30. Лантаноиды на внешнем энергетическом уровне содержат по:
31. Сколько примерно имеются металлов в периодической системе Менделеева:
+ более девяти ста
- менее восьми ста
- менее двадцати ста
32. Во сколько раз литий легче осмия:
+ в сорок пять раз
- в шестьдесят раз
- в семьдесят раз
33. Провода высоковольтных изготавливают из:
34. Бронза является сплавом:
- железа и алюминия
- вольфрама и серебра
35. На данном рисунке представлена:
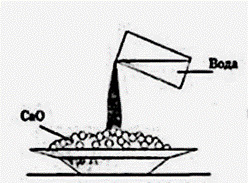
+ реакция гашения извести водой
- реакция соединения калия с хлором
- окисление перманганата калия
36. При взаимодействии с кислородом металлы образуют:
37. При взаимодействии щелочноземельных металлов с водой образуются:
- альдегиды и кетоны
38. Оксидом железа можно назвать:
39. В алюминотермии используется:
тест*40. Взаимодействие металлов с оксидами является реакцией:
Тесты по химии 9 класс. Тема: "Металлы"
3. Как проходит условная граница между металлическими и неметаллическими элементами:
+ слева направо, снизу вверх
28. Легкому окислению поддаются:
35. Кто изображен на данной фотографии:

Тест по теме: «Металлы. Общая характеристика. Получение металлов».
тест по химии (9 класс) на тему
Тест в 2-х вариантах по теме: «Металлы. Общая характеристика. Получение металлов" для контроля знаний учащихся 9 класса по линиям учебника Рудзитиси, Фельдмана.
| Вложение | Размер |
|---|---|
| metally_testirovanie.doc | 29.5 КБ |
Тест по теме: «Металлы. Общая характеристика. Получение металлов».
1. На внешнем энергетическом уровне три электрона имеются у атомов металлов:
Б) кальция, бария;
В) алюминия, индия;
Г) алюминия, кальция.
2. Металлом, строение внешнего энергетического уровня которого …4s 2 , является:
3. Строение атомов кальция характеризуется следующим распределением электронов по электронным слоям в электронной оболочке:
4. Железо проявляет степень окисления +2 в соединении формула которого
5. Способ восстановления металлов более активным алюминием называется
С 1. Напишите электронную формулу Zn.
С 2. Охарактеризуйте металлическую химическую связь. Как она возникает? Что из себя представляет металлическая кристаллическая решетка?
С 3. Найдите число протонов, нейтронов и электронов у иона Cu 2+ .
1. На внешнем энергетическом уровне два электрона имеются у атомов металлов:
А) калия, серебра;
Г) магния, кальция.
2. Металлом, строение внешнего энергетического уровня которого …3s 1 , является:
3. Строение атомов магния характеризуется следующим распределением электронов по электронным слоям в электронной оболочке:
4. Сu проявляет степень окисления +1 в соединении формула которого
5. У атомов металлов на наружном энергетическом уровне находится
В) 2,3,7,8 электронов
Г) от 1 до 3 электронов.
С 1. Напишите электронную формулу Cu.
С 2. Каковы физические свойства металлов. Поясните.
С 3. Найдите число протонов, нейтронов и электронов у иона Ag + .
Урок по теме "Общие способы получения металлов"
Урок в курсе химии 9 класса к учебнику О.С.Габриеляна.
Конспект урока по теме:"Металлы, их положение в Периодической системе, строение атомов металлов. Общие физические свойства металлов."

Урок в 9 классе "Общие способы получения металлов"
В помощь учителю материал можно использовать для подготовки отрытого урока.

Вопрос А-29 (Понятие о металлургии: общие способы получения металлов.)
Понятие о металлургии: общие способы получения металлов. Общие научные принципы химического производства (на примере промышленного получения аммиака, серной кислоты, метанола). Химическое загрязнение .

Урок на тему: "Общая характеристика щелочных металлов"

Урок химии в 11 классе по теме: «Металлы в природе. Общие способы получения металлов»
"Человек не может обойтись без металлов. Если бы не было металлов, люди влачили бы самую жалкую жизнь среди диких зверей. ".

Методическая разработка урока по химии «Металлы в природе. Общие способы получения металлов» 9 класс (базовый курс, О.С. Габриелян)
В данной разработке приведен подробный конспект урока химии в 9 классе по теме «Металлы в природе. Общие способы получения металлов». Содержание соответствует базовому курсу химии авт.
Читайте также:
