Тест 7 щелочные металлы вариант 1
Обновлено: 21.09.2024
Тесты по химии 11 класс. Тема: "Металлы"
Правильный вариант ответа отмечен знаком +
1. В какой группе находится металл полоний:
2. К четвертой группе относится элемент:
3. Как проходит условная граница между между металлическими и неметаллическими элементами:
4. Металлургический процесс включает в себя:
+ восстановление ионов металла
- окисление ионов неметалла
- восстановление ионов неметалла
5. Пирометаллургией является:
+ процесс получения металлов из их соединений при высокой температуре
- процесс получения неметаллов из их соединений при низкой температуре
- процесс получения неметаллов из их соединений при высокой температуре
6. В пирометаллургии используются:
- как восстановители, так и окислители
7. При алюмотермии используют металл:
8. В гидрометаллургии получают:
+ металлы из растворов их соединений
- неметаллы из растворов их соединений
- воду из растворов их соединений
9. В электрометаллургии используется процесс:
- обработка при предельно высокой температуре
- реакция замещения и соединения
тест 10. При электролизе восстановителем является:
11. Чем определяются физические свойства металлов:
+ типом кристаллической решетки
- количеством протонов, электронов, нейтронов
- расположением в определенной группе или подгруппе
12. Отличием атомов металлов от неметаллов можно назвать:
+ содержат небольшое количество электронов на внешнем уровне, большой радиус и низкая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, маленький радиус и высокая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, большой радиус и высокая электроотрицательность
13. Металлической является связь:
+ между ионами металлов
- между ионами неметаллов
- между ионами металла и неметалла
14. Для какого агрегатного состояния не характерна металлическая связь:
- для жидкого состояния
- для твердого состояния
15. Чем обусловлена электропроводность металлов?
+ наличием свободных электронов
- наличием свободных нейтронов
- наличием свободных протонов
16. С повышением температуры электропроводность:
- может как повышаться, так и понижаться
17. Электропроводность увеличивается от:
+ ртути к серебру
- алюминия к цинку
18. Максимальной теплопроводностью обладает:
19. Наиболее пластичным металлом называют:
тест-20. Твердым веществом при нормальных условиях не является:
21. Самым твердым металлом является:
- щелочно – земельные металлы
22. Самым тяжелым металлом является:
23. Самым тугоплавким металлом является:
24. К черным металлам можно отнести:
25. Какие степени окисления имеют металлы:
- как положительные, так и отрицательные
26. Металлы в соединениях проявляют свойства:
- окислительно – восстановительные свойства
27. Какая закономерность уменьшения восстановительных свойств металлов:
+ слева направо, снизу-вверх
- справа налево, сверху вниз
28. На данном изображении представлена:
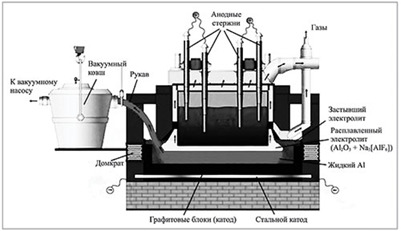
+ схема получения алюминия электролизом
- схема получения железа электролизом
- схема получения гидроксида алюминия электролизом
29. Чем левее находится металл в ряду, тем:
+ больше его восстановительная способность
- меньше его восстановительная способность
- больше его окислительная способность
тест_30. Лантаноиды на внешнем энергетическом уровне содержат по:
31. Сколько примерно имеются металлов в периодической системе Менделеева:
+ более девяти ста
- менее восьми ста
- менее двадцати ста
32. Во сколько раз литий легче осмия:
+ в сорок пять раз
- в шестьдесят раз
- в семьдесят раз
33. Провода высоковольтных изготавливают из:
34. Бронза является сплавом:
- железа и алюминия
- вольфрама и серебра
35. На данном рисунке представлена:
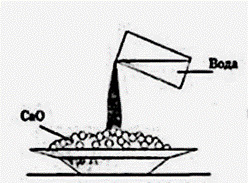
+ реакция гашения извести водой
- реакция соединения калия с хлором
- окисление перманганата калия
36. При взаимодействии с кислородом металлы образуют:
37. При взаимодействии щелочноземельных металлов с водой образуются:
- альдегиды и кетоны
38. Оксидом железа можно назвать:
39. В алюминотермии используется:
тест*40. Взаимодействие металлов с оксидами является реакцией:
Тест по теме "Щелочные металлы"

Тест содержит задания по теме "Щелочные металлы" на 2 варианта. Можно использовать для контроля знаний учащихся по данной теме.
Просмотр содержимого документа
«Тест по теме "Щелочные металлы"»
Металлы IА группы
Щелочным металлом является
Ca 2) Cs 3) Cd 4) Sr
Только щелочные металлы находятся в ряду элементов
Na, Ca, K 3) Na, Rb, Ba
Li, K, Be 4) Cs, Rb, Li
В ряду щелочных металлов Li → Na → K происходит
Уменьшение их атомного радиуса
Ослабление притяжения внешних электронов к ядру
Увеличение степени окисления в соединениях
Степень окисления калия в пероксиде калия
Формула вещества с техническим названием поташ
Семейство щелочных металлов занимает IА группу периодической системы химических элементов Д.И. Менделеева.
Щелочные металлы используют для производства проводов.
В химических реакциях щелочные металлы проявляют сильные восстановительные свойства.
При горении все щелочные металлы образуют оксиды.
Максимальная степень окисления щелочных металлов в химических соединениях равна +2.
Щелочные металлы получают в промышленности путем электролиза расплавов их солей.
В схеме уравнения реакции Х + Н2О → У + Н2 веществами Х и У являются соответственно:
К и К2О 3) К и КОН
Гидроксид калия взаимодействует с каждым из веществ, формулы которых
Запишите уравнения возможных реакций.
Допишите уравнения возможных реакций:
NaOH + KCl → 4) KOH + CaO →
K + S → 5) LiOH + HNO3 →
Be 2) Mg 3) Rb 4) Ba
Li, Cs, Ca 3) Rb, K, Be
Cs, Na, Li 4) Na, K, Sr
В ряду щелочных металлов Cs → Rb → K происходит
Увеличение числа электронов на внешнем слое
Распределение электронов по электронным слоям в атоме калия
2, 8,1 2) 2, 8, 8,1 3) 2, 1 4) 2,2
Формула вещества с техническим названием едкий натр
С помощью электролиза раствора хлорида натрия можно получить натрий.
Все щелочные металлы легкоплавкие и легко режутся ножом.
На внешнем слое атомов щелочных металлов находится по одному электрону.
Щелочные металлы – это малоактивные простые вещества.
Щелочные металлы взаимодействуют с водой, образуя щелочь и водород.
При горении натрия в избытке кислорода образуется оксид натрия.
В схеме уравнения реакции Na + X→ NaOH + Y веществами Х и Y являются соответственно
Вещества, каждое из которых взаимодействует с гидроксидом лития
(ЕГЭ 5) Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует гидроксид калия.
1) гидроксид алюминия
2) гидроксид магния
3) оксид кремния
4) оксид кальция
5) хлорид натрия
(ЕГЭ 7) Установите соответствие между твердым веществом и продуктами его взаимодействия с гидроксидом натрия:
А) Zn(OH)2 1) не взаимодействуют
(ЕГЭ 7) Установите соответствие между твердым веществом и продуктами его взаимодействия с карбонатом натрия:
5) не взаимодействует
(ЕГЭ 8) В пробирку с раствором соли Х добавили несколько капель раствора вещества Y. В результате реакции наблюдали выделение бесцветного газа без запаха. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
Запишите в таблицу номера выбранных веществ под соответствующими буквами
(ЕГЭ 9) Дана схема превращений:
Из приведённого списка выберите вещества X и Y.
4) KOH(р-р, избыток)
Запишите в поле ответа номера выбранных веществ.
(ЕГЭ 11) Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать.
ФОРМУЛА ВЕЩЕСТВА РЕАГЕНТЫ
Запишите в таблицу выбранные цифры под соответствующими буквами
(ЕГЭ 23) Установите соответствие между названием соли и реакцией среды этой соли в растворе.
А) ортофосфат натрия 1) кислая
Б) нитрат цинка 2) щелочная
В) силикат калия 3) нейтральная
Г) сульфат натрия 4) сильно щелочная
Запишите в таблицу выбранные цифры под соответствующими буквами.
(ЕГЭ 23) Установите соответствие между формулой соли и отношением этой соли к гидролизу.
ФОРМУЛА СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ
А) KClO4 1) гидролизуется по катиону
Б) CH3COONH4 2) гидролизуется по аниону
В) NH4NO3 3) не гидролизуется
Г) Al2S3 4) гидролизуется как по катиону, так и по аниону
(ЕГЭ 25) Установите соответствие между формулами веществ и реагентом, с помощью которого можно различить их водные растворы.
(ЕГЭ 32) К раствору сульфата алюминия добавили избыток раствора гидроксида натрия. в полученный раствор небольшими порциями прибавили соляную кис лоту, при этом наблюдали образование объёмного осадка белого цвета, который растворился при дальнейшем прибавлении кислоты. В образовавшийся раствор прилили раствор карбоната натрия. Напишите уравнения писанных реакций.
(ЕГЭ 32) При сливании водных растворов сульфита калия и перманганата калия выпал осадок. Осадок при нагревании обработали концентрированной соляной кислотой, при этом наблюдалось образование газа. Полученный газ прореагировал с алюминием. Продукт данной реакции растворили в избытке
раствора гидроксида натрия. Напишите уравнения четырёх описанных реакций.
(ЕГЭ 34) Навеску гидрокарбоната натрия массой 42 г нагревали в течение некоторого времени. При растворении полученного твёрдого остатка в избытке соляной кислоты выделилось 6,72 л (н. у.) газа. Определите, сколько процентов гидрокарбоната разложилось. Напишите уравнения реакций.
(ЕГЭ 34)Навеску основного карбоната меди массой 55,5 г нагревали в течение некоторого времени. При растворении полученного твёрдого остатка в избытке соляной кислоты выделилось 3,92 л (н. у.) газа. Определите, сколько
процентов вещества разложилось при нагревании. Напишите уравнения реакций. (Относительную атомную массу меди примите равной 64.)
(ЕГЭ 34) Смесь оксида меди(II) и алюминия общей массой 15,2 г подожгли с помощью магниевой ленты. После окончания реакции полученный твёрдый остаток частично растворился в соляной кислоте с выделением 6,72 л газа (н. у.). Рассчитайте массовые доли (в %) веществ в исходной смеси. Относительную атомную массу меди примите равной 64.
Тест 7 щелочные металлы вариант 1
Тесты по химии 9 класс. Тема: "Щелочные металлы"
1. К какой группе относятся щелочные металлы:
2. Какой элемент можно отнести к щелочным металлам:
3. Оксиды щелочных металлов при взаимодействии с водой образуют:
4. Какая степень окисления на внешнем энергетическом уровне у щелочных металлов:
5. Щелочные металлы являются:
- как восстановителями, так и окислителями
6. От лития к цезию:
+ увеличивается радиус атомов и уменьшается электроотрицательность
- уменьшается радиус атома и уменьшается электроотрицательность
- увеличивается радиус атома и увеличивается электроотрицательность
7. Какой цвет имеют щелочные металлы:
8. Кто впервые получил калий и натрий:
9. Формулой глауберовой соли является:
- KCl * MgCl2 * 6 H2O
тест 10. Каким путем получают щелочные металлы:
11. С галогенами щелочные металлы образуют:
12. При сгорании на воздухе какой металл образует оксид:
13. Какой металл образуется пероксид:
14. При взаимодействии металла с водородом образуется:
15. При каких условиях хранят натрий и калий:
+ под слоем керосина
- под слоем подсолнечного масла
- под слоем металлической пластинки
16. В какой цвет окрашивает катион лития пламя горелки:
17. Воздействие щелочи проявляется:
18. Поваренную соль используют:
+ для приготовления пищи
- для дезинфекции поверхностей
- в качестве анальгетического средства
19. Какая концентрация хлорида натрия содержится в физиологическом растворе:
тест-20. Главным внеклеточным ионом является:
21. Калийные удобрения используют в:
- в машинном производстве
- в пищевой промышленности
22. Температура плавления увеличивается:
+ от цезия к литию
- от лития к цезию
- от натрия к калию
23. Реакцией образования пероксида натрия является:
+ 2 Na + O2 = Na 2 O2
- 2 K + O2 = K2 O 2
- 4 Li + O2 = 2 Li O
24. Какая степень окисления в пероксидах:
25. Из пероксида натрия можно получить:
26. Реакцией получения пероксида натрия является:
+ Na2O2 + H2O = 2NaOH + H2O2
- 6 Li + N2 = 2Li3N
- 2Cs + 2H20 = 2CsOH + H2 (газ)
27. При взаимодействии лития с азотом образуется:
28. Каустической содой называют:
29. Гидроксид калия используется в:
- для очистки нефти и масел
- в производстве искусственных волокон
тест_30. Химические свойства щелочных металлов определяются:
- природой как катиона, так и аниона
31. На данной фотографии изображено пламя при горении металла. Какой металл горит в данном случае?

32. Электролизом хлорида натрия получают:
33. Из хлорида калия изготавливают:
34. Технической содой называют:
35. Питьевой содой можно назвать:
36. При нагревании гидрокарбонат разлагается на:
+ NaHCO3 = t = Na2CO3 + H20 + CO 2 (газ)
- NaHCO3 =t= H2CO3 + NaOH + O2 (газ)
- NaHCO3 = Na2CO3 + NaOH + CO2 (газ)
37. Гидрокарбонат натрия используют:
+ при изготовлении кондитерского блюда
- при производстве антидепрессантов
38. Карбонат калия обычно называют:
39. В каком году Иоганн Рудольф Глаубер открыл сульфат натрия:
Щелочные металлы

Внимание! Все тесты в этом разделе разработаны пользователями сайта для собственного использования. Администрация сайта не проверяет возможные ошибки, которые могут встретиться в тестах.
Вопросы теста "Щелочные металлы" соответствуют вопросам ЕГЭ по данной теме. Времени 15 минут. Система оценивания 5-бальная. Удачи!
Список вопросов теста
Вопрос 1
Установите соответствие между исходными(-ым) веществами(-ом), вступающими(-им) в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- А) KHCO3 и HCl
- Б) KHCO3 и KOH
- В) Cl2 и KOH → (t°)
- Г) KHCO3 → (t°)
Вопрос 2
- А) Al2O3
- Б) NaOH
- В) H2S
- Г) I2
Вопрос 3
Из предложенного перечня типов реакций выберите два, к которым можно отнести реакцию, протекающую между растворами гидроксида калия и хлорида меди(II):
- практически необратимая
- реакция обмена
- окислительно-восстановительная
- реакция гидролиза
- реакция нейтрализации
Вопрос 4
Установите соответствие между схемой реакции и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- А) KOH + Cl2 → (t°)
- Б) KOH + Cl2 → (0 °C)
- В) KClO3 → (t°, кат.)
- Г) KClO3 → (t°)
Вопрос 5
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
- 1) ZnSO4
- 2) ZnO
- 3) K2[Zn(OH)4]
- 4) (ZnOH)2S
- 5) ZnS
Вопрос 6
В пробирку с раствором вещества X добавили по каплям раствор вещества Y. При этом сначала наблюдали выпадение осадка, а затем - его растворение.
Из предложенного перечня выберите два вещества, которые могут вступать в описанную реакцию.
- 1) SnCl2
- 2) NH4Cl
- 3) NaOH
- 4) H2SO4
- 5) MgCl2
Вопрос 7
В пробирку с раствором вещества X добавили раствор кислоты Y. В результате произошла реакция, которую описывает следующее сокращённое ионное уравнение:
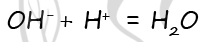
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) серная кислота
- 2) гидроксид бария
- 3) сульфид калия
- 4) угольная кислота
- 5) гидроксид натрия
Вопрос 8
В схеме превращений, протекающих в водном растворе
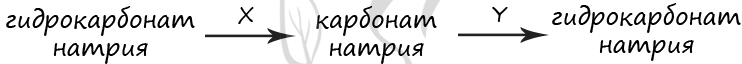
веществами «X» и «Y» соответственно являются
- 1) соляная кислота
- 2) карбонат кальция
- 3) гидроксид натрия
- 4) углекислый газ
- 5) карбонат бария
Вопрос 9
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Читайте также:
