Тяжелые металлы в растениях пдк
Обновлено: 08.05.2024
Глава 1. ТЯЖЕЛЫЕ МЕТАЛЛЫ: БИОЛОГИЧЕСКАЯ РОЛЬ,
СОДЕРЖАНИЕ В ПОЧВАХ И РАСТЕНИЯХ (агроэкологический аспект)
Тяжелые металлы – это группа химических элементов с относительной атомной массой более 40. Появление в литературе термина «тяжелые металлы» было связано с проявлением токсичности некоторых металлов и опасности их для живых организмов. Однако в группу «тяжелых» вошли и некоторые микроэлементы, жизненная необходимость и широкий спектр биологического действия которых неопровержимо доказаны (Алексеев, 1987; Минеев, 1988; Краснокутская и др., 1990; Сает и др., 1990; Ильин, 1991; Кадмий: экологические…, 1994; Тяжелые…, 1997; Пронина, 2000).
Различия в терминологии в основном связаны с концентрацией металлов в природной среде. С одной стороны, концентрация металла может быть избыточной и даже токсичной, тогда этот металл называют «тяжелым», с другой стороны, при нормальной концентрации или дефиците его относят к микроэлементам. Таким образом, термины микроэлементы и тяжелые металлы - категории скорее всего качественные, а не количественные, и привязаны к крайним вариантам экологической обстановки (Алексеев, 1987; Ильин, 1991; Майстренко и др., 1996; Ильин, Сысо, 2001).
Функции живого организма нераздельно связаны с химизмом земной коры и должны изучаться в тесной связи с последним (Виноградов, 1957; Вернадский, 1960; Авцын и др., 1991; Добровольский, 1997). По мнению А.П. Виноградова (1957), количественное содержание того или иного элемента в организме определяется его содержанием во внешней среде, а также свойствами самого элемента, с учетом растворимости его соединений. Впервые научные основы учения о микроэлементах в нашей стране обосновал В. И. Вернадский (1960). Фундаментальные исследования были проведены А.П. Виноградовым (1957) – основоположником учения о биогеохимических провинциях и их роли в возникновении эндемических заболеваний человека и животных и В.В. Ковальским (1974) – основоположником геохимической экологии и биогеографии химических элементов, впервые осуществившим биогеохимическое районирование СССР.
В настоящее время из 92 встречающихся в природе элементов 81 обнаружен в организме человека. При этом 15 из них ( Fe , I , Cu , Zn , Co , Cr , Mo , Ni , V , Se , Mn , As , F , Si , Li ) признаны жизненно необходимыми. Однако они могут оказывать отрицательное влияние на растения, животных и человека, если концентрация их доступных форм превышает определенные пределы. Cd , Pb , Sn и Rb считаются условно необходимыми, т.к. они, по всей видимости, не очень важны для растений и животных и опасны для здоровья человека даже при относительно низких концентрациях (Добровольский, 1980; Рэуце, Кырстя, 1986; Ягодин и др., 1989; Авцын и др., 1991; Давыдова, 1991; Вронский, 1996; Панин, 2000; Пронина, 2000).
В течение длительного времени в биогеохимических исследованиях микроэлементов превалировал интерес к геохимическим аномалиям и возникающим из-за них эндемиям природного происхождения. Однако в последующие годы, в связи с бурным развитием промышленности и глобальным техногенным загрязнением окружающей среды, наибольшее внимание стали привлекать аномалии элементов, в большей степени ТМ, имеющих индустриальное происхождение. Уже сейчас во многих регионах мира окружающая среда становится все более химически «агрессивной». В последние десятилетия основными объектами биогеохимических исследований стали территории промышленных городов и прилегающих к ним земель (Геохимия…, 1986; Лепнева, 1987; Ильин и др., 1988, 1997; Kabala , Singh , 2001; Kathryn and etc ., 2002), особенно если на них выращиваются, а затем используются в пищу сельскохозяйственные растения (Рэуце, Кырстя, 1986; Ильин, 1985, 1987; Кабата-Пендиас, Пендиас, 1989; Черных, 1996 и др.).
Влияние микроэлементов на жизнедеятельность животных и человека активно изучается и в медицинских целях. В настоящее время выявлено, что многие заболевания, синдромы и патологические состояния вызваны дефицитом, избытком или дисбалансом микроэлементов в живом организме и имеют общее название «микроэлементозы» (Авцын и др., 1991).
В проведенных нами исследованиях металлы изучались с позиций их токсического воздействия на живые организмы, вызванного антропогенным загрязнением окружающей среды, поэтому для изученных элементов мы использовали термин «тяжелые металлы».
1.1. Биологическая роль и токсикологическое влияние тяжелых металлов
В последние годы все сильнее подтверждается важная биологическая роль большинства металлов. Многочисленными исследованиями установлено, что влияние металлов весьма разнообразно и зависит от содержания в окружающей среде и степени нуждаемости в них микроорганизмов, растений, животных и человека.
Фитотоксичное действие ТМ проявляется, как правило, при высоком уровне техногенного загрязнения ими почв и во многом зависит от свойств и особенностей поведения конкретного металла. Однако в природе ионы металлов редко встречаются изолированно друг от друга. Поэтому разнообразные комбинативные сочетания и концентрации разных металлов в среде приводят к изменениям свойств отдельных элементов в результате их синергического или антагонистического воздействия на живые организмы. Например, смесь цинка и меди в пять раз токсичнее, чем арифметически полученная сумма их токсичности, что обусловлено синергизмом при совместном влиянии этих элементов. Подобным образом действует и смесь цинка с никелем. Однако существуют наборы металлов, совместное действие которых проявляется аддитивно. Ярким примером этого являются цинк и кадмий, проявляющие взаимный физиологический антагонизм (Химия…,1985). Очевидны проявления синергизма и антагонизма металлов и в их многокомпонентых смесях. Поэтому суммарный токсикологический эффект от загрязнения среды ТМ зависит не только от набора и уровня содержания конкретных элементов, но и особенностей их взаимного воздействия на биоту.
Таким образом, влияние ТМ на живые организмы весьма разнообразно Это обусловлено, во-первых, химическими особенностями металлов, во-вторых, отношением к ним организмов и, в-третьих, условиями окружающей среды. Ниже, согласно имеющимся в литературе данным (Химия…,1985; Кеннет, Фальчук, 1993; Кадмий: экологические …, 1994; Strawn , Sparks , 2000 и др.), приводим краткую характеристику влияния ТМ на живые организмы.
Свинец. Биологическая роль свинца изучена весьма слабо, однако в литературе встречаются данные (Авцын и др., 1991), подтверждающие, что металл жизненно необходим для животных организмов на примере крыс. Животные испытывают недостаток этого элемента при концентрации его в корме менее 0,05-0,5 мг/кг (Ильин, 1985; Кальницкий, 1985). В небольших количествах он необходим и растениям. Дефицит свинца в растениях возможен при его содержании в надземной части от 2 до 6 мкг/кг сухого вещества (Кальницкий, 1985; Кабата-Пендиас, Пендиас, 1989).
Повышенный интерес к свинцу вызван его приоритетным положением в ряду основных загрязнителей окружающей природной среды (Ковальский, 1974; Сает, 1987; Доклад…, 1997; Снакин, 1998; Макаров, 2002). Металл токсичен для микроорганизмов, растений, животных и людей.
Избыток свинца в растениях, связанный с высокой его концентрацией в почве, ингибирует дыхание и подавляет процесс фотосинтеза, иногда приводит к увеличению содержания кадмия и снижению поступления цинка, кальция, фосфора, серы. Вследствие этого снижается урожайность растений и резко ухудшается качество производимой продукции. Внешние симптомы негативного действия свинца – появление темно-зеленых листьев, скручивание старых листьев, чахлая листва. Устойчивость растений к его избытку неодинаковая: менее устойчивы злаки, более устойчивы бобовые. Поэтому симптомы токсичности у различных культур могут возникнуть при разном валовом содержании свинца в почве - от 100 до 500 мг/кг (Кабата-Пендиас, Пендиас, 1989; Ильин, Сысо, 2001). Концентрация металла выше 10 мг/кг сух. в-ва является токсичной для большинства культурных растений (Рэуце, Кырстя, 1986).
В организм человека свинец в основном поступает через пищеварительный тракт. При токсичных дозах элемент накапливается в почках, печени, селезенке и костных тканях. При свинцовом токсикозе поражаются в первую очередь органы кроветворения (анемия), нервная система (энцефалопатия и нейропатия) и почки (нефропатия). Наиболее восприимчива к свинцу гематопоэтическая система, особенно у детей.
Кадмий хорошо известен, как токсичный элемент, но он же относится к группе "новых" микроэлементов (кадмий, ванадий, кремний, олово, фтор) и в низких концентрациях способен стимулировать их рост некоторых животных (Авцын и др., 1991). Для высших растений значение кадмия достоверно не установлено.
Основные проблемы, связанные у человечества с этим элементом, обусловлены техногенным загрязнением окружающей среды и его токсичностью для живых организмов уже при низких концентрациях (Ильин, Сысо, 2001).
Токсичность кадмия для растений проявляется в нарушении активности ферментов, торможении фотосинтеза, нарушении транспирации, а также ингибировании восстановления N О2 до N О. Кроме того, в метаболизме растений он является антагонистом ряда элементов питания ( Zn , Cu , Mn , Ni , Se , Ca , Mg , P ). При токсичном воздействии металла у растений наблюдаются задержка роста, повреждение корневой системы и хлороз листьев. Кадмий достаточно легко поступает из почвы и атмосферы в растения. По фитотоксичности и способности накапливаться в растениях в ряду ТМ он занимает первое место ( Cd > Cu > Zn > Pb ) (Овчаренко и др., 1998).
Кадмий способен накапливаться в организме человека и животных, т.к. сравнительно легко усваивается из пищи и воды и проникает в различные органы и ткани. Токсичное действие металла проявляется уже при очень низких концентрациях. Его избыток ингибирует синтез ДНК, белков и нуклеиновых кислот, влияет на активность ферментов, нарушает усвоение и обмен других микроэлементов ( Zn , Cu , Se , Fe ), что может вызывать их дефицит.
Обмен кадмия в организме характеризуется следующими основными особенностями (Авцын и др., 1991): отсутствием эффективного механизма гомеостатического контроля; длительным удержанием (кумуляцией) в организме с очень долгим периодом полувыведения (в среднем 25 лет); преимущественным накоплением в печени и почках; интенсивным взаимодействием с другими двухвалентными металлами как в процессе всасывания, так и на тканевом уровне.
Хроническое воздействие кадмия на человека приводит к нарушениям почечной функции, легочной недостаточности, остеомаляции, анемии и потере обоняния. Существуют данные о возможном канцерогенном эффекте кадмия и о вероятном участии его в развитии сердечно-сосудистых заболеваний. Наиболее тяжелой формой хронического отравления кадмием является болезнь итай-итай, характеризующаяся деформацией скелета с заметным уменьшением роста, поясничными болями, болезненными явлениями в мышцах ног, утиной походкой. Кроме того, отмечаются частые переломы размягченных костей даже при кашле, а также нарушение функции поджелудочной железы, изменения в желудочно-кишечном тракте, гипохромная анемия, дисфункция почек и др. (Авцын и др., 1991).
Цинк. Особый интерес к цинку связан с открытием его роли в нуклеиновом обмене, процессах транскрипции, стабилизации нуклеиновых кислот, белков и особенно компонентов биологических мембран (Пейве, 1961), а также в обмене витамина А. Ему принадлежит важная роль в синтезе нуклеиновых кислот и белка. Цинк присутствует во всех 20-ти нуклеотидилтрансферазах, а его открытие в обратных транскриптазах позволило установить тесную взаимосвязь с процессами канцерогенеза. Элемент необходим для стабилизации структуры ДНК, РНК, рибосом, играет важную роль в процессе трансляции и незаменим на многих ключевых этапах экспрессии гена. Цинк обнаружен в составе более 200 ферментов, относящихся ко всем шести классам, включая гидролазы, трансферазы, оксидоредуктазы, лиазы, лигазы и изомеразы (Авцын и др., 1991). Уникальность цинка заключается в том, что ни один элемент не входит в состав такого количества ферментов и не выполняет таких разнообразных физиологических функций (Кашин, 1999).
Повышенные концентрации цинка оказывают токсическое влияние на живые организмы. У человека они вызывают тошноту, рвоту, дыхательную недостаточность, фиброз легких, является канцерогеном (Кеннет, Фальчук, 1993). Избыток цинка в растениях возникает в зонах промышленного загрязнения почв, а также при неправильном применении цинксодержащих удобрений. Большинство видов растений обладают высокой толерантностью к его избытку в почвах. Однако при очень высоком содержании этого металла в почвах обычным симптомом цинкового токсикоза является хлороз молодых листьев. При избыточном его поступлении в растения и возникающим при этом антагонизме с другими элементами снижается усвоение меди и железа и проявляются симптомы их недостаточности.
Медь – является одним из важнейших незаменимых элементов, необходимых для живых организмов. В растениях она активно участвует в процессах фотосинтеза, дыхания, восстановления и фиксации азота. Медь входит в состав целого ряда ферментов-оксидаз – цитохромоксидазы, церулоплазмина, супероксидадисмутазы, уратоксидазы и других (Школьник, 1974; Авцын и др., 1991) и участвует в биохимических процессах как составная часть ферментов, осуществляющих реакции окисления субстратов молекулярным кислородом. Данные по токсичности элемента для растений немногочисленны. В настоящее время основной проблемой считается недостаток меди в почвах или ее дисбаланс с кобальтом. Основные признаки дефицита меди для растений – замедление, а затем и прекращение формирования репродуктивных органов, появление щуплого зерна, пустозернистых колосьев, снижение устойчивости к неблагоприятным факторам внешней среды. Наиболее чувствительны к ее недостатку пшеница, овес, ячмень, люцерна, столовая свекла, лук и подсолнечник (Ильин, Сысо 2001; Adriano ,1986).
В организме взрослого человека половина от общего количества меди содержится в мышцах и костях и 10% - в печени. Основные процессы всасывания этого элемента происходят в желудке и тонкой кишке. Ее усвоение и обмен тесно связаны с содержанием в пище других макро- и микроэлементов и органических соединений. Существует физиологический антагонизм меди с молибденом и сульфатной серой, а также марганцем, цинком, свинцом, стронцием, кадмием, кальцием, серебром. Избыток данных элементов, наряду с низким содержанием меди в кормах и продуктах питания, может обусловить значительный дефицит последней в организмах человека и животных, что в свою очередь приводит к анемии, снижению интенсивности роста, потере живой массы, а при острой нехватке металла (менее 2-3 мг в сутки) возможно возникновение ревматического артрита и эндемического зоба. Чрезмерное поглощение меди человеком приводит к болезни Вильсона, при которой избыток элемента откладывается в мозговой ткани, коже, печени, поджелудочной железе и миокарде.
Никель. Биологическая роль никеля заключается в участии в структурной организации и функционировании основных клеточных компонентов – ДНК, РНК и белка. Наряду с этим он присутствует и в гормональной регуляции организма. По своим биохимическим свойствам никель весьма схож с железом и кобальтом. Недостаточность металла у жвачных сельскохозяйственных животных проявляется в снижении активности ферментов и возможности летального исхода.
До настоящего времени в литературе не встречаются данные о дефиците никеля для растений, однако в ряде экспериментов установлено положительное влияние внесения никеля в почвы на урожайность сельскохозяйственных культур, которое, возможно, связано с тем, что он стимулирует микробиологические процессы нитрификации и минерализации соединений азота в почвах (Кашин, 1998; Ильин, Сысо, 2001; Brown , Wilch , 1987). Токсичность никеля для растений проявляется в подавлении процессов фотосинтеза и транспирации, появлении признаков хлороза листьев. Для животных организмов токсический эффект элемента сопровождается снижением активности ряда металлоферментов, нарушением синтеза белка, РНК и ДНК, развитием выраженных повреждений во многих органах и тканях. Экспериментально установлена эмбриотоксичность никеля (Строчкова и др., 1987; Ягодин и др., 1991). Избыточное поступление металла в организм животных и человека может быть связано с интенсивным техногенным загрязнением почв и растений этим элементом.
Хром. Хром относится к числу элементов, жизненно необходимых животным организмам. Основные его функции - взаимодействие с инсулином в процессах углеводного обмена, участие в структуре и функции нуклеиновых кислот и, вероятно, щитовидной железы (Авцын и др., 1991). Растительные организмы положительно реагируют на внесение хрома при низком содержании в почве доступной формы, однако вопрос о незаменимости элемента для растительных организмов продолжает изучаться.
Токсичное действие металла зависит от валентности: шестивалентный катион гораздо токсичнее трехвалентного. Симптомы токсичности хрома внешне проявляются в снижении темпов роста и развития растений, увядании надземной части, повреждении корневой системы и хлорозе молодых листьев. Избыток металла в растениях приводит к резкому снижению концентраций многих физиологически важных элементов, в первую очередь К, Р, Fe , Mn , Cu , B . В организме человека и животных общетоксикологическое, нефротоксическое и гепатотоксическое действие оказывает Cr 6+ . Токсичность хрома выражается в изменении иммунологической реакции организма, снижении репаративных процессов в клетках, ингибировании ферментов, поражении печени, нарушении процессов биологического окисления, в частности цикла трикарбоновых кислот. Кроме того, избыток металла вызывает специфические поражения кожи (дерматиты, язвы), изъявления слизистой оболочки носа, пневмосклероз, гастриты, язву желудка и двенадцатиперстной кишки, хромовый гепатоз, нарушения регуляции сосудистого тонуса и сердечной деятельности. Соединения Cr 6+ , наряду с общетоксикологическим действием, способны вызывать мутагенный и канцерогенный эффекты. Хром, помимо легочной ткани, накапливается в печени, почках, селезенке, костях и костном мозге (Краснокутская и др., 1990).
Влияние токсичных концентраций ТМ на растения приведено в таблице 1.1, а на здоровье человека и животных – в таблице 1.2.
Тяжелые металлы в растениях пдк
в почве и растениях является чрезвычайно сложным из-за невозможности полного учета всех факторов природной среды. Так, изменение только агрохимических свойств почвы (реакции среды, содержания гумуса, степени насыщенности основаниями, гранулометрического состава) может в несколько раз уменьшить или увеличить содержание тяжелых металлов в растениях. Имеются противоречивые данные даже о фоновом содержании некоторых металлов. Приводимые исследователями результаты различаются иногда в 5-10 раз.
экологического нормирования тяжелых металлов. В некоторых случаях за предельно допустимую концентрацию принято самое высокое содержание металлов, наблюдаемое в обычных антропогенных почвах, в других- содержание, являющееся предельным по фитотоксичности. В большинстве случаев для тяжелых металлов предложены ПДК, превосходящие верхнюю норму в несколько раз.
тяжелыми металлами используется коэффициент концентрации, равный отношению концентрации элемента в загрязненной почве к его фоновой концентрации. При загрязнении несколькими тяжелыми металлами степень загрязнения оценивается по величине суммарного показателя концентрации (Zc). Предложенная ИМГРЭ шкала загрязнения почвы тяжелыми металлами преведена в таблице 1.
Таблица 1. Схема оценки почв сельскохозяйственного использования по степени загрязнения химическими веществами (Госкомгидромет СССР, № 02-10 51-233 от 10.12.90)
В таблице 2 приведены официально утвержденные ПДК и допустимые уровни их содержания по показателям вредности. В соответствие с принятой медиками-гигиенистами схеме нормирование тяжелых металлов в почвах подразделяется на транслокационное (переход элемента в растения), миграционное водное (переход в воду), и общесанитарное (влияние на самоочищающую способность почв и почвенный микробиоценоз).
Таблица 2. Предельно-допустимые концентрации (ПДК) химических веществ в почвах и допустимые уровни их содержания по показателям вредности (по состоянию на 01.01.1991. Госкомприрода СССР, № 02-2333 от 10.12.90).
*- валовое содержание- ориентировочное.
**- противоречие; для мышьяка среднее фоновое содержание 6 мг/кг, фоновое содержание свинца обычно тоже превышает нормы ПДК.
Разработанные в 1995 г. ОДК для валового содержания 6 тяжелых металлов и мышьяка позволяют получить более полную характеристику о загрязнении почвы тяжелыми металлами, так как учитывают уровень реакции среды и гранулометрический состав почвы.
Таблица 3. Ориентировочно допустимые концентрации (ОДК) тяжелых металлов и мышьяка в почвах с различными физико-химическими свойствами (валовое содержание, мг/кг) (дополнение №1 к перечню ПДК и ОДК №6229-91).
Из материалов следует, что в основном предьявлены требования к валовым формам тяжелых металлов. Среди подвижных только медь, никель, цинк, хром и кобальт. Поэтому в настоящее время разработанные нормативы уже не удовлетворяют всем требованиям.
является фактором емкости, отражающим в первую очередь потенциальную опасность загрязнения растительной продукции, инфильтрационных и поверхностных вод. Характеризует общую загрязненность почвы, но не отражает степени доступности элементов для растения. Для характеристики состояния почвенного питания растений используются только их подвижные формы.
Их определяют используя различные экстрагенты. Общее количество подвижной формы металла- применяя кислотную вытяжку (например 1н HCL). В ацетатно-аммонийный буфер переходит наиболее мобильная часть подвижных запасов тяжелых металлов в почве. Концентрация металлов в водной вытяжке показывает степень подвижности элементов в почве, являясь самой опасной и "агрессивной" фракцией.
Предложено несколько ориентировочных нормативных шкал. Ниже находится пример одной из шкал предельно допустимых подвижных форм тяжелых металлов.
Таблица 4. Предельно допустимое содержание подвижной формы тяжелых металлов в почве, мг/кг экстрагент 1н. HCl (Х. Чулджиян и др., 1988).
Фитотоксичное действие тяжелых металлов при техногенном загрязнении окружающей среды

В работе описаны загрязнение окружающей среды тяжелыми металлами, распространение и аккумуляция металлов в природной среде и их негативные воздействия на растения.
The pollution plumbum producing plant is influence on heavy metals accumulation processing of plants. Theheavymetalswillbechangedofplantsgename.
Основными источниками антропогенного поступления тяжелых металлов в окружающую среду являются металлургические предприятия, тепловые электростанции, карьеры и шахты по добыче полиметаллических руд, транспорт, химические средства защиты сельскохозяйственных культур от болезней и вредителей, сжигание нефти и различных отходов и пр. Наиболее мощные ореолы тяжелых металлов возникают вокруг предприятий черной и особенно цветной металлургии в результате атмосферных выбросов. Действие загрязняющих веществ распространяется на десятки километров от источника поступления элементов в атмосферу. По приведенным ниже данным можно судить о размерах антропогенной деятельности человека: вклад техногенного свинца составляет 94–97 %(остальное природные источники)., кадмия-84–89 %процентов, меди-56–87 %, никеля-66–75 %, ртути -58 % [1,2].
Заметное загрязнение атмосферного воздуха и почвы происходит за счет транспорта, в том числе авиационного. Большинство тяжелых металлов, содержащихся в пылегазовых выбросах промышленных предприятий, как правило, более растворимы, чем природные соединения [3].
Тяжелые металлы - это группа химических элементов с относительной атомной массой более 40. Появление в литературе термина «Тяжелые металлы» было связано с проявлением токсичности некоторых металлов и опасности их для живых организмов. Однако в эту группу вошли и некоторые микроэлементы, жизненная необходимость и широкий спектр биологического действия которых неопровержимо доказаны. Влияние микроэлементов на жизнедеятельность животных и человека активно изучается и в медицинских целях. В настоящее время выявлено, что многие заболевания, синдромы и патологические состояние вызваны дефицитом, избытком и дисбалансом микроэлементов в живом организме и имеют общее название «микроэлементы».
Фитотоксичное действие тяжелых металлов проявляется, как правило, при высоком уровне техногенного загрязнения ими почв и во многом зависит от свойсв и особенностей поведения конкретного металла. Однако в природе ионы металлов редко встречаются изолированно друг от друга. Поэтому разнообразные комбинативные сочетания и концентрации разных металлов в среде приводят к изменениям свойств отдельных элементов в результате их антогонического воздействия на живые организмы [4].
Растительная пища является основным источником поступления ТМ организм человека и животных. По данным с ней поступают 40–80 % тяжелых металлов, и только 20–40 %. — с воздухом и водой. Поэтому от уровня накопления тяжелых металлов в растениях, используемых в пищу, в значительной степени зависит здоровье населения. Химический состав растений, как известно, отражает элементный состав почв. Поэтому избыточное накопление тяжелых металлов растениями обусловлено, прежде всего, их высокими концентрациями в почвах.
Несмотря на существенную изменчивость различных растений к накоплению тяжелых металлов, биоаккумуляция элементов имеет определенную тенденцию, позволяющую упорядочить их в несколько групп: 1) Cd,Cs, Rb — элементы интенсивного поглощения; 2) Zn, Mo, Cu, Pb, Co, As –средней степени поглощения; 3) Mn, Ni, Cr –слабого поглощения; 4) Se, Fe, Ba, Te — элементы труднодоступные растениям.
Другой путь поступления тяжелых металлов в растения — некорневое поглощение из воздушных потоков. Поступление элементов в растения через листья (или фолиярное поглощение) происходит, главным образом, путем неметаболического проникновения через кутикулу. Тяжелые металлы, поглощенные листьями могут переносится в другие органы и ткани и включаться в обмен веществ.
Свинец и кадмий относятся высокотоксичным металлам. В придорожных растениях количество свинца резко повышено, оно в 10–100 раз выше по сравнению с растениями, растущими вдали от дорог. Между содержанием свинца в растениях и расстоянием дерева от дороги существует доказуемая обратная зависимость. Свинец в достаточно высокой концентрации тормозит прорастание семян растений, замедляет рост корней в длину, а также образование корневых волосков. Листья отравленных свинцом растений становятся хлоротичными в межжилковых зонах. Особенно сильно поражаются молодые листья. Высокое содержание свинца в растениях негативно влияет на рост и развитие:
- снижается активность фотосистемы І и ІІ, причем фотосистема-ІІ более чувствительная к действию этого фитотоксиканта.
- оказывает ингибирующее влияние на реакцию Хилла, т. е. на способность изолированных хлоропластов на свету выделять кислород.
- в хлорпластах растений наблюдается подавление образования АТФ;
- вызывает потерю тургора клетками растений;
- прекращается деление клеток корня;
- подавляется образования корнеплодов, урожайность культурных растений;
- снижается количество каротина и аскорбиновой кислоты;
Некоторые травянистые растения, чувствительны по отношению к свинцу: ячмень, овес, пшеница, картофель. Среди дикорастущих следует отметить смолевку, которая от высокого содержания свинца приобретает карликовую форму, листья и стебли становятся темно-красными, а цветки мелкими и невзрачными [5].
Главным загрязнителем окружающей среды кадмием является цветная металлургия и обработка цветных металлов. Кроме того кадмий поступает в атмосферу при сгорании мусора и отходов. Большое количество кадмия обнаруживается в растения, произрастающих поблизости от автодорог. Так, например в хвое ели обыкновенной, растущей поблизости автодорог количество кадмия возрастает в 11–17 раз. Симптомы избыточного поступления в растения кадмия проявляются в постепенном изменении окраски кончиков листьев и черешков до красновато-бурой и пурпурной. При этом листья скручиваются и опадают. Кадмий замедляет темпы роста растений. При внесении его в количестве 20 мг на 1 кг почвы урожай растения снижался на 50 %. По силе своего действия кадмий превосходит многие другие тяжелые металлы. Гибель растений отмечается при концентрации кадмия в почве в количестве 30 мг/кг и выше. Большое количество кадмия поступает в почву при разработке и добыче цинковых руд. На таких почвах нельзя выращивать растения, ибо этот токсикант аккумулируется в тканях растений и может затем поступать в организм человека. Накопления кадмия происходит главным организм человека. Одна из причин торможения роста растений, произрастающих в присутствии кадмия — резкое ослабление интенсивности фотосинтеза. Присутствие в 1 кг листьев 96 мг этого элемента снижает интенсивность фотосинтеза на 50 % [6].
Поступление тяжелых металлов в растения может происходить непосредственно из воздуха с оседающей на листья и хвою пылью и транслокации из почвы: доля тяжелых металлов в составе пыли на поверхности листьев вблизи источника составляет в среднем 30 проц. от общего содержания в них тяжелых металлов. В понижениях и с наветренной стороны это доля может доходить до 60 %. По мере удаления от источника роль атмосферного загрязнения заметно уменьшается.
Главным загрязнителем атмосферы кадмием является цветная металлургия и обработка цветных металлов. Кроме того, кадмий поступает в окружающую среду при сгорании некоторых видов топлива и особенно при сжигании мусора и отходов. Из атмосферы кадмий поступает в почву. Загрязнение ее этим элементом носит устойчивый характер, поскольку из почвы он вымывается медленно. Большое количество кадмия обнаруживается в растения, произрастающих поблизости от автомобильных дорог. Так, например в хвое ели обыкновенной, растущей поблизости от автострад, количество кадмия возрастает в 11–17 раз. Симптомы избыточного поступления в растения кадмия проявляются в постепенном изменении окраски кончиков листьев и черешков до красновато-бурой и пурпурной. При этом листья скручиваются и становятся хлоратичными и опадают. По силе своего действия на растения кадмий превосходит многие другие тяжелые металлы. Гибель растений отмечается при концентрации этого элемента в почве в количестве 30 мг/кг. Вблизи предприятий, выбрасывающих в атмосферу кадмий наблюдается резкое снижение урожайности и даже гибель культурных растений. Накопление кадмия происходит главным образом в корнях растений (риса, пшеницы), однако часть его достигает органов. Одна из причин торможения роста растений, произрастающих в присутствии кадмия, резкое ослабление интенсивности фотосинтеза. Присутствие в 1 кг листьев 96 мг этого элемента снижает интенсивность фотосинтеза на 50 %. Существует прямая зависимость между содержанием кадмия в почве и поступлением его в растения.
Токсическое влияние оказывают на растения и другие металлы, загрязняющие природную среду, например бериллий, марганец, медь, хром, ванадий, цинк и др.
1. Кузнецов А. В. Контроль техногенного загрязнения почв и растений // Агрохимический вестник. –1997г. -№ 5, -С. 7–9
2. Минеев В. Г. Проблема тяжелых металлов в современном земледелии // Тяжелые металлы и радионуклиды. –М., 1994г. –С. 42–48
3. Бутовский Р. О. Тяжелые металлы как техногенные химические загрязнители и их токсичность для почвенных беспозвоночных животных //Агрохимия.-2005 г. -№ 4, -С 73–91.
4. Алексеев Ю. В. Тяжелые металлы в почвах и растениях. –Ленинград, 1987 г. –С. 141–144.
5. Зырин Н. Г. Тяжелые металлы в почвах и растениях в районе медеплавильного завода. –м., 1986г. –С. 81
6. Артомонов В. И. Растения и чистота природной среды. –М., 1986 г. –С. 27–31.
Основные термины (генерируются автоматически): металл, растение, кадмий, окружающая среда, почва, лист, организм человека, цветная металлургия, элемент, главный образ.
Накопление тяжелых металлов в растениях в зависимости от уровня загрязнения почв

В статье рассматриваются проблемы загрязнения окружающей среды от деятельности металлургической промышленности. Приведены основные загрязняющие вещества металлургического производства. Даны содержания тяжелых металлов в почве и растениях.
In the article it is considered a problem of environmental pollutioncaused by mining industry. The main polluters of thi mining and metallurgical complex are given by stages of regeneration cycle. Recommendations on refining the ecologicalcondition
Одним из основных принципов концепции устойчивого развития является: право на развитие должно быть реализовано таким образом, чтобы удовлетворять потребности в развитии сохранении окружающей среды нынешнего и будущих поколений. Так как особенность многих видов природных ресурсов проявляется в том, что их использование ограничено во времени. Уровень их потребления сегодня должен жестко предопределять возможность удовлетворения потребности в них в будущем. Именно с этой проблемой природопользования связан вопрос рационального использования природных ресурсов, так как предприятия перерабатывающей промышленности в основной своей части являются эколого-опасными. Поэтому решение данных проблем предопределяет необходимость поиска оптимального, рационального обеспечения текущих и будущих потребностей и выработки обоснованной политики недропользования и охраны окружающей среды [1]. В настоящее время воздействие человека на окружающую среду по своим масштабам превосходит способности природы к самовосстанавлению. Опасны мигрирующие отходы не полностью протекающих технологических процессов: газовые выбросы, сточные воды промышленных предприятий, содержащие токсичные соединения и попадающие в почву и водоемы [2].
Наиболее крупные загрязнители окружающей среды в Южно-Казахстанской области сосредоточены в городе Шымкент. Среди них АО ПК «Южполиметалл» расположен в территории города и оказывает существенное влияние на загрязнение окружающей среды, а неблагоприятная экологическая обстановка в районе свинцового производства складывалась годами. АО ПК “Южполиметалл” оказывает существенное влияние на накопление тяжелых металлов в почве и растениях.
Мы изучили закономерности распространения и аккумуляции тяжелых металлов растениями в зависимости от содержания их в почве и определили содержание тяжелых металлов в почве и растениях распространенных участках территории города
Для исследования использованы были следующие методы: атомно-адсорбционным метод определения содержания тяжелых металлов в почве и растениях (свинец, кадмйя, цинк и медь).
Для оценки пространственного распределения тяжелых металлов в г.Шымкент были выбраны 4 пункта исследования.
Пункт № 1 расположен в 200 м от АО ПК “Южполиметалл”. Пункт № 2 расположен на расстоянии 3 км от свинцового производства, в центре города. Пункт № 3 расположен на расстоянии 5 км в северо-восточном направлении города. Пункт № 4 — контрольный пункт, расположенный в 80 км от города. Из выше перечисленных пунктов отбирались пробы почвы и растения, как подорожник ланцетолистный (Plantago lanceolata), мятлик луговой (Paa protensis) и ячмень заячий (Hordeum leporinum), клен ясенелистный (acer negundo), тополь черный (Populus nigra), карагач (Ulmus pumila), ива Вавилонская (Salix babilonica), акация белая (Robinia pseudoacacia)
Данные о содержании тяжелых металлов в почве представлен в рисунке 1.
Как видно из таблицы, содержание свинца в почве показало, что максимальная концентрация данного элемента характерна для района металлургического производства. Содержание свинца в пункте № 1 составило 946,11 ± 5,04 мг/кг, что превышает ПДК в 27 раз, а контрольный показатель в 45 раз. Это объясняется тем, что 30–35 % промышленных выбросов оседают на территории производства. Высокотоксичный свинец является основным выбросом свинцового производства, так как происходит накопление его в почве. В других пунктах исследования по мере удаления от свинцового производства наблюдается снижение содержания свинца в почве.
Содержание цинка в почве составляет в пункте № 1 171,30±4,64 мг/кг, то-есть по сравнению с контрольным пунктом в 14 раз превышает контрольный показатель, а ПДК в 2 раза. Высокое содержание цинка так-же отмечаны в пункте № 2, оно составляет 20,65±2,14 мг/кг, что превышает контрольный показатель в 10 раз, но не превышает ПДК. В других пунктах содержание цинка не превышает показатель контрольного пункта. Наиболее высокие содержания меди и кадмия так-же были установлены в производственном пункте. Во всех других пунктах содержание меди не превышает ПДК, но по сравнению с контрольным пунктом превышает контрольный показатель. Содержание кадмия во всех пунктах превышает ПДК.
Высокие содержания выше указанных тяжелых металлов установлены в районе АО ПК “Южполиметалл” (пункт № 1). В других пунктах по мере удаления от производства содержание тяжелых металлов в почве снижается.
Рис. 1. Содержание тяжелых металлов в почве (мг/кг)
Почва является важнейшим объектом окружающей среды. В отличие от других объектов окружающей среды (воздух, вода), где протекают процессы самоочищения, почва обладает этим свойствам в незначительной мере. Более того для некоторых веществ, в частности для тяжелых металлов почва является едким акцептором.
Тяжелые металлы прочно сорбируются и взаимодейтвуют с почвенным гумусом, образуя труднорастворимые соединения. Таким образом идет их накопление в почве. Наряду с этим в почве под воздействием различных факторов происходит постоянная миграция поподающих в нее веществ и перенос их на большие расстояния [3].Тяжелые металлы попадающие в почву с выбросами предприятий, прочно связываются уже в верхнем слое. Максимальное содержание металлов в почвах наблюдается на расстояниях 1–3 км от источников загрязнения [4].
Данные о содержании тяжелых металлов в растениях представлены на рисунке 2,3.
Как видно из рисунка, акация белая, тополь черный и мятлик луговой аккумулирует свинец в высокой степени. Его содержание в пункте № 1 составило в акаций белой 292,9 мг/кг, что превышает ПДК 58 раз, а контрольный показатель в 15 раз. Содерание свинца в тополе 91,42 мг/кг (18 ПДК), контрольный показатель превышает в 5 раз, в мятлике луговой — 67,14 мг/кг, что превышает контрольный показатель в 27 раза, а ПДК — в 13 раз. Содержание свинца в ячмене тоже высокое, оно составило 42,14±2,32 мг/кг, что превышает контрольный показатель в 21 раз, а ПДК — в 8 раз. У подорожника ланцетолистного содержание свинца составляет 31,07±2,65 мг/кг, что превышает контрольный показатель в 15 раз, а ПДК — в 6 раз. Анализ результатов определения содержания цинка в изучаемых видов растениий также показал различную аккумулятивную способность.
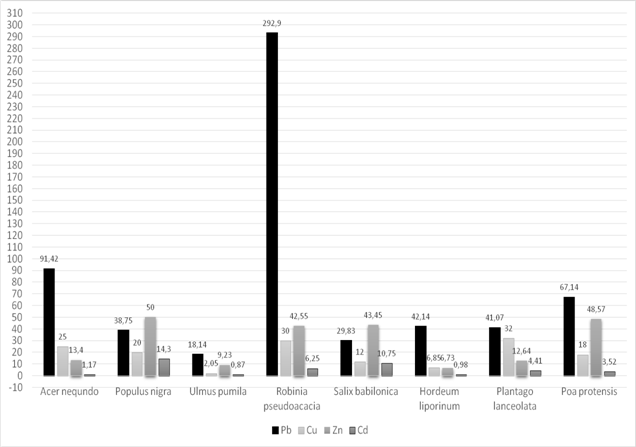
Рис. 2. Содержание тяжелых металлов в растениях (Пункт № 1- район ЗАО «Южполиметалл»), (мг/кг)
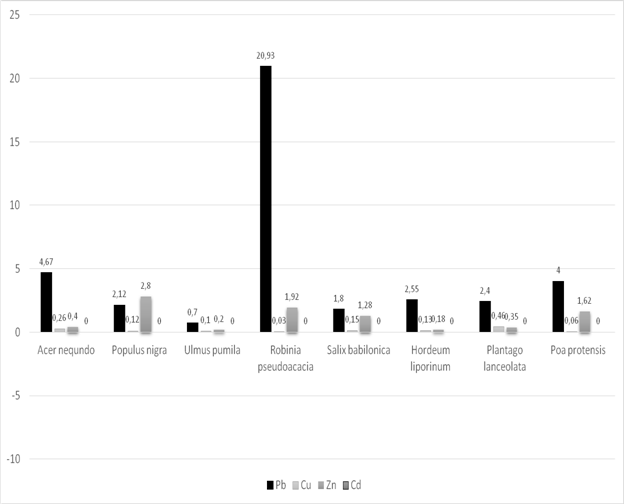
Рис. 3 Содержание тяжелых металлов (Пункт № 4 — контрольный пункт), (мг/кг) ПДК: Свинец–5мг/кг; цинк–30мг/кг; кадмий–0,3мг/кг.
Максимальное содержание цинка в растениях так-же было отмечано в пункте № 1, у мятлика лугового оно составляет 48,57±3,46 мг/кг, что превышает ПДК 1,6 раза, а контрольный показатель в 12 раз. У подорожника ланцетолистного и ячменя заячего содержание цинка не превышает ПДК, но намного выше по сравнению с контрольным пунктом. Содержание кадмия во всех растениях значительно выше ПДК.
Результаты проведенных исследований показали, что с увеличением поступления в почву тяжелых металлов, соответственно повышается уровень поглощения тяжелых металлов растениями.Таким образом, результаты исследований свидетельствуют о загрязнении почв и растений тяжелыми металлами металлургического производства.
1. Окружающая среда и устойчивое развитие в Казахстане. Обзор ПРООН. Алматы, 2004г. 210 с.
2. Гринь А. В., Ли С. К. Поступление тяжелых металлов в растения в зависимости от их содержания по миграции // Тезисы докладов II — Всемирного совещания по миграции загрязненных веществ в почвах и определенных сферах. Ленинград, 1980г. — С. 46–48.
3. Микшевич Н. В., Ковальчук Л. А. Тяжелые металлы в системе “почва — растения — животные” в зоне действия медеплавильного предприятия // Материалы 2 — Всесоюзной Международной Конференции по ТМ в окружающей среде и охраны природы. 1988г. — С. 127–129.
4. Садовников Л. К. Влияние промышленных предприятий на окружающую среду// Тезисы доклодов. Мониторинг содержания ТМ в почвах естественных и техногенных ландшафтов. г. Пущино, 1984г. –С.163
Основные термины (генерируются автоматически): контрольный показатель, окружающая среда, почва, контрольный пункт, металл, пункт, раз, свинцовое производство, содержание свинца, содержание цинка.
Содержание тяжелых металлов в лекарственных растениях

Введение
В современной медицине широко используются синтетические лекарственные средства. Их выпуск год от года возрастает. Но на протяжении всей истории человечества лекарственные растения применяются для лечения различных заболеваний. Используются они и в наши дни. [1, 2]. Опыт практической медицины показал, что можно разумно сочетать современные синтетические препараты и давно известные народные средства на основе лекарственных растений [3]. Во флоре Челябинской области насчитывается около 150 видов лекарственных растений [4].
Бурное развитие промышленности и широкое использование автотранспорта привело к значительному возрастанию уровня тяжелых металлов в окружающей среде. Тяжелые металлы обладают способностью к миграции и накоплению в пищевых цепях. В данном контексте необходимо учитывать содержание тяжелых металлов в лекарственных растениях.
Цель настоящей работы — собрать информацию о лекарственных растениях и определить содержание тяжелых металлов в выбранных растениях.
В рамках поставленной цели были решены следующие задачи: (1) определить значение лекарственных растений в жизни человека; (2) проанализировать многообразие лекарственных растений Челябинской области; (3) осуществить сбор лекарственных растений, подготовить пробы, провести химический анализ на тяжелые металлы.
Объект исследования — лекарственные растения Челябинской области.
Предмет исследования — видовой состав и содержание тяжелых металлов в лекарственных растениях. В работе были использованы такие методы как анализ литературы, полевые исследования, рентгенофлуоресцентный анализ. Гипотеза состояла в следующем: в лекарственных растениях, произрастающих у автомобильных дорог, содержатся больше тяжелых металлов, чем в растущих на экологически чистых территориях.
Экспериментальная часть
Сбор материала проводился на территории Центрального района города Челябинска на газонах вдоль автодорог и в глубине соснового леса (условно-чистая территория). Растения высушивались до воздушно-сухого состояния. Затем сухие образцы измельчали в ступке, а затем прессовали в форме таблетки диаметром ~4 см (Рис. 1). Образцы были проанализированы в лаборатории Центра нанотехнологий Южно-Уральского государственного университета с использованием рентгенофлуориметра Rigaku SuperMini200. При использовании метода РФА с образцом не происходит никаких химических изменений. Использовался полуколичественный метод анализа, содержание металлов представлено в виде массовых процентов оксидов элементов.
Результаты и их обсуждение
Был проведен элементный состав нескольких лекарственных растений — подорожника, клевера и тысячелистника, собранных в черте города Челябинске и в глубине соснового леса (Табл. 1).
Исследования показали, что растения, собранные в городе, содержат большее количество тяжелых металлов (марганца, железа, цинка, меди и хрома). Гипотеза подтвердилась — в лекарственных растениях, произрастающих у автомобильных дорог, содержатся загрязняющие потенциально токсичные металлы. Поэтому в таких местах нельзя заготавливать лекарственные растения.

Рис. 1. Таблетирование образцов
Результаты рентгенофлуоресцентного анализа, % масс.
Читайте также:
