Удаление кислорода из металла
Обновлено: 05.10.2024
Удаление кислорода при плавке никеля в вакууме
При обсуждении путей выделения газов из жидкого металла в вакууме было показано, что только водород и азот могут непосредственно путем десорбции выделяться из сплавов на основе железа и из,самого железа в атмосферу в виде молекул. Для выделения кислорода из жидкого железа требуется такое низкое давление над расплавом, при котором в первую очередь будет происходить сильное испарение самого железа.
Напротив, из раствора кислорода в жидком никеле термодинамически возможно выделение кислорода в атмосферу печи непосредственно десорбцией, поскольку упругость диссоциации закиси никеля 6,3 мм рт. ст. Если понизить давление кислорода ниже этого значения, то должно происходить выделение его из раствора.
Поданным табл. 17, 18 построена диаграмма рис. 43. Кривая А рис. 43 соответствует зависимости предельных содержаний кислорода в жидком никеле от температуры согласно уравнению (27). С повышением температуры растворимость кислорода в жидком никеле возрастает, соответственно увеличивается и предельное парциальное давление кислорода в газовой фазе, при котором наступает насыщение расплава кислородом.
Эти парциальные давления- невелики. Уже при парциальном

давлении кислорода 0,1—2,0 мм рт. ст. наступает насыщение никеля кислородом. При давлениях ниже предельных содержание кислорода в никеле обратно пропорционально температуре. С повышением температуры содержание кислорода при одном и том же
давлении газовой фазы понижается. Из термодинамических данных следует, что удаление кислорода из никеля при 1500° С должно происходить при давлении кислорода в газовой фазе ниже 0,018 мм рт. ст. или при общем давлении воздуха менее 0,09 мм рт. ст.
КИНЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ УДАЛЕНИЯ КИСЛОРОДА ИЗ жидкого НИКЕЛЯ
Относительно малая величина коэффициента диффузии кислорода по сравнению с другими газами может быть объяснена большими размерами диффундирующего атома или иона кислорода. Радиус иона 02~ равен 1,32 А, в то время как радиус иона азота и водорода значительно меньше: rH+ ^ 10~5 А.
Относительно формы существования кислорода в жидких металлах существуют различные мнения. В. И. Явойский [7], рассматривая существование кислорода в жидком железе указывает, что, находясь в окружении совершенно идентичных атомов железа, атом кислорода на какое-то время приближается к одному из атомов железа. При этом электронное облако атома железа резко смещается в сторону атома кислорода, форма существования которого приближается к иону О2". Ион О2- является энергетически более выгодной формой по сравнению с атомом кислорода.
Однако многие исследователи считают, что кислород присутствует в металлическом растворе в виде [О], т. е. в атомарной, а не в ионной форме.
Очевидно, в расплавленном никеле вследствие близости свойств расплава железа и никеля форма существования кислорода должна быть такой же, как и в железе.
В работе [87] определили коэффициент диффузии кислорода в жидком железе при 1630° С, который оказался равным 3—7,8 X X 10 -3 см2/с, в более поздней работе [88] получено значение 1,33•1O-4 см2/с при 1600° С, т. е. величины, близкие к тем, которые были определены нами.
Металлографическое изучение никеля, переплавленного в вакууме, подтверждает полученные результаты. Фотографии микрошлифов, изготовленных из исходной шихты, из проб, отобранных в вакууме, ^и из конечных слитков представлены на рис. 46.
На. р«с. 46, а показаны включения в исходном никеле при содержании кислорода в нем 0,5%, а также шлифы, изготовленные из слитков, переплавленных при различных давлениях и температурах. По сравнению с исходным никелем количество неметаллических включений на шлифе резко сократилось, несмотря на высокое содержание кислорода. Так, на рис. 46, б представлен шлиф из металла с содержанием кислорода 0,23%, на рис. 46 в,— 0,19%, и т. д.
Небольшое количество включений на шлифах — это результат растворения закиси никеля в металле за время выдержки в вакууме. Напомним, что в исходном металле много включений потому, что в открытой плавке для насыщения никеля кислородом вводили твердую закись никеля, которая не успевала полностью раствориться в никеле. Ее растворение происходило уже во время плавки в вакууме. Наблюдаемые на шлифах включения закиси никеля выпали из жидкого раствора в момент кристаллизации, когда растворимость кислорода в металле понизилась

в связи с изменением агрегатного состояния. Это подтверждается также расположением неметаллических включений (см. рис. 46 г). Отчетливо видно расположение включений по границам зерен и почти полное отсутствие их в центре зерна. В момент кристаллизации жидкой фазы в маточном растворе отсутствовали включения окисной фазы, которые могли бы стать центрами кристаллизации. Включения выделялись из металла уже в ходе кристаллизации и вместе с другими загрязнениями отталкивались растущими кристаллами к границам, где и фиксировались при окончании процесса кристаллизации.
Как видно из кинетических характеристик удаления кислорода из никеля путем простой выдержки в вакууме, процесс этот имеет очень малую скорость, да и равновесные содержания кислорода, которые можно было бы достигнуть при таком рафинировании, достаточно высоки. Поэтому таким способом очистить никель от кислорода нельзя. Для рафинирования никеля от кислорода необходимо использовать раскислители. С помощью углерода в вакууме можно быстро понизить содержание кислорода в никеле до очень низких значений.
На рис. 47 показаны результаты опытов по раскислению никеля углеродом при температурах 1550 и 1650° С и давлении 10~2 мм рт. ст. При температуре 1650° С и
При использовании для раскисления 0,05%—0,1% С содержание кислорода изменялось почти в строго стехиометрическом соотношении в соответствии с реакцией (1) на 0,06—0,07%. Удаление кислорода наиболее заметно происходило благодаря образованию окиси углерода, в первые 10—15 мин выдержки в вакууме.
Все о раскислении стали
Раскисление металла сводится к удалению кислорода из жидкого металла. Кислород может присутствовать в виде оксидов. А удаляется он специальными раскислителями или восстановителями, то есть веществами, которые способны связываться с кислородом. Эта процедура считается частью рафинирования металлов.


Что это такое?
От раскисления сталей зависит и их качество. Раскисление стали – процесс по снижению уровня кислорода в ней до показателя, который полностью исключает окислительные реакции в слитке. В процессе будут образовываться жидкие, твердые либо газообразные продукты, которые надо удалить, пока слиток не затвердеет. Именно они понижают качество стали, влияют на возможности материала. Сплав раскисляют строго дозированными добавками. Это ферросилиций, алюминий, ферромарганец, также кремний и титан. Обычно эти компоненты применяются в осаждающем методе раскисления.

Куда реже убрать кислород решают способом диффузного вмешательства, вакуумного либо электрошлакового раскисления. После таких манипуляций применяться будет большая усадочная раковина, то есть цена спокойной стали возрастет. Но усадочную раковину не используют, а отрезают от основной части, потому что она считается дефектом разливки сплава. И слиток потеряет до 16% всей массы.
Алгоритм раскисления предполагает несколько этапов: растворение раскислителей в жидком металле, процессы с участием раскислителя и кислорода, а также формирование зародышей, и выпуск продуктов раскисления.

Классификация сталей по степени раскисления
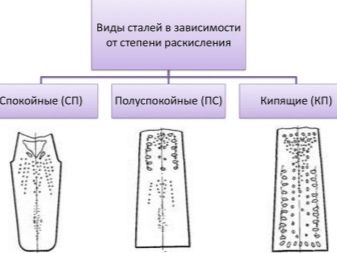
Всего существует 3 степени сталераскисления. Чтобы получить эталон выплавки слитка, кипение регулируется, либо предотвращается вовсе. И если регулируется, сталь будут называть кипящей, если останавливается – спокойной. Но так как стали подразделяются все же на 3 вида, есть еще промежуточный – полуспокойные.
Спокойные
В английском языке такой вид называется совсем иначе, чем в русском, – killed steel. Тем не менее это одна и та же сталь. У спокойного вида фактически не происходит газовыделения при отвердевании слитка после разливки. И это является итогом полного сталераскисления: из стали целиком удаляется кислород, образуется усадочная раковина вверху слитка. Потом эту часть отрезают, и отдают в лом.
Все виды легированных сталей, большая часть низколегированных сталей и многие виды углеродистых наименований используют именно в виде спокойной стали. Если говорить о непрерывной разливке, сталь также подвергают «успокоению». У этого материала гомогенная структура, химический состав ее распределен равномерно, свойства также равны. А получение данного вида требует раскисления алюминием, ферромарганцевыми сплавами, а также кремнистыми.
Бывает, применяется силицид кальция или некие иные раскислители тех же свойств. Такая степень раскисления, например, у стали 20.
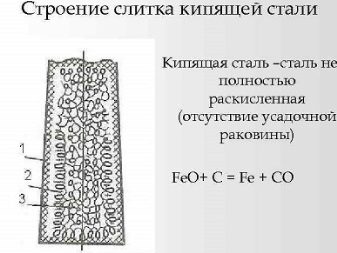
Кипящие
Для такого вида, наоборот, характерен высокий уровень выделения газов во время затвердевания материала. Химический состав стали будет различаться по поперечному сечению, а также между верхней и нижней частями слитка. Как итог, в наружной слиточной оболочке формируется условно чистое железо, и сердцевина слитка имеет высокую концентрацию примесных и легирующих составляющих. В частности, это углерод, фосфор, сера и азот, имеющие низкую температуру плавления.
Наружная часть слитка получается почище, потому ее используют при прокатке. В целом же слитки из данного вида стали отлично подходят для изготовления таких ходовых изделий, как плиты, трубы, проволока. Что же до производственной технологии, так она предполагает максимум марганца и углерода. В этой стали, к слову, нет большого количества очевидных раскислителей (титана, кремния, также алюминия). И кипящая сталь существенно дешевле других вариаций в этой классификации. Верхнюю часть слитка не отправляют в лом, и раскислители используют не активно.

Полуспокойные
Выделение газов в данном случае будет подавляться не полностью, ведь стали раскисляются только частично. То есть больше, чем в спокойных газах, но значительно меньше, чем в кипящих. Это промежуточный вариант. До того момента, как газы начнут выделяться, в слитке сформируется корковый слой, довольно толстый. Если сталь полураскислена грамотно, усадочной раковины не будет. Правда, будут пузыри, широко рассеянные по толще в центре верхушки слитка. Но эти пузыри все равно заварятся при прокатке слитка.
Использование полуспокойные стали находят, как правило, в сортовом прокате, изготовлении труб и штрипса. Главное, что их отличает, – довольно неоднородный химсостав, что-то между спокойной и кипящей сталью (что и логично).


А еще отличаются они меньшей сегрегацией химэлементов по сравнению со спокойным видом. А также обязательно нужно отметить, что в верхней части слитка отслеживается тенденция к положительной химической сегрегации.
Есть еще один тип стали, которая раскислена, она называется закупоренная. Очень похожа на кипящую сталь, но по степени подавления продукции газов она будет посреди кипящей и полуспокойной. На производство таких слитков идет меньше раскислителей, чем для тех же полуспокойных. А значит, есть маневр для формирования наружного слоя слитка при затвердевании. Если стальные слитки закупоривают механически, применяются очень тяжелые чугунные крышки (сверху они герметизируют изложницу, тормозя образование наружной оболочки).
Основные способы
Главным способом по праву считается глубинное раскисление. Другое его название – осаждающее. Его используют при выплавке стали во всех агрегатах плавления стали и проводят присадкой в металл элементов, что связывают кислород в прочные окислы, потому и название такое – глубинное. Включения окислов удаляются полноценно либо относительно полноценно в ходе осаждения. То есть они всплывают, или их выносит металлопотоками и трансформацией в шлак, либо на межфазные твердые поверхности.
Другой способ раскисления – диффузионный. Он осуществляется за счет диффузий, в которых участвуют металл и шлак, что содержит менее 1% оксида железа. Этот шлак – вполне себе восстановитель относительно металла, и он способен понизить в последнем кислородный показатель. Наконец, еще один способ сводится к вакуумной обработке стали. И зависит он от того, что в вакууме равновесное с углеродом включение кислорода снижается.
Удаление кислорода из металла



Раскислением называют удаление из металлического расплава растворенного кислорода. Поэтому операция раскисления производится лишь при плавке тех металлов и сплавов, которые способны, находясь в жидком состоянии, растворять кислород. В металлургии известно несколько способов раскисления: осадочное, контактное или диффузионное, обработкой расплава водородом с последующим вакуумированием, плавкой в достаточно глубоком вакууме при малом остаточном давлении.
В литейном производстве, как правило, применяют осадочное раскисление, которое заключается в том, что растворенный кислород связывают в нерастворимые в расплаве оксиды с помощью специально вводимых в расплав добавок, называемых раскислителями. Упрощенно итог процесса раскисления можно описать реакцией m [О]Me + n[R]Me ⇔ RnOm, где [О]Me — концентрация кислорода в расплаве; [R]Me — концентрация раскислителя в расплаве; RnOm — нерастворимый в расплаве оксид.
Константа равновесия этой реакции Kp = 1/[О]Me m [R]Me n, если считать, что образующийся оксид находится в свободном виде. Таким образом, между остаточными концентрациями кислорода и раскислителя имеется обратная зависимость. Эта зависимость справедлива в том случае, если содержание кислорода и раскислителя выражено в атомных долях и если учитываются показатели степеней, определяемые стехиометрией образующегося оксида. Растворы кислорода и раскислителя в расплаве обычно не являются совершенными, и поэтому вместо концентраций надо использовать активности. Образующийся оксид раскислителя нередко растворяется в других оксидах (шлаке, оксидах основного металла). Поэтому в выражении константы в числителе должна быть поставлена не 1, а концентрация или, вернее, активность оксида раскислителя в шлаке или сплаве оксидов. Таким образом, действительное выражение константы реакции раскисления оказывается весьма сложным.
Тем не менее главную особенность итоговой реакции раскисления — обратное соотношение между концентрациями остаточных содержаний кислорода и раскислителя в расплаве — можно четко видеть, даже если выражать эти концентрации в обычных процентах по массе. Так были получены следующие данные (трех измерений):

Очевидно, что в качестве раскислителя может быть использован металл или элемент, обладающий значительно большим сродством к кислороду, чем раскисляемый металл. В первом приближении это может быть оценено по стандартному значению изобарно-изотермического потенциала ΔZ (свободная энергия Гиббса) реакций образования свободных оксидов раскислителя и раскисляемого металла. Чем больше по абсолютному значению отрицательная величина ΔZ оксида раскислителя по сравнению с величиной ΔZ оксида раскисляемого металла, тем более полного удаления кислорода можно ожидать.
Однако для успешного раскисления важен не просто перевод кислорода в нерастворимую форму. Возникшие в результате раскисления во всем объеме расплава частицы оксидов раскислителя являются типичными первичными докристаллизационными неметаллическими включениями. Они должны быть по возможности полностью удалены из расплава. Способы их удаления приведены выше. Как правило, используется отстаивание расплава и обработка шлаком или флюсом. Для более быстрого всплывания продуктов раскисления желательно, чтобы они были в виде компактных частиц лучше всего шарообразной формы, т. е. чтобы они находились в жидком состоянии. Именно поэтому основную долю кислорода из жидкой стали удаляют, вводя в качестве раскислителей совместно кремний и марганец, поскольку образующиеся силикаты марганца имеют точку плавления не более 1200—1300 °C. Для раскисления никеля и его сплавов используют совместные добавки углерода, марганца, кремния и магния. Надо отметить, что сложные раскислители в большей мере снижают содержание остаточного кислорода, чем каждый из составляющих, взятый в большом количестве.
Еще лучшие условия для отделения продуктов раскисления создаются, если эти продукты находятся в газообразном состоянии. Примером подобного раскислителя является фосфор, вводимый в медь и некоторые ее сплавы в виде 15 %-ной лигатуры медь—фосфор, называемой фосфористой медью. Для сплавов железа и никеля фосфор не может быть использован как раскислитель, так как обладает в этих расплавах сравнительно небольшой раскисляющей способностью. Из-за этого пришлось бы иметь слишком большое остаточное содержание в расплаве этого элемента, являющегося для железа и никеля вреднейшей примесью. Однако в меди — уже при 0,01 % P равновесное содержание кислорода становится менее 0,001 %.
Для окончательного раскисления сталей используют алюминий, который резко снижает содержание кислорода. Однако при этом расплав загрязняется твердыми частицами оксида алюминия, которые очень трудно удаляются, и поэтому они являются причиной заметного снижения пластических свойств металла.
Расчет потребного количества раскислителя необходимо производить с учетом вида продуктов раскисления, желательного минимума содержания кислорода и равновесного остаточного содержания раскислителя.
Контактное раскисление осуществляется таким образом, что раскислитель не растворяется в расплаве, а лишь соприкасается с ним. Реакция раскисления идет на поверхности раздела расплав—раскислитель, куда кислород доставляется путем диффузии и конвекции. Контактное раскисление проходит очень медленно, но его преимущество в том, что расплав не загрязняется неметаллическими включениями, так как продукты раскисления остаются на поверхности раздела расплав—раскислитель. Контактное раскисление проводят иногда применительно к меди и ее сплавам. В качестве нерастворимых раскислителей используют углерод (графит), карбид кальция. Типичным примером контактного раскисления является плавка стали под безжелезистым шлаком, который способен поглотить из расплава кислород в виде закиси железа
В заключение еще раз следует уточнить, что операция раскисления применяется лишь к тем расплавам, которые содержат растворенный кислород. Поэтому раскислению обязательно подвергают углеродистые и малолегированные стали. Без раскисления в отливках из этих сталей образуются пузыри из-за выделения оксида углерода. Чугуны не требуется раскислять при плавке, поскольку в них кислород не может находиться в растворенном виде из-за большого содержания углерода, кремния и марганца. Никель и сплавы никеля с медью, железом, хромом, марганцем при обычной плавке на воздухе обязательно требуется раскислять перед разливкой. Чистая медь и сплавы меди с серебром, никелем, марганцем, оловом, свинцом растворяют в себе заметные количества кислорода, поэтому их необходимо раскислять. Сплавы меди с такими активными по отношению к кислороду металлами, как цинк, алюминий, хром, цирконий, не способны растворять кислород, и для них обычное раскисление фосфористой медью не имеет смысла. Сплавы на основе алюминия, магния цинка никогда не раскисляют.
Удаление кислорода из металла
Содержание азота и водорода в металле по ходу продувки и конечные содержания этих газов в стали определяются их концентрацией в сырых материалах и соотношением интенсивностей двух противоположных процессов: растворения газов в металле и их удаления с пузырями окиси углерода. При продувке сверху растворению газов в металле способствует высокая температура реакционной зоны и значительный путь, проходимый газами в ванне.
Содержание азота и водорода в стали, выплавляемой различными процессами, представлено в табл. 3.16.

ВОДОРОД. Кислородно-конвертерный способ производства стали обладает предпосылками, обеспечивающими меньшее по сравнению с мартеновским процессом содержание водорода в стали. В процессе плавки содержание водорода изменяется от исходного содержания в металлошихте, в основном в чугуне (3-7 см3/100 г) до значений, указанных в таблице. Эти значения меньше критических, при которых начинает проявляться вредное действие водорода на качество литого металла. Это очень важно для сталей ответственного назначения.
Основными источниками поступления водорода в ванну конвертера являются чугун и стальной скрап. Значительное количество лом вносит в виде ржавчины. Много влаги может попасть с несвежей, частично гидратированной известью.
Содержание водорода в металле мало зависит от содержания влаги в исходных материалах, если их не вводят в конвертер в конце продувки. Основная часть водорода в процессе плавки удаляется с газовой фазой. Kpoме того, очень подвижный водород интенсивно вымывается из металла пузырьками CO.
Основной причиной пониженного содержания водорода в кислородно-конвертерной стали является незначительное содержание влаги и водорода в газовой фазе над металлом. В отличие от атмосферы рабочего пространства мартеновской печи, где происходит сжигание топлива с образованием H2O и H2, содержание этих газов в полости конвертера не превышает 1%.
Процесс растворения водорода можно выразить следующим неравенством:

Отсюда вытекает, что содержание водорода в стали тем выше, чем выше парциальное давление его в конвертерных газах.
Переход водорода в сталь из водяных паров описывается уравнением:


Первоначальный уровень содержания водорода в металле определяется его содержанием в шихте. В первый период продувки (4-6 мин) отмечается увеличение концентрации водорода в металле, что связано с поступлением его из ржавчины металлолома, гидратной влаги извести и из атмосферы конвертера; парциальное давление водяных паров в атмосфере в этот период достаточно высокое, так как скорость окисления углерода невелика. Существенная нестабильность значений концентраций водорода, полученная на разных плавках, объясняется различным количеством водорода, поступающим из разных источников; через 4-6 мин содержание углерода в металле снижается, что связано с увеличением скорости обезуглероживания и вымывающего действия пузырей CO. В конце продувки содержание водорода в металле увеличивается, что объясняется падением скорости окисления углерода.
Конечное содержание водорода в конвертерной ванне в значительной степени зависит от момента ввода водородосодержащих добавок - чем ближе этот момент к концу продувки, тем выше концентрация водорода.
Радикальным средством снижения содержания водорода в стали является вакуумирование, в процессе которого степень удаления водорода составляет 50-70% и более.
АЗОТ. Кислородно-конвертерный процесс вследствие присущих ему особенностей (низкого парциального давления азота в кислородном дутье, высокой скорости окисления углерода, отсутствия подсосов воздуха в полость конвертера) хорошо приспособлен для получения металла с низким содержанием азота на выпуске.
Содержание азота в кислородно-конвертерном металле представляет наибольший интерес при производстве низкоуглеродистых сталей, предназначенных для холодной пластической деформации. Влияние азота на пластичность стали и склонность ее к старению в процессе службы и, в частности, при низких температурах полностью исчезает, когда его концентрация в стали не превышает 0,001-0,0005%. С учетом определяющей роли азота в качественных показателях стали на этом вопросе следует остановиться более подробно.
Азот хорошо растворяется в жидком железе - при 1600°С растворяется 0,044% N - и очень ограниченно в твердом. В железе при комнатных температурах растворимость азота становится значительно меньше его фактического содержания. Однако в отличие от водорода азот не выделяется из стали при охлаждении, образуя пересыщенный раствор. Выпадение азота из пересыщенного раствора, возможное при термомеханической обработке металла, приводит к понижению пластичности стали и называется старением.
Равновесная с газовой фазой концентрация азота в металле определяется законом Сивертса:

Константа пропорциональности является функцией состава металлической ванны и температуры. При увеличении температуры значения Kn увеличиваются, что приводит к увеличению растворимости азота в металле.
Для кислородно-конвертерного процесса парциальное давление азота в дутье Pn приобретает особое значение. Это связано с тем, что температура реакционной зоны может достигать 2500°C.
Поскольку металл в реакционной зоне контактирует с кислородной струей и практически не содержит углерода, растворимость азота в нем будет соответствовать его растворимости в чистом железе. Расчетами В.И. Явойского показано, что максимальная растворимость азота при чистоте кислорода 97% (PN2 = 0,18 ат изб. и T = 2200°С) равна 0,0256%.
Металл, насыщенный азотом в реакционной зоне, переносится в объем металла, удаленный от нее. Естественно, что концентрация азота во всем объеме ванны будет во много раз меньше не только вследствие более высокого содержания примесей ванны и меньшей температуры металла, но и вследствие резкого снижения парциального давления азота при относительно высокой скорости окисления углерода и большой концентрации углеродсодержащих газов в отходящих газах. Тем не менее, сказанное выше свидетельствует о целесообразности снижения температуры реакционной зоны, в частности за счет вдувания пылевидных материалов.
Факторы, определяющие содержание азота в конвертерной ванне.
К основным источникам поступления газов в конвертерную сталь можно отнести:
- шихтовые материалы;
- атмосфера плавильного агрегата;
- технический кислород;
- ферросплавы и добавки, вводимые в металл;
- атмосфера, окружающая жидкий металл в процессе его выпуска и разливки и др.
Шихтовые материалы и ферросплавы. Ниже приведены данные по содержанию газов в различных материалах.

Данные таблицы 3.17 свидетельствуют, что важнейшими источниками поступления азота в конвертерную сталь являются прежде всего шихтовые материалы (чугун, скрап, ферросплавы и т.д.). Для кислородно-конвертерного процесса основной составляющей шихты является чугун, поэтому очевидно, что доля азота, вносимого чугуном, должна быть значительной. Содержания азота в чугунах различных заводов варьируются в пределах 0,003-0,014%. Различный уровень азота в передельных чугунах ряда заводов объясняется специфическими условиями производства на этих предприятиях. В целом с чугуном вносится в конвертерную ванну до 75% от общего его количества.
Дутьевой режим плавки. Одним из факторов, определяющих содержание азота в стали, является степень чистоты кислородного дутья. Как показали исследования, проведенные в промышленных условиях на HЛMK, металлургическом комбинате «Криворожсталь», низкое содержание азота (около 0,002%) может быть получено только при продувке металла кислородом высокой степени чистоты (более 99,7%). Снижение чистоты кислородного дутья до 99,2-99,5% приводит не только к росту содержания азота, но и к увеличению разброса этой величины от плавки к плавке. Взаимосвязь чистоты кислорода η и содержания азота в низкоуглеродистой стали перед выпуском ее из конвертера характеризуется следующими данными, представленными а таблице 3.18.

Продувка металла кислородом чистотой около 98% приводит к повышению содержания азота в металле до 0,0063-0,0090%. Изменение содержания азота в металле в зависимости от степени чистоты дутья связано с тем, что в металл вдувается газ с очень низким парциальным давлением азота. В этом случае удаление азота из металла тем выше, чем выше степень разрежения (чистоты кислорода) и интенсивность перемешивания ванны выделяющейся окисью углерода (рис. 3.55).

Как видно из рисунка, в области I по истечении 5-6 мин продувки процесс деазотации расплава становится более интенсивным, чем переход азота в металл, причем этот процесс развивается до определенного содержания азота в металле (0,003-0,004%) и зависит от его парциального давления в реакционной зоне и от скорости обезуглероживания в этот период. При продувке кислородом пониженной чистоты (92-99% О2) содержание азота в металле достигает минимума примерно на 12-й мин, после чего начинает расти. В последней трети периода продувки отмечается стабилизация содержания азота, что указывает на относительное равенство потоков поступления и удаления азота.
Однако при несоблюдении оптимальных режимов ведения плавки наблюдается повышение концентрации азота в металле даже при высокой чистоте кислорода. Одним из факторов, определяющих содержание азота в металле, является интенсивность подачи кислорода. Установлено, что при продувке кислородом высокой чистоты повышение интенсивности продувки способствует снижению содержания азота в стали.
Значительный уровень и пределы колебаний по содержанию азота в металле вполне объяснимы, если учесть большое его количество, вносимое кислородным дутьем по сравнению с другими источниками (табл. 3.19).

В процессе проведения исследований на 130-т конвертерах В.И. Явойский с сотрудниками установили, что содержание азота в металле после продувки определяется чистотой кислородного дутья и содержанием углерода:

Другим важнейшим фактором дутьевого режима, влияющим на содержание азота в металле, является положение фурмы над поверхностью металла.
Азот из атмосферы может переходить в сталь в результате эжекции его струей кислорода. Эжекция невозможна при продувке в режиме «затопленной» струи. Однако в конце продувки с повышением высоты фурмы содержание азота повышается вследствие его подсоса через горловину (рис. 3.56).

Для предотвращения этого процесса предполагается вдувать в конце продувки в летку аргон и присаживать в конвертер известняк, прокатную окалину, железную руду, что позволяет стабилизировать содержание азота в металле после продувки на уровне 0,002%.
Додувки. Особо необходимо остановиться на роли додувок с точки зрения повышения азота в стали. Особенно неприятные последствия имеют место при двух и более додувках (рис. 3.57).

Додувки неизбежно приводят к приросту в металле азота по следующим причинам:
1 - при додувках обновляется атмосфера в конвертере;
2 - увеличивается подсос воздуха, так как додувки ведутся в режиме «открытой струи».
Необходимо отметить, что особую опасность представляют додувки, проводимые при низком содержании углерода (рис. 3.57).
Шлаковый режим. Важным технологическим фактором, определяющим конечное содержание азота в металле, является шлаковый режим конвертерной плавки, прежде всего, состояние шлака, его количество, что связано с защитным действием шлакового слоя. При оптимальном шлаковом режиме плавки шлак в процессе продувки находится во вспененном состоянии и металл изолирован от контакта с атмосферой. Если в процессе продувки наблюдается сворачивание шлака, то перед выпуском плавки получают металл с повышенным содержанием азота. Экспериментально установлено, что насыщение металла азотом в конвертере начинается по истечении 60% времени продувки (рис. 3.58), в связи с чем для получения низких концентраций азота поддерживать шлак во вспененном состоянии необходимо в последние 50% времени продувки.

Насыщение стали азотом в процессе выпуска и разливки. Заметное влияние на содержание азота в готовом металле оказывает поглощение азота в процессе выпуска, раскисления и разливки, причем отмечается множество факторов, влияющих на процесс поглощения азота во время выпуска. Так, установлено, что поглощение металлом азота возрастает с уменьшением диаметра летки и увеличением ее длины, с возрастанием толщины шлакового покрова, снижается с сокращением высоты падения металла и содержания кислорода в жидкой стали. Оно существенно зависит также от продолжительности выпуска и геометрии струи, т.е. определяется величиной контактной поверхности металла с атмосферным воздухом в процессе слива.
Насыщению металла азотом способствует также ввод раскислителей и легирующих в сталеразливочный ковш в процессе его наполнения.
Химсостав металла. Все элементы по степени своего влияния на растворимость азота в железе условно можно разделить на три группы:
1. Элементы, образующие достаточно устойчивые нитриды. При легировании этими элементами растворимость азота в железе увеличивается. К элементам этой группы относятся Cr, V, В, Mn, Si, Al, Ti, Nb, Zr и РЗМ. Коэффициент активности азота в сплавах железа с этими элементами понижается.
2. Элементы - аналоги железа, практически не влияющие на растворимость азота: Ni, Co.
3. Элементы, уменьшающие растворимость азота - С, Р.
В целом можно констатировать, что кислородно-конвертерный процесс является уникальным с точки зрения получения низкого азота в металле после продувки. Этот процесс позволяет без особых усилий достичь его содержания 0,002% и менее при соблюдении следующих условий:
1. Высокая чистота кислорода (99,7-99,8%).
2. Использование чугуна с низким содержанием азота. В этом смысле перспективно использование чугуна, обработанного известью и природным газом, где достигаются одновременно низкие концентрации серы (0,003 - 0,005%) и азота (меньше 0,003%). При переделе такого чугуна получают сталь с 0,0013% азота.
3. Вакуумирование стали с низким содержанием серы.
4. Полное исключение додувок при получении низкоазотистых сталей.
5. Снижение температуры реакционной зоны за счет ввода извести, руды, агломерата и др.
6. Присадка в ковш при выпуске плавки газифицирующих добавок (известняк, руда и др.) в количестве до 2 кг/т, которые выполняют роль как интенсификаторов кипения, так и активных газообразующих.
7. Предотвращение насыщения азотом металла в процессе выпуска, вне-печной обработки и разливки, так как вакуумирование стали с целью ее деазотации малоэффективно.
КИСЛОРОД. Обеспечение заданных содержаний кислорода для разных типов стали достигается соответствующим режимом раскисления. При определенной технологии раскисления содержание кислорода в металле к моменту начала разливки тем выше, чем выше его содержание к моменту раскисления.
Кроме того, от содержания кислорода в жидкой стали зависят загрязненность готового металла оксидными включениями (продуктами раскисления), поведение металла при разливке и структура слитка (заготовки), а также концентрация кислорода, остающегося в твердом растворе; последний способствует старению стали, увеличивает ее хрупкость, повышает электросопротивление и отрицательно влияет на магнитные свойства.
В жидкой стали возможно существование кислорода в активной, несвязанной форме и в форме оксидных включений. Кислород в настоящее время является единственным элементом, активность которого можно определять непосредственным измерением - путем измерения величины Э.Д.С. в высокотемпературном концентрационном гальваническом элементе.
Переход кислорода из дутья в металл идет в две стадии; на первой происходит окисление преимущественно железа:


Естественно, что в металле реакционной зоны содержание кислорода выше, чем во всем объеме ванны. Металл реакционной зоны является по существу донором кислорода всей ванны.
Наряду с процессом перехода кислорода из шлака в металл идут процессы окисления других примесей, в результате которых кислород выводится из шлака и металла, и содержание кислорода в каждый момент плавки определяется скоростью этих двух взаимно противоположных процессов. Изменение содержания кислорода по ходу продувки показано на рис. 3.59 (по данным Р.В. Старова).

В самом начале продувки при невысокой скорости окисления углерода и плохом перемешивании ванны содержание кислорода несколько повышается. С началом интенсивного окисления углерода содержание кислорода снижается, причем снижается и разброс значений, ст. Уменьшение скорости окисления и содержания углерода приводит к резкому росту и абсолютных значений, и разброса значений содержания кислорода.
Удаление кислорода из металла
Одной из задач вакуумной индукционной плавки является достижение низких содержаний газов в стали и сплавах. По существу только в вакууме можно обеспечить содержание водорода 0,0001 — 0,0002%, кислорода 0,0002—0,001%, азота 0,005—0,10%.
Столь низкие содержания газов и соответственно неметаллических включений способствуют созданию сталей и сплавов с высокими механическими, электротехническими, антикоррозионными и другими свойствами, с плотной кристаллической структурой.
Удаление кислорода в вакуумной плавке может происходить из жидкого металла в результате всплывания окисных неметаллических включений, удаления пузырьков СО при взаимодействии кислорода с углеродом, растворенным в металле, или испарения летучих субокислов некоторых компонентов.
Субокислы, это наинизшие окислы элемента, обладающие высокой упругостью пара. Испарением этих окислов в некоторых случаях возможно объяснить несоответствие между количеством окисленного углерода.
Непосредственное выделение кислорода из жидкого железа в атмосферу возможно, если парциальное давление кислорода в газовой фазе будет равно или меньше 4,5•1O-6 мм рт. ст., а общее давление 2,25-10'5 мм рт. ст., считая, что растворимость кислорода в железе при 16С0° С равна 0,23%.
Правда, теоретически нельзя отрицать возможности испарения низших окислов железа. А. М. Самарин предполагает вероятность образования окисла типа FexO. При х > 1 упругость пара Fe^O над железом, насыщенным кислородом, должна быть равна 0,1 — 0,5 мм рт. ст. в интервале 1550—1700° С.
При помощи масс-спектрометра в системе А1Ж—Al2O3 было установлено наличие в паровой фазе ионов АГ, AlO+, Al2O+, Al2Ot. Наиболее заметным был пик, соответствующий массе Al2O+. В системе Si-SiO2 находили соединение SiO. Упругость пара моноокиси кремния, находящейся в железе, может быть вычислена по уравнению
При выплавке трансформаторной стали, содержащей 4% Si при 1600° С, упругость пара SiO равна 1,03 мм рт. ст., т. е. выше давления в печи, поэтому можно допустить, что часть кислорода из этой стали будет удаляться в виде SiO.
Несколько иначе обстоит дело с удалением кислорода из жидкого никеля. Растворимость кислорода в никеле при 1500° С равна 0,38%, что соответствует парциальному давлению кислорода или упругости диссоциации закиси никеля 6,3 10~2 мм рт. ст. или давлению воздуха 0,31 мм рт. ст. Поэтому, если давление атмосферы над жидким никелем будет < 0,3 мм рт. ст., то никель можно рафинировать от кислорода простой выдержкой под вакуумом. Но это справедливо лишь для никеля.
В целом же под процессом дегазации мы понимаем удаление из жидкого металла растворенных в нем водорода и азота.
Механизм удаления азота и водорода при плавке в вакууме
Удаление азота и водорода из жидкого металла может происходить в результате следующих процессов:
1) всплывания нитридных и гидридных неметаллических включений, если существуют условия образования таких фаз в жидком металле;
2) выделения пузырьков азота и водорода, зарождающихся в ванне жидкого металла, в случае высокого содержания газов в металле, при котором создаются условия, необходимые для преодоления сил поверхностного натяжения и ферростатического давления для образования зародышевых пузырьков на поверхности футеровки или на неметаллических включениях;
3) десорбции газа с открытой поверхности ванны, к которой атомы газа подаются диффузионным или конвективным путем.
Последний процесс имеет значение также и при удалении газов в виде пузырей, когда должен происходить массоперенос растворенных в жидком металле азота и водорода к месту образования и роста пузырьков или к всплывающим пузырькам.
Причиной удаления газов из металла в вакууме является подчинение растворов азота и водорода в жидком металле закону Генри или его частному случаю — закону Сивертса.
По закону Сивертса (закону квадратного корня)
где Kh — растворимость водорода;
K — растворимость азота в данном сплаве при данной температуре и при парциальном давлении рНз и Pn2, равном 1 ат.
При 1600° С растворимость водорода в жидком железе составляет 0,0027%, а азота — 0,043%. Температурные зависимости констант растворимости выражаются уравнениями:
Отметим, что при невысоких содержаниях в железе С, Si, Mn, Ni, Cr растворимость и активность водорода почти не изменяется по сравнению с чистым железом. В то же время наличие Cr, V, Ti, Nb значительно понижает коэффициент активности азота в расплаве и тем самым прочнее связывает азот в металле. Вместе с тем присутствие углерода и кремния повышает активность азота и способствует его удалению.
В ряде работ было установлено отклонение растворов азота в легированных расплавах от закона Сивертса. Хотя растворы азота и водорода в жидком железе следуют термодинамическим закономерностям, однако поведение этих газов при плавке металла в вакууме различно.
Если содержание водорода в сталях и сплавах, выплавленных в вакуумных печах, почти полностью соответствует равновесным значениям, определяемым парциальными давлениями водорода над жидкой ванной, то содержание азота в металле редко удовлетворяет этой зависимости. Достижение содержания водорода в металле, выплавленном в вакууме, порядка в 1 см3/100 г не является необычным.
Получение металла с концентрацией азота порядка тысячных долей процента, а в легированных сталях и сплавах сотых долей является в то же время трудной задачей. Удалению водорода способствует то, что он обладает значительно более высокой подвижностью в жидких металлах, чем азот. Коэффициенты диффузии водорода на порядок больше коэффициентов диффузии азота.
Несомненно, что в процессах выделения газов в вакууме кинетические факторы играют большую роль, а относительно азота можно на основании практического опыта сказать, что кинетика превалирует над термодинамикой. Такие процессы, как образование пузырьков газа, их рост, всплывание, выделение газа в пузырьки при их подъеме, всплывание включений, подвод газа к поверхности газовыделения протекают во времени. В зависимости от природы расплава и условий плавки время достижения равновесных состояний может оказаться очень большим или практически недостижимым.
Рассмотрим процесс удаления азота при выплавке нержавеющей стали типа X17 с 17—18% Cr в вакуумной индукционной печи емкостью 800 кг. Тигель печи имеет глубину 0,75 м, давление в камере печи во время плавки 0,01 мм рт. ст. Предполагаем, что удаление азота происходит путем выделения пузырей. Тогда используем уравнение
по которому рассчитаем давление азота, необходимое для образования пузырька. Атмосферным давлением 0,01 мм рт. ст. можно пренебречь. Принимаем, что образование пузырька происходит на дне тигля:
yh = 360 мм рт. ст. при а = 1000 дин/см - ^
Если принять радиус образующегося пузырька 0,05 см, то = 390 мм рт. ст. ^ 0,51 ат.
Такому давлению соответствует концентрация азота
где 0,155 — коэффициент активности в сплаве с 17% Cf
Таким образом, для пузырькового удаления азота концентрация его в металле должна быть высокой (0,198%). Условия удаления азота из металла облегчаются при кипении стали в вакууме или при продувке ее инертным газом. Пузырьки окиси углерода или аргона представляют собой готовую газовую фазу, в которую выделяется азот. Проходящий сквозь металл поток пузырей перемешивает слои жидкого металла и способствует ускорению массо-перенрса азота к границе газовыделения.
При продувке металла аргоном через пористые пробки, установленные в подине ковша, содержание азота изменилось с 0,01 до 0,002—0,003% [47, 48].
Очевидно, что для выработки технологии плавки в вакууме, обеспечивающей максимальное удаление азота, недостаточно знания только термодинамических величин. Необходимы сведения о механизме газовыделения, которые можно получить при исследовании кинетических особенностей процессов.
Процесс удаления газа из металла можно представить в виде ряда последовательно протекающих стадий.
1. Перенос растворенных атомов газа в жидком металле посредством конвективной диффузии к поверхности раздела металл—газ (безразлично к зеркалу ванны или к пузырькам газа, возникающим в объеме металла; пузырьки могут быть азотными, водородными, из окиси углерода, аргона).
2. Диффузионный перенос (молекулярная диффузия) атомов газа через тонкий пограничный диффузионный слой, в котором отсутствует гидродинамическое перемешивание и в котором концентрация газа линейно изменяется от концентрации в объеме металла С до концентрации в поверхностном слое Cn.
3. Адсорбция атомов газа в поверхностном адсорбционном слое.
4. Химическая реакция молизации адсорбированных атомов азота или водорода:
5. Десорбция образовавшихся молекул в газовую фазу.
6. Отвод молекул газа в газовой фазе от поверхности раздела. Эта ступень может осуществляться также и путем образования и всплывания пузырьков газа.
Для того чтобы определить время, необходимое для осуществления требуемой степени дегазации выплавляемого металла, надо знать значение константы скорости, характеризующей протекание реакции газовыделения, а также степень влияния технологических факторов (нагрева металла, перемешивания ванны, геометрических параметров ванны) на скорость дегазации.
Из законов химической кинетики известно, что скорость сложного процесса определяется скоростью наиболее медленной стадии. Задача состоит в правильном определении медленной или лимитирующей стадии. Тогда скорость всего процесса может быть рассчитана по* кинетическому уравнению, относящемуся именно к данной* стадии.
В условиях вакуумной плавки, когда газовая атмосфера непрерывно откачивается вакуумными насосами, скорость действия которых намного превышает скорость газовыделения из металла, можно предположить, что шестая стадия не будет ограничивать процесс дегазации.
Благодаря наличию конвективных потоков в металле подвод вещества к поверхности раздела осуществляется с достаточно большой скоростью, поэтому принято считать, что и первая стадия не будет лимитировать весь процесс дегазации.
Скорость десорбции газа с поверхности металла можно оценить при помощи уравнения Лэнгмюра:
где оз0 — скорость испарения, г/(см2-с);
P0 — упругость пара испаряющегося элемента, мм рт. ст.;
M — молекулярная масса;
T — температура, К. Если над поверхностью металла находится атмосфера с парциальным давлением газа р1у то это учитывается следующим образом:
где С — концентрация газа в металле; К — константа растворимости газа.
Нами проведен расчет скорости десорбции водорода и азота из расплава Fe—Cr—Ni при 1600° С и давлении водорода или азота в камере печи 1 мм рт. ст., который дал величины:
Опытные значения скорости, полученные на плавках в печи сопротивления, оказались равными coN=3,5-10~8 г/(см2-с), сон ==2,8.10"7 г/(см2-с), т. е. значительно меньше скорости десорбции, полученной расчетным путем [49].
На этом основании можно предположить, что и пятая стадия процесса не будет лимитирующей.
Итак, остается рассмотреть роль остальных стадий: диффузии, адсорбции и химической реакции.
Известно, что диффузионные процессы относятся к реакциям, подчиняющимся уравнениям первого порядка. К этому же порядку относится и реакция адсорбции газа в поверхностном слое.
Реакция молизации определяется кинетическим уравнением второго порядка. Установление порядка лимитирующей ступени позволяет, по крайней мере, ответить на вопрос, что контролирует процесс дегазации: химическая реакция или диффузионно-адсорбционная стадия.
Вопрос о механизме и лимитирующем звене процессов удаления азота и водорода остается до сих пор дискуссионным. А. Симкович считает, что лимитирующей стадией удаления азота является адсорбционный процесс. Большинство авторов, в том числе Р. Пелки и Дж. Эллиотт, считают, что лимитирующей стадией является диффузия азота в жидком металле и адсорбция. Е. С. Левин, П. В. Умрихин и К. Т. Курочкин [50] придерживались мнения, что удаление водорода из металла в зависимости от его содержания может происходить в трех режимах: кинетическом, смешанном, диффузионном.
В. И. Явойский и А. Н. Морозов, однако, предполагают, что для удаления водорода из жидкого металла под вакуумом лимитирующим является процесс диффузии и только от него зависит процесс удаления водорода из металла.
Если в работе [51 ] указывается, что скорость поглощения или выделения азота по существу не зависит от температуры, то данные работ [52, 53] свидетельствуют о том, что скорость удаления азота сильно растет с повышением температуры. А. Н. Морозов и М. М. Карнаухов [54] также отмечали большой температурный коэффициент процесса удаления азота. Они объясняли это повышенной подвижностью атомов азота вследствие электромагнитного перемешивания металла при подводе более высокой мощности к индуктору.
В работе [53] отмечено, что повышение температуры с 1600 до 1700° С сопровождается возрастанием коэффициента массо-переноса азота P = DIb с 14,5•1O -3 до 17,3-103 см/с, где D — коэффициент диффузии; S — толщина диффузионного слоя. Этот коэффициент характеризует скорость переноса азота из объема металла к поверхности раздела фаз. Увеличение скорости процесса дегазации при повышении температуры в условиях плавки в вакуумной индукционной печи связано как с возрастанием коэффициентов диффузии азота и водорода, так и с более интенсивным перемешиванием металла.
Большое значение для процессов дегазации имеет удельная поверхность, т. е. отношение поверхности раздела ванны к объему металла FIV. Чем больше удельная поверхность, тем больше должна быть скорость дегазации. Рассматривая этот фактор, необходимо в отдельных случаях учитывать и роль дегазации через стенки огнеупорного сосуда, которой часто пренебрегают. Так, К. Бротцманн [55] считает, что уже при высоте столба жидкого металла 10 мм большая часть газов выделяется через стенки тигля. Для доказательства этого положения по ходу плавки в вакуумной индукционной печи снижали температуру металла до тех пор, пока на поверхности жидкого металла не образовывалась твердая корочка. При этом не отмечали уменьшения выделения газов из металла, что, по мнению автора и свидетельствует о выделении газов через стенки тигля.
На наш взгляд, удаление газа через стенки тигля имеет второстепенное значение по сравнению с удалением его с открытой поверхности ванны.
При рассмотрении поверхности дегазации необходимо учитывать появление на поверхности любых загрязнений, например
шлака, а также возникновение пузырькового кипения вследствие либо протекания процесса раскисления углеродом, либо продувки газом. Загрязнения или шлак значительно уменьшают поверхность раздела, поток пузырей во много раз ее увеличивает. К сожалению, рассчитать поверхность раздела металл—газ при кипении ванны является трудной задачей.
На скорость поглощения или выделения азота влияют такие элементы, как Аl, Nb, Ni, Si, S, О, Ti.
Сильное влияние оказывает кремний и алюминий даже при небольших содержаниях. Объяснение этого явления заключается в раскислении металла кремнием и алюминием и устранением тормозящего влияния кислорода, о котором необходимо сказать особо.
Кислород, а также сера значительно сильнее других компонентов металлических расплавов влияют на скорость удаления азота из металла. Уже при содержании кислорода 0,01% скорость деазотации металла в вакууме резко понижается. Так же действует и сера. Однако влияние серы слабее влияния кислорода. По-разному пытаются объяснить заградительное влияние кислорода на удаление азота. Ранее считали, что на поверхности ванны, содержащей много кислорода, образуется тонкий окисный слой, препятствующий газовыделению или газопоглощению. Другая гипотеза предполагает образование молекулы окиси азота, которая представляет собой более высокую энергетическую форму, чем азот и кислород, и таким образом создает барьер для удаления азота [56].
В настоящее время своим наибольшим приближением к действительности завоевывает признание гипотеза адсорбционного торможения кислородом или серой удаления азота. По этой гипотезе, выдвинутой Дж. Эллиоттом и Р. Пелки, развитой А. Н. Морозовым, атомы кислорода занимают адсорбционные центры на поверхности жидкого расплава и препятствуют адсорбции атомов азота, подходящих из глубины металла к поверхности раздела. В результате возникает адсорбционный барьер на поверхности раздела фаз, который значительно снижает скорость удаления азота. Такое же влияние оказывает и сера. Подтверждает эту гипотезу тот факт, что кислород, сера и азот являются поверхностно активными элементами.
Для выяснения кинетических характеристик процесса выделения азота, водорода и кислорода (последнего из жидкого никеля) при плавке в вакууме было проведено исследование дегазации жидкого металла в вакуумной печи сопротивления [49, 57]. Плавка в печи сопротивления в отличие от плавки в вакуумной индукционной печи не накладывает электромагнитных возмущений на ванну металла и позволяет получить данные, свободные от влияния перемешивания.
Плавки проводили в печи сопротивления с вольфрамовыми или графитовыми нагревателями с отбором проб и измерением температуры термопарой погружения. Схема опытной установки приведена на рис. 28.
Сверху печь была закрыта водоохлаждаемой крышкой, имевшей вакуумный шлюз, уплотнение типа Вильсон, шток с пробницей для отбора проб жидкого металла, и смотровое окно. При измерении температуры вместо штока с пробницей устанавливали

термопару погружения типа BP 5/20 в трубке из нержавеющей стали. Подвижной шток снизу оканчивался резьбой, на которую навинчивали втулку для крепления кварцевой пробницы. Пробница представляла собой кварцевый развальцованный стаканчик с отверстиями на расстоянии 20—40 мм от запаянного конца.
Температуру металла поддерживали постоянной в течение плавки с точностью ±10° С при точности измерения =t5° С. Плавки проводили в корундовых литых тиглях диаметром 30—40 мм и высотой 120 мм.
Читайте также:
