Удаление серы и фосфора из металла шва
Обновлено: 05.10.2024
Выше (см. гл. 9) уже рассмотрено поведение отдельных компонентов сплавов и их влияние на качество получаемого металла шва. Однако в заключение надо сделать обобщение влияния на качество сварных соединений, так называемых «вредных» примесей, к которым относятся сера, фосфор, кислород, азот, водород, а в некоторых случаях н углерод.
Сера — всегда вредная примесь при сварке металлов, так как она образует относительно легкоплавкие эвтектики Me — — MeS, что создаст возможность образования «горячих» или кристаллизационных трещин в металле шва. Ее содержание в металле и в сварочных материалах всегда следует жестко лимитировать.
Снижение вредного влияния серы достигается ее переводом из сульфидов железа в сульфиды с более высокой температурой плавления (MnS; Гпл=1883 К; CaS; Г„л= 2273 К), с тем чтобы она не могла участвовать в процессе кристаллизации, образуя неметаллические включения, еще в жидком металле сварочной ванны (Гпл=1800 К).
Это достигается при введении в сварочную ванну достаточного количества марганца. Кальций вводят в металл ванны в виде силикокальция через электродные покрытия или порошковую проволоку.
Общее снижение содержания серы в металле при сварке возможно при сильно основных шлаках. Бескислородные фто - ридные флюсы также способствуют удалению серы из металла в результате образования летучих фторидов металла (FeF2, FeF3) и твердых сульфидов:
CaFs + FeS-^CaS + FeFst.
Сера удаляется при электрошлаковой сварке и переплаве металлов.
Фосфор — почти всегда вредная примесь в металлах, снижающая их пластичность. Так, при кристаллизации стали фосфор образует ряд соединений с железом (БезР, Fe2P, FeP и FeP2), отличающихся своей хрупкостью, кристаллы которых могут стать зародышами холодных трещин. Содержание фосфора в металле шва при дуговой сварке понизить практически не удается, так как он удаляется в окислительных шлаках, а сварочные шлаки — восстановительные. Концентрация фосфора в шве снижается только при электрошлаковой сварке.
При сварке медных сплавов фосфор не представляет собой вредную примесь, так как он способен раскислять металл, образуя летучий оксид Р2О5:
5Cu20 + 2Cu3P-> 16Cu + P205f.
Кислород — вредная примесь в металле при сварке, снижающая пластические свойства металла, поэтому при всех видах сварки предусматривается процесс раскисления металла шва до допустимой нормы. При сварке металлов высокой активности (Al, Ti, Zr) следует создавать бескислородную атмосферу — аргон, гелий, вакуум, галидные флюсы, так как раскислителей для таких металлов подобрать нельзя.
Однако при сварке конструкционных сталей следует сохранять некоторую окисленность металла для уменьшения растворимости водорода.
Азот поглощается металлом сварочной ванны из атмосферы дугового промежутка, в котором он находится в основном в атомарном и частично в ионизированном состояниях. Растворимость азота в жидком металле выше, чем в твердом, и в процессе кристаллизации металла шва он может выделяться в газообразном состоянии, образуя поры.
При кристаллизации металла сварочной ванны азот образует почти со всеми металлами соединения — нитриды различной степени устойчивости (см. рис. 9.33). Особенно устойчивые нитриды образуют ^-металлы IVB, VB, VIB групп периодической системы. Нитриды железа Fe4N, Fe2N образуют очень хрупкие игольчатые кристаллы, разрушение которых приводит к зарождению холодных трещин (замедленное разрушение). Из промышленных металлов только медь не дает устойчивых нитридов и поэтому ее можно сваривать в атмосфере азота (см. п. 10 3).
Однако азот не всегда представляет собой вредную примесь и в некоторых сталях аустенитного класса содержание его доводят до 0,3. 0,4%.
Водород при сварке — всегда вредная примесь («водородная хрупкость»).
Источники водорода при сварке металлов: 1) водород, поглощенный металлом из атмосферы дугового разряда, и 2) водород, растворенный в основном металле.
Водород, поглощенный из атмосферы дугового разряда, в которой он находится в атомарном и в ионизированном состояниях, при кристаллизации резко понижает свою растворимость и, выделяясь из металла, вызывает возникновение пор и трещин.
Водород, содержащийся в основном металле, может находиться в состоянии твердого раствора внедрения — диффузионно-подвижный водород, а также находиться в связанном состоянии — гидридный водород. Водород в молекулярном состоянии находится в микронесплошностях металла.
Диффузионно-подвижный водород может перемещаться в металле в результате концентрационной или термической диффузии, создающейся вследствие градиента температур. Последний вид диффузии описывается уравнением
9.10. Рафинирование сварочной ванны и модифицирование металла шва
Третья важная металлургическая операция, протекающая в сварочной ванне одновременно с раскислением и легированием металла, - его рафинирование, т. е. очищение от вредных примесей - серы и фосфора. Полное удаление этих примесей при плавке и сварке стали невозможно (см. гл. 8). Однако для рафинирования металла шва по содержанию серы условия сварочного процесса в общем более благоприятны, чем в сталеплавильном производстве. Наиболее существенными из них являются следующие:
более высокая температура металла и шлака, особенно на стадии образования капель (Тк = 3000 К), что способствует диссоциации сернистых и фосфорных соединений, ослабляет их химические связи и тем самым облегчает удаление серы и фосфора из металла шва в шлак;
интенсивное перемешивание металла со шлаком в кипящих каплях и в сварочной ванне увеличивает относительную массу шлака в 100-1000 раз по сравнению с относительной массой шлака при плавке стали;
использование специальных рафинирующих компонентов: кальция Са, церия Се, лантана La, иттрия I и других в электродных покрытиях или сварочных флюсах позволяет провести удаление или связывание вредных примесей.
Таким образом, несмотря на кратковременность взаимодействия металла со шлаком, при сварке плавлением есть возможность получать металл шва с меньшим содержанием серы и фосфора, чем в основном металле.
9.10.1. Влияние серы на структуру и свойства шва

Источниками поступления серы и фосфора в зону сварки служат: флюсы и электродные покрытия, в состав которых входят содержащие примеси серы компоненты, например марганцевые руды, а также расплавленные основной и электродный металлы.
Важно отметить, что распределение серы по сечению толстолистового основного металла может быть крайне неравномерным вследствие ликвации при кристаллизации литых слябов, не подвергающихся при прокатке значительным деформациям. Поэтому при сварке на некоторых участках шва концентрация серы может оказаться весьма высокой, а механические свойства шва очень низкими даже при ее средней концентрации в металле, удовлетворяющей требованиям ГОСТа. Это явление называют металлургической наследственностью в металле. Содержание серы в металле в количестве, превышающем допустимые нормы, резко снижает его механические свойства и является причиной красноломкости металла, а при сварке приводит к появлению в шве кристаллизационых трещин.
Механизм влияния примесей серы на наплавленный металл состоит в следующем. В сталях сера образует с железом сульфид железа FeS, температура плавления которого составляет 1468 К, т. е. ниже температуры плавления стали на «300 К. Сульфид железа почти не растворяется в твердом железе.

При кристаллизации шва FeS выделяется из него и соединяется с другими примесями в виде легкоплавкой сернистой эвтектики (рис. 9.31) или в виде отдельных включений разного вида. Эвтектики могут быть двойными либо тройными, например:
В процессе направленной кристаллизации металла шва, протекающем в интервале температур ликвидус-солидус, эти легкоплавкие сернистые эвтектики оттесняются растущими кристаллитами металла шва к границам между кристаллитами и к месту их стыка (в центральной части сварочной ванны) и становятся частью так называемых межкристаллитных прослоек. К моменту окончания кристаллизации металла шва такие межкристаллитные прослойки могут быть еще в жидком состоянии (Тэ < Тс). Если возникнут растягивающие напряжения от усадки шва и временных сварочных деформаций в шве, то возможно появление на этих участках горячих трещин кристаллизационного типа (рис. 9.32).
Сера и ее удаление из металла шва.
Сера образует с железом сульфид железа FeS, температура плавления которого 1195 °С.Сульфид железа почти не растворяется в твердом железе и выделяется в нем илив виде эвтектики или в виде отдельных включений разного вида и формы. Эвтектики могут быть двойные либо тройные, например:
FeS+Fe(Тпл = 985 °С); 2FeO•Si02+FeS;FeS+Fe+MnS(Тпл = 980 °C) и др.
В процессе кристаллизации металла (рис. 130, б), протекающем в интервале температур ТЛ–Тс (ликвидус — солидус), этисернистые эвтектики оттесняются растущими кристаллами металла шва к границам между ними и к месту стыка кристаллов в центральную часть сварочной ванны(на рис. 130, а — в затушеванную зону)
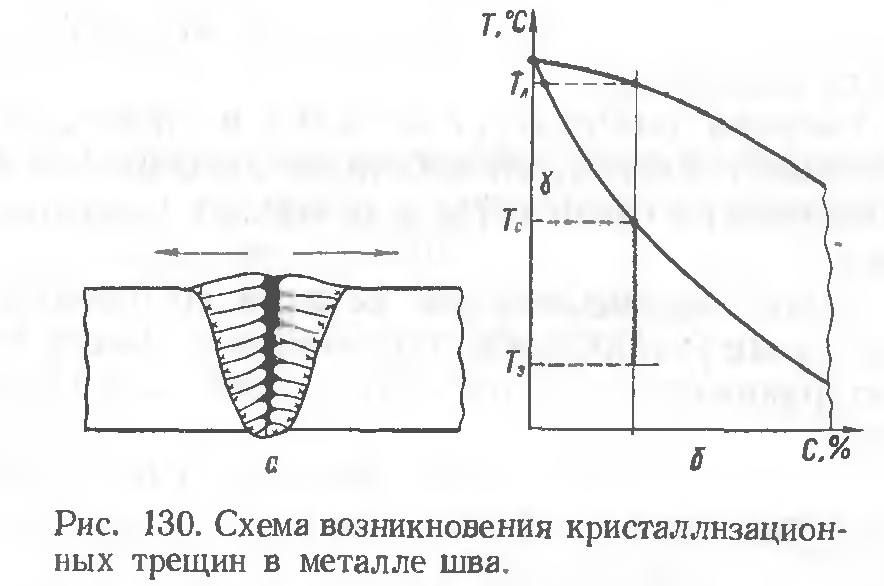
и становятся частьютак называемыхмежкристаллитных прослоек.К моменту окончания кристаллизации металла шва такие межкристаллитные прослойки могут быть еще в жидком состоянии(Т3— температура затвердевания сернистых эвтектик; Т3< Тс).
Тогда возникновение заметных по величине растягивающих напряжений в шве (показаны стрелками на рис. 130, а) может вызвать появление на этих участках кристаллизационных, или горячих, трещин.Одновременное наличие в металле углерода и кремния увеличивает склонность швов к кристаллизационным трещинам.
Для более полного удаления серы из металла и благоприятного распределения оставшейся ее части в сварочную ванну нужно вводить такие элементы, которые имели бы к сере большее сродство, чем железо.
Образующиеся сульфиды должны обладать высокой температурой плавления и не создавать эвтектик. По степени возрастания прочности образующихся сульфидов их можно расположить в ряд, представленный в табл. 36.
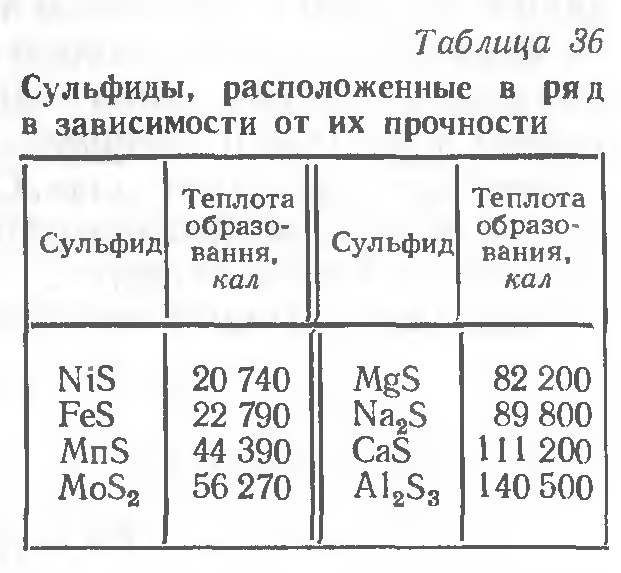
Как видим, наибольшим сродством к сере обладают Al, Са, Na, Mg. Однако использование их для связывания серы неудобно, так как все они имеют более высокое сродство к кислороду и связываются им в оксиды.
Из числа элементов, приведенных в табл. 36, наибольший интерес с этой точки зрения представляет Мnпо таким причинам:
1) он имеет сравнительно высокое сродство к сере;
2) как правило, всегда присутствует в стали в сравнительно больших количествах;
3) образует тугоплавкий сульфид, равномерно распределяющийся по всему объему металла;
4) при концентрациях в стали более 0,5—0,6% способствует переходу серы в шлак.
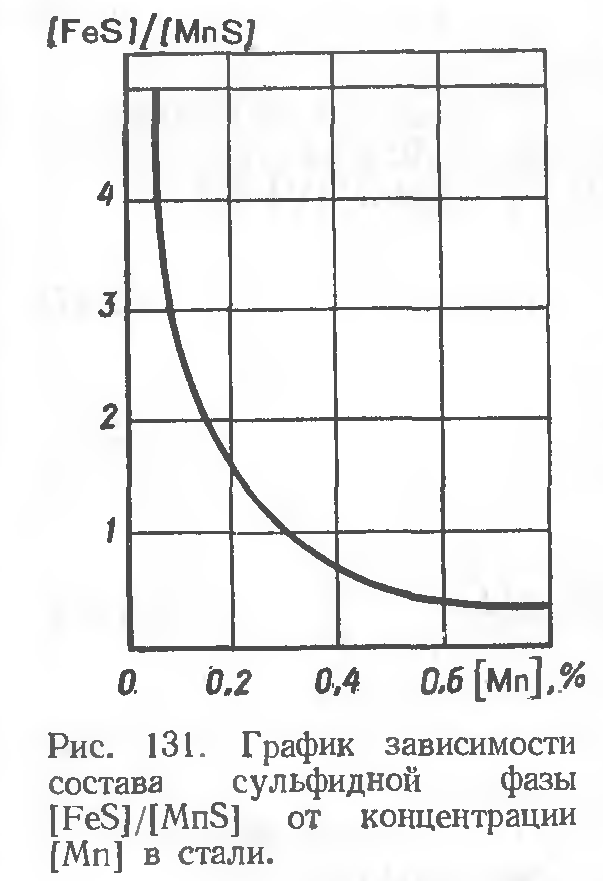
Согласно рис. 131, где показана зависимость состава сульфидной фазы [FeS]/[MnSj от концентрации марганца в малоуглеродистой стали, свидетельствуют о том, что марганец полезен главным образом как элемент, переводящий серу в более благоприятную форму существования в стали, тогда как его десульфурирующая способность относительно мала.
В сварочной практике связывают и удаляют серу чаще всего двумя способами: с помощью Мп и МпО, а также СаО.Сера образует с марганцем относительно прочный сульфид MnS с температурой плавления —1620 °С.
Сульфид марганца слабо растворим в металле и хорошо — в шлаке; поэтому он в значительном количестве переходит в шлак.
оставшийся в металле MnS распределяется в мелкодисперсном виде достаточно равномерно и не образует легкоплавких эвтектик.
Основной реакциейсвязывания серы марганцем является
IFeS] + [Mn] ↔ (MnS) + [Fe]
с константой равновесия
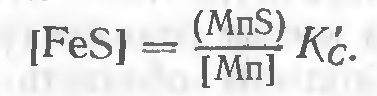
Однако эффективность связывания серы в сульфид марганца по такой реакции мала, так как направо она заметно развивается лишь при пониженных температурах, когда скорости протекающих процессов весьма замедляются. В итоге в металле шва оказываются значительные количества FeS.
Поэтому реакция дополняется второй:
[FeS] + (MnO) ↔ (MnS) + [FeO],
Для второй реакции константа равновесия Кс растет с увеличением температуры, т. е. с ростом температуры реакция сдвигается в сторону большего выхода (MnS) и [FeO].
Рассматривая реакции совместно, можно отметить, что превращению FeS в MnS способствуют: 1) лучшая раскисленность металла (реакция 2);
2) увеличение содержания марганца в металле (реакция 1);
3) высокая концентрация (МпО) в шлаке (реакция 2).
Обычно принимают отношение в металле равным 20…25, что позволяет избежать кристаллизационных трещин.
Связывание серы известью основано на образовании весьма прочного сульфида кальция, практически нерастворимого в металле. Процесс протекает в соответствии с реакцией
[FeS] + (CaO)↔ (CaS) + [FeO].
Константа равновесия реакции растет с увеличением температуры, т. е. при этом процесс интенсивнее развивается вправо, в сторону образования (CaS).
Лучшее раскисление металла и введение в шлак окиси кальция будет способствовать уменьшению содержания [FeS] в металле.
Увеличение содержания (СаО) в шлакеприводит к росту константы распределения (S)/[S], чтообеспечивает более полный переход серы из металла в шлак.
Удаление серы из металла
Фосфор повышапет хрупоксть стали при низких температурах. Источник фосфора – сырье , т.к. в плавке он полностью переходит в чугун (0,1-2%), что гораздо выше допустимых концентраций в стали (0,02-0,05). Фосфор обладает бОльшим сродством к кислороду чем железо и его удаляют методом окислительного рафинирования. Удаление фосфора возможно по двум реакциям:
Для реакции 1 константа равновесия при Т=1600 оС равна 1 и реакция обратима, поэтому за счет железистых шлаков нельзя обеспечить высокую степень дефосфорации. Оксид P2O5 – кислотный оксид и полнота его удаления так же, как и кремния значительно возрастает с увеличением основности шлака. Поэтому в производственных условиях дефосфорацию обеспечивают вводом CaO. Из константы равновесия для реакции 2 учитывая, что шлак – идеальный раствор, а металл – бесконечно разбавленный получают выражение для коэффициента распределения фосфора.
Активность железа =1. Таким образом для увеличения L необходимо:
1. Повысить окислительную способность шлака и увеличить его основность, т.е. повысить активность FeO и активность CaO.
2. Понизить коэффицент активности фосфора в шлаке, что достигается увеличением его основности.
3. Увеличить К2, для чего необходимо понизить температуру металла. Поскольку реакция 2 – экзотермическая, то повышение температуры приводит к уменьшению К2 и следовательно к уменьшению Lp. Однако скорость дефосфорации с ростом температуры увеличивается. Поэтому наилучшие результаты по обесфосфориванию достигаются при оптимальном нагреве. Конечное содержание фосфора зависит помимо Lp от его прихода и относительного количества шлака. Чем его больше тем ниже P.
Поэтому для получения чистой по фосфору стали процесс ведут с большим количеством шлака и промежуточным его скачиванием.
Сера, растворяясь в металле концентрируется в оставшемся расплаве, обладая ничтожной растворимость в твердом железе, она в дальнейшем выделяется на границах зерен металла в виде легкоплавких соединений с оксидами железа. Поэтому сталь становится красноломкой (хрупкой при Т=800-1200 о С – температура прокатики). Однако и в холодном состоянии прочность стали уменьшается. Содержание Серы должно быть не более 0,02-0,05%. Необходимо ее удаление, которе осуществляют на всех стадиях (при подготовке руд, изготовлении чугуна и с стали). Источником серы являются железные руды и кокс. Содержание серы в коксе 0,4-2%. В рудах тоже до 2%, но она легко удаляется при подготовке руд, поэтому основным источником серы в настощее время является кокс.
Обессеривание железных руд
В рудах сера содержится в основном в виде перита FeS2 и реже в виде перротина. У сульфидов с остом температуры прочность и сродство железа к сере падают. Перит FeS2 – непрочное химическое соединение и при нагреве до 700 оС он распадается. FeS – более прочный оксид и его диссоциация практически неосуществима. В окислительной атмосфере перотин окисляется. При температурах обжига окатышей и агломерации (1500 К). Константа скорости перротина существенно больше единицы и реакция необратима, т.е. FeS обладает значительным сродством к кислороду и, возможно практически полное удаление серы из руд с одновременным окислением железа. Обжиг руд, агломерация и обжиг окатышей ведут при большом избытке воздуха и, следовательно кислорода. Температурный режим (1500 К) создает благоприятные условия для диссоциации FeS2 до FeS, а окислительная среда – для окисления FeS и выгорания серы. Кинетика имеет те же особенности, характерные для гетерогенных реакций. Превращение начинается с наружней поверхности кусков. Со временем с утолщением слоя продуктов реакции Fe3O4 лимитирующим звеном становится внутренняя диффузия. Скорость таких реакций увеличивается с уменьшением размеров кусков, поэтому агломерация и обжиг окатышей используют мелкие материалы, что позволяет вести обессеривание гораздо полнее. При агломерации удаляется 70-90% серы при обжиге окатышей 60-80%, поэтому содержание серы в агломерате и окатышей не превышает 0,05%.
Читайте также:
