Укажите причину возникновения скачка потенциала на границе металл раствор
Обновлено: 04.05.2024
Растворимость одного вещества в другом – свойство, присущее всем веществам. Растворимость может быть неограниченной и крайне малой, что зависит от термодинамических свойств растворяемого вещества и растворителя. Даже при чрезвычайно малой растворимости одного вещества в другом всегда осуществляется переход веществ через поверхность их контакта.
Любой металл растворяется в воде, однако растворимость металлов изменяется в очень широких пределах. Например, щелочные металлы бурно взаимодействуют с водой, при этом выделяется из воды водород и образуется раствор гидроксида.
Серебро практически не реагирует с водой, тем не менее процесс перехода частиц серебра в воду происходит, и получается лечебная «серебряная вода». Таким образом, одни металлы хорошо растворяются в воде, другие – крайне плохо. Ответ на вопрос, чем обусловлена различная растворимость металлов в воде, дает область химической науки – электрохимия.
Ниже мы поговорим об особой группе электрохимических реакций, протекающих на границе раздела фаз, в частности металл–вода (или раствор соли металла). Эти реакции характеризуются переносом заряда (электронов) и вещества через границу раздела фаз твердое вещество–жидкость.
Вы знаете, что металл проводит ток благодаря тому, что в его кристаллической решетке есть свободные (точнее, слабо связанные с атомами) электроны. А это означает, что в кристаллической решетке имеется некоторое количество положительно заряженных ионов металла.
Если металлическую пластинку, например медную, погрузить в воду или раствор соли меди, то из слоя металла, находящегося на границе с водой, положительно заряженные ионы Cu 2+ начнут переходить в воду. Из-за этого пластинка приобретает отрицательный заряд. Между отрицательно заряженной пластинкой и перешедшими в раствор положительно заряженными ионами возникает электростатическое притяжение, что препятствует дальнейшему переходу ионов в раствор, т.е. процесс растворения металла прекращается. Подойдя к поверхности пластинки, принимают от нее электроны и, переходя в нейтральное состояние, осаждаются. Через некоторое время устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости их осаждения на металле. На рис. 8.5 ион металла для простоты изображен негидратированным.
При контакте металла с водой или раствором соли металла жидкая и кристаллическая фазы приобретают на границе раздела противоположные заряды, в результате чего на межфазной границе образуется двойной электрический слой и возникает разность электрических потенциалов. Равновесие между металлом, жидкой фазой и двойным электрическим слоем полностью подчиняется всем положениям смещения химического равновесия. На рис. 8.5 двойной электрический слой изображен в виде двух плотных слоев электронов и катионов. В действительности каждый слой распространяется по обе стороны от места контакта металла с водой, и постепенно количество электронов и катионов в слоях понижается.
Равновесие между ионами раствора и металлом выражается уравнением
Cu 2+ (р-р) + 2е = Сu (кр.).
В уравнении равновесия электрохимической реакции, принимаемые электроны обычно записывают в левой части уравнения, перед знаком равенства. Соблюдение этого правила крайне важно, т.к. по таким уравнениям можно предсказывать направление электродных процессов.
Посмотрите на написанное уравнение – это уравнение окислительно-востановительной реакции! Поэтому все, что вы знаете об окислительно-восстановительных реакциях, следует использовать и для этих реакций.
Система, состоящая из проводника электрического тока и раствора (или расплава) электролита, в который погружен проводник, называется электродом. Так, медная пластинка, погруженная в водный раствор сульфата меди CuSО4, – типичный электрод.
Состояние равновесия электродного процесса определяется электродным потенциалом Е, представляющим собой разность потенциалов двух фаз на границе металл–электролит. Непосредственно измерить абсолютное значение электродного потенциала нельзя, но его можно сравнить с потенциалами других электродов (при стандартных условиях).
На медном электроде (медь–раствор с концентрацией ионов Cu 2+ , равной 1 моль/л) при разомкнутой гальванической цепи устанавливается равновесие, характеризующееся стандартным электродным потенциалом, равным 0,34. В:
Cu 2+ + 2e = Cu , E = 0,34 В.
Положительное значение потенциала этой электродной реакции означает, что реакция может проходить самопроизвольно (при наличии второго электрода, поставляющего электроны), т.е. ионы меди могут переходить в металлическую медь (медь будет осаждаться на электроде).
Хотя, разумеется, знак заряда электрода не зависит от способа написания уравнения электродного процесса, при его записи в противоположном направлении знак потенциала необходимо изменить на противоположный.
Стандартный потенциал цинкового электрода равен –0,76 В:
Zn 2+ + 2e = Zn, E = –0,76 B.
Отрицательное значение электродного потенциала цинка свидетельствует о невозможности прохождения реакции по этому уравнению. Самопроизвольно проходит процесс в противоположном направлении:
Zn – 2e = Zn 2+ , E = 0,76 B.
Уравнение этой реакции показывает, что цинк может «растворяться» в кислотах, или, более правильно, цинк реагирует с ионами водорода и образуются ионы цинка и газообразный водород.
Если расположить стандартные электродные потенциалы металлов в порядке уменьшения их отрицательного значения и повышения положительного, т.е. в порядке возрастания их электродных потенциалов, то получится ряд стандартных электродных потенциалов.
Чем более отрицателен (менее положителен) электродный потенциал, тем выше способность металла посылать ионы в раствор и тем сильнее проявляет себя металл как восстановитель. Металлический литий – самый сильный восстановитель среди металлов, а металлическое золото в данном перечне уравнений реакций – самый слабый восстановитель.
Все металлы, расположенные в этом списке выше водорода, т.е. имеющие отрицательное значение электродного потенциала, растворяются в растворах кислот с концентрацией ионов водорода
1 моль/л. Если электродный потенциал металла имеет положительный знак, то металл не растворяется в растворах кислот с Эти правила можно не запоминать, лучше запомнить общий подход (уже вам известный) к определению направления окислительно-восстановительной реакции в гальваническом элементе.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Гальвани-потенциал на границе двух металлов
Электродный потенциал представляет собой сложную величину, определяемую тремя отдельными скачками потенциала: скачком потенциала на границе металл электрода – платина и скачками потенциала на границах металл – раствор и платина – раствор. Теория возникновения электродного потенциала должна основываться поэтому на определённых представлениях о природе как скачка потенциала между двумя металлами, так и скачка потенциала на границе металл – раствор.
Рассмотрим вначале гальвани-потенциал g1,2 между двумя металлами. Соотношение, существующее между вольта- и гальвани-потенциалами, можно найти, используя правило, по которому сумма всех работ переноса элементарного заряда по замкнутому контуру равна нулю (см. рис. 18):
| Рис. 18. Связь между вольта- и гальвани-потенциалами на границе двух металлов |
Работа переноса частицы i с зарядом zF из одной фазы в другую определяется, как известно, разностью электрохимических потенциалов этой заряженной частицы в двух фазах:
В условиях равновесия – = 0 и
Если обе фазы – металлы, то в обмене между ними участвуют электроны, заряд которых zi F = – F. Для этого случая можно написать
Уравнение (6) могло бы служить основой для расчёта гальвани-потенциала, если бы были известны химические потенциалы электронов в двух фазах. Однако, как уже отмечалось, определить для заряженных частиц изменение только химических потенциалов невозможно, поскольку при их переносе из одной фазы в другую одновременно с химической работой совершается также и электрическая.
Получим выражение для вольта-потенциала между фазами 1 и 2: подставим значение g1,2 из уравнения (3) в уравнение (4):
Для частного случая контакта двух металлов
(wе – работа выхода электрона из металла).
Работа выхода электрона доступна непосредственному экспериментальному определению, и поэтому при помощи уравнения (8) можно рассчитать величину вольта-потенциала. Чем меньше работа выхода электрона из данного металла, тем при данной температуре большее число электронов может покинуть металл и перейти в вакуум и тем положительнее будет заряд обкладки дипольного слоя в металле. Если сблизить два металла с различными работами выхода, то электроны будут переходить от металла с меньшей работой выхода к металлу с большей. В результате этого первый металл зарядится положительно, а второй – отрицательно. Например, для пары Cu½Zn VCu, Zn = 0,3 В, тогда как ЭДС системы Zn½ZnSO4½CuSO4½Cu равна 1,11 В. Таким образом, потенциал V1, 2 составляет заметную долю обратимой ЭДС электрохимической системы.
Гальвани-потенциал на границе металл – раствор
Осмотическая теория Нернста
Первая количественная теория электродного потенциала была предложена Нернстом в 1890 г.; она получила название осмотической теории электродного потенциала и ЭДС. Теория Нернста сыграла большую роль в развитии электрохимии. Она основана на следующих принципах:
1. Электродный потенциал определяется скачком потенциала на границе металл – раствор, а ЭДС электрохимической системы представляет собой разность двух таких скачков потенциала.
2. Электродный потенциал возникает только в результате обмена ионами между металлом и раствором.
3. Движущими силами обмена ионами являются осмотическое давление растворённого вещества p и электролитическая упругость растворения металла Р.
Первый принцип нельзя считать верным, поскольку скачок потенциала на границе металл – раствор в общем случае не совпадает с электродным потенциалом, а представляет собой лишь его некоторую часть. Ошибочно также предположение, что ЭДС электрохимической системы всегда равна разности двух гальвани-потенциалов. Она определяется не двумя, а тремя скачками потенциала, включая потенциал, возникающий в месте контакта двух разных металлов. Таким образом, теорию Нернста нельзя считать теорией электродного потенциала и ЭДС. Это – теория гальвани-потенциала металл – раствор, то есть того слагаемого электродного потенциала и ЭДС, которое зависит от состава раствора.
Второй принцип находится в согласии с вероятным механизмом возникновения равновесного скачка потенциала на границе металл – раствор, хотя обмен ионами не исчерпывает всех возможных причин, приводящих к образованию скачка потенциала на этой границе. Справедливость предположения об обмене ионами между металлом и раствором в ходе установления равновесного потенциала (и при его достижении) была доказана впоследствии многими исследованиями с помощью меченых атомов. При помощи этого, а также ряда других методов удалось не только подтвердить сам факт обмена ионами, но и количественно оценить его. Поскольку в обмене участвуют заряженные частицы, то его интенсивность можно выразить в токовых единицах и охарактеризовать токами обмена Iо . Токи обмена относят к 1 см 2 (1 м 2 ) поверхности раздела электрод – раствор; они служат кинетической характеристикой равновесия между электродом и раствором при равновесном значении электродного потенциала и обозначаются io . Интенсивность обмена зависит от материала электрода, природы реакции и изменяется в широких пределах.
По третьему принципу осмотической теории Нернста токи обмена возникают в результате существования сил осмотического давления раствора и электролитической упругости растворения металла.
С помощью указанных принципов Нернст получил качественную картину возникновения скачка потенциала металл – раствор и вывел количественную зависимость величины этого скачка от состава раствора. Полученное им уравнение имеет вид
или при использовании соотношения между осмотическим давлением и концентрацией соответствующих ионов (M z + ) p = RTc, вытекающего из теории идеальных растворов,
(Е o L|M – нормальный потенциал Нернста). Уравнение (9) называется формулой Нернста для электродного потенциала. Оно внешне не отличается от общего термодинамического уравнения для электродного потенциала применительно к частному случаю электродов 1-го рода. Нормальный потенциал Нернста можно отождествить со стандартным потенциалом, если вместо концентраций в уравнение (9) подставить активности.
По теории Нернста нормальный потенциал является простой функцией электролитической упругости растворения металла. Из теории Нернста следует вывод о независимости стандартных электродных потенциалов от природы растворителя, поскольку величина Р, определяющая нормальный, или стандартный, потенциал электрода, не является функцией свойств растворителя, а зависит лишь от свойств металла. Однако ни опыт, ни теоретические соображения не согласуются с подобного рода представлениями, что также приводит к необходимости пересмотра физических предпосылок теории Нернста.
43 Возникновение скачка потенциала на границе раздела металл-раствор.
Если пластину любого металла погрузить в воду или раствор электролита, содержащий ионы этого металла, то небольшая часть металла перейдет в раствор, в форме положительно заряженных ионов, а сама пластина , концентрируя на себе избыток свободных электронов , приобретает отрицательный заряд. Такому переходу содействует связывание ионов металла с молекулами воды (растворителя).В итоге устанавливается равновесие
Me 2+ + m H2O ↔ Me 2+ · m H2O
Me + m H2O ↔ Me 2+ · m H2O +2e
Положительно заряженные ионы Me +2 , перешедшие в раствор, концентрируются у поверхности пластины, приобретающей отрицательный заряд, в результате возникает двойной электрический слой (ДЭС) , обусловливающий резкий скачок электрического потенциала на границе металл - раствор электролита.
Эту разность электрических потенциалов или скачок потенциала на границе металл-раствор электролита называют электродным потенциалом.
Величина электродного потенциала зависит от природы металла, концентрации, точнее активности ионов металла в растворе и температуры.
Математически эта зависимость выражается уравнением В.Г.Нернста (1888).
EMe = E 0 Me + (R ∙T/n ·F) / ln аMe n+ ,
а в случае разбавленных растворов полностью диссоциирующих солей данного металла
ЕMe = E 0 Me + (R∙T/n · F) / ln [Me n+ ],
где E 0 Me- стандартный электродный потенциал
R- универсальная газовая постоянная
F- постоянная Фарадея
n - заряд иона металла
аMe, n + , [ Me n + ] – активность или концентрация ионов металла (моль\л)
После перехода от натурального логарифма к десятичному и подстановки значений
F=96500 Кл, точнее 96487 Кл уравнение примет вид EMe = E 0 Me + 0,0592/n ·lg [Me n+ ]
44 Возникновение скачка потенциала на границе раздела фаз вызывается различными причинами, зависящими от природы граничащих фаз. Металлы, имеющие отрицательные значения электродных потенциалов , стоящие левее водорода, способны его вытеснять из разбавленных растворов кислот. Чем меньше электродный потенциал металла Е 0 ,тем легче он окисляется и труднее восстанавливается из своих ионов. Чем меньше алгебраическая величина потенциала, тем выше восстановительная способность этого металла и тем ниже окислительная способность его ионов (в ряду стандартных электродных потенциалов).
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов, отвечающих полуреакции восстановления катиона металла Me n+ : Me n+ + nē → Me.
Металлы, потенциал к-рых менее положительный, чем у кислородного электрода, термодинамически неустойчивы в контакте с О2 (или воздухом) и водой. Поэтому электрохимический ряд напряжений служит для ориентировочных оценок скорости электрохим. коррозии в водных р-рах при обычных температурах, а также для выбора безопасных контактных пар (гальванич. пар) разнородных металлов. Если металл электроотрицательнее, чем Н2, то может идти активный коррозионный процесс.
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакцияхв водных растворах.
Возникновение скачка потенциала на границе фаз
Скачки потенциала возникают на границах: 1) Ме1 – Ме2 - контактный потенциал; 2) Ме – раствор – электрохимический потенциал; 3) раствор 1 – раствор 2 – диффузионный потенциал.
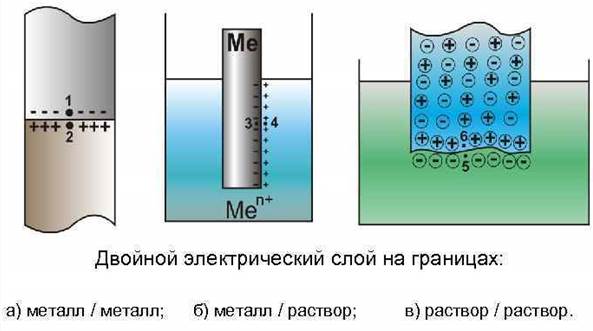
Между электродом и контактирующим с ним раствором электролита возникает разность электрических потенциалов (скачок потенциала), называемая электродным потенциалом. Возникновение его связано с протеканием на границе Ме – раствор равновесных электрохимических реакций.
Причины возникновения электрохимического потенциала:
Энергию, необходимую для отрыва иона от металла, обозначим UМе, выделяющуюся при сольватации (гидратации) иона в растворе через Uсольв. Энергия UМе зависит только от природы Ме, энергия Uсольв зависит от природы ионов, их активности в растворе и от природы растворителя.
Если металлическую пластинку (электрод) опустить в раствор своей соли, то в зависимости от соотношения UМе / Uсольв возможны различные начальные электродные процессы.
а) ТД условие образования отрицательного заряда на поверхности Ме:
энергия Uсольв > UМе; хим .потенциал μ Ме > μ раствора
ион переходит из Ме в раствор, Ме заряжается отрицательно
б) ТД условие образования положительного заряда на поверхности Ме:
ион переходит из раствора в Ме, Ме заряжается положительно.
По мере протекания рассматриваемых процессов на электроде будет изменяться соотношения UМе / Uсольв , и наступит такой момент, когда UМе = Uсольв, скорости обоих процессов выравниваются, устанавливается равновесие. Скачок потенциала – электродный потенциал достигает равновесного значения.
Отдавать свои катионы в раствор и заряжаться отрицательно способны только химически активные Ме, например, цинк, алюминий, железо. У малоактивных Ме, таких как медь, ртуть, серебро, ионы могут переходить в раствор в незначительных количествах. Поэтому при контакте этих Ме с растворами их солей преимущественно идет осаждение катионов из раствора на Ме. В результате Ме заряжается положительно, а раствор, в котором остались анионы, отрицательно.
Некоторые металлы (например, золото, платина, медь, серебро и др.) обладают настолько прочными кристаллическими решетками, что катионы из нее почти не могут выйти и перейти в раствор. Поэтому они практически не имеют собственного скачка потенциала. Но поверхность таких металлов может адсорбировать многие другие вещества, которые способны окисляться или восстанавливаться. Такие электроды (металлы) в этом случае называют инертными, а потенциал их определяется равновесием между окисленной и восстановленной формой веществ адсорбированных на их поверхности.
При условной записи электродов границу проводников I и II рода обозначают вертикальной чертой. Например, для медного электрода (медная пластина, опущенная в раствор соли меди) условная запись имеет вид:
Вертикальная линия характеризует поверхность раздела между 2-мя фазами; слева указываются ионы, находящиеся в растворе – окисленная форма; справа – электродный материал – восстановленная форма.
Измерить абсолютное значение электродного потенциала, возникающего на границе металл – раствор, невозможно, так как для подключения измерительного прибора необходим второй металлический электрод, на котором при погружении в раствор сразу же образуется свой собственный двойной электрический слой, т. е. скачок потенциала. В этом случае измеряют только относительную величину потенциала по отношению к электроду, принятому за стандарт (электрод сравнения), при этом будет измерена разность потенциалов двух электродов, называемая электродвижущей силой (ЭДС) цепи.
Таким образом, электродным потенциалом называют ЭДС электрохимической цепи, составленной из стандартного и исследуемого электрода.
Обычно в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого условно принят за нуль при всех температурах. Водородный электрод представляет платиновую пластину, покрытую тончайшим порошком платины (платиновой чернью), которая опущена в раствор с активностью ионов водорода ан+ = 1 (обычно 1 М раствор H2SO4) и омывается током чистого Н2 при нормальном давлении (101325 Па).
Электрохимическая схема стандартного электрода:
На водородном электроде протекает следующая реакция:
Н + + е → ½ Н2
Условным потенциалом электрода называют ЭДС гальванического элемента, составленного из исследуемого электрода и стандартного водородного электрода при соблюдении условий:
-диффузионный потенциал отсутствует;
-водородный электрод размещается слева, исследуемый – справа;
-полурекция на исследуемом электроде записывается как реакция восстановления (такая реакция называемая потенциалопределяющей).
Условный потенциал электрода называют стандартным условным потенциалом, если активности всех участников электродной полурекции равны единице.
Значения стандартных электродных потенциалов (Е о ) являются константой, свойственной каждому электроду, и приведено в справочных таблицах физико-химических величин при 25°С.
Относительно потенциала стандартного водородного электрода, принятого за нуль, все стандартные потенциалы металлических электродов будут или положительнее, или отрицательнее его.
Если расположить Ме в порядке возрастания значений их стандартных потенциалов, то получится ряд стандартных электродных потенциалов, или электрохимический ряд напряжений:
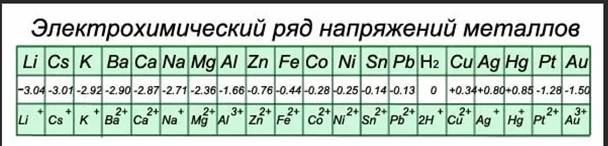
На практике водородный электрод используется редко, вместо него используют другие электроды сравнения,потенциалы которых предварительно точно определяют относительно водородного электрода.
Читайте также:
