Ванна для получения чистых металлов путем электролиза
Обновлено: 01.05.2024
Цели урока. Показать практическое применение электролиза для получения щелочных металлов, алюминия, очистки меди от примесей, а также для получения золота и серебра из анодного ила; решить расчетные задачи на нахождение одной из величин: времени, силы тока и количества вещества, образующегося или израсходованного в электролизной реакции.
Получение щелочных металлов
А.В.Вольта считал, что причиной возникновения электрического тока в гальваническом элементе является контакт двух разнородных металлов, а в них самих никаких изменений не происходит. Ясно, что в этом случае элемент должен работать вечно. На практике вечного элемента никогда не получалось, любой из них рано или поздно прекращал работу.
Другие исследователи заметили, что в работающем гальваническом элементе протекают химические процессы. В частности, поверхность цинка в соляном растворе при работе вольтова столба подвергается коррозии. Впоследствии было доказано, что химические реакции на границе проводников первого и второго рода, т.е. электродов и растворов, являются источником возникновения электрической энергии.
Таким образом, гальванический элемент – это устройство, в котором химическая энергия превращается в электрическую. Закон сохранения энергии выполняется и в этом случае: после завершения химических реакций ток прекращается.
Сразу же после создания химического источника электрической энергии стала бурно развиваться новая наука – электрохимия. В лабораториях разных стран ученые собирали гальванические батареи, пропускали ток через растворы различных веществ и с интересом наблюдали, что происходит в каждом случае. На этом пути было сделано множество важных экспериментальных открытий: установлено, например, что на электродах, опущенных в обычную речную воду, выделяются водород и кислород, а водные растворы солей щелочных металлов разлагаются с выделением водорода и образованием щелочей на одном полюсе и выделением кислорода и образованием кислот – на другом.
Г.Дэви
(1778–1829)
Пожалуй, самым замечательным результатом электрохимических работ того времени было проведенное английским химиком Гемфри Дэви разложение расплавов щелочей и получение новых элементов – калия и натрия. До этого никому никаким способом не удавалось разложить на элементы гидроксиды калия и натрия. Позже Дэви получил электролизом барий, кальций, стронций, магний, бор.
Кстати, открытие натрия стоило ему очень дорого: образовавшийся при электролизе металлический натрий в виде мелких шариков поднялся на поверхность расплава и воспламенился. Произошел взрыв. Осколки стекла попали ученому в глаза. Несмотря на то, что на один глаз Дэви ослеп, его энтузиазм и преданность науке не уменьшились. Он сделал еще много открытий.
Сейчас натрий получают электролизом расплава хлорида натрия в специальных электролитических устройствах – электролизерах. На рис. 1 представлен электролизер Даунса. Он сконструирован таким образом, чтобы натрий и хлор не могли вступать в контакт друг с другом и снова образовывать хлорид натрия. Предусмотрено также, чтобы натрий не вступал в контакт с воздухом и не образовывал оксид. К хлориду натрия добавляют хлорид кальция, что позволяет понизить его температуру плавления приблизительно до 600 °С (для чистого хлорида натрия она равна ~800 °С).
Рис. 1. Электролизер Даунса
для промышленного получения натрия
История получения алюминия
Приоритет открытия и получения металлического алюминия, который одно время называли «серебром из глины», принадлежит датскому физику Хансу Кристиану Эрстеду (1777–1851), известному больше своими работами по электромагнетизму. Чтобы получить алюминий, Эрстед нагревал безводный хлорид алюминия с амальгамой натрия (раствором натрия в ртути):
AlCl3 + 3Na(Hg) = Al(Hg) + 3NaCl.
Продукты реакции он обработал водой для растворения хлорида натрия, а из остатка, содержащего амальгаму алюминия, удалил нагреванием ртуть. Так в 1825 г. впервые был получен алюминий. Название «Aluminium» дал новому металлу английский химик и физик Дэви. «Alumen» на латинском языке означает квасцы (сульфат калия-алюминия), известные с давних пор и имеющие состав
KAl(SO4)2•12Н2О.
В 1827 г. немецкому химику Ф.Велеру (1800–1882) также удалось выделить алюминий, используя реакцию восстановления гексафтороалюмината натрия металлическим калием:
Алюминий в этом случае легко отделяется от фторидов калия и натрия, легко растворимых в воде.
Все это были лабораторные способы получения очень небольших количеств алюминия.
В 1845 г. два химика независимо друг от друга – немец Р.В.Бунзен (1811–1899) и француз А.Э.Сент-Клер Девилль (1818–1881) – разработали первый промышленный метод получения алюминия, основанный на восстановлении расплава тетрахлороалюмината натрия:
Nа[АlCl4] + 3Na = Аl + 4NaCl.
На Парижской всемирной выставке в 1855 г. демонстрировалось «серебро Девилля» – слиток алюминия ценой 2400 марок за 1 кг (90 долларов за фунт – по другим источникам). Алюминий стоил дороже, чем золото и серебро. Известно, что богатые люди того времени щеголяли алюминиевой столовой посудой.
Наполеон III (племянник Наполеона I), узнав об алюминии, задумал снабдить своих солдат нагрудниками и касками, сделанными из этого металла. По его приказу Сент-Клер Девиллю были выделены большие средства для получения нужного количества алюминия. Однако Наполеону III пришлось ограничить свое желание изготовлением алюминиевых кирас только для небольшой группы его личной охраны.
Способ Сент-Клер Девилля все же имел лабораторные масштабы. Современный промышленный метод получения алюминия, основанный на электролизе расплава Nа3[АlF6], был разработан американцем Ч.М.Холлом.
Ч.М.Холл (1863–1914)
Холл приступил к исследованию проблемы восстановления алюминия примерно в 1885 г., после того как узнал от одного профессора о трудностях, связанных с восстановлением руд. Когда Холл начал свои исследования, ему шел всего 21-й год. В дровяном сарае неподалеку от своего дома он оснастил лабораторию самодельным и взятым напрокат оборудованием. Приблизительно через год ему удалось решить проблему. «Профессор, я получил его!» – с таким криком вбежал к американскому химику Иветту в 1886 г. молодой инженер Холл, держа на протянутой ладони 12 маленьких шариков алюминия – первого алюминия, полученного электрохимическим методом.
Почти одновременно аналогичное открытие сделал во Франции Поль Эру, которому в то время было столько же лет, сколько и Холлу. Суть открытия заключалась в том, что Al2O3 растворяется в криолите (редком минерале, который добывали из небольших залежей в Гренландии), образуя проводящий раствор.
Схема из патента Ч.М.Холла
на получение алюминия
Открытия Холла и Эру сделали возможным промышленное получение алюминия в больших масштабах. Алюминий стал широко распространенным и всем известным металлом. Цена на него в конце концов упала до 15 центов за фунт. Даже сейчас алюминий стоит не дороже 80 центов за фунт.
Суть метода Холла
Сырьем служит оксид алюминия, добываемый в виде минерала боксита. После предварительной очистки Al2O3 растворяют в расплавленном криолите Nа3[АlF6], в результате чего образуется раствор, проводящий электрический ток. Расплавленную смесь электролизуют при помощи угольных электродов, как показано на рис. 2.
Рис. 2.
Обычный электролизер для получения алюминия по методу Холла.
Поскольку расплав алюминия имеет бо'льшую плотность,
чем расплав смеси Nа3[АlF6] и Al2O3, металл скапливается
в нижней части электролизера
На электродах происходят реакции:
на аноде: С (тв.) + 2О 2– = СO2 (г.) + 4e,
на катоде: 3е + Al 3+ Al (ж.).
Электролиз с активными электродами
В электролитическом процессе получения алюминия по методу Холла анод вступает в реакцию:
С (тв.) + 2O 2– = CO2 (г.) + 4e.
Следовательно, электродные реакции включают окисление и восстановление не только растворителя и растворенных веществ, но и самих электродов.
При электролизе водных растворов на металлических электродах происходит окисление электрода, если его окислительный потенциал выше потенциала воды. Например, медь окисляется легче, чем вода:
Cu (тв.) = Cu 2+ (водн.) + 2е,
К одному из многих интересных применений таких электролизных процессов относится рафинирование, или очистка, металлической меди. В промышленности соединения меди восстанавливают с помощью химических восстановителей. Например, для восстановления сульфида меди Сu2S через расплавленную руду продувают воздух:
Полученная таким способом медь называется губчатой; она имеет чистоту приблизительно 99% и содержит примеси железа, цинка, золота, серебра и других веществ. Некоторые примеси значительно снижают электропроводность металлической меди. Поэтому медь, идущую на изготовление электрических проводов, подвергают дальнейшей очистке.
Такую очистку проводят путем электролиза. Губчатую медь помещают в электролизер и делают анодом (рис. 3).
Рис. 3. Рафинирование металлической меди
Тонкие листы чистой меди играют роль катода. Электролитом служит водная смесь серной кислоты и сульфата меди. При пропускании электрического тока медь растворяется на аноде и осаждается на катоде:
на аноде: Cu (тв.) = Cu 2+ (водн.) + 2е,
на катоде: Cu 2+ (водн.) + 2е = Cu (тв.).
Такие металлы, как цинк и железо, которые окисляются легче, чем медь, вместе с ней растворяются на аноде. Поскольку они восстанавливаются труднее, чем медь, тщательно регулируя напряжение электролитической ячейки, можно предотвратить их осаждение на катоде.
Такие металлы, как серебро и золото, которые окисляются труднее, чем медь, не растворяются на аноде. По мере растворения меди они падают с анода и скапливаются под ним на дне ванны в виде ила. Анодный ил периодически извлекают из электролитической ванны в процессе ее чистки. Он служит важным источником получения золота и серебра. Таким способом в США получают бо'льшую часть золота.
Другим интересным применением электролиза является покрытие металлов. Если, например, в только что описанной ванне вместо меди сделать катодом какой-либо другой металл, то в процессе электролиза на нем будет образовываться медное покрытие. Металл, который наносят на другие поверхности, делают анодом (рис. 4) (см. с. 44). Электропокрытие защищает различные предметы от коррозии и улучшает их внешний вид. Многие наружные части автомобилей, например бамперы и дверные ручки, электролитически покрывают хромом.
Рис. 4.
Электролитическое
покрытие изделия серебром.
Покрываемое изделие – катод, а металл,
наносимый в качестве покрытия, – анод
Решение расчетных задач по теме «Электролиз»
Задача 1. Вычислите массу алюминия, полученного за 1 ч при электролизе расплавленного AlCl3 током силой 10А.
По закону Фарадея:
где m – масса образовавшегося вещества (г),
M – молярная масса вещества (г/моль),
n – количество принимаемых или отдаваемых электронов,
I – сила тока (А),
t – продолжительность процесса (с),
F – постоянная Фарадея (F = 96 500 Kл/моль = 26,8 А ч/моль).
Al 3+ + 3e Al 0 (n = 3).
Ответ. m(Al) = 3,36 г.
Задача 2. Через раствор, содержащий Cu 2+ , в течение 5 мин пропускают ток постоянной силы. За это время масса катода увеличивается на 1,24 г.
Какова сила пропускаемого тока?
В данном случае нас интересует полуреакция:
Cu 2+ + 2e = Cu (n = 2).
Ответ. I = 12,6 А.
Домашнее задание. Решить задачи.
1. Сколько минут потребуется для осаждения 10 г металлического никеля из раствора сульфата никеля(II) при силе тока 1,5 А?
2. Сколько литров газообразного Cl2 (н.у.) выделится при электролизе водного раствора NaCl током силой 2 А за время 1 ч?
Л и т е р а т у р а
Фримантл М. Химия в действии. М.: Мир, 1991; Браун Т., Лемей Г.Ю. Химия в центре наук. М.: Мир, 1983; Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения. М.: Химия, 1995; Энциклопедия для детей. Т. 17. Химия. М.: Аванта +, 2003.
Ванна для получения чистых металлов путем электролиза
При выполнении заданий с кратким ответом впишите в поле для ответа цифру, которая соответствует номеру правильного ответа, или число, слово, последовательность букв (слов) или цифр. Ответ следует записывать без пробелов и каких-либо дополнительных символов. Дробную часть отделяйте от целой десятичной запятой. Единицы измерений писать не нужно.
Если вариант задан учителем, вы можете вписать или загрузить в систему ответы к заданиям с развернутым ответом. Учитель увидит результаты выполнения заданий с кратким ответом и сможет оценить загруженные ответы к заданиям с развернутым ответом. Выставленные учителем баллы отобразятся в вашей статистике. Полное правильное решение каждой из задач с развернутом решением должно включать законы и формулы, применение которых необходимо и достаточно для решения задачи, а также математические преобразования расчёты с численным ответом и при необходимости рисунок, поясняющий решение.
Установите соответствие между физическими величинами и единицами этих величин в системе СИ.
1) килограмм (1 кг)
3) ньютон-метр (1 Н · м)
4) ньютон на метр (1 Н/м)
Установите соответствие между формулами для расчёта физических величин и названиями этих величин. В формулах использованы обозначения: — частота колебаний; υ — скорость распространения волны. К каждой позиции первого столбца подберите соответствующую позицию второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
2) амплитуда колебаний
3) период колебаний
4) число колебаний за некоторый промежуток времени
В стальной кастрюле, поставленной на электрическую плитку, нагревается вода. На рисунке представлены графики зависимости количества полученной теплоты Q от времени t для кастрюли (график 1) и для воды (график 2). Потери теплоты в окружающую среду пренебрежимо малы. Масса кастрюли
1) больше массы воды
2) меньше массы воды
3) равна массе воды
4) может быть как больше, так и меньше массы воды
Прочитайте текст и вставьте на места пропусков слова (словосочетания) из приведённого списка.
Известно, что по мере спуска в недра Земли температура постепенно ________ (А). Это обстоятельство и сам факт извержения вулканами ________ (Б) лавы невольно наталкивали на мысль, что на определенных глубинах вещество земного шара находится в расплавленном состоянии. Однако на самом деле всё не так просто. Одновременно с повышением температуры растет давление в земных глубинах. А ведь чем больше давление, тем ________ (В) температура плавления (см. рис.).
Согласно современным представлениям большая часть земных недр сохраняет ________ (Г) состояние. Однако вещество астеносферы (оболочка Земли от 100 км до 300 км в глубину) находится в почти расплавленном состоянии. Так называют твёрдое состояние, которое легко переходит в жидкое (расплавленное) при небольшом повышении температуры (процесс 1) или понижении давления (процесс 2).
Источником первичных расплавов магмы является астеносфера. Если в каком-то районе снижается давление (например, при смещении участков литосферы), то твёрдое вещество астеносферы тотчас превращается в жидкий расплав, то есть в магму.
Список слов и словосочетаний:
Запишите в таблицу выбранные цифры под соответствующими буквами. Цифры могут повторяться.
Сплошной кубик, имеющий плотность ρк и длину ребра a, опустили в жидкость с плотностью ρж = 998 кг/м 3 (см. рис.). Найдите давление, оказываемое жидкостью на верхнюю грань кубика, если h1 = 0,1 м.
По международному соглашению длина волны, на которой суда передают сигнал бедствия SOS, равна 600 м. Чему равна частота передаваемого сигнала? Ответ дайте в кГц.
При нагревании куска металла массой 200 г от 20 °С до 60 °С его внутренняя энергия увеличилась на 2400 Дж. Какова удельная теплоёмкость металла? Ответ запишите в джоулях на килограмм на градус Цельсия.
На рисунке изображены два одинаковых электрометра. Шар электрометра А заряжен отрицательно и показывает 3 единиц заряда, шар электрометра Б заряжен положительно и показывает 2 единицы заряда. Каковы будут показания электрометров, если их шары соединить тонкой алюминиевой проволокой?
Чему равно общее сопротивление участка цепи, изображённого на рисунке, если R1 = 2 Ом, R2 = 4 Ом, R3 = 10 Ом, R4 = 10 Ом?
В результате бомбардировки изотопа лития α-частицами образуется изотоп бора: Чему равно массовое число частицы Х?
В инерциальной системе отсчёта брусок, которому сообщили начальную скорость скользит вверх по наклонной плоскости (см. рис.). Как изменяются по мере подъёма скорость бруска и его полная механическая энергия? Для каждой величины определите соответствующий характер изменения:
3) не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
| Скорость бруска | Полная механическая энергия бруска |
С помощью собирающей линзы получено изображение A1B1 предмета AB (см. рис.). Как изменится фокусное расстояние линзы, а также яркость изображения, если закрыть чёрной бумагой нижнюю половину линзы?
Для каждой величины определите соответствующий характер изменения:
| Фокусное расстояние линзы | Яркость изображения предмета |
На рисунке представлены графики зависимости проекции скорости Vх от времени t для четырёх тел, движущихся вдоль оси Ох. Используя рисунок, выберите из предложенного перечня два верных утверждения. Укажите их номера.
1) Тело 1 движется с ускорением.
2) В момент времени, соответствующий точке Б на графике, скорость тела 2 равна нулю.
3) Тело 4 находится в состоянии покоя.
4) Точка А на графике соответствует встрече тел 1 и 3.
5) От начала отсчёта до момента времени, соответствующего точке В на графике, тело 2 прошло больший путь по сравнению с телом 3.
В справочнике физических свойств различных материалов представлена следующая таблица:
сопротивление
(при 20 °С),
Ом · мм 2 /м
Используя данные таблицы, выберите из предложенного перечня два верных утверждения. Укажите их номера.
1) При равных размерах проводник из алюминия будет иметь меньшую массу по сравнению с проводником из меди.
2) Проводники из константана и никелина при одинаковых размерах будут иметь одинаковые электрические сопротивления.
3) При равных размерах проводник из серебра будет иметь наименьшую массу (среди веществ, указанных в таблице).
4) При замене спирали электроплитки с нихромовой на константановую такого же размера электрическое сопротивление спирали уменьшится.
5) При равной длине проводник из железа с площадью поперечного сечения 4 мм 2 будет иметь такое же электрическое сопротивление, что и проводник из никелина с площадью поперечного сечения 1 мм 2 .
Необходимо проверить гипотезу о том, что период колебаний математического маятника не зависит от массы груза. Какую пару грузов и нитей следует выбрать для проверки этой гипотезы?
| № | Груз | Масса | Длина нити |
|---|---|---|---|
| 1 | Груз 1 | m1 | 50 см |
| 2 | Груз 2 | m1 | 100 см |
| 3 | Груз 3 | m2 | 50 см |
| 4 | Груз 4 | m3 | 75 см |
Учитель на уроке, используя палочку и два лоскута одной и той же ткани, последовательно провёл опыты по электризации. Первый опыт показал, что после трения лоскутков ткани о палочку наблюдается взаимное отталкивание лоскутков. Второй опыт показал, что после трения палочки о ткань наблюдается взаимное притяжение между палочкой и тканью.
Выберите из предложенного списка два утверждения, которые соответствуют результатам проведённых экспериментальных наблюдений. Укажите их номера.
1) И палочка, и ткань электризуются при трении.
2) При трении палочка и ткань приобретают разные по знаку заряды.
3) При трении электризуется только ткань.
4) При трении ткань приобретает положительный заряд.
5) Электризация связана с перемещением протонов с одного тела на другое.
Используя штатив лабораторный с муфтой и лапкой, пружину, грузы массой (100 ± 2) г, линейку длиной 300 мм с миллиметровыми делениями, соберите установку для определения жёсткости пружины. Подвесьте пружину за один из концов к штативу. Прикрепив к свободному концу пружины груз, измерьте удлинение пружины. Абсолютная погрешность измерения длины равна цене деления.
1) сделайте рисунок экспериментальной установки;
2) запишите формулу для определения силы упругости;
3) запишите условие равновесия груза на пружине;
4) укажите результаты измерения удлинения пружины после прикрепления к ней одного, двух и трёх грузов с учётом абсолютных погрешностей измерений;
5) определите жёсткость пружины и оцените погрешность её измерения.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
Установите соответствие между техническими устройствами и физическими явлениями, лежащими в основе принципа их действия. К каждой позиции первого столбца подберите соответствующую позицию из второго столбца.
А) ванна для получения чистых металлов путем электролиза
Б) электрический кипятильник
1) взаимодействие постоянных магнитов
2) действие магнитного поля на проводник с током
3) тепловое действие тока
4) химическое действие тока
Запишите в таблицу выбранные цифры под соответствующими буквами.
Выберите два верных утверждения, которые соответствуют содержанию текста. Запишите в ответ их номера.
1. Внутренняя энергия раствора по сравнению с суммой внутренней энергии кристалла и растворителя при той же температуре в большинстве случаев больше.
2. Внутренняя энергия раствора по сравнению с суммой внутренней энергии кристалла и растворителя при той же температуре в большинстве случаев такая же.
3. Внутренняя энергия раствора по сравнению с суммой внутренней энергии кристалла и растворителя при той же температуре в большинстве случаев пренебрежимо мала.
4. Ноги будут мерзнуть меньше на заснеженном тротуаре.
5. Ноги будут мерзнуть меньше на тротуаре, посыпанном солью.
Охлаждающие смеси
Возьмём в руки кусок сахара и коснёмся им поверхности кипятка. Кипяток втянется в сахар и дойдёт до наших пальцев. Однако мы не почувствуем ожога, как почувствовали бы, если бы вместо сахара был кусок ваты. Это наблюдение показывает, что растворение сахара сопровождается охлаждением раствора. Если бы мы хотели сохранить температуру раствора неизменной, то должны были бы подводить к раствору энергию. Отсюда следует, что при растворении сахара внутренняя энергия системы сахар-вода увеличивается.
То же самое происходит при растворении большинства других кристаллических веществ. Во всех подобных случаях внутренняя энергия раствора больше, чем внутренняя энергия взятых в отдельности кристалла и растворителя при той же температуре.
В примере с сахаром необходимое для его растворения количество теплоты отдаёт кипяток, охлаждение которого заметно даже по непосредственному ощущению.
Если растворение происходит в воде при комнатной температуре, то температура получившейся смеси в некоторых случаях может оказаться даже ниже 0 °С, хотя смесь и остаётся жидкой, поскольку температура застывания раствора может быть значительно ниже нуля. Этот эффект используют для получения сильно охлажденных смесей из снега и различных солей.
Снег, начиная таять при 0 °С, превращается в воду, в которой растворяется соль; несмотря на понижение температуры, сопровождающее растворение, получившаяся смесь не затвердевает. Снег, смешанный с этим раствором, продолжает таять, забирая энергию от раствора и, соответственно, охлаждая его. Процесс может продолжаться до тех пор, пока не будет достигнута температура замерзания полученного раствора. Смесь снега и поваренной соли в отношении 2 : 1 позволяет, таким образом, получить охлаждение до −21 °С; смесь снега с хлористым кальцием (СаСl2) в отношении 7 : 10 — до −50 °С.
Практическое применение электролиза
При прохождении через раствор или расплав электролита электрического тока, на электродах происходит выделение растворенных веществ или иных веществ, являющихся продуктами вторичных реакций на электродах. Этот физико-химический процесс и называется электролизом.

Суть электролиза
В создаваемом электродами электрическом поле, ионы в проводящей жидкости приходят в упорядоченное движение. Отрицательный электрод — это катод, положительный — анод.
К аноду устремляются отрицательные ионы, называемые анионами (ионы гидроксильной группы и кислотные остатки), а к катоду — положительные ионы, называемые катионами (ионы водорода, металлов, аммония и т. д.)
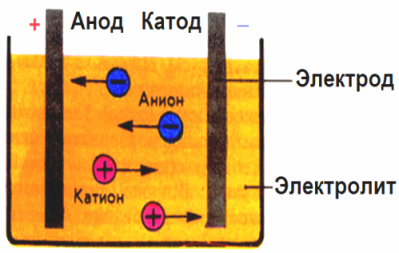
На электродах протекает окислительно-восстановительный процесс: на катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов), а на аноде — электрохимическое окисление частиц (атомов, молекул, анионов). Реакции диссоциации в электролите — это первичные реакции, а реакции, которые протекают непосредственно на электродах, называются вторичными.
Законы электролиза Фарадея
Разделение реакций электролиза на первичные и вторичные помогло Майклу Фарадею установить законы электролиза:
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах.
Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
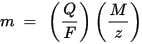
m — масса осаждённого на электроде вещества, Q — полный электрический заряд, прошедший через вещество F = 96 485,33(83) Кл·моль−1 — постоянная Фарадея, M — молярная масса вещества (Например, молярная масса воды H2O = 18 г/моль), z — валентное число ионов вещества (число электронов на один ион).
Заметим, что M/z — это эквивалентная масса осаждённого вещества. Для первого закона Фарадея M, F и z являются константами, так что чем больше величина Q, тем больше будет величина m. Для второго закона Фарадея Q, F и z являются константами, так что чем больше величина M/z (эквивалентная масса), тем больше будет величина m.
Электролиз широко применяется сегодня в промышленности и в технике. Например, именно электролиз служит одним из эффективнейших способов промышленного получения водорода, пероксида водорода, диоксида марганца, алюминия, натрия, магния, кальция и прочих веществ. Применяется электролиз для очистки сточных вод, в гальваностегии, в гальванопластике, наконец — в химических источниках тока. Но обо всем по порядку.
Получение чистых металлов из руд путем электролиза
Благодаря электролизу многие металлы извлекается из руд и подвергается дальнейшей переработке. Так, когда руду или обогащенную руду — концентрат — подвергают обработке реагентами, металл переходит в раствор, затем путем электроэкстракции металл выделяют из раствора. Чистый металл выделяется при этом на катоде. Таким путем получают цинк, медь, кадмий.
Электрорафинированию металлы подвергают для устранения примесей и чтобы перевести содержащиеся примеси в удобную для дальнейшей переработки форму. Металл, подлежащий очистке, отливают в виде пластин, и применяют эти пластины в качестве анодов при электролизе.
Когда ток проходит, металл анода растворяется, переходит в виде катионов в раствор, затем катионы разряжаются на катоде, и образуют осадок чистого металла. Примеси анода не растворяются - выпадают анодным шламом, или переходят в электролит, откуда непрерывно или периодически удаляются.
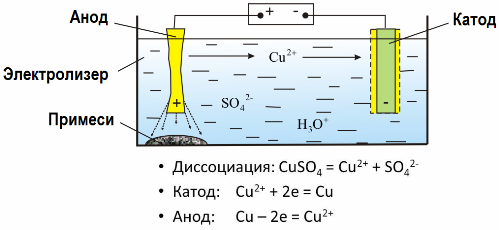
Рассмотрим в качестве примера электрорафинирование меди. Главный компонент раствора - сульфат меди — наиболее распространенная и дешевая соль этого металла. Раствор обладает низкой электрической проводимостью. Для ее увеличения в электролит добавляют серную кислоту.
Кроме того, в раствор вводят небольшие количества добавок, способствующих получению компактного осадка металла. Вообще, электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
Очистка сточных вод путем электролиза
Электролиз находит применение в очистке сточных вод (процессы электрокоагуляции, электроэкстракции и электрофлотации). Электрохимический метод очистки — один из наиболее часто применяемых. Для электролиза используют нерастворимые аноды (магнетит, оксид свинца, графит, марганец, которые наносят на титановую основу), или растворимые (алюминий, железо).
Такой метод применяют для выделения из воды токсичных органических и неорганических веществ. К примеру, медные трубы очищают от окалины раствором серной кислоты, и промышленные сточные воды приходится затем очищать путем электролиза с нерастворимым анодом. На катоде выделяется медь, которая снова может использоваться на том же предприятии.
Щелочные сточные воды очищают электролизом от цианистых соединений. С целью ускорения окисления цианидов, повышения электропроводности и экономии электроэнергии, к водам применяют добавку в виде хлорида натрия.
Электролиз проводят с графитовым анодом и стальным катодом. Цианиды разрушаются в ходе электрохимического окисления и хлором, который выделяется на аноде. Результативность такой очистки близка к 100%.
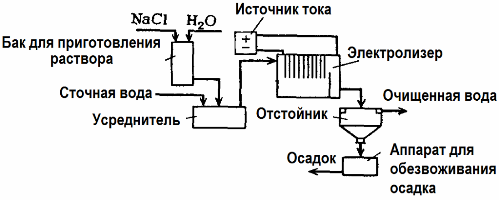
Кроме непосредственно электохимической очистки можно включить в процесс электролиза коагуляцию. Исключив добавки солей, электролиз проводят с растворимыми алюминиевыми или железными анодами. Тогда не только разрушаются загрязнители на аноде, но и растворяется сам анод. Образуются активные дисперсные соединения, которые коагулируют (сгущают) коллоидно-дисперсные загрязнения.
Этот метод эффективен при очистке сточных вод от жиров, нефтепродуктов, красителей, масел, радиоактивных веществ и т. д. Он называется электрокоагуляцией.
Гальваностегия
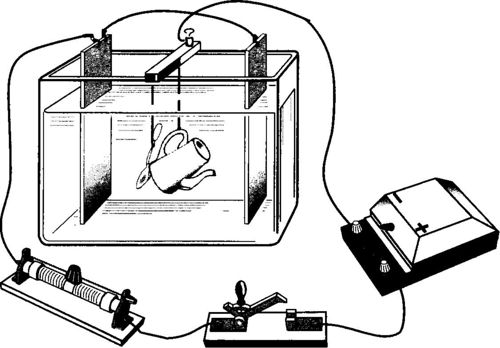
Гальваностегия — это электролитическое нанесение определенных металлов с целью защиты изделий от коррозии и для придания им соответствующего эстетического оформления (покрытие производят хромом, никелем, серебром, золотом, платиной и т. п.). Вещь тщательно очищают, обезжиривают, и используют как катод в электролитической ванне, в которую налит раствор соли того металла, которым необходимо покрыть изделие.
В качестве анода применяют пластину из этого же металла. Как правило применяют пару анодных пластин, а подлежащий гальваностегии предмет располагают между ними.
Гальванопластика
Гальванопластика - осаждение металла на поверхности разных тел для воспроизведения их формы: формы для отливки деталей, скульптур, печатных клише и т.д.

Гальваническое осаждение металла на поверхности предмета возможно лишь тогда, когда поверхность эта или весь предмет являются проводниками электрического тока, поэтому для изготовления моделей или форм желательно использовать металлы. Наиболее подходят для этой цели легкоплавкие металлы: свинец, олово, припои, сплав Вуда.
Эти металлы мягки, легко обрабатываются слесарным инструментом, хорошо гравируются и отливаются. После наращивания гальванического слоя и отделки металл формы выплавляют из готового изделия.
Однако наибольшие возможности для изготовления моделей все же представляют диэлектрические материалы. Чтобы металлизировать такие модели, нужно придать их поверхности электропроводность. Успех или неудача в конечном итоге зависят в основном от качества токопроводящего слоя. Слой этот может быть нанесен одним из трех способов.
Самый распространенный способ — графитирование, он пригоден для моделей из пластилина и других материалов, допускающих растирание графита по поверхности.
Следующий прием — бронзирование, способ хорош для моделей относительно сложной формы, для разных материалов, однако за счет толщины бронзового слоя несколько искажается передача мелких деталей.
И, наконец, серебрение, пригодное во всех случаях, но особенно незаменимое для хрупких моделей с очень сложной формой — растений, насекомых и т. п.
Химические источники тока
Также электролиз является основным процессом, благодаря которому функционируют самые современные химические источники тока, например батарейки и аккумуляторы. Здесь присутствуют два электрода, контактирующие с электролитом.
Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Подробнее смотрите здесь: Химические источники электрического тока
Лимонная батарейка (для увеличения нажмите нажмите на картинку)

Подробнее о том, как работает такая батарейка смотрите здесь: Как сделать батарейку из лимона в домашних условиях
Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно-разделённых процессов: на отрицательном аноде восстановитель окисляется, образующиеся свободные электроны переходят по внешней цепи к положительному катоду, создавая разрядный ток, где они участвуют в реакции восстановления окислителя. Таким образом, поток отрицательно заряженных электронов по внешней цепи идет от анода к катоду, то есть от отрицательного электрода к положительному.
Явление электролиза находит себе многочисленные технические применения.
1. Электролитический метод получения чистых металлов. Хорошим примером является электролитическое очищение или рафинирование меди. Медные руды содержат сернистые соединения меди, ее окислы, а также и примеси посторонних металлов (Ni, Pb, Sb, As, Bi и др.). Полученная непосредственно из руды медь, содержащая примеси, отливается в виде пластин и помещается в качестве анода в раствор . Подбирая определенное напряжение на электродах ванны (0,20-0,25 В), можно добиться, чтобы на катоде выделялась только металлическая медь. При этом посторонние примеси либо переходят в раствор (без выделения на катоде), либо выпадают на дно ванны в виде осадка («анодный шлак»).
Электролитическое извлечение металлов может происходить не только из водных растворов, но также и из расплавов этих веществ, которые и в твердом состоянии образованы из ионов (например, NaCl); при плавлении их ионы приобретают необходимую подвижность. Электролиз расплавов лежит в основе процесса огромной технической важности (рис. 111) – получения металлического алюминия из бокситов, содержащих окись алюминия (). Так как при этих процессах применяют очень большие токи, то выделяющаяся, согласно закону Джоуля-Ленца, теплота оказывается достаточной для поддержания вещества в расплавленном состоянии.
Рис. 111. Получение металлического алюминия электролизом расплавленных бокситов, содержащих окись алюминия: 1 – угольные аноды, 2 – дно и стенки угольной ванны, служащие катодом
Получение металлов путем электролиза (электрометаллургия) играет в современной цветной металлургии исключительно важную роль. В настоящее время весь алюминий добывается электролитически. Для добывания алюминия строят гигантские предприятия. Энергия, затрачиваемая на электрометаллургию во всем мире, исчисляется миллиардами киловатт-часов в год.
73.1. Какова мощность тока, при помощи которого можно получить 150 кг алюминия в сутки? Какова необходимая поверхность электродов? Электролитическое получение алюминия ведется при напряжении около 5 В и плотности тока около 40 А/м2. Потери составляют около 5 % всей затраченной энергии.
2. Гальваностегия. Посредством электролиза можно покрыть металлические предметы слоем другого металла. Этот процесс называется гальваностегией. Особое техническое значение имеют при этом электролитические покрытия трудно окисляемыми металлами, в частности – никелирование и хромирование, а также серебрение и золочение, часто применяемые для предохранения металлов от разрушения на воздухе (от коррозии).
Для получения нужных покрытий предмет тщательно очищают механически, обезжиривают и помещают как катод в электролитическую ванну, содержащую соль того металла, которым желают покрыть предмет. На рис. 112 изображена электролитическая ванна для никелирования. В качестве электролита употребляют различные растворы солей никеля. Для более равномерного покрытия полезно применять две пластины в качестве анода, помещая предмет между ними.
Рис. 112. Электролитическое никелирование: 1 – никелевые аноды, 2 – никелируемый предмет, служащий катодом
73.2. При электролитическом никелировании обычно употребляют ток плотности около 40 А/м2. Сколько времени нужно вести электролиз, чтобы получить слой никеля толщины 0,02 мм? Плотность никеля равна кг/м3. Значение электрохимического эквивалента никеля, необходимое для решения, вычислите сами, принимая во внимание, что никель двухвалентен и относительная атомная масса его равна 58,70.
73.3. Найдите массу сернокислого никеля, который должен быть израсходован для никелирования поверхности, имеющей площадь 50 см2, если толщина покрытия никелем должна быть равна 0,02 мм. Сколько времени нужно проводить никелирование при плотности тока 30 А/м2?
3. Гальванопластика. Посредством электролиза можно не только покрыть предметы слоем того или иного металла, но и изготовить их рельефные металлические копии (например, монет, медалей и т. п.). Этот процесс был изобретен русским физиком и электротехником Борисом Семеновичем Якоби (1801-1874) в сороковых годах прошлого века и называется гальванопластикой. Для изготовления рельефной копии с предмета сначала делают слепок из какого-либо пластичного материала, например из воска. Этот слепок делают электропроводным, покрывая его графитом, и погружают в электролитическую ванну в качестве катода, где на нем и осаждается слой металла нужной толщины.
Гальванопластика находит важное применение в типографском деле, в процессе электротипии. В этом процессе сначала изготовляют обычный набор текста и снимают с него слепок из воска или пластмассы. После покрытия слепка графитом на нем осаждают в электролитической ванне толстый слой меди и для придания прочности слою меди копию заливают с задней стороны «типографским металлом». Полученная рельефная копия набора употребляется затем для печатания.
Электролиз
Электролиз в промышленных масштабах используется для извлечения из металлосодержащих руд металлов и их очищения от примесей. При помощи этого физико-химического процесса на производстве получают медь и алюминий. Заряд химических источников тока (аккумуляторов) также происходит, благодаря протеканию этой реакции.
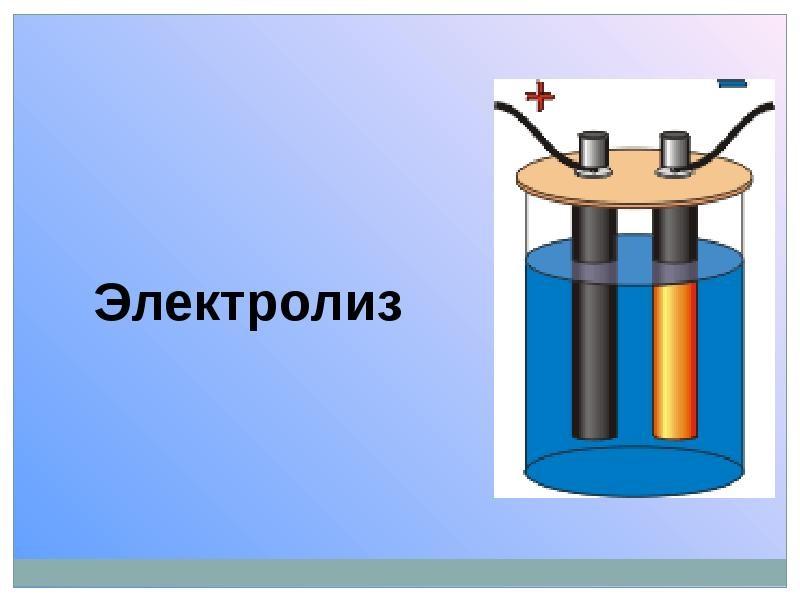
Определение электролиза
Химическая реакция, в результате которой на электродах происходит оседание компонентов из электролитических растворов веществ, и протекающая под действием электрического тока – вот что такое электролиз. Он включает в себя комплекс процессов окисления и восстановления, происходящих на электродах. Обязательным условием является движение постоянного тока от электрода к электроду.
В чём заключается процесс
Технологический порядок электролиза, или ещё его называют гальванолизом, происходит по законам химии и физики. При этом берутся электропроводящие растворы (жидкости), в которых при помощи двух электродов организовано электрическое поле.
Внимание! Электроды имеют названия. Катод (К) – электрод, имеющий отрицательный потенциал, анод (А) – электрод с положительным потенциалом.
Ионы движутся упорядоченно через раствор, который носит название электролита. При этом ионы, относящиеся к металлам, водороду (катионы) направляются к катоду, к аноду стремятся ионы, принадлежащие к кислотным остаткам или гидроксильной группы (анионы). Катионы имеют положительный знак заряда, анионы – отрицательный. Пропускание электрического тока при электролизе может осуществляться, как через растворы, так и через расплавы электролитов.
Информация. При приготовлении электролита происходит диссоциация раствора на ионы. Это обусловлено взаимодействием растворителя на растворяемое вещество. Такая реакция называется первичной. Дальнейшее воздействие электрического тока на электролит вызывает вторичную реакцию гальванолиза.
Подобное разделение на первичность и вторичность позволило Майклу Фарадею обосновать законы, применяемые к гальванолизу.
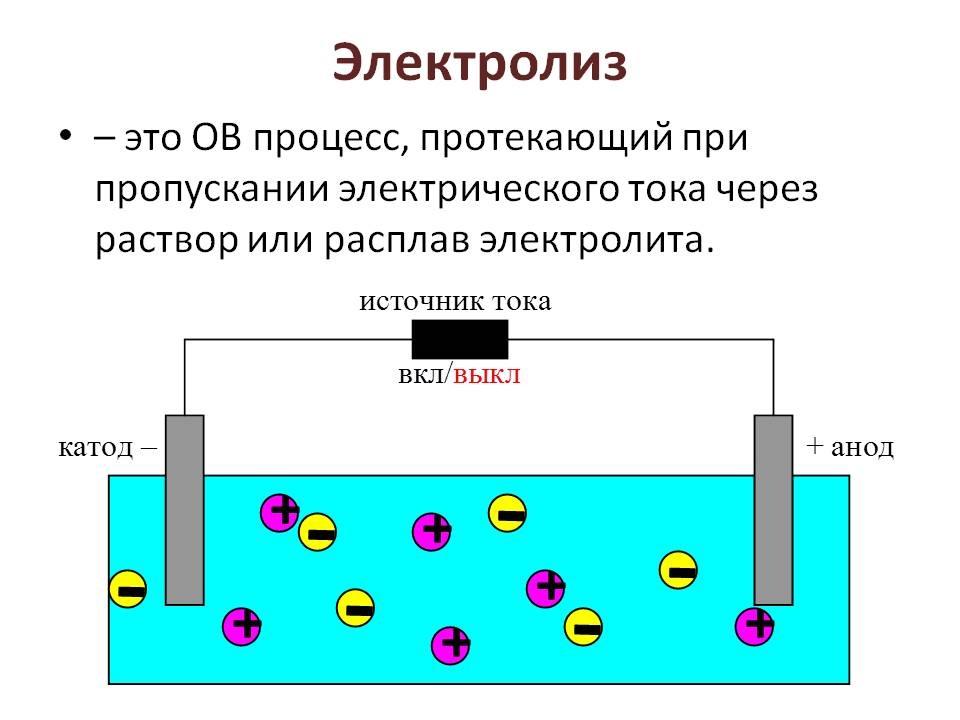
Электролиз растворов
Использование воды для приготовления раствора электролита осложняет процесс. В растворах солей и щелочей вода ведёт себя при электролизе неоднозначно. Это проявляется в том, что H2O ведёт себя как окислитель, так и как восстановитель. На катоде она получает электроны и восстанавливает атомы водорода до газообразной формы водорода. На аноде вода отдаёт отрицательно заряженные частицы, тогда атомы кислорода окисляются до газообразной формы кислорода. Кислота, используемая в качестве раствора для электролита, лишена этой проблемы.
Катодные процессы
Катод, помещённый в растворы солей, притягивает к себе катионы металлов. Эти катионы выступают как окислители.
Важно! У отдельных металлов способности ионов окислять различны. Чтобы оценить способности окисления – восстановления, необходимо опираться на электрохимический ряд напряжений.

У каждого металла (далее обозначен как М) свой электрохимический потенциал (ЭХП). Чем он меньше, тем восстановительные свойства выше, а окислительная способность у соответствующих ионов этого металла ниже.
ЭХП величина относительная, потому у отдельных ионов разная величина ЭХП. У водорода он равен нулю.
Во время процесса электролиза, протекающего в растворах солей, выявлены следующие замечания:
- когда в солях присутствуют активные М, то не они восстанавливаются на катоде, а водород;
- если М в электролите имеет среднюю активность, то на катоде разряжаются (восстанавливаются) оба: и водород, и М;
- при неактивном М на катоде восстанавливается только он, потому что его ион – более сильный окислитель, чем водородный ион.
Примерами таких процессов на катоде могут служить следующие реакции:
- при активном М: 2H2O +2ē → H2 + 2OH—;
- при М средней активности: Men+ + nē → Me0 и 2H+2O +2ē → H20 + 2OH—, где Ме – это растворённый металл;
- в случае неактивного М в солях: Men+ + nē → Me0.
Замечено, что, когда с катодом взаимодействуют водородные катионы H+, происходит их разряжение до молекул водорода — 2H+ + 2ē → H20
Анодные процессы
Плюс, поданный на анод, притягивает к себе анионы вместе с молекулами воды. В данном случае анод является окислителем, а восстановители – молекулы H2O или анионы кислотных остатков.
В процессе гальванолиза на аноде происходят следующие реакции:
- кислотные остатки, не содержащие кислорода, окисляются до нулевой степени окисления: неМеn- – nē = неМе0, где – неМе – это неметалл;
- при содержании в остатке кислорода окисляется вода и выделяет молекулы кислорода (молекулярный кислород О2): 2H2O-2 – 4ē → O20 + 4H+;
- в случае контакта с анодом гидроксид-иона последний также окисляется: 4O-2H– – 4ē → O20 + 2H2O, с выделением молекулярного кислорода.
Исключение. Фтор обладает электроотрицательностью более высокой, чем кислород. Поэтому электролиз растворов фторидов протекает с окислением молекул воды вместо фторид-ионов.
Суммарные процессы электролиза
Что получается в суммарной реакции гальванолиза, можно рассмотреть на примере хлорида натрия. При пропускании электрического тока на электродах происходит следующее:
- катод – на нём восстанавливается H – водород: 2H+2O +2ē → H20 + 2OH–;
- анод – на электроде происходит окисление хлорид-ионов: 2Cl– – 2ē → Cl20.
В этой реакции электролиза не принимают участия ионы натрия. Тем не менее, они входят в суммарное уравнение раствора хлорида натрия при электролизе. Оно имеет вид:
2H+2O + 2NaCl– → H20 + 2NaOH + Cl20.
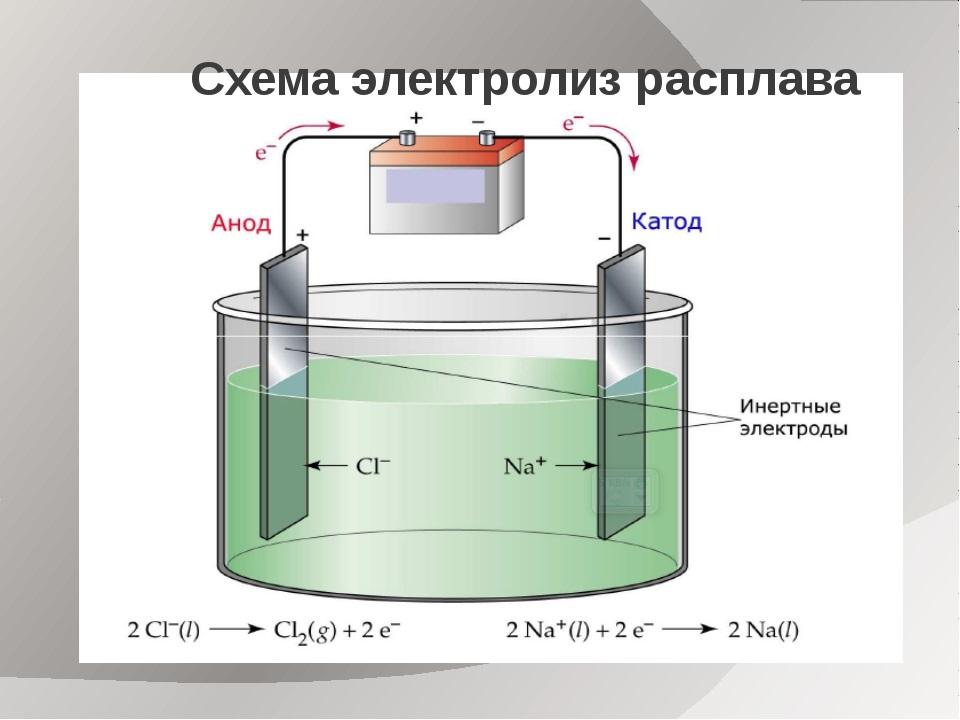
Электролиз расплавов
Если сравнить гальванолиз расплавов и растворов, то в расплавах все М: активные, малоактивные и неактивные, реагируют на процесс электризации одинаково.
Внимание! Вода при электролизе расплавов в электролите отсутствует. Поэтому осложнений, связанных с её вмешательством, не возникает. Описание такой реакции можно рассмотреть на примере расплава NaCl (хлористого натрия).
В этом случае на катоде происходит восстановление катионов Na:
Анод вызывает окисление анионов Cl:
Общее уравнение гальванолиза расплава NaCl будет иметь вид:
2Na+Cl– → 2Na0 + Cl20.
Электролиз с растворимыми электродами
В этом случае электролиз металлов осуществляется при помощи электродов, выполненных из того же М, который присутствует в электролите. Также электроды могут быть изготовлены из М активностью выше.
Важно! При протекании этого процесса на аноде восстанавливаются не анионы или молекулы H2O, а окисляется сам анод. Его частицы растворяются (окисляются) и восстанавливаются уже на катоде.
В случае с медным анодом при электролизе меди, где электролитом является сульфат меди, происходит следующее:
- ионы меди, входящие в раствор, восстанавливаются на катоде: Cu2+ + 2ē → Cu0;
- медный анод подвергается окислению своих частиц меди: Cu0 – 2ē → Cu2+.
Таким образом, если медную заготовку, имеющую примеси, использовать в качестве анода при гальванолизе в сульфате меди, то на катоде будет оседать медь в чистом виде. Анодный электрод при этом будет растворяться.
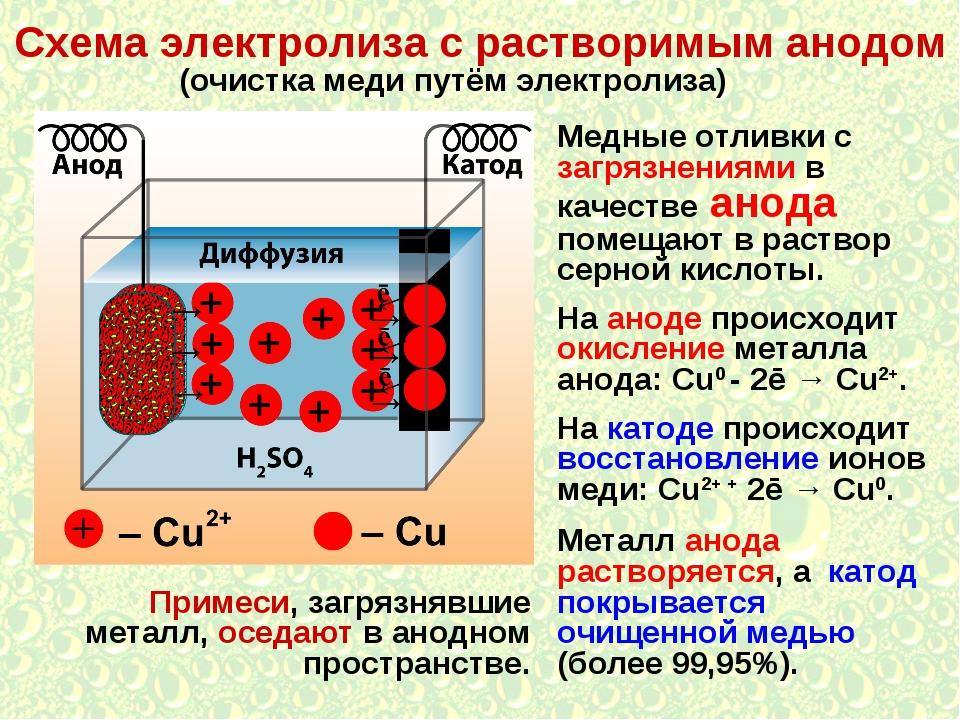
Вот перечень некоторых металлов, которые могут быть растворимыми электродами:
- медь (Cu);
- серебро (Ag);
- цинк (Zn);
- кобальт (Co);
- олово (Sn);
- никель (Ni);
- кадмий (Cd).
На растворимом аноде в начальной стадии электролиза процессы проходят при минимальном стандартном потенциале на электроде. Если электролиз не остановить, то значение потенциала отклоняется в отрицательную сторону. Это вызвано поляризацией из-за пребывания на катоде электронов.
К сведению. Потенциалы электродов могут отклоняться от их изначального значения в ходе электролиза. Это явление называют поляризацией. Она бывает электрохимической и концентрационной.
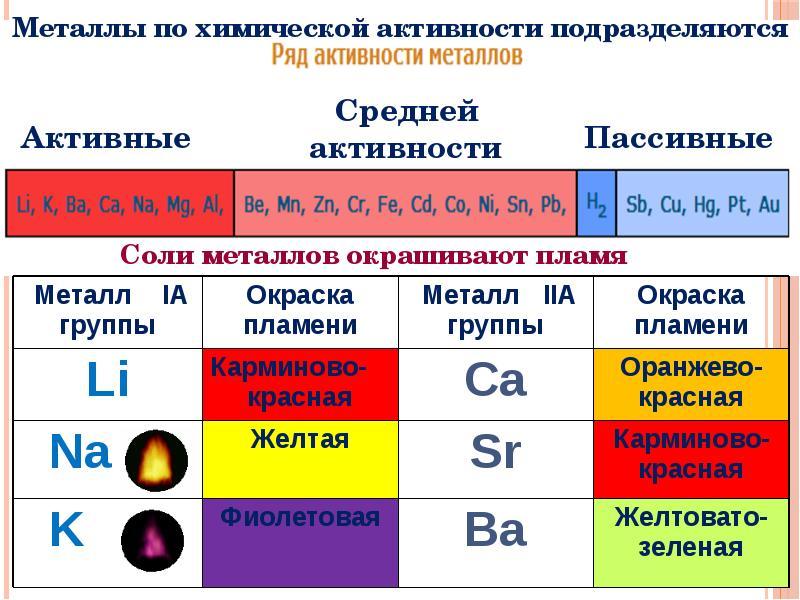
Активные металлы
Это тот тип металлов, который легко вступает в реакции. В периодической таблице это элементы 1-й и 2-й группы. Так как металлические свойства у элементов становятся слабее в ряду слева направо, то к ним относятся:
- щелочные металлы: литий, калий, натрий, цезий, франций, рубидий;
- щелочноземельные элементы: бериллий, магний, кальций, стронций, барий, радий;
- алюминий.
Данные металлы имеют один или два валентных электрона и легко их отдают, являясь восстановителями. К отличительным особенностям активных металлов относятся:
- мягкость;
- лёгкость;
- низкая температура плавления.
При взаимодействии с кислородом (на воздухе) щелочных металлов возможно самовозгорание. Самовозгорание щелочноземельных металлов происходит при повышении температуры. При взаимодействии их с водой образуются щёлочь и водород, вступая в реакцию с кислотами, они образуют соли.
Менее активные металлы и неактивные металлы
Среднюю активность проявляют металлы, стоящие в ряду после алюминия Al и до водорода H2.
К неактивным относятся элементы, стоящие правее водорода: медь (Cu), ртуть (Hg), серебро (Ag), платина (Pt), золото (Au).
Практическое применение в производстве
Такой электрохимический процесс, как электролиз, примеры которого можно увидеть повсеместно, является неотъемлемой частью промышленности:
- получение химически чистого сырья: фтор, хлор, щёлочи, чистые водород и кислород и т.д.;
- применение электролиза в гидрометаллургии: переработка сырья с содержанием металлов;
- элекрорафинирование (применение растворимых анодов) для окончательной очистки металлов;
- электроэкстракция (использование нерастворимых анодов) для выделения нужных металлов из растворов;
- гальванические процессы: гальванопластика и гальваностегия.
Информация. Процессы электролиза не протекают бесконтрольно. В цепь электролизёра включают медный кулонометр. Единица измерений прибора – 1 Кл (кулон). В этом случае контролируется количество результата (продукта) анодных, катодных реакций при 100%-ном выходе по току, необходимому для прохождения реакций.
Гальваностегия – способ электрохимического покрытия металлических поверхностей другими металлами:
- сталь подвергают никелированию, хромированию, оцинкованию;
- медь покрывают серебром, никелем и иными металлами.
Поверхность основания обрабатывают так, чтобы покрытие держалось крепко и защищало конструкцию от влияния внешних факторов. В то же время изделиям придавался эстетический вид.
Гальванопластика позволяет получать точные копии заготовки, выполненные из благородных металлов. Широко используется при изготовлении матриц, копий со скульптур, ювелирных изделий, деталей сложной геометрии. При этом способе важно, чтобы заготовка отделилась от покрытия.

Электролиз открывает широкие возможности для работы с металлами и электролитами. При помощи этого процесса можно самостоятельно выполнять работы не только в области гальванотехники, но и получать чистые металлы в небольших количествах. При этом не стоит путать самопроизвольные химические реакции в гальванических элементах и реакции, протекающие в электролизёрах.
Видео
Читайте также:
