Верны ли следующие суждения о свойствах щелочных металлов
Обновлено: 04.10.2024
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
Подобная схема универсальная для брома и для йода. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO + NaI + H2O (без нагревания)
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)
Металл – восстановитель, отдаёт электроны
Пероксид, надпероксид окислители
4KO2 + 2CO2 → 2K2CO3 + 3O2 с кислотными оксидами образуются соли
Na2O2 + 2H2O → 2NaOH + H2O2 вода превращается с перекись, образуется щелочь
Соли калия – хроматы и бихроматы- сильные окислители – используются в ОВР
Взаимопревращение хроматов и дихроматов
Оксиду хрома (VI) соответствуют сразу две кислоты – хромовая Н2CrO4 и дихромовая Н2Cr2O7, Хромат калия K2CrO4и дихромат калия K2Cr2O7– соли этих кислот. Хроматы – желтого цвета, дихроматы – оранжевого. В кислой среде хромат-ион превращается в дихромат-ион. В присутствии щелочи дихроматы снова становятся хроматами. Хромат калия превращаем в дихромат, добавляя кислоту. Желтый раствор становится оранжевым.
В стакан с дихроматом калия добавляем щелочь, оранжевый раствор становится желтым – дихроматы превращаются в хроматы.
1. При пропускании сероводорода через подкисленный серной кислотой раствор дихромата оранжевая окраска раствора переходит в зелёную и одновременно жидкость становится мутной вследствие выделения серы:
2. При действии концентрированной соляной кислоты на дихромат калия выделяется хлор и получается зелёный раствор, содержащий хлорид хрома (III):
3. Если пропускать диоксид серы через концентрированный раствор дихромата калия, содержащий достаточное количество серной кислоты, то образуются эквимолекулярные количества сульфатов калия и хрома (III):
Вопросы и задания
Верны ли следующие суждения о металлах и их соединениях?
А. Калий обладает более выраженными металлическими свойствами, чем магний.
Б. Оксид натрия проявляет более выраженные основные свойства, чем оксид алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Решение.
Основные свойства оксидов и гидроксидов и металлические свойства элементов усиливаются по периоду справа налево и по группе сверху вниз, поэтому оба утверждения верны.
Верны ли следующие суждения о свойствах щелочных металлов и их соединений?
А. Все щелочные металлы реагируют с кислородом только при повышенной температуре.
Б. Оксиды щелочных металлов проявляют амфотерные свойства.
Не все щелочные металлы реагируют с кислородом только при повышенной температуре - в зависимости от степени измельченности и активности, они с разной скоростью реагируют с кислородом.
Верны ли следующие суждения о строении атомов и свойствах щелочных металлов?
А. Атомы щелочных металлов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns 1 .
Б. Все щелочные металлы способны взаимодействовать с водой при обычной температуре.
Атомы щелочных металлов в основном состоянии действительно имеют электронную конфигурацию внешнего энергетического уровня ns 1 .
Все щелочные металлы взаимодействуют с водой при обычной температуре.
А. Восстановительные свойства у калия выражены сильнее, чем у магния.
Б. Высшие оксиды металлов IA группы имеют состав .R2O
Калий находится левее и ниже магния в Периодической системе, поэтому его восстановительные свойства выражены сильнее, чем у магния.
Высшие оксиды металлов IA группы действительно имеют состав.
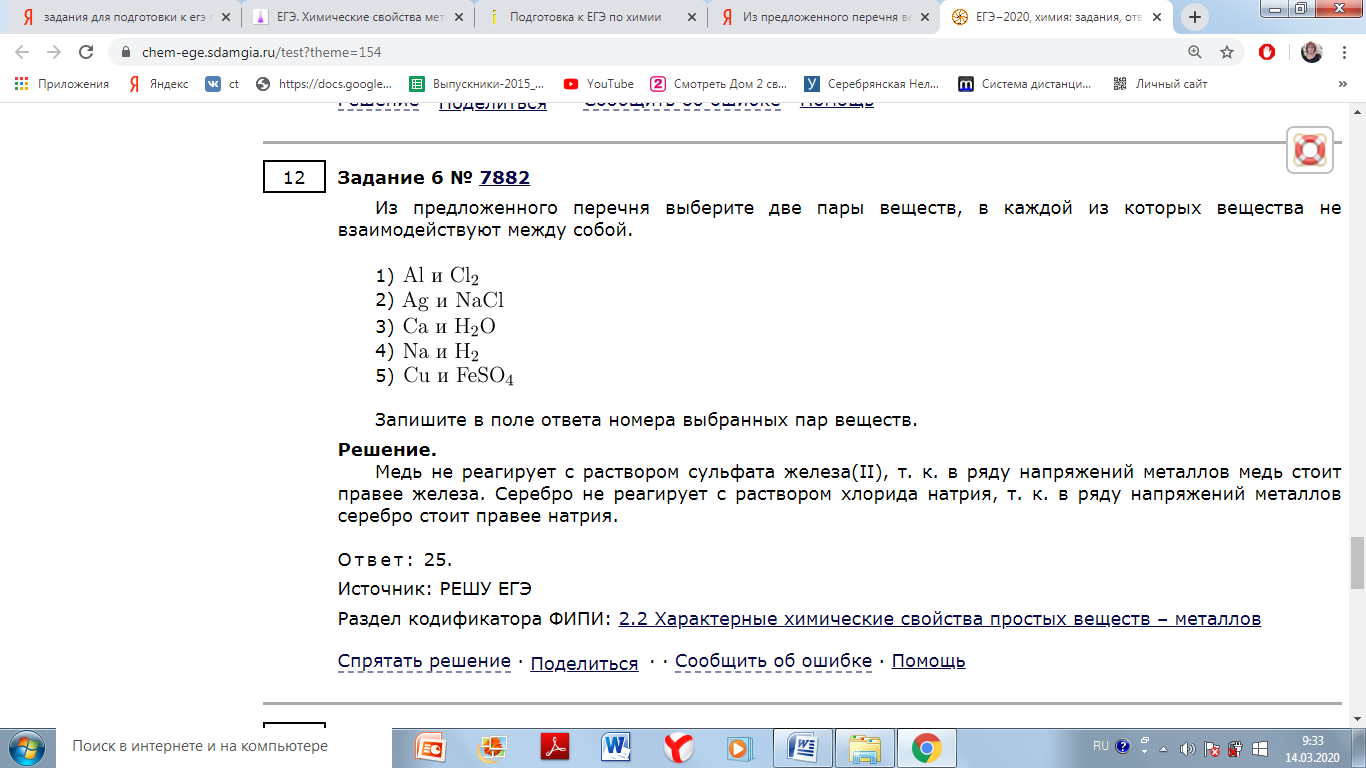

Из предложенного перечня выберите две пары веществ, которые взаимодействуют с водой при обычной температуре.
1) магний и углерод
2) фтор и натрий
3) калий и стронций
4) азот и алюминий
5) железо и серебро
Натрий и калий — щелочные металлы, стронций — щелочноземельный, при обычных условиях взаимодействуют с водой с образованием щелочи и водорода. Фтор активно реагирует с водой с образованием кислорода.
Из предложенного перечня выберите два вещества, которые реагируют с серой и азотом.
Азот — малореакционоспособное соединение. Среди представленных вариантов он реагирует только с магнием и литием при нагревании с образованием нитрида магния.
Из предложенного перечня выберите два вещества, при взаимодействии которых с водой образуется щёлочь.
Только гидроксид бария и натрия растворимы в воде, поэтому только при взаимодействии воды с барием или натрием образуется щелочь.
Из предложенного перечня выберите два вещества, которые при взаимодействии с водой не образуют щёлочь.
Гидроксид магния малорастворим, поэтому не является щелочью, а серебро с водой не реагирует.
Из предложенного перечня выберите два вещества, которые с щелочами не взаимодействуют.
Алюминий — амфотерный металл, реагирует со щелочами.
Натрий — щелочной металл с щелочами не реагирует.
Бром — диспропорционирует в щелочи.
Сера также диспропорционирует с образованием сульфита и сульфида металла.
Магний — типичный металл, со щелочью не реагирует.
Из предложенного перечня выберите два вещества, которые взаимодействуют с щелочами.
Среди перечисленных веществ со щелочью реагирует только сера и алюминий — сера диспропорционирует с образованием сульфита и сульфида металла, а алюминий является амфотерным металлом, который реагирует со щелочами.







Из предложенного перечня выберите два вещества, с каждым из которых взаимодействует оксид цинка.
1) гидроксид натрия
2) оксид серы (VI)
3) оксид азота (II)
5) сульфат калия
Оксид цинка как амфотерный оксид будет реагировать с щелочами и кислотными оксидами.
Из предложенного перечня простых веществ выберите два, которые реагируют c щелочами при обычных условиях.
Хлор (2) реагирует с щелочами с образованием смеси солей хлорноватистой и соляной кислот.
Алюминий (3) — амфотерный металл — легко реагирует с щелочами.
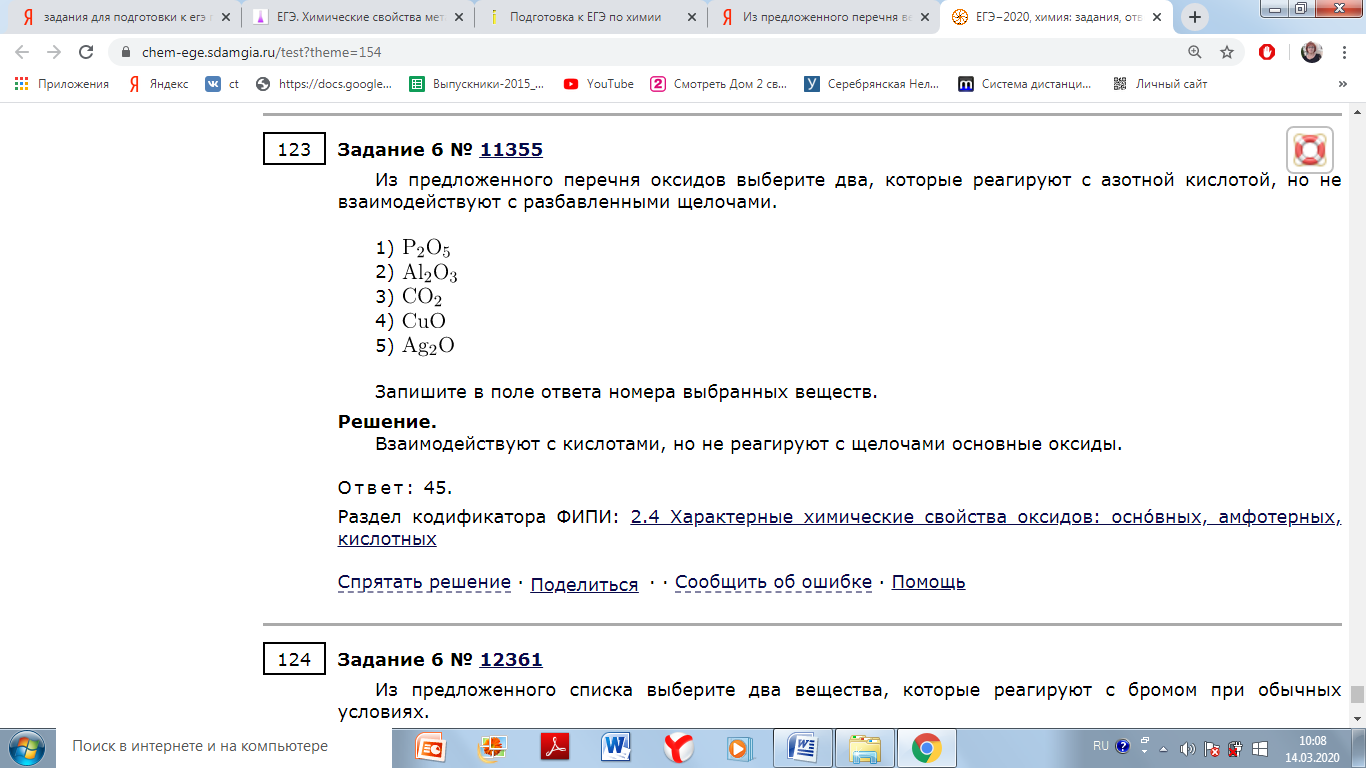
Из предложенного списка реактивов выберите два, которые способны растворить фосфор.
2) разбавленная соляная кислота
3) концентрированная азотная кислота
4) концентрированная щёлочь
5) насыщенный раствор хлорида натрия
В воде фосфор не растворяется. Но его легко растворяют концентрированная азотная кислота и концентрированная щелочь.
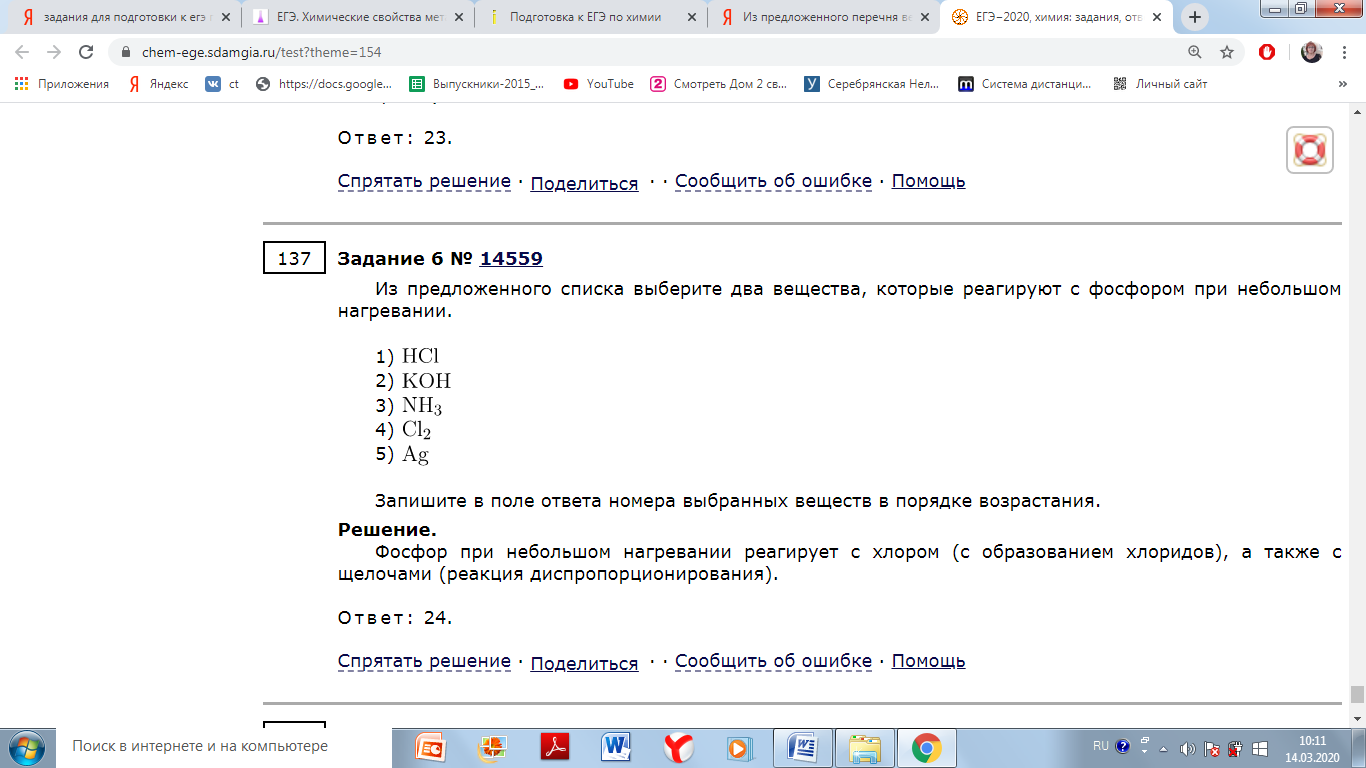
Из предложенного списка выберите два вещества, которые реагируют с бромом в обычных условиях.
2) раствор гидроксида калия
4) соляная кислота
5) углекислый газ
Бром при обычных условиях реагирует с сероводородом, так как является активнее серы, а так же реагирует с растворами щелочей.
Из предложенного перечня выберите два простых вещества, которые реагируют с щелочами.
Фтор, хлор и другие галогены, реагируют со щелочами, состав продуктов зависит от температуры.
Из предложенного перечня выберите два вещества, которые могут реагировать и с соляной кислотой, и с раствором гидроксида натрия.
Алюминий и цинк — амфотерные металлы, поэтому реагируют и с кислотами и со щелочами.
Из предложенного перечня выберите два вещества, которые взаимодействуют с раствором гидроксида лития.
С этой щелочью будет реагировать цинк и алюминий.
Из предложенного перечня простых веществ выберите два, которые реагируют с раствором щёлочи при обычных условиях.
Разберём каждый вариант.
1. Бром реагирует с щелочами, как и другие галогены, с образованием соли.
2. Азот химически инертен.
3. С щелочами категорически не вступает в реакцию.
4. Медь малоактивный металл, не являющийся амфотерным, реагирует с концентрированными кислотами, но не с щелочами.
5. Алюминий амфотерный, вступает в реакцию с щелочами, образуя комплексную соль.
Из предложенного списка простых веществ выберите два, которые реагируют с разбавленными растворами щелочей при обычных условиях.
С разбавленными растворами щелочей реагируют амфотерные металлы, их оксиды и гидроксиды, также галогены, кислотные оксиды и кислоты, соли (если образуется газ, вода или осадок).
Из предложенного перечня выберите два вещества, которые образуют щёлочь при взаимодействии с водой.
Только гидроксид калия и кальция растворимы в воде, поэтому только при взаимодействии воды с калием или кальцием образуется щелочь.
Цинк — металл, соединения которого проявляют амфотерные свойства, реагирует со щелочами.
Самостоятельная работа по химии по теме "Щелочные металлы" (9 класс)
Часть А. Тестовые задания с выбором одного правильного ответа.
А.1. Атому натрия соответствует электронная формула
1) 1s 2 2s 2 2p 6 3s 2 , 2) 1s 2 2s 2 2p 6 3s 1 , 3) 1s 2 2s 1 , 4) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
А.2. Химические элементы расположены в ряду в порядке увеличения их атомных радиусов 1) Li , Na , K . 2) K , Na , Li . 3) Li , K , Na 4) Na , K , Li
А.3 . Атомы щелочных металлов отличаются друг от друга
1.высшей степенью окисления, 2.числом электронов на внешнем слое,
3. степенью окисления в соединениях, 4. числом энергетических уровней.
А.4. Щелочной металл, наиболее активно взаимодействующий с водой,
1) цезий, 2) натрий, 3) калий, 4) литий.
А.5. Литий взаимодействует с веществами, формулы которых,
А.6. В химической реакции, уравнение которой 2 Na + 2 H 2 O = 2 NaOH + H 2, элемент натрий
1) понижает степень окисления, 2) является восстановителем, 3) является окислителем,
4) не изменяет степени окисления.
А.7. Верны ли следующие суждения о щелочных металлах?
А. Активность щелочных металлов возрастает с увеличением их порядковых номеров.
Б. При взаимодействии с галогенами щелочные металлы образуют соединения с ионной кристаллической решёткой.
1) верно только А, 2) верно только Б, 3) верны оба суждения, 4) неверны оба суждения.
А.8. Вещество Х в схеме превращений Li --- X ---- LiOH
1) LiNO 3, 2) LiH , 3) LiCl , 4) Li 2 O .
А.9. Гидроксид калия взаимодействует с веществами, формулы которых
А.10. Формула вещества с техническим названием поташ
В.1. Вещество, взаимодействующее с гидроксидом натрия и соляной кислотой
1. гидроксид цинка, 2. карбонат натрия, 3. оксид кальция, 4. алюминий, 5. хлорид меди ( II )
В.2. Установите соответствие между техническим названием вещества и его формулой
А. Каустическая соль.
Б. Кальцинированная сода.
В. Глауберова c оль.
Часть С . Задания с развернутым ответом.
С.1. Технический литий массой 9 г, содержащий 20% примесей, поместили в сосуд с водой. Рассчитайте объём выделившегося газа.
С.2. Через раствор вещества А, изменяющего окраску индикатора и окрашивающего пламя спиртовки в фиолетовый цвет, пропустили газообразное вещество Б. К полученному раствору прилили раствор хлорида кальция, при этом образовался осадок вещества С, по составу идентичный мрамору. Определите вещества А, Б, С и напишите уравнения протекающих реакций.
Щелочные металлы и их соединения.
А.1. Формула гидроксида химического элемента, в атоме которого распределение электронов по слоям соответствует схеме 2,1
1) LiOH, 2)NaOH, 3) KOH, 4) CsOH
А.2. Степень окисления калия в пероксиде калия 1) -1, 2) 0, 3) +1, 4) +2.
А.3. Атом лития отличается от иона лития
2) числом протонов,
3) радиусом частицы,
4) числом нейтронов.
А.4. Щелочной металл, при взаимодействии которого с кислородом образуется оксид,
1) литий, 2) натрий, 3) калий, 4) рубидий.
А.5. С калием вступают в реакцию каждое из веществ в ряду 1) S и NaOH , 2) HCl и CaO
А.6. Вещество Х в схеме превращений Na ------ X ------ NaHCO 3
1) хлорид натрия, 2) пероксид натрия, 3) гидрид натрия, 4) гидроксид натрия.
А.7. Верны ли следующие суждения о свойствах щелочных металлов?
А. Щелочные металлы хранят под слоем керосина.
Б. Литий легче воды в 2 раза.
1) верно только А. 2) верно только Б. 3) верны оба суждения, 4) неверны оба суждения.
А.8. Для получения нерастворимого в воде основания можно использовать раствор щёлочи и соль 1) сульфат аммония, 2) хлорид магния, 3) нитрат кальция, 4)фосфат калия.
А.9. Щёлочь может образоваться в результате взаимодействия 1) кислотных оксидов с основными, 2) кислот с основаниями, 3) основных оксидов с водой, 4) растворов 2-х солей
А.10. Наибольшее количество калия содержится в 1) хлебе, 2) картофеле, 3) кураге, 4) яблоках.
В1. Карбонат натрия взаимодействует с каждым из веществ, формулы которых
В2. Установите соответствие между названием элемента и русским переводом слова
Вариант 1
Объяснение: химический элемент имеет 4 электронных слоя, то есть находится в 4-м периоде. На внешнем слое элемент имеет только один электрон, значит стоит в первой группе 4-го периода. Правильный ответ - 3.
Задание №2.
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1. Натрий → магний → алюминий
2. Бериллий → магний → алюминий
3. Барий → стронций → кальций
4. Калий → натрий → литий
Объяснение: металлические свойства элементов усиливаются в группе сверху вниз и в периоде справа налево, то есть надо найти последовательность элементов, которые будут соответствовать этой закономерности. Это - вторая последовательность. Правильный ответ - 2.
Задание №3.
Ковалентной полярной связью образовано каждое из веществ, формулы которых:
Объяснение: ковалентная полярная связь образуется между двумя разными неметаллами. Рассмотрим вариант 3: сера, кислород, водород и фтор являются неметаллами. Все эти вещества образованы двумя разными неметаллами, что нам подходит. Правильный ответ - 3.
Задание №4.
Валентность неметаллов последовательно увеличивается в ряду водородных соединений, формулы которых:
1. HF → CH4 → H2O → NH3
2. SiH4 → AsH3 → H2S → HCl
3. HF → H2O → NH3 → CH4
4. SiH4 → H2S → AsH4 → HCl
Объяснение: определим степени окисления всех неметаллов во всех приведенных соединениях водорода.
1. HF(-1) → C(-4)H4 → H2O(-2) → N(-3)H3
2. Si(+4)H4 → As(+3)H3 → H2S(-2) → HCl(-1)
3. HF(-1) → H2O(-2) → N(-3)H3 → C(-4)H4
4. Si(+4)H4 → H2S(-2) → As(+3)H3 → HCl(-1)
Правильный ответ - 3.
Задание №5.
К солям относится каждое из двух веществ:
1. Fe2(SO4)3 и AlCl3
2. Ba(NO3)2 и H3PO4
3. Li2SO4 и Fe(OH)3
Объяснение: соли состоят из катиона металла и аниона кислотного остатка. Соли получаются по реакции нейтрализации, например:
2NaOH + H2SO4 → Na2SO4 + H2O
Поэтому, нам подходит первый вариант ответа: сульфат железа (III) и хлорид алюминия. Правильный ответ - 1.
Задание №6.
К химическим явлениям не относится процесс:
1. Брожение сахара
2. Горение свечи
3. Перегонки воды
4. Горение спирта
Объяснение: химическое явление - такое явление, при котором происходит хотя бы одна химическая реакция. Так, химическая реакция идет при брожении сахара, горении свечи и спирта. Перегонка воды - это дистилляция (нагревание до 100С воды с последующей конденсацией паров). Правильный ответ - 3.
Задание №7.
Только катионы калия и фосфат-анионы образуются при диссоциации вещества формулы которого?
Объяснение: образование только катионов калия фосфат-ионов возможно только если в состав молекулы входят эти ионы, то есть подходит только фосфат калия. Проверяем: К3РО4 → К + + РО4³‾. Правильный ответ - 4.
Задание №8.
Уравнению реакции
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
соответствует сокращенное ионное уравнение:
2. Zn(OH)2 + 2Н + → Zn² + + 2H2O
3. Zn² + + SO4²‾ → ZnSO4
4. Zn² + + H2SO4 → Zn² + + SO4 ² ‾ + Н +
Объяснение: гидроксид цинка нерастворим, поэтому и диссоциировать в воде он не будет, поэтому нам подходит только второй вариант. Правильный ответ - 2.
Задание №9.
Верны ли следующие суждения о щелочных металлах?
А. При взаимодействии с галогенами щелочные металлы образуют соли.
Б. С водой щелочные металлы вступают в реакции замещения.
1. Верно только А
2. Верно только Б
3. Верны оба суждения
4. Оба суждения неверны
Объяснение: верны оба суждения.
Докажем это реакциями:
2Na + Cl2 → 2NaCl
2K + 2H2O → 2KOH + H2↑
Задание №10.
Оксид углерода (IV) взаимодействует с каждым из двух веществ:
1. Вода и сернистая кислота
2. Оксид кальция и гидроксид кальция
4. Кислород и оксид магния
Объяснение: СО2 - кислотный оксид, при взаимодействии с водой образует угольную кислоту, с кислотами не взаимодействует (так как в реакцию не вступают два вещества с одинаковыми свойствами), оксислиться кислородом не может, так как углерод находится в высшей степени окисления (+4). То есть СО2 вступает в реакцию с веществами, имеющими основные свойства, то есть оксид кальция и гидроксид калия. Правильный ответ - 2.
Задание №11.
Раствор серной кислоты взаимодействует с каждым из двух веществ:
1. Хлорид бария и оксид углерода (IV)
2. Железо и нитрат бария
3. Карбонат натрия и сероводород
4. Ртуть и гидроксид меди (II)
Объяснение: разбавленная серная кислота вступает в реакцию с металлами, стоящими в ряду напряжений металлов до водорода - это железо, но не ртуть. Кислоты не взаимодействуют с кислотными оксидами (СО2) и другими кислотами (сероводород), вступают в реакцию обмена с солями. если при этом выпадает осадок или выделяется газ. Учитывая все перечисленное выше, запишем химические реакции раствора серной кислоты с веществами из варианта 2:
H2SO4 + Fe → FeSO4 + H2↑
H2SO4 + Ba(NO3)2 → 2HNO3 + BaSO4↓
Правильный ответ - 2.
Задание №12.
Среди веществ: KCl, K2S, K2SO4 - в реакцию с раствором Zn(NO3)2 вступают
Объяснение: соли вступают в реакцию обмена только при образовании осадка или выделении газа.
Напишем соответствующие реакции:
Zn(NO3)2 + 2KCl ≠ 2KNO3 + ZnCl2 (реакция не идет так как оба продукта растворимы)
Zn(NO3)2 + K2S → 2KNO3 + ZnS↓
Zn(NO3)2 + K2SO4 → ZnSO4 + 2KNO3 (реакция не идет так как оба продукта растворимы)
Правильный ответ - 1.
Задание №13.
Верны ли следующие сужения об обращении с газами в процессе лабораторных опытов?
А. Прежде, чем поджечь водород, его необходимо проверить на чистоту.
Б. Полученный из бертолетовой соли хлор нельзя определять по запаху.
Объяснение: при реакции водорода с кислород получается вода, данная реакция идет со взрывом, перед поджиганием водород нужно проверить на чистоту, чтобы не допустить образование примесей. Ни хлор, ни любой другой газ нельзя определять по запаху. Правильный ответ - 3.
Задание №14.
Окислительные свойства водород проявляет в реакции, уравнение которой
1. CuO + H2 → Cu + H2O
2. H2 + Cl2 → 2HCl
4. 2H2 + O2 → 2H2O
Объяснение: окислительные свойства водород проявляет только в гидридах, где имеет степень окисления -1. Среди продуктов представленных реакций есть один гидрид - гидрид кальция, в этой реакции водород и является окислителем. Правильный ответ - 3.
Задание №15.
Массовая доля натрия в сульфате натрия составляет:
Объяснение: для нахождения массовой доли натрия в сульфате натрия воспользуемся формулой:
ω = (n x Ar(Na))/Mr(Na2SO4)
n - количество атомов элемента в веществе
Здесь нужно не забыть, что в данной соли два натрия!
ω(Na) = 2х23/142 = 0,324
Задание №16.
В ряду химических элементов Al → Si → P
1. Увеличивается заряд ядер атомов
2. Возрастают кислотные свойства образуемых ими гидроксидов
3. Увеличивается число электронных уровней
4. Уменьшается электроотрицательность
5. Возрастает атомный радиус
Объяснение: представленные элементы находятся в третьем периоде, стоят друг за другом и имеют порядковые номера - 13,14,15 соответственно. В периоде увеличивается электроотрицательность (а с ней и неметаллические свойства) и уменьшается радиус, но увеличивается заряд ядер атомов (равен порядковому номеру). Правильный ответ - 12.
Задание №17.
Для метана характерны следующие утверждения
1. В состав молекулы входят два атома углерода
2. Характерны реакции присоединения
3. Не растворяется в воде
4. Обесцвечивает бромную воду
5. Вступает с хлором в реакции замещения
Объяснение: формула метана - СН4, это алкан, то есть он не вступает в реакции присоединения (значит бромную воду не может обесцвечивать как этилен). Но вступает в реакцию замещения с хлором и не растворяется в воде. Правильный ответ - 35.
Задание №18.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
А) Fe и Ag 1. AgNO3(р-р)
Б) CaO и CaCO3 2. Фенолфталеин
В) NH3(р-р) и NH4Cl(р-р) 3. Na2SO4
Объяснение: железо и серебро будем различать соляной кислотой, так как с железом она будет реагировать, а с серебром - нет (растворы кислот реагируют с металлами до водорода), соляной кислотой отличим и оксид кальция от карбоната кальция: при реакции с карбонатом кальция выделится углекислый газ. Раствор аммиак имеет щелочную среду, а раствор хлорида аммиака - кислую, что нам покажет индикатор - фенолфталеин. Правильный ответ - 442.
Задание №19.
Установите соответствие между названием вещества и реагентами, с которыми это вещество может взаимодействовать.
Название вещества Реагенты
А) Фтор 1. ZnO, Mg
Б) Соляная кислота 2. Al, H2O
В) Хлорид натрия 3. SiO2, CuO
4. H2SO4(конц), AgNO3(р-р)
Объяснение: фтор реагирует с алюминием с образованием соли и с водой (с образованием фтороводорода и кислорода). Соляная кислота реагирует с оксидом цинка (реакция обмена) и магнием (реакция замещения водорода). Хлорид натрия реагирует с концентрированной серной кислотой и нитратом серебра (качественная реакция на хлорид-ионы). Правильный ответ - 214.
Задание №20.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
CuSO4 + KI → K2SO4 + CuI + I2
Определите окислитель и восстановитель.
Объяснение: CuSO4 + KI → K2SO4 + CuI + I2
В данной реакции меняют степени окисления йод и медь. Запишем электронно-ионный баланс.
Cu(+2) +1e→ Cu(+1) | 2 (окислитель)
2I‾ -2e→ I2° | 1 (восстановитель)
Ставим двойку перед йодидом калия (так как она есть в балансе) и перед медью. Двойку перед йодидом калия поменяем на 4, так как в правой части получилось 4 йода. Уравниваем калий справа и сульфат-ионы, получаем такой результат:
2CuSO4 + 4KI → 2K2SO4 + 2CuI + I2
Задание №21.
К раствору нитрата бария добавили 200 г раствора серной кислоты и получили 9,32 г соли. Какова массовая доля кислоты (в %) в исходном растворе?
Объяснение: запишем уравнение реакции, найдем количество вещества сульфата бария, такое же количество вещества и серной кислоты, найдем массу кислоты (вещества), затем найдем массовую долю.
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
n(BaSO4) = 9,32/235 = 0,04 моль
n(H2SO4) = n(BaSO4) = 0,04 моль
m(H2SO4 вещества) = 0,04 x 98 = 3,92 г
ω(H2SO4) = 3,92/200 x 100% = 1,96%
Ответ: массовая доля кислоты в исходном растворе равна 1,96%.
Задание №22.
Даны вещества: CuCl2, H2SO4(), Fe, Na2O, KOH, Na2SO4. Используя воду и необходимые вещества только из этого списка, получите в две стадии гидроксид железа (II). Опишите признаки проведения реакций. Для реакции ионного обмена напишите сокращенное ионное уравнение реакции.
Объяснение: есть несколько способов получить нужное вещество. Приведем один из них.
Верны ли следующие суждения о свойствах щелочных металлов и их соединений?
1. Все щелочные метталы реагируют с кислородом только при повышение температуры 2.
Оксиды щелочных металлов проявляются амфотерные свойства.

1. Все щелочные метталы реагируют с кислородом только при повышение температуры
нет они окисляются и при комнатной
Оксиды щелочных металлов проявляются амфотерные свойства я бы не сказал.

Щелочной металл + кислота→ что должно получится?
Щелочной металл + кислота→ что должно получится?
Щелочной металл + кислотный оксид→ ?

Какую валентность проявляют щелочные металлы в оксидах и гидроксидах?
Какую валентность проявляют щелочные металлы в оксидах и гидроксидах?
Напишите уравнения образования оксида и гидроксида щелочного металла лития.

Окислительные или востановительные свойства проявляют щелочные металлы при взаимодействии с неметаллами?
Окислительные или востановительные свойства проявляют щелочные металлы при взаимодействии с неметаллами.

Химические свойства щелочных металлов, с примерами?
Химические свойства щелочных металлов, с примерами.
Каковы общие физические свойства щелочных металлов?
Каковы общие физические свойства щелочных металлов?
Свойства щелочных металлов?
Свойства щелочных металлов.
Общие свойство металлов?
Общие свойство металлов.

Охарактеризуйте физические свойства щелочно - земельных металлов?
Охарактеризуйте физические свойства щелочно - земельных металлов.
Верны ли следующие суждения о строении атомов и свойствах щелочных металлов?
А. Атомы щелочных металлов в основном состоянии имеют электронную конфигурацию внешнего энергетического уровня ns1.

С чем реагируют щелочно - земельные металлы?
С чем реагируют щелочно - земельные металлы?
Я про алюминийАлюминий – легкий, прочный и пластичный металл. Это один из самых востребованных металлов, и по темпам роста потребления он давно и с большим отрывом оставил позади сталь, никель, медь и цинк. Алюминий без преувеличений можно назвать ..
Тому що рН показує ступінь концентрації катіонів гідрогену у воді, що є дуже важливим для косметики.

1. дано N(NH3) = 4. 816 * 10 ^ 23 - - - - - - - - - - - - - - - - - - - - - - - - - - - - - V(NH3) - ? N(NH3) / N(A) = V(NH3) / Vm V(NH3) = N(NH3) * Vm / N(A) = 4. 816 * 10 ^ 23 * 22. 4 / 6. 02 * 10 ^ 23 = 15. 58 L ответ 15. 58 л 2) дано m(O2)..
Соотвественно правильным ответом будет являться : 4) KCl ; 5) AgCl ; 6) NH4Cl.
Дано W(O) = 47 % - - - - - - - - - - - - - - - - E - ? Е - это неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 - это алюминий Al2O3 ответ алюминий.
Напиши нормально не понятно или сфоткай.

В SO3 32 / (32 + 3 * 16) = 0, 4 или 40 %.
Реакции есть на фотографии.
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O соляная кислота отдаёт в свободном виде половину имеющегося хлора. M(Cl общ. ) = 1000 * 0, 365 * 0, 9726 = 355 г масса выделившегося хлора = 355 / 2 = 177, 5 г.

Типы химической реакции соединение, разложение замещение.
© 2000-2022. При полном или частичном использовании материалов ссылка обязательна. 16+
Сайт защищён технологией reCAPTCHA, к которой применяются Политика конфиденциальности и Условия использования от Google.
Читайте также:
