Вещества состоящие из ионов металла и неметалла называются
Обновлено: 04.10.2024
видами химической связи являются ионная, ковалентная. Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар) , которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12.
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или отдачи электронов Ионная связь характерна для солей и щелочей. Сущность ионной связи лучше рассмотреть на примере образования хлорида натрия. Натрий, как щелочной металл, склонен отдавать электрон, находящийся на внешнем электронном слое. Хлор же, наоборот, стремится присоединить к себе один электрон. В результате натрий отдает свой электрон хлору.
В итоге образуются противоположно заряженные частицы — ионы Na+ и Сl-, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами.
виды химической связи
1. ионная (NaCl)
2. ковалентная
2.1 полярная (C=O)
2.2 неполярная (O=O)
3. водородная
4. металлическая
1. ионная (NaCl)
2. ковалентная
2.1 полярная (C=O)
2.2 неполярная (O=O)
3. водородная
4. металлическая
5.похожа на водородную только с другими элементами
6.Донор акцепторная
В итоге образуются противоположно заряженные частицы — ионы Na+ и Сl-, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами.
2 Нравится Пожаловаться
В итоге образуются противоположно заряженные частицы — ионы Na+ и Сl-, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами.
Нравится Пожаловаться
видами химической связи являются ионная, ковалентная. 1. ионная (NaCl)
2. ковалентная
2.1 полярная (C=O)
2.2 неполярная (O=O
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12.
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Простые и сложные вещества
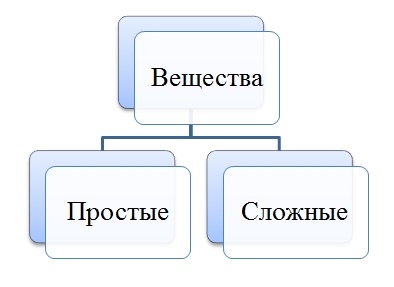
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: H2, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: H2O, NH3, OF2, H2SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
- С - алмаз, графит, карбин, фуллерен.
- O - кислород, озон.
- S - ромбическая, моноклинная, пластическая.
- P - белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).
Основные классы неорганических веществ
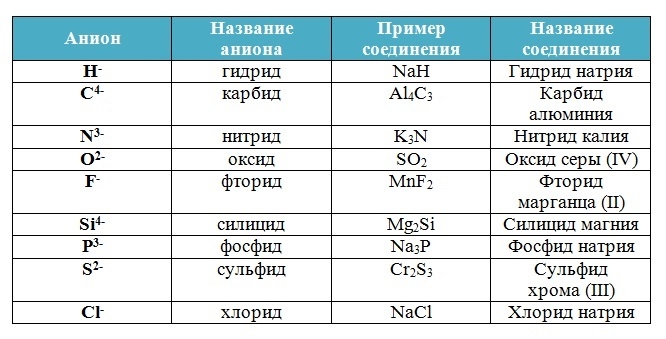
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Соответствие кислотных оксидов и кислот
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
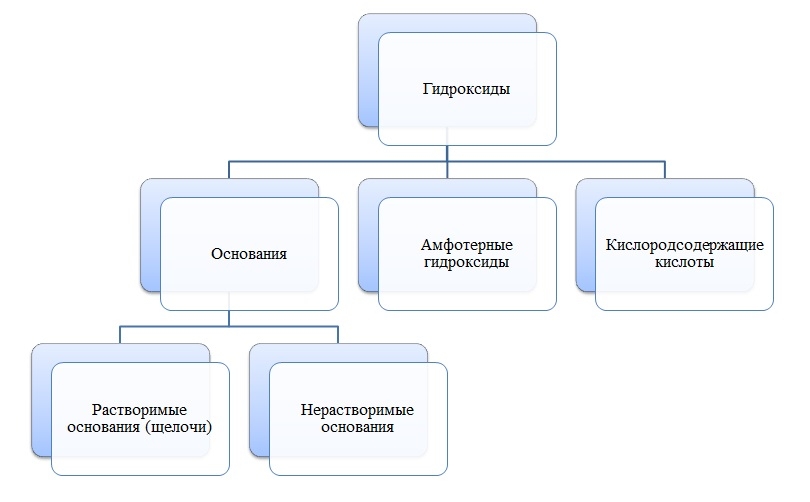
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония NH4+
NaOH, NH4OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
H2SO4, HNO3, H2Cr2O7, HMnO4
Соли- соединения, состоящие из катионов металлов (или NH4+) и кислотных остатков.
Вопрос по Химии за 8 класс
Какие сходства и различия существуют между основными видами химических связей (Полярная и Неполярная ковалентная связь, Донорно- акцепторная связь, Ионная связь)?
Химическая связь — это взаимодействие частиц (атомов, ионов) , осуществляемое путем обмена электронами. Различают несколько видов связи.
При ответе на данный вопрос следует подробно остановиться на характеристике ковалентной и ионной связи.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар) , которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: (на схеме электроны обозначены точками) .
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд, а на атоме водорода — частичный положительный . Таким образом, молекула становится полярной:
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или
отдачи электронов Ионная связь характерна для солей и щелочей. Сущность ионной связи лучше рассмотреть на примере образования хлорида натрия. Натрий, как щелочной металл, склонен отдавать электрон, находящийся на внешнем электронном слое. Хлор же, наоборот, стремится присоединить к себе один электрон. В результате натрий отдает свой электрон хлору.
В итоге образуются противоположно заряженные
частицы — ионы Na+ и Сl-, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами.
После рассмотрения каждого вида связи следует перейти к их сравнительной характеристике.
Для ковалентной неполярной, полярной и ионной связи общим является участие в образовании связи внешних электронов, которые еще называют валентными. Различие же состоит в том, насколько электроны, участвующие в образовании связи, становятся общими. Если эти электроны в одинаковой мере принадлежат обоим атомам, то связь ковалент-ная неполярная; если эти электроны смещены к одному атому больше, чем другому, то связь ковалент-ная полярная. В случае, если электроны, участвую щие в образовании связи, принадлежат одному атому, то связь ионная.
Металлическая связь — связь между ион-атомами в кристаллической решетке металлов и сплавах, осуществляемая за счет притяжения свободно перемещающихся (по кристаллу) электронов (Mg, Fe).
Все вышеперечисленные отличия в механизме образования связи объясняют различие в свойствах веществ с разными видами связей.
Ионная связь
В этом материале речь пойдет о том, что такое ионная связь и чем она отличается от других видов, которые изучают на уроках химии в 8 классе.
О чем эта статья:
Общие сведения о химических связях
Давайте вспомним, как образуются химические связи. Для этого представим атом: он состоит из ядра с положительным зарядом и набора отрицательно заряженных электронов, которые располагаются на нескольких уровнях. Внешний уровень называется валентным, на нем располагаются валентные электроны. Они могут образовывать пары или быть свободными, т. е. неспаренными.
Во взаимодействии двух атомов участвуют свободные электроны внешней оболочки. Сколько таких электронов имеется у атома — столько химических связей он может образовать.
При этом каждый атом стремится приобрести устойчивую конфигурацию — двух- или восьмиэлектронную внешнюю оболочку, подобную той, что есть у инертного газа. Атом может достичь ее, отдавая или принимая часть электронов, а также образуя общую электронную пару с другим атомом. Если в результате получается два разноименно заряженных иона, говорят об ионном типе связи. Он характерен для взаимодействия атомов металла и неметалла.
Определение ионной связи
Рассмотрим этот тип связи на примере реакции натрия и водорода, в результате которой получается гидрид натрия. У атома натрия Na есть один свободный электрон на внешнем уровне, в то время как атому водорода H не хватает одного электрона, чтобы завершить внешнюю оболочку и принять стабильную форму. Поскольку натрий имеет более низкую электроотрицательность, чем водород, он отдает свой валентный электрон и получает отрицательный заряд. Водород принимает этот электрон и получает положительный заряд. В итоге образуется два иона — катион Na + и анион H - .
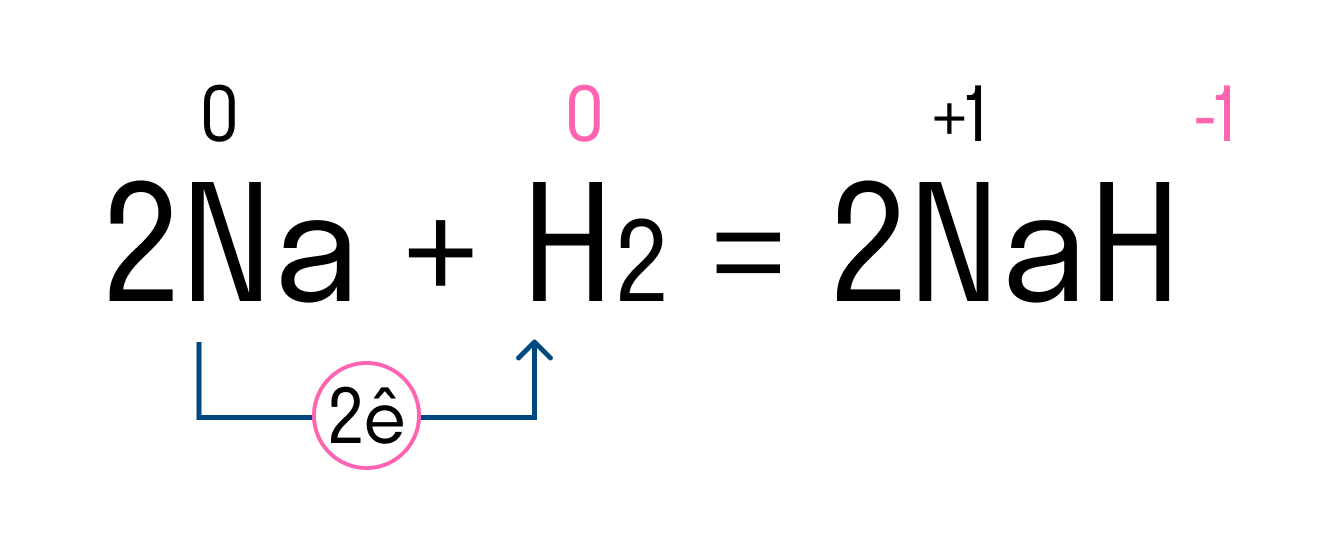
Между положительным ионом Na + и отрицательным H - возникает электростатическое притяжение, которое и удерживает их вместе. Так образуется ионная связь в гидриде натрия.
Ионная связь — это тип химической связи, характерный для разноименно заряженных ионов, которые образовались в результате отдачи и присоединения электронов атомами. В нее вступают элементы с большой разностью электроотрицательности. Обычно так взаимодействуют атомы металла и неметалла.
Чаще всего именно так связаны в соединениях щелочные и щелочноземельные металлы с галогенами. Поскольку у щелочных металлов электроотрицательность ниже, их атомы становятся катионами, а атомы галогенов — анионами.
Механизм образования ионной связи похож на донорно-акцепторный механизм ковалентной связи. Первую даже называют крайним выражением второй.
Соли аммония NH4NO3, NH4Cl, (NH4)2SO4 хоть и не являются соединениями металла и неметалла, но также образованы с помощью ионной связи.
Координационное число
Вернемся к нашему примеру с гидридом натрия и посмотрим на кристаллическую решетку, которую имеет это ионное соединение. Каждый ион Na + контактирует с шестью ионами H - . Это максимально возможное для данного иона число химических связей, оно называется координационным.
Координационное число — это количество ближайших соседей иона в ионной кристаллической решетке. По сути это количество связей, которые образует каждый ион в составе сложного вещества.
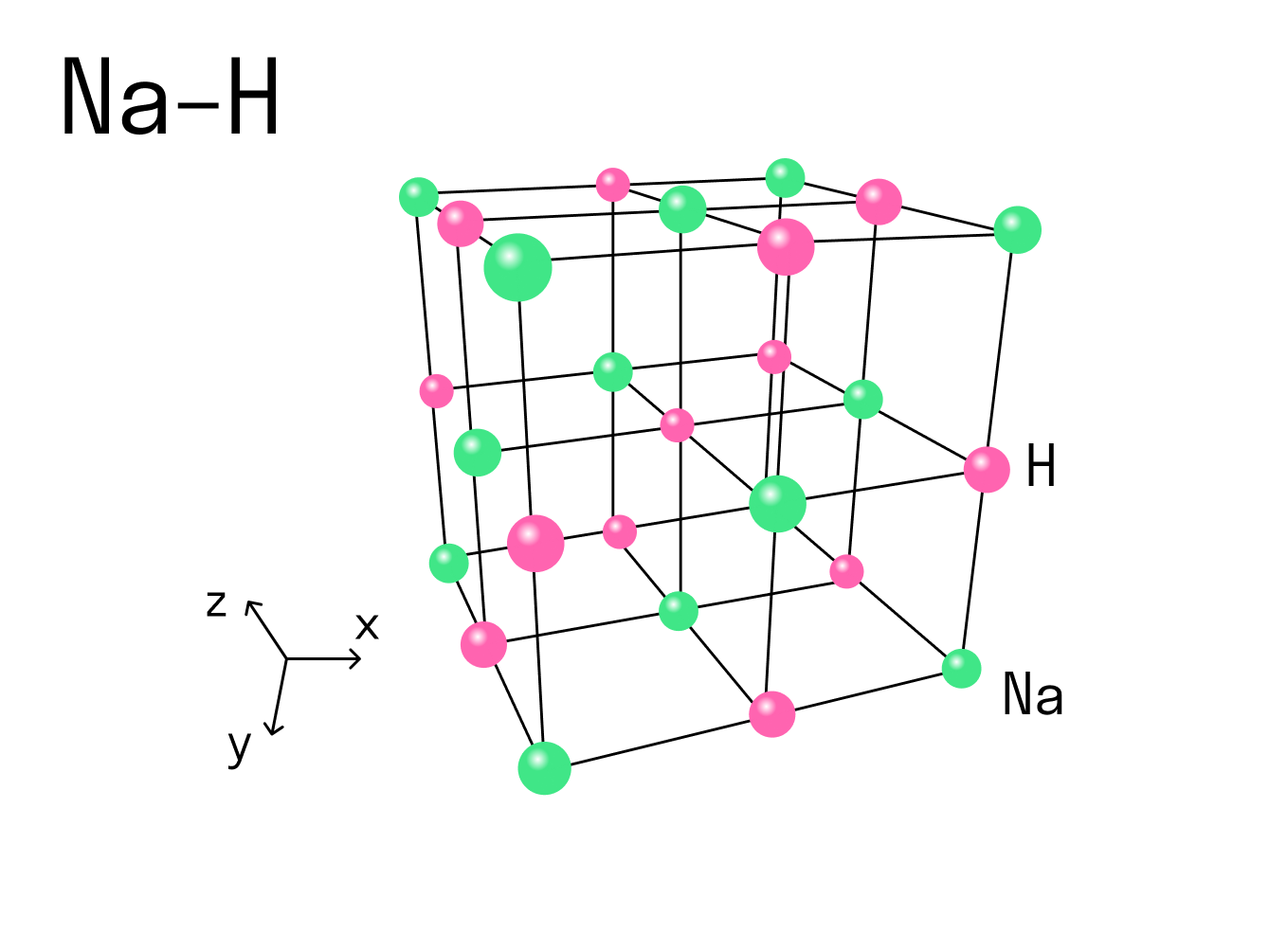
При рассмотрении ковалентной химической связи говорят о валентности — она характеризует, сколько связей есть у конкретного атома с другими атомами. Но к ионным соединениям это понятие не применяют, потому что все ионы в кристаллической решетке взаимодействуют друг с другом. Вместо этого есть координационное число, и оно отражает количество таких взаимодействий.
Примеры веществ с ионной связью
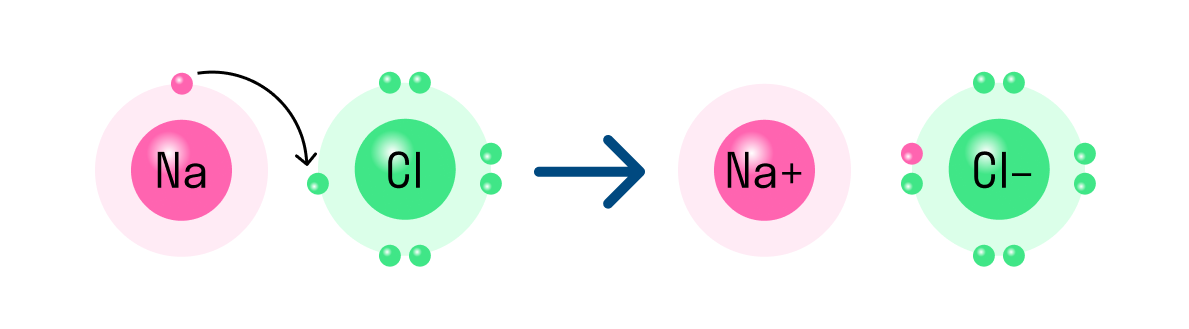
Таким же образом, как в гидриде натрия, ионы образуются и в других подобных ему соединениях. Например, в хлориде натрия NaCl атом натрия имеет один свободный электрон и отдает его атому хлора. В итоге оба завершают свой внешний уровень. Образуется ион натрия с положительным зарядом и отрицательно заряженный ион хлора.
Другой пример ионной химической связи — сульфид натрия Na2S. В данном случае у нас также есть натрий с одним свободным электроном и сера, у которой на внешнем уровне есть 2 свободных электрона из 6. Таким образом, чтобы завершить уровень и обрести стабильную форму, сере нужно 2 электрона. Поэтому в формуле сульфида серы присутствует два атома натрия.
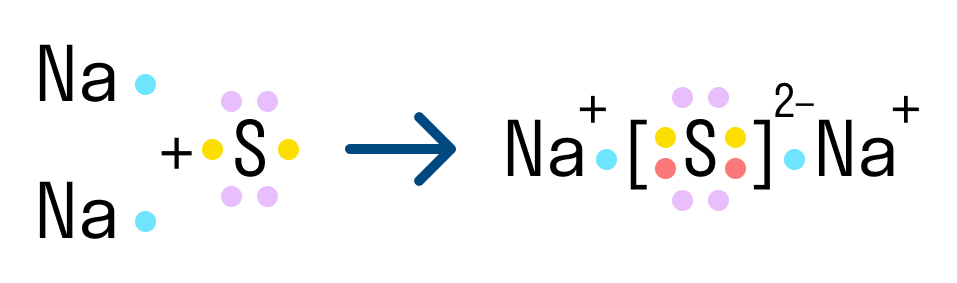
Характеристики ионной связи
Мы узнали, как образуется ионная связь, а теперь поговорим о ее характеристиках. Она существенно отличается от других типов связи между атомами.
не имеет кратности.
Разберемся в каждом пункте и начнем с направленности. Ковалентная полярная связь направлена, потому что она подразумевает смещение общей электронной пары к тому атому, который имеет большую электроотрицательность. В случае с ионами все иначе. Согласно закону Кулона притяжение между отрицательным и положительным ионом идет по прямой, соединяющей эти заряженные частицы. В кристаллической решетке все разноименно заряженные ионы взаимодействуют друг с другом и притяжение распределяется равномерно, поэтому говорят, что ионная связь не направлена.
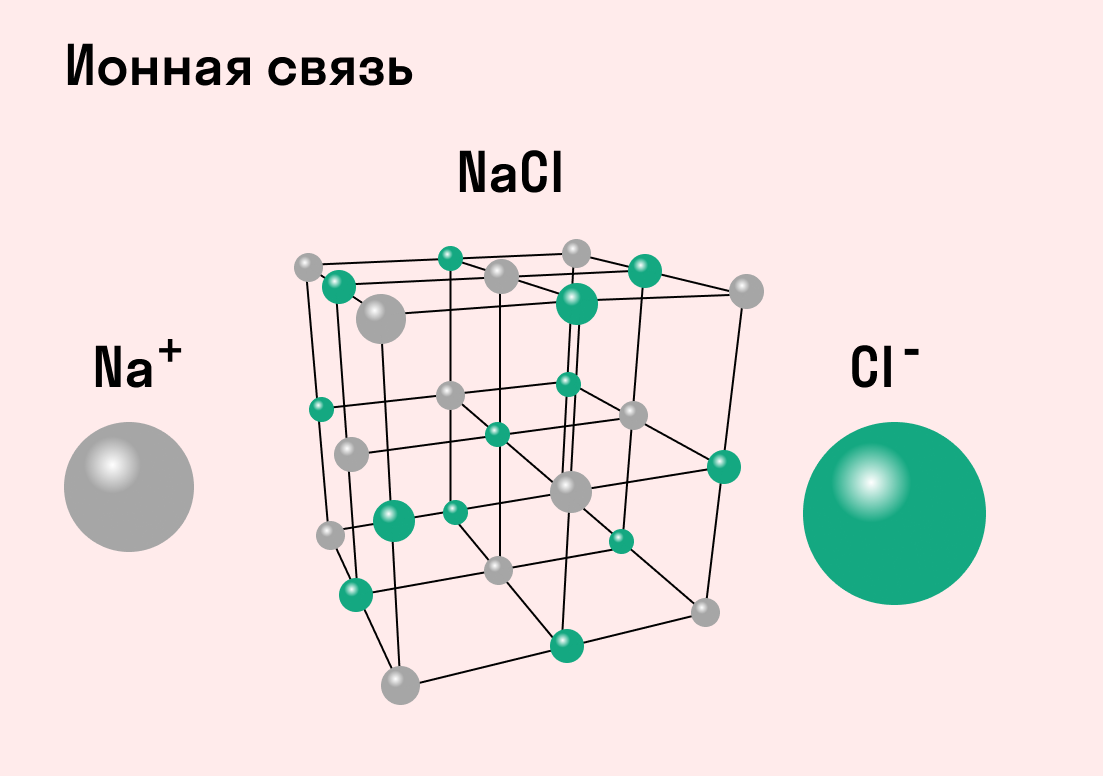
А как насчет насыщаемости? Эта характеристика указывает на то, что атом может вступить в ограниченное количество химических связей, поскольку имеет ограниченное число неспаренных электронов. Но ионная связь — это не процесс соединения свободных электронов в пары, а взаимное притяжение ионов. Каждый ион может притягивать к себе неограниченное число ближайших соседей, поэтому нет смысла говорить о насыщаемости.
Из вышесказанного понятно, что ионная связь не имеет и кратности. Эта характеристика означает число общих электронных пар у атома, но в данном случае мы рассматриваем притяжение между ионами.

Физические свойства ионной связи
Между ионами в молекуле всегда образуется достаточно сильное притяжение, поэтому вещества с ионной связью в обычных условиях твердые и нелетучие. Такие соединения сложно разрушить при помощи тепловой энергии, что обуславливает высокую температуру кипения и плавления. При этом ионы имеют небольшой радиус взаимодействия — это придает веществам хрупкость.
Свойства ионных соединений:
растворимость в воде,
Типичным веществом с ионными связями можно считать хлорид натрия NaCl или поваренную соль. Ее кристаллы в точности соответствуют всем характеристикам.
Как определить ионную связь
Чтобы быстро понять, является ли нужное нам соединение ионным, выполните следующие действия:
Посмотрите, какие элементы входят в состав соединения. Формула вещества с ионной связью должна включать металл и неметалл. Если это щелочной металл (I группа таблицы Менделеева) и галоген (VII группа), то связь между ними точно ионная.
По шкале Полинга определите электроотрицательности обоих элементов соединения. Если разница между ними больше 1,7 — связь ионная. Это объясняется тем, что такой тип связи характерен для веществ, у которых сильно отличаются показатели электроотрицательности.
Дополнительным способом убедиться в правильности результата может стать оценка физических свойств вещества. Если оно имеет высокую температуру кипения или плавления и проводит электроток — связь скорее всего ионная.
Вопросы для самопроверки:
Опишите, как образуется ионная связь. Какие условия для этого необходимы?
Что такое координационное число элемента в ионном соединении?
Каковы основные физические свойства ионных соединений?
В чем разница между характеристиками ионной и ковалентной связей?
Как можно определить ионную связь, зная электроотрицательность элементов в соединении?

Из этой статьи вы узнаете, какие вещества называются простыми, а какие сложными, в чем их различия и особенности строения.
Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
Проведите диагональ от 5-го до 85-го номера химических элементов.
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
Характеристика химического элемента
Характеристика простого вещества
Расположение в периодической системе (атомный номер, номер группы или периода)
Относительная атомная масса
Строение атома (число электронов, протонов или нейтронов, количество заполненных энергетических уровней)
Распространенность в природе
Содержание в соединении (например, в растительных белках или аминокислотах)
Значения электроотрицательности, сродства к электрону, энергии ионизации
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
Влияние на живой организм
Температуры кипения и плавления
Взаимодействие с другими веществами
Содержание в каких-либо смесях веществ (например, газов)
Аллотропия
Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
Образующиеся простые вещества называют аллотропными модификациями.
Аллотропия характерна для следующих химических элементов:
углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
фосфор (красный, белый и черный);
кислород (кислород и озон);
кремний (аморфный и кристаллический);
Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of "Crystal" by manfredxy on Envato Elements.
The image 2 is a derivative of "Rough Graphite rock" by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
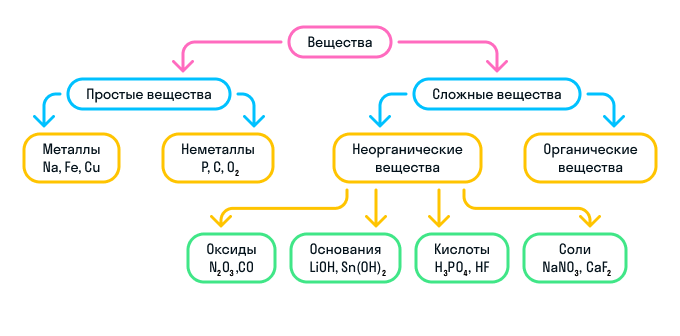
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
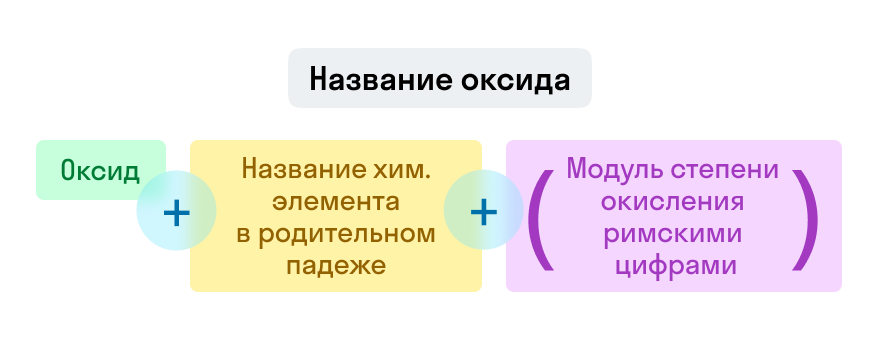
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три;
Na2O — оксид натрия. Читается: натрий два о.
Основания
Примеры названий гидроксидов:
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
Примеры названий солей:
KNO3 — нитрат калия. Читается: калий эн о три;
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
Читайте также:
