Двойной электрический слой на границе металл раствор
Обновлено: 18.05.2024
Скачок потенциала (или разность потенциалов, т.е. гальвани-потенциал), который возникает на границе соприкосновения металла с электролитом, называется электродным потенциалом. Причиной его появления является возникновение двойного электрического слоя на границе металл – раствор при помещении металла (проводника I рода) в раствор его собственной соли (проводника II рода). Для того, чтобы понять механизм электрохимических процессов, протекающих при этом, необходимо иметь представление о строении двойного электрического слоя.
Представление о двойном электрическом слое (ДЭС) развивалось на основе различных теорий, каждая из которых внесла свой положительный вклад в развитие этого представления и имеет свои недостатки.
А Б В
А б
Рис. 7.14. Двойной электрический слой
а – по Гельмгольцу; б – по Гуи – Чапмену:
АБ – плотная часть; БВ – диффузионная часть
Основное модельное представление о строении ДЭС дает теория Гельмгольца, которая рассматривает только электростатическое взаимо-действие ионов с металлом. Согласно этой теории заряды на поверхности металла притягивают из раствора ионы противоположного знака и отталкивают одноименно заряженные с ним ионы. Поэтому ДЭС по Гельмгольцу аналогичен плоскому конденсатору, если считать, что заряды равномерно «размазаны» вдоль поверхности металла (рис. 7.14, а)
Теория Гуи и Чапмена учитывает и тепловое движение ионов. Модель ДЭС дополняет теория О. Штерна, которая учитывает реальный размер ионов, а также возможность специфической адсорбции ионов. Ряд усовершенствований в теорию О. Штерна внесли А. Фрумкин, О. Есин, Е. Эрмлер, Д. Грэм и другие.
Двойной электрический слой на границе металл – раствор возникает за счет электрических зарядов, находящихся на металле, и ионов противоположного знака, ориентированных у поверхности металла. В формировании ионной обкладки ДЭС принимают участие как электро-статические силы, так и силы теплового движения, в результате действия которых двойной электрический слой приобретает размытое (диффузное) строение.
В общем случае под строением ДЭС понимают распределение зарядов в его ионной обкладке, которую упрощенно можно разделить на две части:
1. Плотную или гельмгольцевскую, образованную ионами, практически вплотную подошедшими к металлу.
2. Диффузную, созданную ионами, находящимися на расстояниях от металла, превышающих радиус сольватированного иона. Толщина плотной части порядка 10 – 8 см, диффузной – 10 – 7 -10 – 3 см (рис. 7.14, б).
Величина скачка потенциала на границе металл – раствор складывается из падения потенциала y в плотной части двойного слоя и падения потенциала y1, в диффузной.
Строение двойного электрического слоя определяется общей концентрацией (С) раствора. С ее увеличением усиливается процесс, способствующий формированию диффузной части. При этом двойной слой сжимается, что приводит к изменению y1. В концентрированных растворах диффузная часть практически отсутствует, и двойной электрический слой подобен плоскому конденсатору (рис. 7.15), где:
При установлении равновесия происходит выравнивание электрохимичес-ких потенциалов ионов Ме z + в растворе и в кристаллической решетке металла:
4.5. Двойной электрический слой.
Электрокинетические явления
80. ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ (ИОННЫЙ) СЛОЙ - слой ионов, образующихся на поверхности частиц в результате адсорбции ионов из раствора или диссоциации поверхностного соединения. Ионы, непосредственно связанные с поверхностью и придающие ей заряд, называются потенциалопределяющими. Ионы противоположного знака, которые непосредственно не адсорбируются, но под действием сил электростатического притяжения остаются вблизи адсорбированных ионов, называются противоионами.
Распределение противоионов определяется двумя противоположными факторами: электростатическим и адсорбционным притяжениями, удерживающими противоионы у поверхности, и диффузией этих ионов, выравнивающей их концентрации в поверхностном слое и объеме. Устанавливается равновесное распределение зарядов с убывающей плотностью по направлению от поверхности частиц.
Согласно современной теории двойного слоя, учитывающей размеры ионов, внешнюю обкладку можно разделить на два слоя: адсорбционный слой ионов, приближенных вплотную к поверхности, и диффузный.
Адсорбционный слой, в который входят потенциалопределяющие ионы и прочно связанные противоионы, обычно неподвижен и перемещается вместе с ядром.
Граница (плоскость) скольжения устанавливается при относительном перемещении фаз. Предполагается, что плоскость скольжения разделяет адсорбционную и диффузную части двойного слоя или несколько смещена в жидкую фазу, оставляя часть противоионов диффузного слоя в неподвижном слое жидкости.
81. ТЕРМОДИНАМИЧЕСКИЙ ПОТЕНЦИАЛ - полный скачок потенциала между твердой фазой и раствором, соответствует работе перемещения грамм-эквивалента ионов из объема раствора на поверхность.
82. ЭЛЕКТРОКИНЕТИЧЕСКИЙ ПОТЕНЦИАЛ - потенциал на границе скольжения, определяемый свободными противоионами (образующими диффузный слой) и соответствующий работе перемещения грамм-эквивалента ионов из объема раствора на плоскость скольжения.
83. ПЕРЕЗАРЯДКА - явление, имеющее место при введении в систему специфически адсорбирующихся, как правило поливалентных, противоионов. В результате сверхэквивалентной адсорбции ионов число их в адсорбционном слое становится больше количества потенциалопределяющих ионов, что вызывает перемену знака заряда коллоидной частицы. Для компенсации этого заряда образуется новый диффузный слой противоионов.
86. ЭЛЕКТРОФОРЕЗ - движение частиц дисперсной фазы в неподвижной дисперсионной среде под действием приложенного напряжения.
87. ЭЛЕКТРООСМОС - движение жидкости относительно неподвижной твердой поверхности пористых мембран под действие приложенного напряжения.
88. ПОТЕНЦИАЛ ОСЕДАНИЯ (эффект ДОРНА) - возникновение разности потенциалов при движении частиц в неподвижной жидкости.
89. ПОТЕНЦИАЛ ПРОТЕКАНИЯ (эффект КВИНКЕ) - возникновение разности потенциалов при движении жидкости относительно неподвижной твердой поверхности.
90. ПРАВИЛО ФАЯНСА-ПЕСКОВА - на поверхности твердого вещества преимущественно адсорбируются ионы, способные достраивать его кристаллическую решетку, т.е. быть ионами, ее составляющими или изоморфными, или образовывать с ионами решетки труднорастворимые соединения.
Двойной электрический слой
Двойн о й электр и ческий сл о й, два весьма близких друг к другу слоя электрических зарядов разного знака, но с одинаковой поверхностной плотностью, возникающие на границе раздела двух фаз. Двойной электрический слой в целом электронейтрален. При пересечении двойного электрического слоя электрический потенциал изменяется скачком. Двойной электрический слой на поверхности металла возникает из-за того, что электроны металла несколько выходят за пределы решётки, образованной положительными ионами. Скачок потенциала в таком двойном электрическом слое является составной частью работы выхода электрона из металла.
Для электрохимии большое значение имеет двойной электрический слой на границе раздела металл — электролит. При погружении металла в раствор, содержащий ионы этого металла, образуется специфический для границы электрод — раствор ионный двойной электрический слой дополнительно к двойному электрическому слою существовавшему на поверхности металла до погружения, и двойному электрическому слою, возникающему в результате ориентации полярных молекул растворителя (например, воды) у поверхности металла. Так, при погружении серебряной пластинки в раствор KNO3 , содержащий очень мало AgNO3, ионы Ag+ переходят из металла в раствор, избыточные электроны в металле заряжают его поверхность отрицательно и притягивают из раствора ионы К + , образующие у поверхности вторую (положительную) обкладку двойного электрического слоя (см. рис.). Возникающий скачок потенциала приостанавливает дальнейший переход ионов Ag+, и наступает равновесие электрода с раствором. Если концентрация AgNO3 в растворе велика, то, наоборот, ионы Ag+ из раствора переходят в металл, его поверхность заряжается положительно и притягивает из раствора ионы NO3 Существует промежуточная концентрация ионов металла, при которой поверхность металла не заряжается; соответствующий потенциал электрода называется потенциалом нулевого заряда, или нулевой точкой. Важное понятие о нулевой точке как величине, характерной для данного электрода, введено в электрохимию советским учёным А. Н. Фрумкиным.
На ионы в двойном электрическом слое действуют одновременно электростатические силы и силы теплового движения. В результате взаимно противоположного влияния этих сил лишь часть ионов остаётся непосредственно вблизи поверхности электрода (плотная часть двойного электрического слоя, или слой Гельмгольца), а остальные распределяются диффузно в растворе на некотором расстоянии от электрода (диффузный двойной электрический слой, или слой Гуи). Степень диффузности увеличивается с ростом температуры, а также при уменьшении концентрации раствора электролита и при уменьшении заряда электрода. Средняя толщина плотной части двойного электрического слоя порядка радиуса иона (несколько А), поэтому двойной электрический слой обладает высокой электрической ёмкостью (~10 -5 ф/см 2 ) и внутри него действует сильное электрическое поле (~10 6 в/см).
Строение двойного электрического слоя оказывает большое влияние на электрические свойства межфазных границ и на протекающие на них процессы — прежде всего, на механизм и кинетику электрохимических реакций, на электрокинетические явления, на устойчивость коллоидных систем и т. п. Для исследования двойного электрического слоя используются методы измерения поверхностного натяжения и ёмкости, адсорбционные измерения и др.
Лит.: Фрумкин А. Н., Багоцкий В.С., Иофа З. А., Кабанов Б. Н., Кинетика электродных процессов, М., 1952; Парсонс Р., Равновесные свойства заряженных межфазных границ, в кн.: Некоторые проблемы современной электрохимии, пер. с англ., М., 1958; Делахе и П., Двойной слой и кинетика электродных процессов, пер. с англ., М., 1967.
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ, тонкий поверхностный слой из пространственно разделенных электрич. зарядов противоположного знака, образующийся на границе двух фаз. Поскольку пространств. разделение зарядов всегда сопровождается возникновением электрич. разности потенциалов, двойной электрический слой можно рассматривать как своеобразный микроконденсатор, расстояние между обкладками к-рого определяется молекулярными размерами. Образование двойного электрического слоя оказывает существенное влияние на скорость электродных процессов, адсорбцию ионов и нейтральных молекул, устойчивость дисперсных систем, смачиваемость, коэф. трения и др. св-ва межфазных границ. В биол. системах процессы образования и разрушения двойного электрического слоя на клеточных мембранах сопровождают распространение электрич. импульсов вдоль нервных и мышечных волокон. Наиб. детально строение двойного электрического слоя изучено на границе между металлич. электродом и р-ром электролита. При погружении металлич. электрода М в р-р электролита, содержащий ионы этого металла М + (потенциалопределяющие ионы), устанавливается электрохим. равновесие, сопровождаемое выравниванием электрохим. потенциалов этих ионов в кристаллич. решетке металла и в р-ре. Если первоначально электрохим. потенциал ионов М + в металле , то в процессе выравнивания этих величин нек-рое кол-во ионов М + переходит из металла в р-р и пов-сть металла заряжается отрицательно. Притянутые к ней кулоновскими силами катионы из р-ра (не обязательно М + ) образуют положит. обкладку двойного электрического слоя. Возникающая при этом электрич. разность потенциалов препятствует дальнейшему переходу ионов М + из металла в р-р, что и приводит к установлению электрохим. равновесия. Если первоначально не требует перехода ионов М + из металла в р-р или наоборот. В этом случае заряд пов-сти металла равен нулю, а его потенциал, измеренный относительно к.-л. электрода сравнения, наз. потенциалом нулевого заряда. Условия положительно заряженной, отрицательно заряженной и незаряженной пов-сти металла можно осуществить и в том случае, если в р-ре электролита нет потенциалопределяющих ионов.
Для этого необходимо внести в р-р кроме данного металлич. электрода М к.-л. вспомогат. электрод и подсоединить оба электрода к внеш. источнику постоянного напряжения. В зависимости от величины и знака напряжения источника можно произвольно изменять заряд q пов-сти металла М. При q > 0 ионную обкладку двойного электрического слоя образуют притянутые из р-ра анионы, при q < 0 - катионы. При потенциале нулевого заряда, когда q = 0, ионный двойной электрический слой отсутствует, но разность потенциалов на границе р-р|металл (гальвани-потенциал) не равна нулю, т. к. на этой границе существуют т. наз. адсорбционный и электронный двойные электрические слои. Адсорбц. двойной электрический слой связан с некулоновской (специфической) адсорбцией ионов или полярных молекул. Так, напр., на границе ртуть|водный р-р KI при q = 0 донорно-акцепторное взаимод. приводит к специфич. адсорбции анионов I - , к-рые уже вследствие кулоновского взаимод. притягивают эквивалентное кол-во катионов К + . При этом электрич. центры анионов I - оказываются ближе к пов-сти ртути, чем электрич. центры катионов К + , и пространств. разделение зарядов ведет к образованию адсорбц. Двойной электрический слой, отрицат. обкладка к-рого обращена в сторону металла. Полярные молекулы р-рителя или растворенных нейтральных в-в, как правило, адсорбируются на электроде таким образом, что средняя нормальная к пов-сти составляющая дипольного момента не равна нулю. Ориентиров. адсорбция диполей поэтому также приводит к образованию адсорбц. двойного электрического слоя. Напр., при адсорбции молекул бутилового спирта из водного р-ра на незаряженной пов-сти ртути гидрофобные углеводородные радикалы С 4 Н 9 , несущие положит. заряд диполя, ориентированы в сторону пов-сти, а гидрофильные ОН-группы, на к-рых сосредоточен отрицат. заряд, ориентированы в сторону р-ра. Адсорбц. двойной электрический слой может образоваться также и при адсорбции неполярных частиц, если их донорно-акцепторное взаимод. с электродом сопровождается возникновением наведенного дипольного момента (напр., при адсорбции на электродах атомов Н или О). Электронный двойной электрический слой обусловлен квантовомех. св-вами электронов в металлах и полупроводниках. Согласно совр. моделям металла как электронного газа и ионного остова электронный двойной электрический слой связывают с тем, что электронный газ несколько выходит за пределы ионного остова, что и приводит к пространств. разделению зарядов. При этом своей положит. обкладкой двойной электрический слой обращен к металлу, отрицательной - к контактирующей с металлом фазе (р-ру или газу). В полупроводниках из-за малого кол-ва носителей тока (электронов в зоне проводимости и "дырок" в валентной зоне) при наложении внеш. напряжения возникает их неравномерное пространств. распределение в поверхностном слое, к-рое рассматривают как электронный двойной электрический слой внутри полупроводниковой фазы. В общем случае двойные электрические слои, вызванные разными причинами, накладываются друг на друга, что приводит к весьма сложной структуре границы раздела между электродом и р-ром. Возникновение двойного электрического слоя на границе непроводящего твердого тела с р-ром связано либо с адсорбцией, либо с взаимод. поверхностных ионогенных групп твердого тела с молекулами р-рителя. Так, напр., кристаллы AgI, полученные по р-ции KI + AgNO 3 : AgI + KNO 3 , в р-рах с избытком KI адсорбируют ионы I - и заряжаются отрицательно, в р-рах с избытком AgNO 3 адсорбируют ионы Ag + и заряжаются положительно. При этом к заряженной пов-сти AgI под действием электростатич. сил притягиваются ионы противоположного знака, образующие ионную обкладку двойного электрического слоя. С другой стороны, взаимод. поверхностных ионогенных групп разл. оксидов с ионами Н 3 О + , ОН - и молекулами воды в зависимости от рН р-ра может приводить либо к положит., либо к отрицат. заряжению пов-сти оксида.
Методы изучения. Для исследования двойного электрического слоя используют в осн. три группы методов. Во-первых, адсорбц. методы, к-рые основаны на том, что образование двойного электрического слоя связано с адсорбцией разл. компонентов р-ра и вызывает изменение их концентрации. В частности, адсорбц. методы широко используют для изучения двойного электрического слоя, образованного на мелкодисперсных частицах в коллоидных системах. Во-вторых, методы, основанные на электрокапиллярных явлениях. Их сущность состоит в том, что образование двойного электрического слоя уменьшает работу, необходимую для создания новой пов-сти раздела фаз, и тем самым приводит к зависимости межфазного натяжения от потенциала электрода. Применение электрокапиллярных методов ограничено границами раздела между жидкими фазами, на к-рых возможно непосредственное измерение межфазного натяжения; для твердых электродов эти методы дают лишь качеств. информацию о строении двойного электрического слоя. В-третьих, методы, регистрирующие кол-во электричества, затраченного на создание определенного заряда электрода (заряжение двойного электрического слоя). Сюда относятся разл. гальваностатич. и потенциостатич. импульсные методы, а также метод измерения электрич. емкости двойного электрического слоя с помощью синусоидального переменного тока (см. Импедансный метод). Для успешного применения этих методов необходимо, чтобы все подведенное к электроду электричество затрачивалось только на заряжение двойного электрического слоя и не расходовалось на электрохим. р-ции. Электроды, удовлетворяющие этому требованию, наз. идеально поляризуемыми. Сведения о строении двойного электрического слоя на границе р-р|изолятор можно получить на основе изучения электрокинетических явлений. Д войной электрический слой изучают также с помощью оптич. методов (эллипсометрия, разл. варианты электроотражения света, комбинационное рассеяние в адсорбц. слое и др.). На основе указанных методов можно определить заряд пов-сти электрода q, его зависимость от потенциала электрода Е, потенциал нулевого заряда E q = 0, электрич. емкость двойного электрического слоя, равную дq/дE, а также поверхностные избытки (адсорбции) разл. компонентов р-ра в зависимости от Е (или q)и их объемной концентрации.
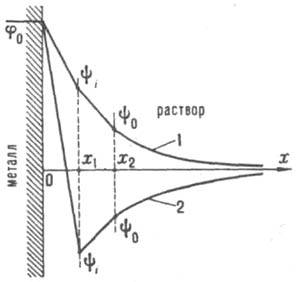
Современная теория двойного электрического слоя, основной вклад в развитие к-рой внесли работы Г. Гелъмгольца (1879), Ж. Гуи (1910), Д. Чапмена (1913), О. Штерна (1924) и Д. Грэма (1947-58), базируется на след. модели ионной обкладки двойного электрического слоя. Благодаря тепловому движению ионы, адсорбировавшиеся на электроде только под действием кулоновских сил, распределяются у пов-сти подобно молекулам газа в земной атмосфере и образуют диффузную часть двойного электрического слоя. Границей диффузной части является т. наз. внеш. плоскость Гелъмгольца х 2 (рис.), до к-рой могут дойти электрич. центры ионов, участвующих в тепловом движении. Между внеш. плоскостью Гельмголъца и пов-стью металла располагается плотная часть двойного электрического слоя, для к-рой характерна диэлектрич. проницаемость существенно меньшая, чем в объеме р-ра. В плотном слое локализуется дипольный двойной электрический слой, образованный ориентированными диполями р-рителя и орг. растворенного в-ва. Кроме того, в плотную часть двойного электрического слоя входят специфически адсорбирующиеся ионы; при этом их электрич. центры образуют т. наз. внутр. плоскость Гельмголъца х 1 .
Схема распределения потенциала в двойном электрическом слое: 1 - при |q 1 | < |q|; 2 - при |q 1 | >|q|
В силу электронейтральности границы раздела плотность заряда q на электроде компенсируется зарядами специфически адсорбиров. ионов (q 1 ) и ионов, находящихся в диффузной части двойного электрического слоя (q 2 ): q= -q 1 -q 2 . Теория двойного электрического слоя позволяет связать величины q и q 1 , с электрич. разностями потенциала в плотной и диффузной частях двойного электрического слоя. Так, падение потенциала в плотной части двойного электрического слоя описывается ур-нием: y u = q/K 02 + q 1 К 12 , где К 02 и K l2 - интегральные емкости соотв. всего плотного слоя и пространства между внутр. и внеш. плоскостями Гельмгольца. Падение потенциала в диффузном слое (потенциал внеш. плоскости Гельмгольца) в р-ре 1,1-валентного электролита с концентрацией с равно: , e 0 - диэлектрич. постоянная, e - диэлектрич. проницаемость р-рителя, a R, Т и F - соотв. газовая постоянная, т-ра и число Фарадея. Потенциал внутр. плоскости Гелъмгольца рассчитывают по ф-ле: y i = (q + l q 1 )/K l2 + y 0 , где l [ 1 - коэф., характеризующий дискретность специфически адсорбиров. ионов. Если |q 1 | > |q|, то говорят, что произошла "перезарядка поверхности" специфически адсорбиров. ионами. В этом случае потенциалы y 0 и y i , имеют знак, противоположный знаку общего скачка потенциала в ионном двойном электрическом слое j 0 = y u + y 0 (см. рис., кривая 2). Для развития теории дипольного двойного электрического слоя, связанного с адсорбцией молекул р-рителя, успешно используется зависимость емкости К 02 от q. Теоретич. расчеты электронного двойного электрического слоя пока крайне противоречивы; с целью упрощения принято считать, что скачок потенциала в электронном двойном электрическом слое металла не зависит от q и потому не вносит вклада в наблюдаемые эффекты. Изучение св-в и строения двойного электрического слоя имеет большое значение для понимания и усовершенствования таких практически важных процессов, как электролиз, электроосаждение металлов, электрохим. р-ции в хим. источниках тока, коррозия металлов, коагуляция в коллоидных системах, флотация, ионный обмен и др.
===
Исп. литература для статьи «ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ» : Дамаскин Б. Б., Петрий О. А., Введение в электрохимическую кинетику, 2 изд., М., 1983; Comprehensive treatise of electrochemistry, ed. by J.O'M. Bockris, B.E. Conway and E. Yeager, v. I, N. Y.-L, 1980. Б. Б. Дамаскин.
Двойной электрический слой. Электродные потенциалы.
1. Электрохимия. Понятие об электродных потенциалах на границе металл/раствор электролита.
2. Таблица стандартных электродных потенциалов. Формула Нернста.
3. Гальванические элементы.
4. Электролиз. Схемы процессов на электродах при электролизе расплавов и водных растворов.
5. Последовательность разрядки ионов на катоде и аноде. Электролиз с нерастворимым и растворимым анодами.
6. Законы электролиза. Применение электролиза в химической технологии.
Задачи изучения темы:
В процессе освоения темы студенты получают представление о электрохимических процессах, электродных потенциалах. Гальванические элементы. Электролиз, последовательность разрядки ионов на катоде и аноде. Применение электролиза.
Студент должен знать:
Формула Нернста для расчета электрохимических потенциалов. Принцип действия гальванического элемента. Расчет ЭДС гальванического элемента. Законы электролиза. Последовательность разрядки ионов на электродах. Электролиз с нерастворимым и растворимым анодами.
Основная и дополнительная литература
2. Ахметов Н.С. Общая и неорганическая химия. М: Высш.шк., 2005. 743 с.
3. Угай Я.А. Общая и неорганическая химия. М: Высш.шк, 2004. 527 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов / под ред. В.А. Рабиновича и др. М.: Интеграл-Пресс, 1997. – 240 с.
5. Некрасов Б.Б. основы общей химии. СПб-М: Высш.шк, 2003 Т. 1, 2.
6. Коровин Н.В. Общая химия. М: Высш.шк., 2005. 557 с.
7. Практикум по общей и неорганической химии: Пособие для студентов вузов. / В.И. Фионов, Т.М. Курохтина, З.Н. Дымова и др.; Под ред. Н.Н. Павлова, В.И. Фролова. – 2-е изд., перераб. и доп. – М.: Дрофа, 2002. – С. 33-47.
Методические разработки кафедры
8. Гаркушин И.К., Лисов Н.И., Немков А.В. Общая химия для технических вузов. Учебное пособие. Самарск. гос. техн. ун-т, Самара. – 2003. – С. 144-166.
9. Тюменцева С.И. Электрохимические процессы. Метод. указания к лабораторной работе.
ЭЛЕКТРОХИМИЯ
Электрохимия – это раздел физической химии, в котором изучаются законы взаимодействия и взаимосвязи химии и электрических явлений, физико-химические свойства ионных систем и процессов на границах раздела фаз с участием заряженных частиц (ē и ионов).
Электрохимия изучает окислительно-восстановительные процессы, которые идут под воздействием постоянного электрического тока, либо сами являются его источником. Т.е. основным предметом ЭХ являются процессы, протекающие на электродах при прохождении тока через растворы (электродные процессы).
ЭХ охватывает все формы взаимодействия между подвижными заряженными частицами в конденсированных фазах как в состоянии равновесия, так и при протекании ОВР на границе раздела и в объеме фаз.
Электрохимиявключает 2 основных раздела:
1) ТД электродных процессов, охватывающая равновесные состояния систем электрод – раствор;
2) кинетика электродных процессов, изучающая законы протекания этих процессов во времени.
Для проведения электрохимического процесса необходима электролитическая ячейка, электролит, электроды и либо источник, либо потребитель постоянного тока. Последнее условие делит все электрохимические процессы на протекающие при электролизе, и в гальванических элементах.
Закономерности ЭХ являются теоретической основой для разработки важных технологических процессов – электролиза и электросинтеза – получение химических продуктов на электродах при прохождении тока через растворы (получение Cl и щелочей, получение и очистка цветных и редких металлов, электросинтез органических соединений), гальванотехника (электропокрытие металлов и получение металлических матриц), создание ХИТ (ГЭ и аккумуляторы, в которых ОВР используется как источник электрического тока), высокотемпературных электролитов, электрокатализ и электрокристаллизация.
ОВР – основа протекания ЭХ процессов.
Двойной электрический слой. Электродные потенциалы.
Особенность электрохимических реакций – это ОВР, протекающие в пограничной области металл (проводник)/раствор, т.е. на поверхности электродов (анода и катода), с участием электронов.
При погружении в воду или раствор соли металлической пластинки, то под действием полярных молекул воды, металл посылает в раствор электроны,
Ме n + + nē ® Ме о
С течением времени устанавливается динамическое равновесие:
Или упрощенно Ме о Ме n + + nē
Выделяют два случая (для активных и малоактивных металлов):
1. активные металлы при погружении в растворы своих солей, даже незначительных концентраций, легко посылают ионы в раствор.
| на примере цинковой пластинки | Zn о – 2ē ® Zn 2+ электрод/р-р электролита Электроны остаются на пластинке и заряжают ее «–», ионы цинка перешедшие в раствор заряжают жидкость «+». На границе раздела металлической пластинки (электрода) с раствором электролита, возникает двойной электрический слой толщиной 10 –7 см с определенной разностью потенциалов. |
2. малоактивные металлы
| на примере медной пластинки | Сu 2+ + 2ē → Cu о из растворов легче переходят на пластинку (при этом происходит их восстановление) заряжая ее положительно, из-за избытка анионов раствор вокруг пластинки заряжается отрицательно. Образуется двойной электрический слой. |
Таким образом, разность потенциалов электрод/электролит называется электродным потенциалом (Е, j [В]). Он зависит от природы металла, концентрации его ионов и температуры.
Если концентрация ионов равна 1 моль/л при температуре 25 о С, то электродный потенциал обозначают j о и называют стандартным электродным потенциалом.
в числителе – окисленная форма, в знаменателе – восстановленная форма, знак соответствует возникающему на металле в двойном слое.
Абсолютное значение электродного потенциала определить невозможно, однако можно определить разность электродных потенциалов исследуемого металла и так называемого водородного электрода, электродный потенциал которого в стандартных условиях принят равным нулю.
Водородный электрод устроен следующим образом:
| Платиновая пластинка помещается в 1 М раствор серной кислоты. Снизу в раствор подается водород, который насыщает платину. При этом на её поверхности устанавливается равновесие Н2 – 2ē ⇄ 2Н + Ввиду химической пассивности платины в данных условиях возникший электродный потенциал относится к водороду и обозначается |
Для определения значения потенциала металла собирают гальванический элемент из водородного электрода и испытуемого металла, погруженного в 1М раствор его соли. Разница электродных потенциалов испытуемого металла и водородного электрода принимается за электродный потенциал испытуемого металла.
Таблица стандартных электродных потенциалов.
Для всех металлов стандартные электродные потенциалы найдены и составляют ряд стандартных электродных потенциалов (ряд активности, ряд напряжений – устаревш. Справедлив только для водных растворов!). На его основании составлена таблица – «Стандартные электродные потенциалы металлов».
Впервые она была составлена в 1886 году выдающимся химиком Н.Н. Бекетовым.
Таблица стандартных электродных потенциалов характеризует химическую активность металлов. В таблице выделяют три группы металлов (деление условное, зависящие от концентрации ионов металла в растворе):
1. очень активные металлы – от лития до алюминия;
2. металлы средней активности от цинка до водорода;
3. неактивные металлы, металлы стоящие за водородом.
Таблица обладает следующими свойствами:
1. чем меньше электродный потенциал металла, тем больше его восстановительная способность и тем активнее металл (восстановительная активность растет, ¯окислительная активность ионов уменьшается);
2. металлы, имеющие отрицательный электродный потенциал и стоящие в ряду напряжений до водорода, вытесняют его из разбавленных растворов кислот, кроме азотной кислоты;
3. каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые в ряду напряжений стоят после него.
Например, железо вытесняет медь из раствора хлорида меди:
а медь вытесняет ртуть из раствора нитрата ртути:
Для условий, отличных от стандартных (по концентрации раствора), величина электродного потенциала рассчитывается по формуле Нернста:
| где | j о – стандартный электродный потенциал (В); F – постоянная Фарадея (96500 Кл/экв); R – универсальная газовая постоянная (8,314 Дж/моль); T – фактическая температура (298 К); n – число электронов, принимающих участие в процессе; – концентрация (активность) ионов металла в растворе (моль/л) |
Подставляя численные значения всех постоянных, получают более простой вид уравнения Нернста:
Пример. Цинковая пластинка погружена в 0,01 раствор её соли.
3. Гальванический элемент – является химическим источником тока.
Гальванический элемент это устройство, предназначенное для преобразования энергии окислительно-восстановительной реакции в электрическую энергию. Простейшим ГЭ является элемент Даниэля-Якоби, состоящий из цинкового и медного электродов, погруженных в растворы своих солей – сульфатов цинка и меди.
Растворы разделены полупроницаемой мембраной.
| Элемент Даниэля-Якоби | На цинковом электроде окисляется цинк Zn – 2ē ® Zn 2+ (анодный процесс), электроны окисленных атомов по внешней цепи поступают на медный электрод, где ионы меди восстанавливаются из раствора Сu 2+ + 2ē → Cu (катодный процесс). |
Одновременно часть ионов SO4 2- для выравнивания отрицательных потенциалов катодного и анодного пространств переходит через пористую перегородку в сосуд с раствором сульфата цинка.
Данные процессы будут идти до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк или не выделится вся медь. Суммарное уравнение процесса
Электроды называются в соответствии с происходящими на них процессами. Электрод, на котором происходит окисление, называется анодом;
электрод, на котором происходит восстановление, называется катодом. Электрическая схема рассмотренного гальванического элемента записывается следующим образом:
| (–) А, Zn | Zn SO4 || Cu SO4 | Cu, К (+) А (–) Zn – 2ē ® Zn 2+ К (+) Сu 2+ + 2ē → Cu |
| Zn + Сu 2+ ® Zn 2+ + Cu Zn + CuSO4 = ZnSO4 +Cu |
Одинарная вертикальная черта означает границу раздела между электродом и электролитом, а двойная черта означает границу между проводниками второго рода, т.е. электролитами. Проводниками 1 рода считают металлы, в которых заряд перемещается за счет движения электронов, а проводниками 2 рода – электролиты (в этом случае носителями заряда являются ионы).
На каждом электроде возникает собственный электродный потенциал. Разность этих потенциалов называется электродвижущей силой или ЭДС
Всегда является положительной величиной, т. к. определяется вычитанием более отрицательного потенциала, из более положительного.
Так, для элемента Даниэля-Якоби ЭДС = – = 0,34 + 0,76 = 1,1В
Элемент Вольта – элемент, в котором электроды находятся в общем растворе электролита.
| (–) А, Zn | H2SO4| Cu, К (+) А (–) Zn – 2ē ® Zn 2+ К (+) 2Н + + 2ē ® Н2 |
| Zn + 2Н + ® Zn 2+ + Н2 Zn + H2SO4 ® ZnSO4+ Н2 |
Наиболее активный цинк посылает свои ионы в раствор, а освободившиеся электроны по внешней цепи перемещаются к меди, где и восстанавливаются имеющиеся в растворе положительные ионы.
В таком элементе на катоде, происходит восстановление ионов электролита (водорода), а с самим катодом (медной пластинкой) ничего не происходит.
То обстоятельство, что образующийся продукт – газ, порождает побочное явление.
Поверхность электрода (медной пластинки) покрывается пузырьками водорода и катодный потенциал становится более отрицательным. Поэтому и ЭДС, т.е. разность потенциалов гальванического элемента уменьшается.
Падение ЭДС ГЭ в следствии изменения химической природы поверхности электрода называется поляризацией. Различают – газовую, концентрационную и химическую поляризации.
Для устранения газовой поляризации применяют деполяризаторы – сильные окислители (кислород, оксид серебра, оксид марганца IV), связывающие образующийся водород в негазообразные продукты. Концентрационную поляризацию можно уменьшить перемешиванием электролита, но целиком ее устранить нельзя.
ЭЛЕКТРОЛИЗ
Электролизом называется окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита.
Окисление и восстановление происходит на электродах пространственно разделенных друг от друга. При пропускании постоянного электрического тока через расплав или раствор электролита его ионы движутся к противоположно заряженным электродам на которых происходит их разрядка. Электрод, на котором при электролизе происходит восстановление положительно заряженных ионов – катионов, является катодом, а электрод, на котором осуществляется процесс окисления анионов – анодом. При электролизе катод (–) заряжен отрицательно, а анод (+) положительно.
Ионы на электродах разряжаются, при этом, и при электролизе, и при гальванических процессах на катоде происходит восстановление, а на аноде – окисление.
На характер и течение электродных процессов при электролизе большое влияние оказывает состав электролита, растворитель, материал анода и режим электролиза (напряжение, плотность тока, температура и др.).
Различают электролиз расплавленных электролитов и их растворов. В последнем случае в процессах участвуют молекулы и ионы воды.
Электролиз расплава
Электролиз расплава, рассмотрим на примере хлорида натрия:
| NaCl расплав ⇄ Na + + Cl – | |
| К (–): Na + Na + + ē®Na | А (+): Cl – 2Cl – – 2ē ®Cl2 |
| NaCl расплав Na + Cl2 |
Электролиз сводится к восстановлению на катоде катиона натрия, а на аноде к окислению аниона хлора.
Если электролизу подвергается соль кислородосодержащей кислоты, например сульфат натрия, то на аноде происходит процесс выделения кислорода.
| Na2SO4 расплав 2Na + + SO4 –2 | |
| К (–): Na + Na + + ē®Na | А (+):SO4 –2 SO4 –2 – 2ē ® SO3 +1/2O2 |
| 2Na2SO4 расплав 4Na + 2SO3 +O2 |
Сущность электролиза состоит в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Читайте также:
