Вещество с металлической связью поваренная соль
Обновлено: 04.10.2024
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
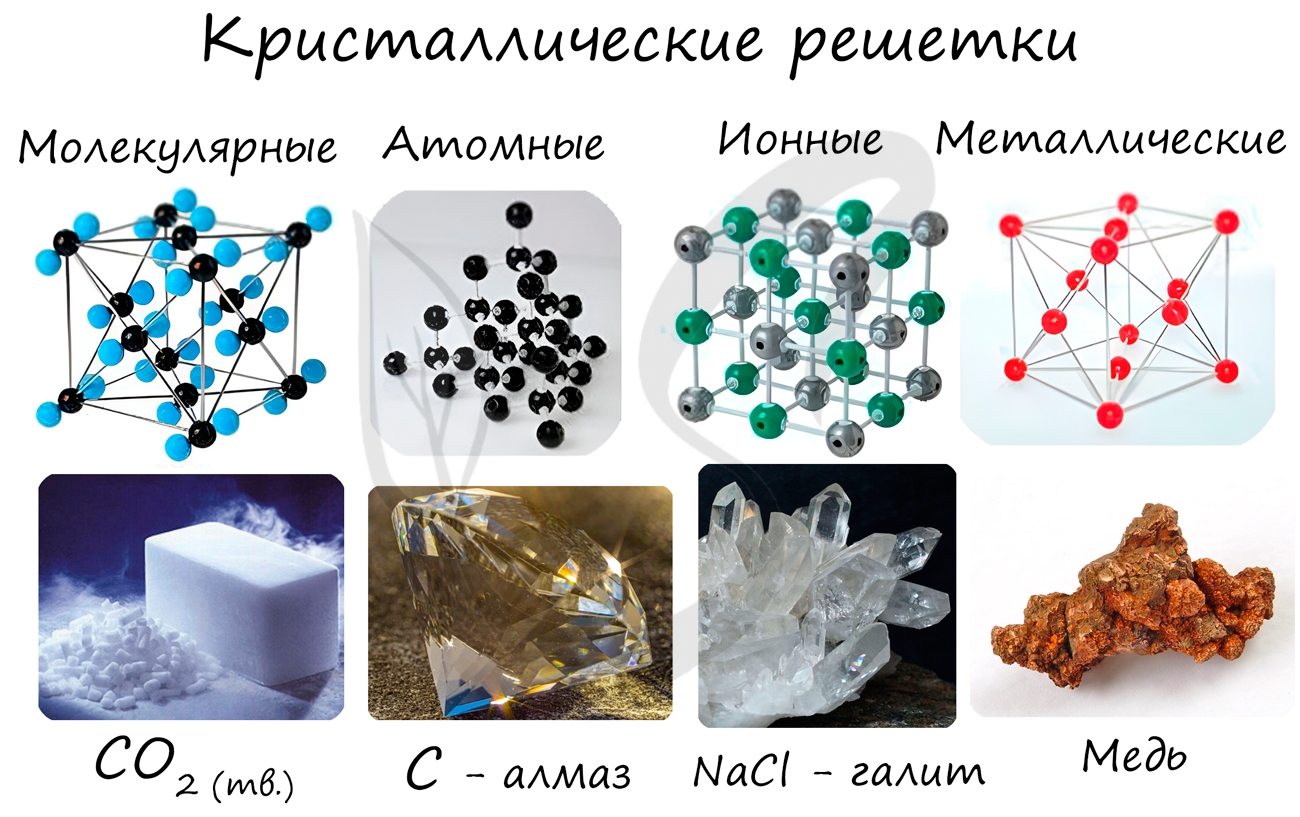
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
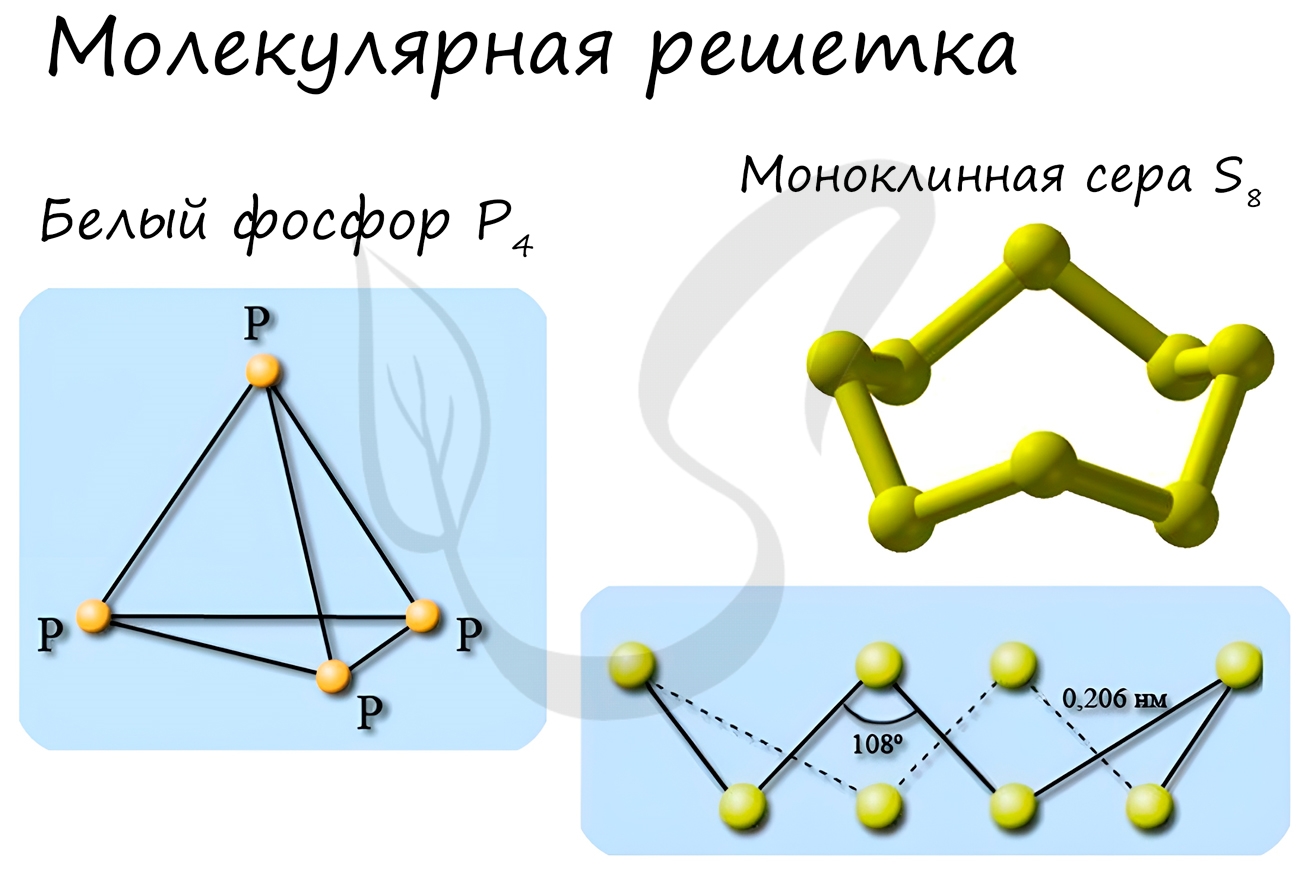
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью - NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.

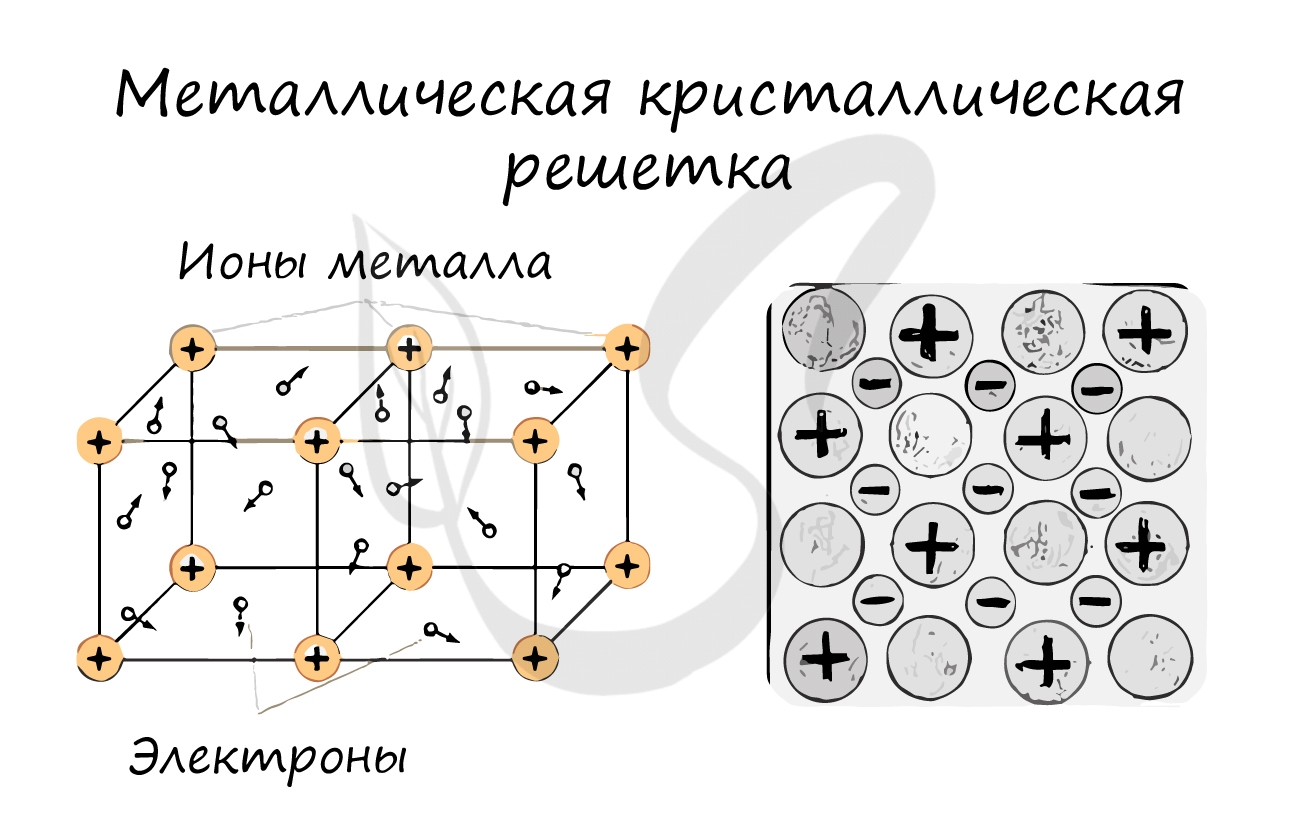
Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Классификация неорганических веществ
Неорганическая химия - раздел химии, изучающий строение и химические свойства неорганических веществ.
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:

Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
- CuO - соответствует основанию Cu(OH)2
- Li2O - соответствует основанию LiOH
- FeO - соответствует основанию Fe(OH)2 (сохраняем ту же СО = +2)
- Fe2O3 - соответствует основанию Fe(OH)3 (сохраняем ту же СО = +3)
- P2O5 - соответствует кислоты H3PO4
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.

Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)

Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
- SO2 - H2SO3
- SO3 - H2SO4
- P2O5 - H3PO4
- N2O5 - HNO3
- NO2 - HNO2, HNO3
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
При реакции с водой кислотный оксид превращается в соответствующую ему кислоту. Исключение SiO2 - не реагирует с водой, так как продукт реакции - H2SiO3 является нерастворимой кислотой.

- CO
- N2O
- NO
- SiO
- S2O
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)

Основания
Основания - химические соединения, обычно характеризуются диссоциацией в водном растворе с образованием гидроксид-анионов. Растворимые основания называются щелочами: NaOH, LiOH, Ca(OH)2, Ba(OH)2.
Гидроксиды щелочных металлов (Ia группа) называются едкими: едкий натр - NaOH, едкое кали - KOH.

Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.

Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
NaOH + HCl → NaCl + H2O (основание + кислота = соль + вода - реакция нейтрализации)
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.

Амфотерные оксиды соответствуют амфотерным гидроксидам. Их свойства такие же двойственные: они реагирую как с кислотами - с образованием соли и воды, так и с основаниями - с образованием комплексных солей.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Al(OH)3 + KOH → (t) KAlO2 + H2O (амф. гидроксид + основание = (прокаливание) соль + вода - при высоких температурах вода испаряется, и комплексная соль образоваться не может)

Кислоты
Кислота - химическое соединение обычно кислого вкуса, содержащее водород, способный замещаться металлом при образовании соли. По классификации кислоты подразделяются на одно-, двух- и трехосновные.
Основность кислоты определяется числом атомов водорода, которое способна отдать молекула кислоты, реагируя с основанием. Определять основность кислоты по числу атомов водорода в ней - часто верный способ, но не всегда: например, борная кислота H3BO3 является слабой одноосновной кислотой, фосфористая кислота H3PO3 - двухосновной кислотой.

Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
H3PO4 + LiOH → Li3PO4 + H2O (кислота + основание = соль + вода - реакция нейтрализации)
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Записать эти кислоты в растворе в виде "H2CO3 или H2SO3" - будет считаться ошибкой. Пишите угольную и сернистую кислоты в разложившемся виде - виде газа и воды.

Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
Однако невозможно (и противоречит законам логики) получить из более слабой кислоты сильную, например из уксусной - серную кислоту. Природу не обманешь :)
K2S + HCl → H2S + KCl (из сильной - соляной кислоты - получили более слабую - сероводородную)
K2SO4 + CH3COOH ↛ (реакция не идет, так как из слабой кислоты нельзя получить сильную: из уксусной - серную)
Подчеркну важную деталь: гидроксиды это не только привычные нам NaOH, Ca(OH)2 и т.д., некоторые кислоты также считаются кислотными гидроксидами, например серная кислота - H2SO4. С полным правом ее можно записать как кислотный гидроксид: SO2(OH)2
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.

Соль - ионное соединение, образующееся вместе с водой при нейтрализации кислоты основанием (не единственный способ). Водород кислоты замещается металлом или ионом аммония (NH4). Наиболее известной солью является поваренная соль - NaCl.
- Средние - продукт полного замещения атомов водорода в кислоте на металл: KNO3, NaCl, BaSO4, Li3PO4
- Кислые - продукт неполного замещения атомов водорода: LiHSO4, NaH2PO4 и Na2HPO4 (гидросульфат лития, дигидрофосфат и гидрофосфат натрия)
- Основные - продукт неполного замещения гидроксогрупп на кислотный остаток: CrOHCl (хлорид гидроксохрома II)
- Двойные - содержат два разных металла и один кислотный остаток (NaCr(SO4)2
Химические связи
Химическая связь - связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
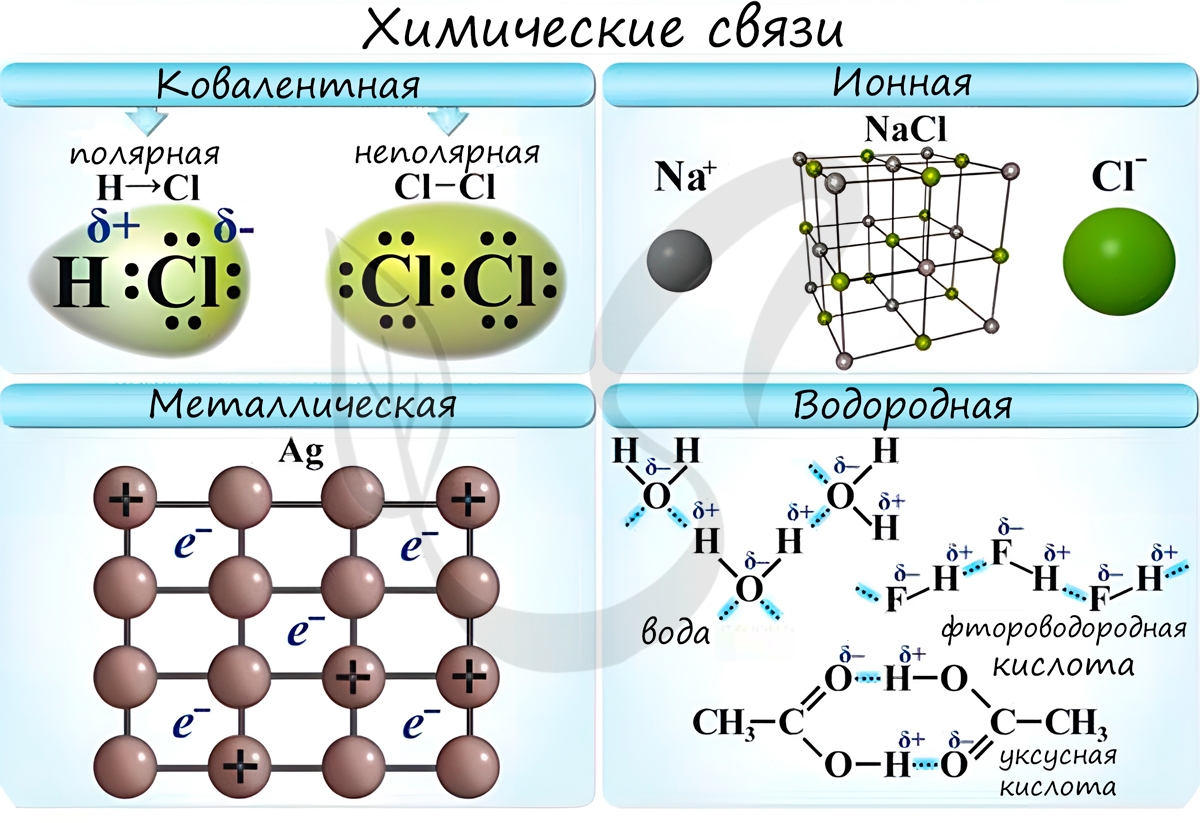
Ковалентная связь ( лат. со - совместно + valens - имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет "полюса" - электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется "полюс" - электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.
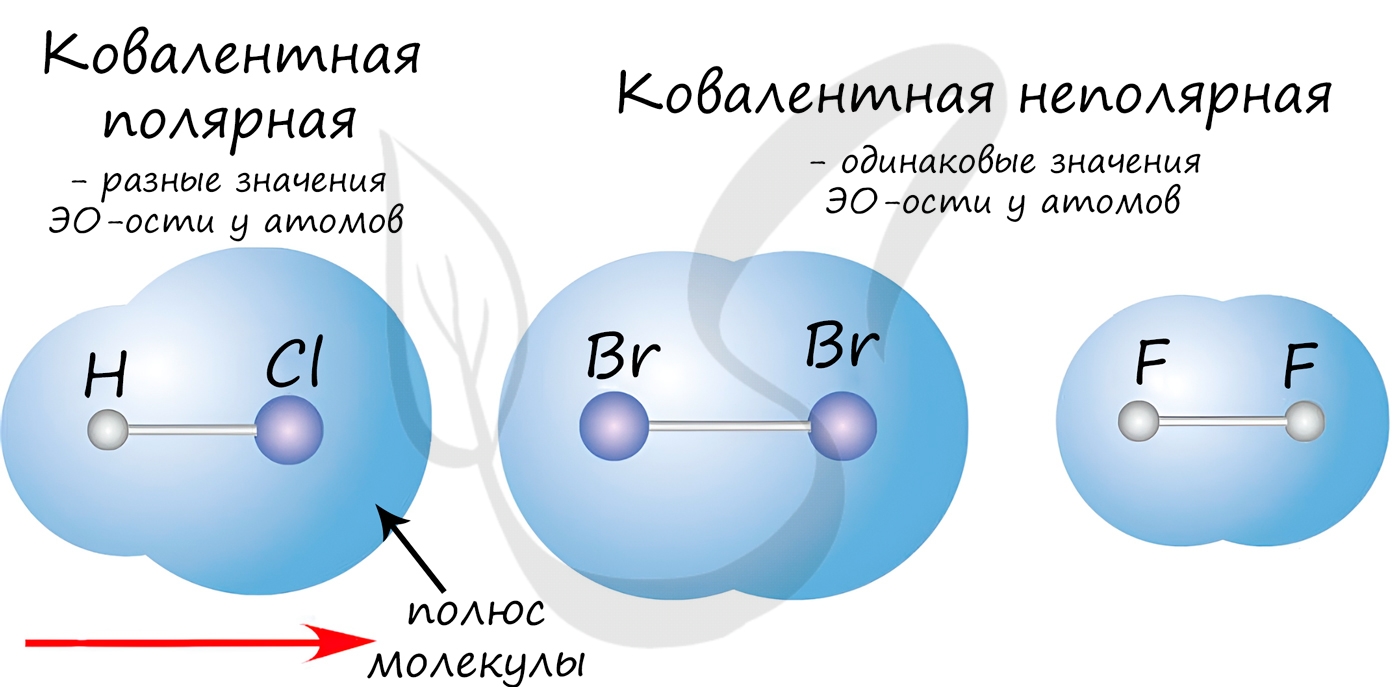
Ковалентная связь может быть образована по обменному механизму - обобществлению электронной пары. В таком случае каждый атом "одинаково" вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
- NH4 + - в ионе аммония
- NH4 + Cl, NH4 + Br - внутри иона аммония во всех его солях
- NO3 - - в нитрат ионе
- KNO3, LiNO3 - внутри нитрат иона во всех нитратах
- O3 - озон
- H3O + - ион гидроксония
- CO - угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] - во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму

Ионная связь
Ионная связь - один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.

Металлическая связь
Металлическая связь - вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости - "электронного газа". По природе металлическая связь близка к ковалентной.
"Облако" электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.

Водородная связь
Водородная связь - вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи - это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
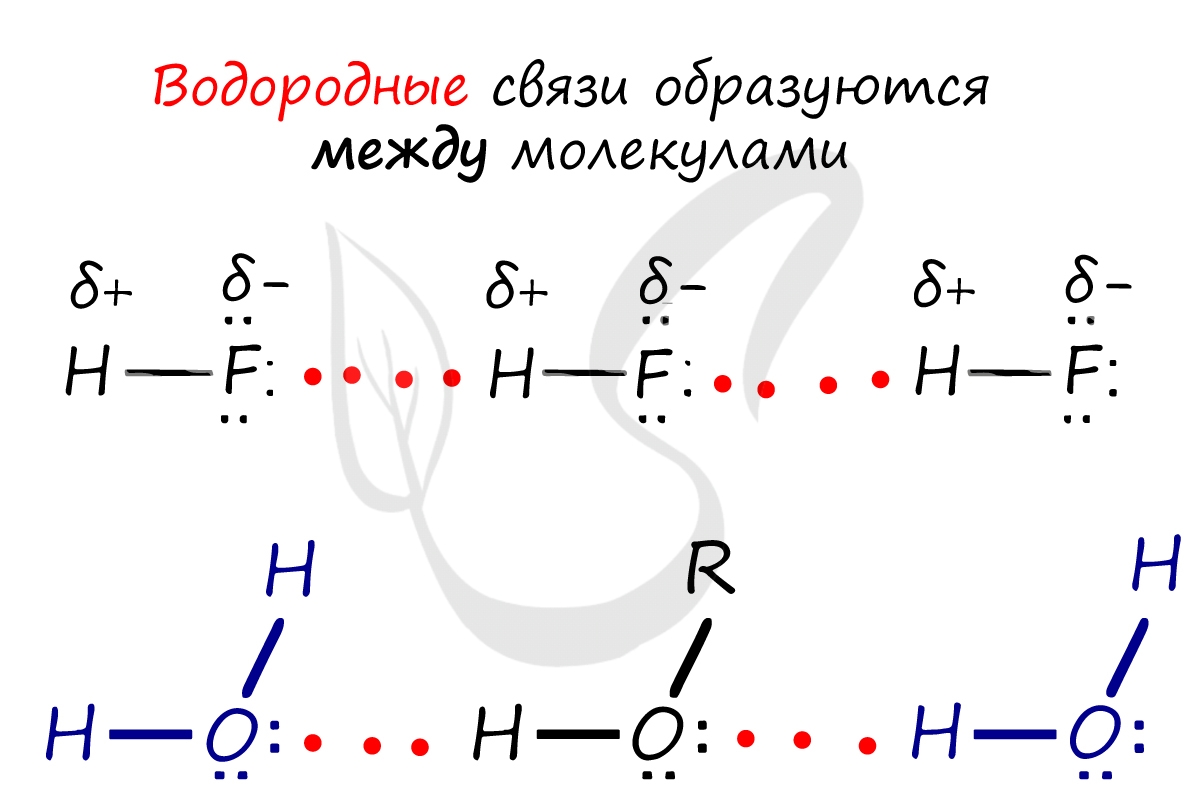
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
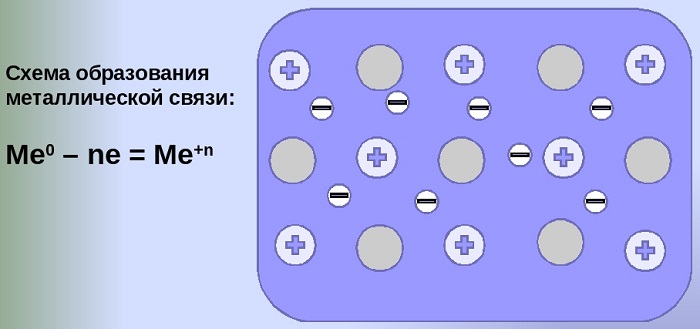
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
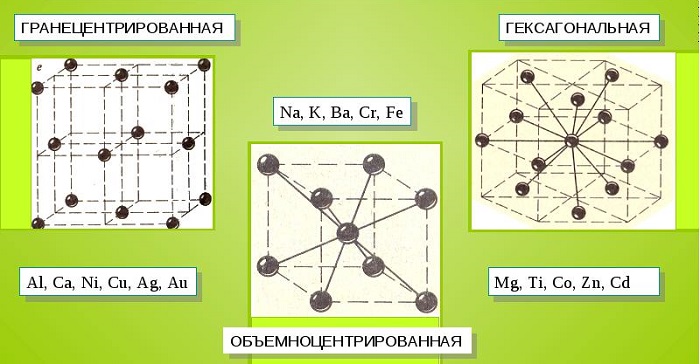
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
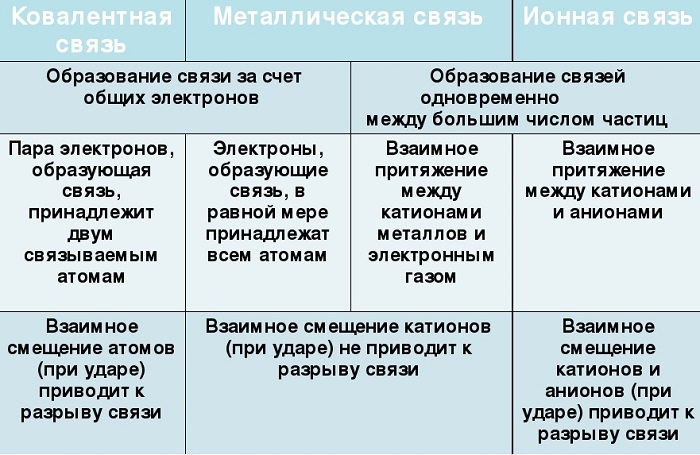
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Соли в химии - общая характеристика, классификация и примеры соединений с названиями
Самая распространенная группа соединений в химии — соли. В природе их можно встретить в виде залежей минералов или растворенными в водах Мирового океана. Без этих химических веществ невозможны многие процессы, происходящие в организме человека: они входят в состав костей и гемоглобина крови. Кроме того, соли широко применяются в разных отраслях промышленности и медицине.

Общие сведения
Все соли имеют сложный химический состав и в зависимости от него могут быть органическими или неорганическими. В теоретической химии существует несколько определений этой группы веществ:
- являющиеся результатом взаимодействия оснований и кислот;
- соединения, образованные одним или несколькими кислотными остатками и ионом металла;
- при электролитической диссоциации — состоящие из катионов и анионов.

Кроме металлов, к кислотным остаткам могут присоединяться ионы аммония (NH4)+, гидроксония (Н3О)+, фосфония (РН4)+ и некоторые другие. С физической точки зрения чаще всего соли — это твердые кристаллические вещества. Встречаются вещества разной окраски. Прозрачные единичные кристаллы в большом количестве имеют белый цвет, например, поваренная соль NaCl.
Их строение представляет собой кристаллическую решетку, в узлах которой находятся анионы, а катионы занимают пространство между узлами. Другое распространенное строение — анионные фрагменты из кислотных остатков, соединенные в бесконечную цепочку, в трехмерных полостях которых находятся катионы. Такую структуру имеют силикаты, что отражается и на их свойствах: высокая температура плавления и неспособность проводить электрический ток.
Кроме ионных, в молекулах солей встречаются и молекулярные ковалентные связи, и промежуточные между ковалентными и ионными. В особую группу солей выделяются так называемые ионные жидкости, температура плавления которых ниже 100 °C, отличающиеся повышенной вязкостью.
Для изучения химических и физических свойств этой группы соединений важным критерием служит их растворимость в воде: полностью, частично или нерастворимые.
Классификация и номенклатура
Основные классы этой группы веществ были описаны французским химиком и аптекарем Г. Руэлем еще в 1754 году, а по мере развития химии к ним добавились новые. Главный принцип классификации солей основан на том, что при взаимодействии металла и кислоты в ней происходит частичное или полное замещение атомов водорода.
Общие характеристики
Формулы солей всегда образуются одним или несколькими металлами, кислотными остатками и гидроксильными группами. В зависимости от этого все солевые соединения делят на такие классы:

- Средние.
- Кислые.
- Основные.
- Двойные или смешанные.
- Комплексные.
- Кристаллогидраты.
Средними считаются те, у которых все атомы водорода образующей кислоты заменены атомами металла. К такому типу соединений относятся и те, в которых водород замещается одновалентной группой аммония NH4. Согласно принятой номенклатуре, названия этих веществ образуются из латинского названия кислотного остатка и русского названия металла. Кислородосодержащие остатки оканчиваются на «ат», бескислородные — на «ид». Например:
- Na2CO3 — карбонат натрия.
- NaCl — хлорид натрия.
- KNO3 — нитрат калия.
Если одному химическому элементу соответствует не одна кислота, то может использоваться и окончание «ит». Это относится к таким кислотам, как серная H2SO4 (сульфаты) и сернистая H2SO3 (сульфиты).
Кислые вещества образуются только от двух- или полиосновных кислот: серной, фосфорной, угольной. Они относятся к неустойчивым соединениям и при нагревании происходит их разложение на составляющие элементы. В названии таких веществ всегда используют приставку «гидро», а если незамещенных атомов водорода осталось два — приставку «ди»:
- NaHSO4 — гидросульфат натрия.
- CaHPO4 — гидрофостфат кальция.
- KH2PO4 — дигидрофосфат калия.

Образование основных солей происходит при частичном замещении гидроксильных групп кислотными остатками, причем валентность основного остатка всегда будет равна числу замещенных гидроксильных групп. Номенклатура названий таких химических соединений образуется в зависимости от количества гидроксогрупп приставками «гидроксо» и «дигидроксо»:
- Аl (OH)SO4 — гидроксосульфит алюминия.
- Cu (OH)Cl — гидроксохлорид меди.
- Fe (OH)2NO3 — дигидроксохлорид железа.
В двойных солях атомы водорода замещаются двумя разными металлами, соответственно и образовываться могут только от двух и более основных кислот: MgK (SO4)2, NaKCO3, KAl (SO4)2.
Комплексные соединения и кристаллогидраты
Этот класс химических соединений отличается большим разнообразием. В изучении комплексных солей (КС) большую роль сыграли швейцарский ученый А. Вернер и русский химик немецкого происхождения В. Освальд. КС состоят из комплексных частиц. Центральный элемент в комплексе называется комплексообразователем, а связанные с ним элементы — лигандами. Их число — это координационное число соединения. Лигандами могут быть как нейтральные молекулы, так и разнообразные ионы и катион водорода H+.
КС так и классифицируются на нейтральные, анионные и катионные. Разными лигандами образуются такие группы химических веществ:
- амиакаты, в которых с комплексообразователем связаны молекулы аммиака — [Co (NH3)6]Cl3;
- аквакомплексы, образованные лигандами воды — [Al (H2O)6]Cl3;
- ацидокомплексы, включающие кислотные остатки — K2[PtCl4].

Кристаллы, образующиеся в водном растворе при выпадении в осадок солей, называются кристаллогидратами. При этом между молекулами воды и солевыми ионами формируются прочные связи, образующие кристаллическую решетку. Химические формулы кристаллогидратов записывают в виде количественного соотношения соли и воды, разделенных точкой — Na2SO4⋅10H2O. В номенклатуре для обозначения количества воды употребляются греческие числа — ди, три, тетра, гекса и так далее, с которых и начинается название. Число выступает приставкой к слову «гидро», а затем следует стандартное название соли: CaSO4⋅2H2O — дигидрат сульфата кальция.
Исторические наименования
Названия химических веществ соответствуют международной системе правил, позволяющей давать им названия, по которым можно правильно составить их формулу. Многие соединения солевой группы давно и хорошо известны, и в процессе их использования химики много лет назад уже как-то называли их. Традиционные или тривиальные названия полезно знать любому человеку. Их список приведен в таблице:
| Соль | Номенклатурное название | Тривиальное название |
| CuSO4⋅5H2O | Пентагидрат сульфата меди | Медный купорос |
| CaCO3 | Карбонат кальция | Известняк |
| AgNO3 | Нитрат серебра | Ляпис |
| NaHCO3 | Гидрокарбонат натрия | Питьевая сода |
| K2СO3 | Карбонат калия | Поташ |
| HgCl2 | Хлорид ртути | Сулема |
| Na2SiO3 | Силикат натрия | Жидкое стекло |
Это далеко не полный перечь общеизвестных наименований. Какой-либо системе они не подчиняются, и тем, кто изучает химию, их надо просто запомнить.
Химические свойства

Соли как химические соединения проявляют разные свойства в зависимости от их структурного состава. В водных растворах могут диссоциировать на анион металла и катион кислотного остатка. Степень диссоциации зависит от того, какую способность растворяться имеют разные виды солей: растворимые диссоциируют полностью, нерастворимые — частично или не диссоциируют. Ход такой реакции зависит от вида соли: средние, двойные и комплексные распадаются на ионы одномоментно, а кислые и основные — ступенчато. Примеры:
- Хлорид натрия: NaCl ↔ (Na+) + (Cl-).
- Сульфат калия-натрия: КNaSO4 ↔ (К+) + (Na+) + (SO42-).
- Хлорид-бромид кальция: CaClBr ↔ (Ca2+) + (Cl -)+ (Br-).
- Гидросульфат калия: КHSO4 ↔ (К+) + (НSO4-), а затем (HSO4-) ↔ (H+) + (SO42-).
- Гидроксохлорид железа: FeOHCl ↔ (FeOH+) + (Cl-), а затем (FeOH+) ↔ (Fe2+) + (OH-).
Некоторые соли под действием температуры могут разлагаться. Например, при нагревании из карбоната кальция СаСO3 получается оксид кальция СаO и кислотный оксид СО2. Солевые вещества, образованные от бескислородных кислот, разлагаются на простые элементы: хлорид серебра AgCl распадается на серебро Ag с выделением хлора Cl. Если солеобразующим соединением выступает кислота с сильными окислительными свойствами, то разложения до простых элементов не происходит: 2КNO3 → 2КNO2 + O2.
Взаимодействие с оксидами и кислотами

Соли реагируют путем сплавления с кислотными или амфотерными оксидами. При этом образуется новое солевое соединение, а оксиды замещаются менее летучими. С основными оксидами такая реакция не происходит. Например, карбонат калия K2CO3 сплавляется с оксидом кремния (IV) SiO2 с образованием силиката калия KSiO3 и выделением углекислого газа CO2: K2CO3 + SiO2 → KSiO3 + CO2↑. K2CO3 может взаимодействовать и с оксидом алюминия, при этом получается алюминат калия KAlO2 и углекислый газ CO2: K2CO3 + Al2O3 → 2KAlO2 + CO2↑.
Взаимодействие с кислотами может происходить только в том случае, если в реакцию вступает кислота и соль, образованная более слабой кислотой. Показателем возможного совместного реагирования солей с кислотами могут быть предполагаемые:
- осадок;
- вода;
- газообразное вещество;
- слабый электролит.
Например, нерастворимое соединение угольной кислоты карбонат магния MgCO3 вступает в реакцию с сильной серной кислотой: MgCO3 + H2SO4 → MgSO4 + 2H2O + CO2. Растворимый силикат калия как производное кремниевой кислоты может взаимодействовать с соляной кислотой, потому что в ходе реакции ожидается получение нерастворимой кремниевой кислоты: K2SiO3 + 2HCl → H2SiO3↓ + 2KCl.
Реакции с основаниями и другими солями
Со щелочами взаимодействуют в основном только соли аммония и тяжелых металлов, если при этом они относятся к растворимым. В результате получают новое солевое вещество и новое основание. Например, в реакцию с гидроксидом калия KOH вступает сульфат меди (II) CuSO4, в результате чего образуется сульфат калия K2SO4, а гидроксид меди Cu (OH) выпадает в осадок: 2KOH + CuSO4 → K2SO4 + Cu (OH)2.

Взаимодействие хлорида аммония с гидроксидом натрия описывается таким уравнением (NH4)2SO4 + 2KOH → 2H2O + K2SO4 + 2NH3↑. Если воздействовать основанием на кислую соль, то в результате получится средняя соль и вода. Например, гидрокарбонат натрия NaHCO3 взаимодействует с гидроксидом натрия NaOH: NaHCO3 + NaOH → Na3CO3 + H2O.
Реакции между солями возможны только в случае хорошей растворимости обоих веществ, при этом образуются две новые соли. С нерастворимым соединением взаимодействие не случается. Некоторые вещества, относящиеся к кислым, реагируют со слабокислыми солями и со своими средними соединениями.
Получение и применение
Многие соединения солей всех видов встречаются в виде залежей минеральных пород и рассолов. Например: известняк, разные виды селитры, поваренная и калийная соли, сильвин, карналлит, натрон, мирабилит и многие другие. Условно все способы получения солевых веществ разделяют на физическую переработку сырья (выпаривание, кристаллизация, флотация и тому подобное) и извлечение их из полупродуктов, отходов других производств и минералов химическими способами, основанными на свойствах солей.
Больше всего химическая промышленность выпускает солей для сельского хозяйства, причем они используются как в качестве удобрений для хорошего роста растений и повышения урожайности, так и для их защиты от сорняков и вредителей. Минеральные соли используют и как сырье для производства самых разнообразных химических веществ, применяемых в таких отраслях:

- производство целлюлозы и бумаги;
- лакокрасочная промышленность;
- моющие средства;
- стекловарение;
- обработка кожи.
В качестве присадок и плавней соли применяются в металлургии для обогащения руд и при выплавке металлов. Производство цемента, одного из самых важных для строительной промышленности компонента, невозможно без известняка. Соли хрома используются при изготовлении огнеупорных материалов. Весь спектр разновидностей солей применяется и в фармацевтической промышленности.
Читайте также:
