Влияние азота на металл
Обновлено: 16.05.2024
В любой стали в некоторых количествах содержатся элементы в обычных условиях являющиеся газами. К ним в первую очередь относятся кислород, азот и водород, в значительной степени влияющие на качество стали.
Процесс, в результате которого газы оказываются в металле в атомарном, ионном состоянии или в виде химических соединений, в металлургической практике обычно называют процессом растворения газов в металле. Условно в этом процессе можно выделить несколько стадий:
1) массоперенос газа к поверхности металла;
2) адсорбция газа на поверхности металла;
3) переход через границу газ-металл;
4) диффузия газа в тонком перемешиваемом (диффузионном) слое жидкости;
5) массоперенос в толщу металла.
Лимитирующей стадией процесса растворения газов в металле, как правило, является либо внешняя диффузия (подвод газа), либо внутренняя диффузия (массоперенос в металле).
Обычно под растворимостью газа принимают его количество, перешедшее в раствор в металле при нормальном парциальном давлении газа.
В зависимости от суммарного (результирующего) изменения энтальпии ∆Нs растворимость газов повышается или понижается с повышением температуры металла. В случае растворения в чистом железе двухатомных газов установлена четкая связь между парциальным давлением р этих газов в атмосфере над расплавом и растворимостью газа в металле:
где S-растворимость газа в металле;
р-парциальное давление газа в атмосфере над расплавом.
Это соотношение называют законом квадратного корня или законом Сивертса.
На основании данных об изменении растворимости азота в железе (рисунок 1) можно сделать следующие выводы:
1) растворимость азота в α- и β-Fe возрастает при повышении температуры;
2) растворимость азота в γ-Fe при повышении температуры снижается, что объясняется снижением прочности нитрида Fe4N;
3) растворимость азота при переходе из жидкого состояния в твердое и из одного аллотропического состояния в другое резко изменяется;
4) растворимость азота в жидком железе с повышением температуры возрастает.

Рисунок 1 - Растворимость азота в жидком железе
Для процесса растворения азота в жидком железе характерны, по крайней мере, две стадии:
1) диссоциация молекулярного азота на атомы N2 → 2N — сопровождается поглощением тепла;
2) растворение атомарного азота N → [N] — сопровождается выделением тепла.
Поскольку ∆Hдис> ∆Hраст ,суммарный процесс протекает с поглощением тепла. При повышенных температурах наблюдается увеличение содержания азота в металле (например, при продувке техническим кислородом с повышенным содержанием азота, в высокотемпературной зоне дуги при электродуговом обогреве и т. п.). При 1600°С и рN2=0,1МПа растворимость азота в жидком железе близка к 0,044 %. При этих условиях азот образует с железом раствор, близкий к идеальному.
Образование нитридов железа (Fe4N, Fe2N) происходит в процессе охлаждения закристаллизовавшегося металла (в основном в области γ-Fe) По влиянию на растворимость азота в жидком железе элементы-примеси металла можно разделить на три группы.
1. Образующие прочные нитриды (ванадий, ниобий, лантан, церий, титан, алюминий). Эти элементы повышают растворимость азота в железе. Такие примеси, как хром, марганец, молибден, обычно нитридов не образуют, но они характеризуются большим химическим сродством к азоту, чем к железу, поэтому также заметно увеличивают растворимость азота.
2. Не образующие нитридов (углерод, никель, медь, фосфор) или образующие с азотом соединения, менее прочные, чем с железом (кремний). Эти элементы заметно снижают растворимость азота в железе.
3. Кислород и сера, мало влияющие на растворимость азота в железе. Являясь сильно поверхностно-активными, они оказывают существенное влияние на кинетику поглощения азота [1].
Влияние содержания примесей железа на растворимость в нем азота видно из рисунка 2. При охлаждении стали, содержащей азот, нежелательным является скачкообразное изменение растворимости. При быстром охлаждении азот не успевает выделиться, и раствор становится пересыщенным. Процесс выделения избыточного азота протекает во время эксплуатации готового изделия и во многих случаях приводит к ухудшению свойств стали (старение и связанное с этим скачкообразное повышение прочности и понижение пластических свойств).

Рисунок 2 - Растворимость азота в сплавах железо-легирующий элемент R при нормальном давлении и температуре 1600 °С
Размеры частиц азота в металле значительно больше, чем водорода, поэтому скорости диффузии азота в железе более низкие. Коэффициент диффузии водорода в жидком железе Dн = (8,0 + 9,0) ∙ 10-3 см2/с, тогда как для азота DN =3,77 ∙10-5 см2/с, т. е. ниже на два порядка, поэтому при снижении давления (обработка вакуумом) водород удаляется из металла с большей интенсивностью, чем азот [2].
Наличие в железе поверхностно-активных примесей заметно влияет на процессы растворения (и соответственно выделения) азота. Так, например, кислород является поверхностно-активной примесью. В результате присутствия в расплаве кислорода образуется богатый кислородом поверхностный слой, приводящий к снижению скорости перехода азота через границу газ — жидкий металл, поэтому при малой степени раскисленности и небольшом перегреве металла над ликвидусом можно продувать сталь азотом без опасения получить чрезмерно высокое его содержание. Иное развитие у процесса, когда металл хорошо раскислен либо когда в агрегате или в какой-то локальной зоне (например, в зоне электрических дуг или в зоне подачи технического кислорода в ванну) имеют место заметные перегревы металла [3].
Влияние азота на свойства стали
Азот является одним из наиболее распространенных элементов: его содержание в нижних слоях атмосферы составляет 78,11% а в земной коре – 0,04%. В нормальных условиях (Т=20 °С и P =1атм) азот представляет собой 2-х атомный газ. Атомный номер – 7, атомный вес – 14,008, плотность молекулярного азота – 1,649 × 10 -3 г/см 3 . Температура плавления – 209,9 °С, а температура кипения – 195,7 °С.
Исследования взаимодействия азота со сталью проводились в течении всего 20 века. Они были начаты Н.П.Чижевским и И.И.Жуковым [7]. Однако только после 40-х годов стали рассматривать возможность использования азота как легирующего элемента. Вопросам влияния азота на свойства сталей, его растворимости и поведения в металле уделялось много внимания, как в нашей стране, так и за рубежом [2…4, 8, 9]. В настоящее время в промышленности используется более 200марок сталей, легированных азотом.
Стали, легированные азотом, принято подразделять на две категории:
-стали с содержанием азота ниже равновесного;
-стали с содержанием азота выше равновесного ("сверхравновесные").
Первые получают в условиях выплавки и кристаллизации при атмосферном давлении азота. Вторые - при повышенном давлении азота, позволяющем сохранить большее его содержание в металле, чем при открытой выплавке.
В последние годы в качестве перспективных сталей с различным уровнем легирования азота для разнообразных сфер применения были отмечены [ 10 ] :
- дисперсионно-твердеющие стали, легированные ванадием, ниобием и титаном;
- высокопрочные коррозионно-стойкие, аустенитные стали;
- стали со структурой азотистого феррита и мартенсита.
Легирование азотом дисперсионно-твердеющих сталей приводит к образованию мелкодисперсных нитридов по границам зерен, препятствующих их росту, позволяет повысить предел текучести и ударную вязкость металла [ 8 ] .
Легирование азотом нержавеющих сталей, позволяет уменьшить в них содержание никеля и марганца в полтора – два раза, а в некоторых случаях вообще исключить эти элементы. Нержавеющие стали, легированные азотом, превосходят по прочности, вязкости и коррозионной стойкости традиционные нержавеющие стали.
Легированные азотом безникелевые стали, применяемые в медицине для изготовления хирургического инструмента и имплантатов 11 обладают повышенной прочностью, износостойкостью и не вызывают негативных явлений и аллергических реакций в человеческом организме.
Нержавеющие мартенситные и ферритные стали, легированные азотом, при соответствующей термической и термопластической обработке обладают повышенной прочностью, коррозионной стойкостью и улучшенной технологической пластичностью при высоких и низких температурах.
Подробное аналитическое обобщение данных о структуре и свойствах нержавеющих сталей, легированных азотом; растворимости азота в них; термодинамике этих растворов, в том числе, в зависимости от концентрации примесей и легирующих элементов; от температур и давлений реакций, протекающих в жидком металле; параметров диффузии и других факторов, связанных с особенностями выплавки, по состоянию на 60-е годы было сделано М.В. Приданцевым, Н.П. Таловым и Ф.Л. Левиным [13].
На основе анализа многочисленных публикаций 14 было показано, что азот:
- образует твердые растворы внедрения в аустените и феррите;
- увеличивает количество аустенита и стабилизирует аустенит по отношению к γ → α и γ→ε превращениям при охлаждении и пластической деформации;
- изменяет предельную растворимость легирующих элементов в γ и α - твердых растворах и влияет на распределение хрома, никеля и других легирующих элементов между аустенитом и ферритом;
- изменяет кинетику образования карбидных и других избыточных фаз при термической обработке;
- снижает энергию дефектов упаковки и, в связи с этим увеличивает деформационную способность аустенита.
Введение азота в сплавы позволяет:
- уменьшить в сплавах содержание никеля, марганца и других аустенитообразующих элементов при сохранении заданной аустенитной или иной структуры и, соответственно, уровня ферромагнитности сплава;
- увеличить содержание в сплавах элементов ферритообразователей, положительно влияющих на механические и коррозионные характеристики сплавов;
- улучшить характеристики технологической пластичности в результате расширения интервала существования аустенита в высокотемпературной области;
- повысить термическую стабильность аустенита и снизить вероятность его распада при нагреве с образованием нитридов и других фаз;
- увеличить коррозионную стойкость (сопротивление питтинговой и ножевой коррозии, коррозионному растрескиванию под напряжением, интеркристаллитной коррозии);
- повысить прочность сплавов путем использования деформационного упрочнения при наклепе [ 1 ] .
Растворимость азота в железе подчиняется закону Сивертса (закону квадратного корня):
где [ N ] – растворимость азота в железе при данном парциальном давлении PN 2 ;
KN константа реакции, численное значение которой зависит от температуры и способов выражения концентрации.
Выполняемость закона Сивертса указывает на идеальность образующегося раствора [18].
Авторам работы [19] для определения растворимости азота в жидком железе до температуры 2650°С предлагается уравнение:
lg [ N ] = (-850/ T ) – 0,905 +0,5 lg PN 2 (1.2)
Из которого следует, что при Т = 1873 °К и PN 2 = 1 атм [ N ] = 0,044%.
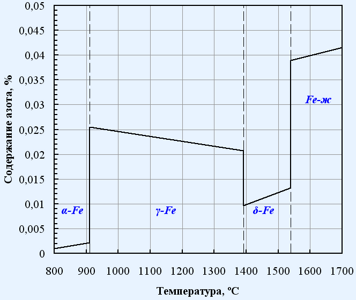
На рис.1.1 представлена температурная зависимость растворимости азота в жидком железе. Диаграмма состояния системы железо-азот приведена на рис. 1.2 .
Рис. 1. 1. Температурная зависимость растворимости азота в жидком железе

Рис.1.2. Диаграмма состояния Fe - N [26]
Концентрация азота, находящегося в равновесии с газообразным азотом растет с увеличением температуры. В точке перехода α→γ (906 °С) скачкообразно изменяется, при дальнейшем росте температуры до перехода γ→ δ (1402 °С) она уменьшается.
Азот может образовывать с железом два соединения Fe 4 N (9,9% N ) и Fe 2 N (11,5% N ). Fe 2 N начинает разлагается при температуре ~ 550 °С. При дальнейшем повышении температуры начинает диссоциировать и Fe 4 N .
Энтальпия растворения азота в жидком железе Δ HN представляет собой разность двух противоположных по знаку величин: энтальпии диссоциации молекулярного азота на атомы (Δ H дис) и энтальпии растворения атомарного азота в жидком железе (Δ HP ). Первый процесс является эндотермическим, а второй – экзотермическим. Так как Δ H дис > Δ HP , то процесс, описанный уравнением (1), протекает с поглощением тепла. Если данные по растворимости азота показывают хорошую согласованность у различных исследователей, то данные по энтальпии имеют значительный разброс.
Результаты статистической обработки большого массива экспериментальных данных позволили авторам работы [27] описать растворимость азота в жидком железе двумя уравнениями:
при Т > 1973 K : lg [ N ] = -1100/ T – 0,79 (1.4)
Таким образом, энтальпия растворения азота в жидком железе до 1973 ° K – 10700 Дж/моль, а выше 1973 ° K – 21000 Дж/моль.
А.М. Самарин, первым обративший на это внимание, связывал изменение Δ H при изменении температуры со структурными превращениями. Известно, что при растворении кислорода оксидная фаза проявляется при очень низком парциальном давлении кислорода в газовой фазе ( PO 2= 10 -8 атм). В отличие от этого, при растворении азота даже при PN 2 > 1атм самостоятельная нитридная фаза не образуется. Образование нитридов типа Fe 2 N и Fe 4 N наблюдали лишь в твердом металле в температурном интервале существования аустенита.
Влияние парциального давления над расплавом железа на его растворимость в зависимости от времени выдержки при T = 1560 ° C представлено на рис. 1.3.
Данные по кинетике азотирования свидетельствуют о том, что для выхода на стационарную концентрацию в чистом железе требуется около 40 мин., причем время практически не зависит от давления азота над расплавом.

Рис. 1.3. Изменение растворимости азота в железе в зависимости от его давления и времени выдержки при температуре 1560 °С [28].
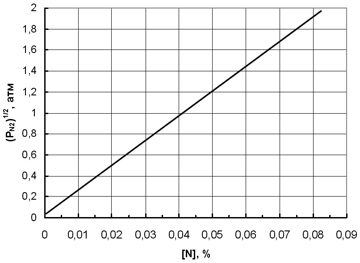
Рис.1.4. Зависимость растворимости азота в жидком железе при температуре 1560 °С от парциального давления азота над расплавом
Присутствие примесей влияет на скорость растворения азота в металле. Так, при увеличении концентрации кислорода в металле от 0,067 до 0,144% время достижения равновесной концентрации увеличивается с 1,5 до 3,0 часов. Отмечено и аналогичное влияние серы: при ее концентрациях 0,49 и 0,87% и давлении азота 0,1МПа время достижения равновесной концентрации возрастает до 3,0 и 6,0 часов соответственно.
В работе [14] представлены данные, характеризующие изменение растворимости азота в жидком железе при температуре 1560 °С в зависимости от давления (до 4 атм.).
Список использованой литературы
Атомарный азот растворяется преимущественно в тех металлах, с которыми он может образовывать химические соединения - нитриды. При растворении в стали азот образует нитриды как с железом, так и с большинством примесей. С железом азот взаимодействует по эндотермическим реакциям и образует два типа нитридов:
Нитрид БедЫ содержит 5,88 % N2, а нитрид Fe2N - 11,1 % N2. Для сварки большее значение имеет нитрид Fe4N, а для процессов, характеризующихся избытком азота, например для азотизации стали, - Fe2N.
В соответствии с равновесной диаграммой состояния «железо - азот» (рис. 9.10) при охлаждении сплава вначале из нитроаустенита
(твердого раствора азота в Fey) выпадает a-фаза, или нитроферрит
(твердый раствор азота в Fea). После достижения температуры
865 К, отвечающей точке А нитроферрит-эвтектоид распадается на механическую смесь феррита и нитрида железа. При дальнейшем уменьшении температуры в равновесных условиях предельная растворимость азота в нитроферрите снижается от 0,135 % при 865 К до 0,001 % при комнатной температуре. Это приводит к тому, что избыточный азот в виде Fe4N выделяется из твердого раствора Fea по диффузионному механизму.
В неравновесных условиях сварки этот процесс практически не развивается, и получают сталь, пересыщенную азотом. При последующем нагреве или при вылеживании происходит медленное выделение нитридов железа. Это явление называют старением. Оно снижает пластичность стали. При нагревании выше 900 К сталей, содержащих нитриды железа, они диссоциируют.
Нитроферрит [а] + + эвтектоид (Fea + Fe4N)
Рис. 9.10. Диаграмма состояния Fe-N2
Таким образом, в железе азот может находиться в твердом растворе Fea и в виде отдельных включений нитридов - главным образом Fe4N. В результате сварки и здесь имеют место существенные отклонения от равновесной диаграммы состояния Fe - N2. Поэтому общее количество растворенного в металле азота вследствие перегрева металла может быть увеличенным. Кроме того, при повышенной скорости охлаждения металла может не закончиться процесс выпадения нитридов железа из твердого раствора Fea, который останется пересыщенным азотом.
С легирующими элементами стали азот также образует нитриды, часто значительно более стойкие, чем нитриды железа. Особенно стойкими в области высоких температур являются нитриды кремния и титана.
' Равновесная растворимость азота в железе сильно зависит от температуры (см. рис. 9.6, б). По мере ее роста в интервале существования феррита растворимость азота увеличивается, а в интервале существования аустенита снижается вследствие снижения парциального давления азота в связи с образованием твердых нитридов по аналогии со снижением растворимости водорода в титане (см. рис. 9.7). В этом интервале кривые зависимости равновесной растворимости от температуры претерпевают скачкообразные изменения в моменты полиморфных превращений железа и при переходе его из твердого состояния в жидкое. При снижении температуры растворимость азота изменяется по тем же законам. В период кристаллизации азот, выделяющийся из металла, может вызвать порообразование. Несмотря на малую степень диссоциации азота в зоне столба дуги (см. рис. 8.9, а), а также ионизации (см. рис. 8.9, б), азот в металле шва присутствует в значительном
количестве, что объясняется большим содержанием его в атмосфере и спецификой его поведения в зоне сварки.
Исследования процесса насыщения металла азотом показали, что возможны следующие пути его протекания.
1. Диссоциированный азот непосредственно растворяется в жидком металле капель. При последующем охлаждении металла образуются нитриды железа. Роль этого процесса мала, так как степень диссоциации при сварке незначительна.
2. Диссоциированный азот образует в высокотемпературной области дугового разряда (см. рис. 9.1) окись азота N0, которая растворяется в каплях. При температурах металла ниже 3300 К окись азота диссоциирует на поверхности сварочной ванны, при этом атомарный азот, вступая во взаимодействие с железом, образует нитриды железа, а кислород - оксиды железа. Термодинамическим расчетом и экспериментом (см. рис. 9.5) подтверждено, что последний вариант (с участием кислорода) наиболее вероятен.
3. Диссоциированный азот непосредственно образует с диссоциированным кислородом в области высоких температур стойкие нитриды, которые, растворяясь согласно закону Сивертса в жидком металле капли, насыщают его азотом. В этом случае по мере охлаждения металла сварочной ванны из раствора может выделиться атомарный азот, который, вступая во взаимодействие с железом, образует нитриды железа.
Содержащиеся в стали нитриды азота весьма сильно влияют на ее свойства. Из рис. 9.11 следует, что с увеличением содержания
сто,2І ств, МПа 55, %
азота N в металле повышаются пределы прочности (ав) и текучести (ат). Этим влияние азота на свойства стали принципиально отличается от влияния кислорода. Вместе с тем по аналогии с кислородом снижаются пластические свойства и особенно резко - ударная вязкость стали. Наряду с этим происходят и другие нежелательные изменения: появляется склонность металла к старению и к хладноломкости (сине-
пи о ломкости); увеличивается склонность
Рис. 9.11. Влияние концен - п J
трации азота в углероди - к закалке; понижается магнитная простой стали на ее механичес - ницаемость; увеличивается электриче - кие свойства ское сопротивление металла.
Итак, для углеродистых и низколегированных сталей азот - нежелательная примесь в металле шва, особенно при действии на него динамической нагрузки. При сварке легированных сталей осуществляют микролегирование азотом с целью частичной замены углерода и увеличения пластичности и прочности сталей. Азот, как и углерод, образует твердый раствор внедрения, т. е. является сильным упрочнителем, но в отличие от углерода не образует карбидов, которые при нагреве растворяются в стали. Нитриды железа более термостойки, чем РезС.
При сварке деталей из высоколегированных сталей аустенитного класса азот вводится специально, так как он повышает устойчивость аустенита и выступает как легирующая добавка, способная заменить некоторое количество углерода и никеля. В таких сталях азот устраняет явление транскристаллизации и улучшает механические свойства, а также может вызвать и эффект упрочнения чугуна.
В условиях сварки деталей из меди азот применяют в качестве инертного защитного газа, не взаимодействующего с медью.
Особенности металлургических процессов при сварке, влияние кислорода, азота и водорода, содержащихся в воздухе, на металл шва
Процесс электрической сварки плавлением характеризуется химическими реакциями, которые возникают между расплавленным металлом и окружающей средой. При переносе металла с электрода в сварочную ванну капли и пары электродного металла и сварочной ванны, нагретые до высоких температур, взаимодействуют с атмосферными и другими газами и жидким шлаком. Поэтому химический состав наплавленного металла может существенно отличаться от химического состава электродов и основного металла. Это, как правило, усугубляется высокой температурой сварочной ванны и малым временем пребывания металла в жидком состоянии. Таким образом, в процессе сварки в течение короткого промежутка времени происходят сложнейшие процессы взаимодействия различных химических элементов. Основное влияние на качество сварного шва оказывают кислород, азот и водород. При неправильном ведении процесса сварки водород образует поры в шве, а кислород и азот существенно ухудшают механические свойства наплавленного металла. Кислород попадает в зону сварки из окружающего воздуха, из влаги кромок свариваемого металла, из влаги флюсов, обмазки электродов и защитных газов, а также из материалов обмазки и флюсов. В материалах обмазки и флюсах кислород находится в виде оксидов марганца, кремния и др. В процессе сварки кислород соединяется с железом и остается в металле шва в виде оксида FeO.
С повышением содержания кислорода в металле шва снижается предел прочности, предел текучести, ударная вязкость; ухудшается коррозионная стойкость, жаропрочность сталей. Удаление кислорода из расплавленного металла достигается за счет введения в сварочную ванну таких элементов, как марганец и кремний. Эти элементы взаимодействуют с оксидом железа FeO, кислород в связанном состоянии переходит в шлак или на поверхность сварочной ванны. Такой процесс называется раскислением. Азот попадает в зону сварки из окружающего воздуха. Азот растворяется в железе, марганце, титане, молибдене и вступает с ними в химическое взаимодействие с образованием нитридов. Нитриды резко увеличивают прочность и снижают пластичность сварного шва. Для уменьшения содержания азота в металле шва необходимо исключить азот из зоны сварки. Этого достигают при сварке в защитных газах. Водород, подобно кислороду и азоту, поглощается в процессе сварки металлом шва. Источником водорода в зоне сварки может служить атмосферная влага, влага покрытия или флюса, влага ржавчины на поверхности сварочной проволоки и на свариваемых кромках. В отличие от кислорода и азота водород не образует в процессе сварки химических соединений с железом, а лишь растворяется в расплавленном металле. Повышенная растворимость водорода в жидком металле приводит к пористости. Уменьшения содержания водорода в металле шва можно добиться путем предварительного прокаливания толстопокрытых электродов и флюсов, тщательной зачисткой свариваемых кромок от ржавчины, окалины и других загрязнений, предварительным нагревом деталей.
Одновременно с удалением из металла шва кислорода, азота водорода необходимо также очищать (рафинировать) металл шва от серы и фосфора, являющихся вредными примесями в сталях. Сера попадает в сварочную ванну из основного металла, сваркой проволоки, покрытий и флюсов. Наиболее неблагоприятной формой сернистых соединений в металле шва является сульфид железа FeS. В процессе кристаллизации он образует с железом эвтектику с температурой плавления ниже, чем у основного металла. Эвтектика располагается между зернами кристаллизующегося металла и является причиной возникновения горячих трещин сноломкость. Избавиться от появления такого дефекта позволяют марганец и кальций, содержащиеся в сварочной проволоке и обмазке электрода. Фосфор в металле шва находится в виде фосфидов железа Fe3P и Fe2P. Увеличение фосфора в металле шва снижает ударную вязкость, особенно при низких температурах, поэтому фосфор необходимо удалять. Это достигается за счет его окисления и удаления в шлак. Для снижения вредного влияния серы и фосфора их содержащееся в основном и электродном металле, в покрытии электродов и флюсах строго ограничивается соответствующими стандартами.
При отсутствии в стали элементов, образующих нитриды при высокой температуре (Ti, Al, Zr, V), после образования α-Fe начинается выделение азота из раствора в виде включений нитридов железа (Fe2N, Fe4N, Fe8N). Это выделение может продолжаться длительное время после охлаждения и, так как оно происходит в основном при низкой температуре, выделившиеся включения дисперсны (размером порядка 10-3 мкм). Дисперсные включения нитридов железа располагаются по кристаллографическим плоскостям и, препятствуя перемещению дислокаций, вызывают охрупчивание металла. Результатом этого является снижение ударной вязкости и относительного сужения, при одновременном повышении твердости и прочности.
Как и выделение нитридов железа, снижение ударной вязкости усиливается при длительном хранении или эксплуатации стальных изделий, достигая минимума через 20—40 суток, поэтому описываемое явление получило название старения. Старение может быть ускорено искусственно, если закаленное железо или сталь подвергнуть холодной пластической деформации, увеличивающей скорость распада твердого раствора и выделения нитридов железа. В результате старения ударная вязкость может уменьшиться в четыре—шесть раз, поэтому склонность к старению является пороком стали. Она характерна для малоуглеродистой стали, не раскисленной алюминием или ванадием [1].
Влияние азота на механические свойства стали показано на рисунке 3.
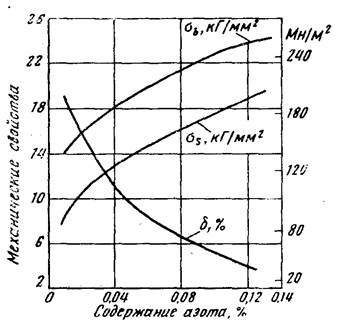
Рисунок 3 – Влияние азота на механические свойства стали
Присадка в сталь элементов, связывающих азот в нитриды при высоких температурах, устраняет склонность стали к старению. Такими элементами являются следующие:
1) алюминий, образующий нитриды в основном во время затвердевания и в твердом металле до температуры превращения γ-Fe в α-Fe;
2) ванадий и цирконий, образующие нитриды во время кристаллизации;
3) титан, образующий нитриды в жидкой стали и во время кристаллизации.
Наибольшее применение получил алюминий, широко применяемый и в качестве раскислителя. При обычных концентрациях азота и алюминия в твердом металле образуются нитриды. Но включения этих нитридов, выделяясь при более высокой температуре, имеют на два-три порядка большие размеры, чем включения нитридов железа, поэтому они не оказывают такого влияния на движение дислокаций и не вызывают старение.
Следовательно, спокойная сталь, раскисленная алюминием, не склонна к старению. Однако и в стали, раскисленной алюминием, может наблюдаться понижение ударной вязкости. Это проявляется при высоком содержании азота и алюминия (например, 0,01% N и 0,2% А1), когда в металле образуется межзеренный излом, проходящий по границам зерен первичного аустенита. Образование такого излома вызвано ослаблением связи между зернами вследствие выделения по их границам включений нитрида алюминия, и оно свидетельствует об ухудшении свойств металла.
Источники газов
К основным источникам газов относятся :
1) шихтовые материалы ;
2) атмосфера плавильного агрегата, а также подаваемое на поверхность или в глубь ванны дутье (технический кислород или воздух );
3) ферросплавы и различные добавки, вводимые в металл или шлак по ходу плавки и разливки ;
4) атмосфера, окружающая жидкий металл при выпуске и разливке.
Большое количество газов вносит в металл шихта и, несмотря на то, что эти газы в значительной мере удаляются из металла по ходу плавки, на насыщенность шихтовых материалов газами обращают особое внимание. Лом содержит обычно 0,003-0,005% N. Чугун содержит обычно 0,0055 N [5].
Читайте также:
