Влияние йода на металл
Обновлено: 05.07.2024
Аннотация научной статьи по энергетике и рациональному природопользованию, автор научной работы — Лебедев М.П., Ларионов В.Р., Васильева Е.Д.
В работе рассматривается йодное выщелачивание , как нетоксичный способ добычи золота из руд. Исследована сорбция имитатора золота (коллоида молекулярной меди) на метастабильном нанокристаллическом сорбенте кристаллогидрата воды. Показано, что после трехкратного пропускания через сорбент медь оказалась полностью сорбированной.
Похожие темы научных работ по энергетике и рациональному природопользованию , автор научной работы — Лебедев М.П., Ларионов В.Р., Васильева Е.Д.
Извлечение золота из упорных сульфидных концентратов в процессе автоклавного окисления с использованием сорбента и галогенсодержащих растворителей
Математическая модель «Сжимающееся ядро» для описания процесса выщелачивания золота из полифракционной руды
IODINE LEACHING OF NOBLE METALS AS AN ALTERNATIVEFOR THE USE OF CYANIDES IN THE CONDITIONS OF THE NORTH
The paper considers iodine leaching as a non-toxic way of extracting gold from ores. The sorption of a gold simulator (a molecular copper colloid) on a metastable nanocrystalline sorbent of water crystalline hydrate has been studied. It is shown that, after passing through the sorbent three times, the copper was completely sorbed.
Текст научной работы на тему «Йодное выщелачивание благородных металловкак альтернатива использования цианидов в условиях Севера»
3. Маргулис Е.В., Арчинова Э.А. Щелочное выщелачивание свинца при комплексной гидрометаллургической переработке свинцово-цинковых возгонов // Цветные металлы, 1989. № 3. 49-51 с.
4. Миронкина Н.В. Разработка технологии извлечения неблагородных элементов из исходных концентратов и промпродуктов аффинажного производства. автореф. дис. на соиск. учен. степ. канд. техн. наук- Иркутск, 2013. 6-8 с.
5. Миронкина Н.В., Вязовой О.Н., Михнев АД, Рюмин АИ. Изучение растворимости сульфата свинца и хлорида серебра в растворах хлористого натрия // Вестник Сибирского гос. аэрокосмического ун-та им. М.Ф. Решетнева. 2006. 82-86 c.
Сведения об авторах
Климов Никита Игоревич,
студент 4 курса, Магистр 2 курса, Апатитский филиал ФГБОУ ВО Мурманский государственный технический университет Россия, 184209, г. Апатиты, ул. Ферсмана, д. 50а
Касиков Александр Георгиевич,
УДК 546.15, 622.234.4
М. П. Лебедев, В. Р. Ларионов, Е. Д. Васильева
ЙОДНОЕ ВЫЩЕЛАЧИВАНИЕ БЛАГОРОДНЫХ МЕТАЛЛОВ
КАК АЛЬТЕРНАТИВА ИСПОЛЬЗОВАНИЯ ЦИАНИДОВ В УСЛОВИЯХ СЕВЕРА
В работе рассматривается йодное выщелачивание, как нетоксичный способ добычи золота из руд. Исследована сорбция имитатора золота (коллоида молекулярной меди) на метастабильном нанокристаллическом сорбенте кристаллогидрата воды. Показано, что после трехкратного пропускания через сорбент медь оказалась полностью сорбированной.
золотодобыча, выщелачивание, цианиды, йод, экологическая безопасность.
M. P. Lebedev, V. R. Larionov, E. D. VasiPeva
IODINE LEACHING OF NOBLE METALS AS AN ALTERNATIVE FOR THE USE OF CYANIDES IN THE CONDITIONS OF THE NORTH
gold mining, leaching, cyanides, iodine, environmental safety.
Республика Саха (Якутия), находясь на территории свыше 3,1 млн. кв. км., является самым крупным субъектом Российской Федерации. Якутия в течение многих лет является одним из ведущих регионов по добыче алмазов, золота, урана и др. Однако, в связи с многовековой вечной мерзлотой, сложными природно-климатическими условиями и неразвитой транспортной логистики реализация разработки и освоения месторождений полезных ресурсов являются сложными и затратными. Большинство крупных и мелких организаций по добыче благородных металлов не внедряют новые методы и технологии добычи и извлечения в связи с сезонностью производимых работы.
ОАО «Алданзолото ГРК», которое использует технологию кучного выщелачивания с использованием цианидов на Куранахской ЗИФ, увеличило добычу по руде на 32 млн. т, а по металлу на 56,5 т за счет перевода забалансовых запасов в балансовые. При этом во всем мире повсеместно устанавливается запрет на использование цианидов, что вызывает обеспокоенность горнодобывающих предприятий. Для решения проблемы извлечения золота не цианистыми соединениями многие ученые, частные компании, научно-исследовательские институты и коммерческие металлургические лаборатории в течение последних трех десятилетий изучали применение альтернативных к цианиду выщелачивателей, которые были сгруппированы в 11 категорий [1].
Потенциал применения растворов йода для извлечения золота известен уже много лет, но информация о систематическом исследовании ограничена. Йод является нетоксичным, а его галогениды образуют наиболее стабильные комплексы золота среди всех галогенидов других галогенов. Выщелачивание золота из руды проводится при низких концентрациях растворов йода. В водном
растворе йод реагирует с йодидом с образованием ионов 1з с Аи (I), а не с образованием комплекса Аи (III) (Е0 для Аи12 < Ли^ [2]). Комплекс Аи (III) нестабилен, так как этот ион окисляет йодидный ион до йода, и восстанавливается до комплекса Аи (I):
Из всех галогенов комплекс золото-йод наиболее устойчив в водном растворе за счет более низкого окислительно-восстановительного потенциала по сравнению с другими галогенами. Скорость растворения золота прямо пропорциональна концентрациям йода и йодида и не сильно подвержена изменениям рН в диапазоне от 2-10 [3-6, 9].
Скорость растворения золота может быть очень высокой и зависит от рН раствора и концентрации выщелачивателя и окислителя [2, 7, 9]. В целом стабильность галогенидов растет в ряду I > Вг > С1, тогда как скорость реакции растет в обратном порядке С1 > Вг > I, причем выщелачивание галоидом происходит значительно быстрее, чем для цианида.
По прогнозам Ке^аП и др.[8], процесс выщелачивания золота протекает при низкой активности свободного йодида, давая такую же растворимость золота, как и гораздо более активные хлоридные электролиты. При том же значении рН 1 кмоль/мм3 дает такую же растворимость Ли (III), что 16 моль/м3 Вг- и 2,5 10-3 моль/м3 I-. Из этого следует, что максимальное ограничение
рН для растворимости золота увеличивается в таком же порядке, а минимальная потребность в активности свободного галогенида находится в обратном. Кроме того, область преобладания комплексов Au (I) возрастает в порядке Cl < Br < I. В процессе выщелачивания для образования комплексов Au (I) потребуется меньше йодида (основной продукт процесса) [9].
Система йод-йодид обычно не окисляет сульфиды металлов, такие как халькоцит и пирротин, что позволяет избежать чрезмерного потребления реагентов на потенциальном предприятии по переработке золота [5]. Следовательно, такая система может быть использована для обработки руд, содержащих сульфидные минералы.
В исследовании [12] показано, что как при низких, так и при высоких концентрациях окислителя (I2 и OCl-) в водном растворе устойчивы ионы
в порядке убывания I-, AuI-, I2 и Ю3. Иная ситуация при высоких значениях pH.
Так, например при pH 10 в растворе преобладают ионы IO3, и скорость растворения золота снижается.
В недавних исследованиях [13], посвященных изучению in situ выщелачивания при низких концентрациях реагентов (например, 10 ммоль/л и 5 ммоль/л), с коэффициентами выщелачивания золота, аналогичными тем, которые получены с использованием насыщенного воздухом раствора 2,7 ммоль/л цианида, были признаны эффективными при обработке окисленной руды.
В работе [14] было изучено влияние на производительность выщелачивания золота из руды разного типа (углеродистая и оксидная) системой йод-йодид при разных концентрациях, а также присутствия кислорода в растворе при комнатной температуре. В углеродистой руде обнаружено только 20 %-ное извлечение золота, так как золото-йодидные комплексы легко адсорбируются на органическом веществе. Извлечение золота из оксидной руды в растворе, содержащем 20 г/л йодида и 4 г/л йода, достигало 77 % за 6 ч и 89 % за 24 ч. При использовании йодида в качестве окислителя золото не извлекалось. Процесс выщелачивания был возможен только при добавлении HCl к раствору йодида, и длился 48 ч. Установлено, что кинетика реакции является первой по отношению к концентрации 3-йодида.
В вопросах извлечения Au, Ag и Pd из отходов печатных плат мобильных телефонов авторами [15] использовалась йод-йодидная система совместно с предварительной обработкой сверхкритическим окислением воды (SCWO). При этом, температура, время и давление предварительной обработки SCWO оказывали существенное влияние на выщелачивание Au, Ag и Pd из (SCWO + HCL) обработанных отходов. Оптимальные условия предварительной обработки SCWO составляли 420 °C и 60 мин для Au и Pd, и 410 °C и 30 мин для Ag. Оптимальными параметрами растворения для Au, Pd и Ag в обработанных (SCWO + HCL) технических отходов с йод-иодидной системой являются время выщелачивания 120 мин (90 мин для Ag), мольное отношение йод-йодид 1 : 5 (1 : 6 для Ag), соотношение твердое вещество-жидкость 1 : 10 г/мл (1 : 8 г/мл для Ag) и pH 9 соответственно. Авторы утверждают, что разработанный в этом исследовании процесс является благоприятным для окружающей среды.
Вопрос восстановления и регенерации активных йода и йодида стоит остро, поскольку стоят они не дешево. Один из методов восстановления заключается в использовании сильных базовых анионообменных смол, которые были протестированы для извлечения как золота, так и реагентов из растворов йод-йодида 17.
Первые патенты на применение этой системы для выщелачивания in situ принадлежат McGrew и Murphy в 1985 [10], Jacobson и Murphy 1988 [11], Kubo 1992 [18], а также для переработки золота из электронного лома Falanga и MacDonald в 1982 [19].
Институтом горного дела Севера СО РАН предложены способы извлечения золота россыпных месторождений с помощью магнитных установок с повышением эффективности извлечения золота от 35 до 80 % [20]. Также ими предложен способ кучного выщелачивания металлов в штабеле тщательно перемешанных с фирном, что дает возможность выщелачивания круглый год, ускорить процесс и увеличить коэффициент фильтрации в условиях Севера [21]. Но, такой способ кучного выщелачивания подразумевает использование цианидов, что наносит вред экологии. Пинигиным С.А. [22] предлагается использование йода в растворах в условиях фильтрации растворителя через слой руды. Полученные данные показали, что общее извлечение золота при фильтрации достигает 99 % при расходе йода 1,44 кг/т. Для полноты извлечения свободного и связанного тонкодисперсного золота, мы предлагаем использование способа сорбции на кристаллогидратах [23]. Лабораторные исследования [24] с использованием имитатора золота коллоида молекулярной меди показали, что после трехкратного пропускания через сорбент (метастабильный нанокристаллический сорбент кристаллогидрата воды) медь оказалась полностью сорбированной. Таким образом, применение данной технологии снизит негативное воздействие на экологию, снизит затраты, при этом не снижая эффективности извлечения.
1. Aylmore, M. G. Advances in Gold Ore Processing. Alternative Lixiviants to Cyanide for Leaching Gold Ores / M. G. Aylmore. - : Elsevier Science, 2005. - 1076 c.
2. Tran, T., Lee, K., Fernando, K., 2001. Halide as an alternative lixiviant for gold processing an update. In: Young, C.A., Twidwell, L.G., Anderson, C.G. (Eds.), Cyanide: Social, Industrial and Economic Aspects. The Minerals, Metals and Materials Society, Warrendale, PA, USA, pp. 501-508.
3. Hiskey, J.B., 1988. Thiourea leaching of gold and silver-technology update and additional applications. Min. Metall. Proc. 1, pp. 173-179.
4. Hiskey, J.B., Atluri, V.P., 1988. Dissolution chemistry of gold and silver in different lixiviants. Min. Proc. Extr. Metall. Rev. 4, pp. 95-134.
5. Hiskey, J.B., Qi, P.H., 1991. Leaching behaviour of gold in iodide solutions. In: World Gold 91. Australasian Institute of Mining and Metallurgy, Melbourne, pp. 115-120.
6. Hiskey, J.B., Qi, P.H., 1993. The nature of gold uptake from iodide solution by carbon. In: Hiskey, J.B., Warren, G.W. (Eds.), Hydrometallurgy Fundamentals, Technology and Innovations. Society of Mining, Metallurgy, and Exploration, Inc., Littleton, Colorado, pp. 437-457.
7. Sergent, R.H., Dagar, A., Shin, C.C., Reid, K.J., 1992. A comparison of bromine and cyanide for refractory gold concentrate. In: Torma, A.E., Gundlier, H.I.H. (Eds.), Precious and Rare Metal Technologies. Elsevier, New York, pp. 149-162.
8. Kelsall, G. H. Thermodynamics of C1-H2O, Br-H2O, I-H2O, Au-Cl-H2O, Au-Br-H2O and Au-I-H20 systems at 298 K. G.H. Kelsall, N.J. Welham and M.A. Diaz. Journal of Electroanalytical Chemistry, 1993, pp. 13-24.
9. T.N. Angelidis, K.A. Kydros and K.A. Matis. A fundamental rotating disk study of gold dissolution in iodine-iodide solutions. Hydrometallurgy, 34. 1993, pp. 49-64.
10. Pat. 4557759 US, Int.Cl.4 C22B 11/04. Iodine leach for the dissolution of gold / McGrew, K.J., Murphy, J.W.; In-Situ, Inc. -№»598706; appl. 10.04.84; publ. 10.12.85.
11.McNulty, T., May 2001. Cyanide substitutes. Min. Mag. 256-261.
12.Davis, A., Tran, T. and Young, D.R. Solution chemistry of iodide leaching of gold. Hydrometallurgy, 32. 1993, pp. 143-159.
13. Evelien Martensa, Hongguang Zhangb, Henning Prommera, Janek Greskowiaka, Matthew Jeffreyb, Paul Robertsf. In situ recovery of gold: Column leaching experiments and reactive transport modeling. Hydrometallurgy 125-126. 2012, pp.16-23
14.Morteza, B. The leaching kinetics of an oxide gold ore with iodide/iodine solutions. Hydrometallurgy. 113-114. 2012, pp. 42-50.
15.Xiu, F.-R., et al. Leaching of Au, Ag, and Pd from waste printed circuit boards of mobile phone by iodide lixiviant after supercritical water pre-treatment. Waste Management (2015), pp. xx-xx.
16.Zhang, H., Coby, A., Jeffery, C.A., Jeffrey, M.I., 2012a. Ion exchange recovery of gold from iodine-iodide solutions. Hydrometallurgy 125-126, pp. 69-75.
17. Zhang, Y., Liu, S., Xie, H., Zeng, X., Li, J., 2012b. Current status on leaching precious metals from waste printed circuit boards. In: 7th International Conference on Waste Management and Technology, Procedia Environmental Sciences, vol. 16, pp. 560-568.
18.Kubo, S., 1992. Development of gold ore leaching method by iodine. In: Swan, S.A., Coyne, K.R. (Eds.), In Situ Recovery of Minerals II. The Minerals, Metals & Materials Society, pp. 405-431.
19.Pat. 4319923 US, Int.Cl.3 C22B 11/04, B44C 1/22. Recovery of gold and/or palladium from an iodideiodine solution / Falanga, B.J., MacDonald, D.I.; Western Electric Co., Inc. - №193875;appl. 03.10.80; publ. 16.03.82.
20.Полезн. модель 115243 РФ, МПК В03В 5/70, В03С 1/06 (2006.01). Шлюз для обогащения россыпей в потоке / Ларионов В.Р., Федосеев С.М. Слепцова Е.С. и др.; Ин-т горного дела Севера СО РАН. -№2010123096/03; опубл. 27.04.2012, Бюл. № 12.
21.Пат. 2398961 РФ, МПК Е21В 43/28 (2006.01) . Способ кучного выщелачивания металлов из труднопроницаемых высокоглинястых пород / Ларионов В.Р., Васильев П.Н., Матвеев А.И. и др.; Ин-т горного дела Севера СО РАН. -№2009100482/03; заявл. 11.01.09; опубл. 10.09.10, Бюл. № 25.
22.Пинигин, С. А. Иодиды как малотоксичные заменители цианида в процессах выщелачивания золотосодержащего сырья / Плаксинские чтения часть III. - Чита: 2002. С. 101-109 (16-19 сентября 2002 г.)
23. Ларионов, В. Р. Технология раздельного обогащения глубоко погребенных россыпей золота реки Б. Куранах / В. Р. Ларионов. и др. // Горный информационно-аналитический бюллетень. - 2012. - 8. - С. 184-189.
24.Ларионов, В. Р. Перспективы извлечения мелкодиспергированных частиц золота в условиях Севера. / В. Р. Ларионов, М. П. Лебедев, А. С. Ларионов // Химическая технология. - 2017. - 3. - С. 124-128.
Сведения об авторах Лебедев Михаил Петрович,
чл.-кор. РАН, д.т.н., председатель ЯНЦ СО РАН, директор Института физико-технических проблем Севера им. В.П.Ларионова СО РАН. Россия, 677891, г. Якутск, ул. Октябрьская, 1.
Ларионов Владимир Романович,
к.х.н., с.н.с. лаборатории обогащения полезных ископаемых Института горного дела Севера им. Н.В. Черского, СО РАН Россия, 677980, г. Якутск, пр. Ленина, 43
Васильева Елена Дмитриевна,
аспирант 1 года обучения, Институт физико-технических проблем Севера
им. В.П.Ларионова СО РАН.
Россия, 677891, г. Якутск, ул. Октябрьская, 1.
УДК 535.015, 54-162.2 Д. В. Мануковская
ВЫДЕЛЕНИЕ СЛОЕВ ФОТОИНДУЦИРОВАННОГО РАССЕЯНИЯ СВЕТА В СТЕХИОМЕТРИЧЕСКИХ КРИСТАЛЛАХ НИОБАТА ЛИТИЯ
Исследованы картины фотоиндуцированного рассеяния света (ФИРС), возбужденные лазерным излучением (Л0 = 530 нм) двух мощностей (Р=35, 160 мВт) в стехиометрических кристаллах LiNbOзстех и LiNb0зстехК20, выращенных по двум разным методикам. В результате статистического анализа картин ФИРС исследованных кристаллов, переведенных в режим оттенков серого, были выявлены точные границы слоев ФИРС. Также было доказано, что информацию о лазерно-индуцированных дефектах несут первые четыре (1', 1", 2, 3) выделенные слоя на картинах ФИРС кристаллов LiNbO3.
ниобат лития, фотоиндуцированное рассеяние света, цифровой анализ изображений.
LAYERING OF PHOTOINDICED LIGHT SCATTERING PATTERNS IN STOICHIOMETRIC LITHIUM NIOBATE CRYSTALS
Photoindiced light scattering (PILS) patterns excited by laser radiation (Л0 = 530 nm) of two powers (Р=35, 160 mV) were researched in stoichiometric crystals LiNbO3stoich and LiNbO3stoichK20 grown by different methods. The crystals were brought to grey-shade mode and then statistically analyzed. Precise boundaries of PILS layers were detected. Only first four layers (1', 1", 2, 3) were proved to carry information about laser-induced defects.
lithium niobate, photoindiced light scattering, digital analysis of the images.
Травление железа
Парафин мог стечь с пластины, если его расплавилось слишком много. Нашему опыту это никак не навредит, но главное – не испортить заготовку для будущего рисунка. В первую очередь необходимо задуть свечу. Далее возьмите шпажку и аккуратно «отрежьте» ненужные потёки. Теперь вы можете легко снять пластину с пламярассекателя, не повредив парафиновый слой.
Не получается процарапать рисунок: парафин отстаёт кусочками.
Скорее всего, слой парафина получился очень толстым. Соскоблите весь парафин и нанесите его заново, только в этот раз постарайтесь не переусердствовать: пластина должна быть покрыта ровным тонким слоем.
Есть несколько причин, почему рисунок мог плохо вытравиться. На том участке пластины, где был нанесён рисунок, могла остаться тонкая плёнка парафина, которая помешала йоду прореагировать с железом. Также возможно, что йод был распределён по пластине недостаточно хорошо. И последняя, но не менее важная причина: время выдержки было меньше 20 минут. Обратите внимание на эти факторы, когда будете повторять опыт.
Другие эксперименты




Пошаговая инструкция
Поместите свечу в горелку и подожгите её.
Накройте горелку пламярассекателем и положите на него железную пластину из пакетика «Fe». Подождите 2 минуты.
Возьмите кусочек парафина и натрите им железную пластину. Осторожно! Металлические части установки очень горячие!
Задуйте свечу и дайте горелке остыть. Подождите 5 – 10 минут.
Процарапайте шпажкой рисунок в парафине.
Добавьте на пластину 1 каплю жидкого мыла.
Отмерьте 5 – 10 капель 2.5%-го раствора йода в жидкое мыло и распределите его по пластине. Подождите 20 минут.
Смойте йод водой.
Тщательно соскаблите парафин шпажкой.
Вы получили вытравленный рисунок на железе!
Утилизация
Утилизируйте твёрдые отходы эксперимента вместе с бытовым мусором. Растворы слейте в раковину и затем тщательно промойте её водой.
Что произошло
Зачем нужно греть пластину?
Для успешного протекания эксперимента важно, чтобы изначально пластина была полностью покрыта парафином. Для того чтобы добиться такой равномерности, парафин расплавляют под действием тепла. После того как пластина остыла, парафин опять застывает и защищает от действия йода всю пластину, за исключением области, где мы сами только что убрали парафин, нанеся рисунок.
Почему возникает рисунок?
Будучи типичным металлом, железо является восстановителем – веществом, отдающим электроны в окислительно-восстановительных реакциях. Йод, другой участник эксперимента, напротив, неметалл, и потому в реакциях с обменами электронов склонен их забирать. Благодаря парафину и мылу железо и йод соприкасаются только в области рисунка. Такая «встреча» сопровождается простой реакцией:
Получившийся при этом йодид железа – водорастворимое соединение, которое легко удаляется с пластины, когда мы ее промываем . Естественно, что в местах, где йод реагирует с железом, второе медленно «тратится», и после проведения эксперимента от такого воздействия остаются углубления – как раз в тех местах, где мы удалили парафин при нанесении рисунка.
Химия йода и его соединений
История открытия этого элемента, напрямую связана с именем французского химика–технолога и фармацевта Бернара Куртуа, родившегося в 1777 и умершего в 1838 году. Свое великое открытие ученый сделал в 1811 г. В этот период, как раз, когда шли Наполеоновский войны, государство нуждалось в больших объемах селитры, которая использовалась для производства пороха. Страна уже имела большие запасы натриевой селитры, но она была малопригодна для производства пороха, так как быстро сырела на воздухе. Однако, уже был известен способ превращения натриевой селитры в калийную, с использованием золы морских водорослей. Этим и занимался Куртуа в своей лаборатории, т.е. в тот период он являлся производителем селитры. По ходу своей работы он заметил, что в золе водорослей находится какое-то вещество, которое разъедает железные и медные сосуды, но ни он сам и ни один из его помощников не знали, как это вещество выделить. Очень распространена версия о том, что совершить открытие Куртуа помог его кот. Говорят, что Бернар Куртуа не только работал в своей лаборатории, но и зачастую любил обедать в ней. А его кот часто находился рядом с ним. В один из таких дней, что-то напугало кота, и он бросился бежать, столкнув на своем пути несколько колб, в одной из которых находился спиртовой экстракт золы водорослей, а в другой серная кислота. Колбы разбились и находящиеся в них вещества смешались вместе, при этом в воздух поднялись фиолетовые пары, а затем выпали в мелкие темные кристаллики вокруг. Действительно, при действие серной кислоты на йодные соли щелочных металлов (NaI, KI), выделяется йодоводород (HI), который является непрочным веществом и в присутствие серной кислоты разлагается с образованием молекулярного йода и некоторых других продуктов: H2SO4 + 8HI = H2S + 4I2 + 4H2O
Куртуа сильно заинтересовался наблюдаемым явлением и хорошо изучил новое вещество. Некоторое время спустя Куртуа сообщил о своем открытие двум друзьям Н. Клеману и Ш.Б. Дезорму. А спустя еще какое-то время, новым элементом заинтересовались двое знаменитых ученых – француз Ж.Л. Гей-Люссак и англичанин Г. Дэви. Начав исследования данного элемента, эти ученые долгое время вели между собой горячие научные споры, а когда пришло время выбирать название химического элемента Гей-Люссак предложил – Йод, а Дэви – Йодин, причем оба руководствовались цветом (от греч. Iodes – фиолетовый).
Йод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском. При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары йода кристаллизуются, минуя жидкое состояние. Этим пользуются на практике для очистки йода от нелетучих примесей. Мало растворим в воде, хорошо во многих органических растворителях.

Нахождение в природе
Йод — редкий элемент. Он чрезвычайно сильно рассеян в природе и, будучи далеко не самым распространенным элементом, присутствует практически везде. Йод находится в виде йодидов в морской воде ( 20—30 мг на тонну морской воды). Присутствует в живых организмах, больше всего в водорослях ( 2,5 г на тонну высушенной морской капусты, ламинарии). Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны, — в термальных источниках Везувия и на острове Вулькано (Италия). Запасы природных йодидов оцениваются в 15 млн тонн , 99 % запасов находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча йода.
Сырьём для промышленного получения йода в России служат нефтяные буровые воды
Природный йод состоит только из одного изотопа — йода-127
Строение атома и атомные характеристики йода
Электронная формула йода: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 .
Конфигурация внешнего электронного слоя — 5s 2 p 5 .
Йод относится к группе галогенов.
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
Известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения.
1) С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
Йод легко реагирует с алюминием, причем катализатором в этой реакции является вода:
2) С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
3) Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I − :
Последняя реакция также используется в аналитической химии для определения йода.
4) Йод может также окислять сернистую кислоту:
5) При растворении в воде йод частично реагирует с ней
6) Йод окисляется концентрированной кислотой:
7) В горячих водных растворах щелочей образуются йодид и йодат
I2 + 2KOH = KI + KIO + H2O
8) При нагревании йод взаимодействует с фосфором:
а йодид фосфора в свою очередь взаимодействует с водой, образуя йодоводород и фосфоновую (трив. фосфористую) кислоту:
Образует ряд кислот: йодоводородную (HI), йодноватистую (HIO), йодистую (HIO2), йодноватую (HIO3), йодную (HIO4).

Йодоводород, газ, очень похож по своим свойствам на хлороводород, но отличается более выраженными восстановительными свойствами. Очень хорошо растворим в воде (425:1), концентрированный раствор йодоводорода дымит вследствие выделения паров HI, образующего с водяными парами туман.
В водном растворе принадлежит к числу наиболее сильных кислот.
Йодоводород уже при комнатной температуре постепенно окисляется кислородом воздуха, причем под действием света реакция сильно ускоряется:
Восстановительные свойства йодоводорода заметно проявляются при взаимодействии с концентрированной серной кислотой, которая при этом восстанавливается до свободной серы или даже до H2S. Поэтому HI невозможно получить действием серной кислоты на иодиды. Обычно йодоводород получают действием воды на соединения йода с фосфором - РI3. Последний подвергается при этом полному гидролизу, образуя фосфористую кислоту и йодоводород: РI3 + ЗН2О = Н3РО3 + 3HI
Раствор йодоводорода (вплоть до 50%-ной концентрации) можно также получить, пропуская H2S в водную суспензию йода.
Йодоводород реагирует с хлоридом железа (III) с образованием молекулярного йода:
или с сульфатом железа (III):
Йодоводород легко окисляется соединениями азота, например, оксидом азота (IV):
Исследовательский проект "Взаимодействие йода с металлом"
Руководитель:
Комлева Наталья Александровна,
учитель начальных классов.
г. Нижневартовск
2012г.
КООРДИНАЦИОННЫЙ ЦЕНТР НАЦИОНАЛЬНОЙ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ «ИНТЕЛЛЕКТУАЛЬНО-ТВОРЧЕСКИЙ ПОТЕНЦИАЛ РОССИИ» МЕЖРЕГИОНАЛЬНЫЙ ФЕСТИВАЛЬ ИССЛЕДОВАТЕЛЬСКИХ РАБОТ «ОТКРЫТИЕ МИРА»
Актуальность выбранной темы
Йода в человеческом организме всего 25 мг, он играет важную роль.
При недостатке йода задерживается физическое и умственное развитие и возникает болезнь.
Одним из важнейших микроэлементов, необходимых для слаженной работы организма является йод. Роль йода в развитии и сохранении жизни на нашей планете не может взять ни один другой элемент. Йод такой знакомый и доступный – в любой аптеке можно купить пузырек йодной настойки, но это совсем не тот йод которого не хватает нашему организму.
И какими еще неизвестным свойствами обладает этот редкий,
но повсеместно распространенный элемент.
Актуальность выбранной темы
Проблема
Человек в повседневной жизни постоянно сталкивается с йодной настойкой и с препаратами содержащими йод. Но как применять их без вреда для здоровья и предметов?
Для полноценного развития организма
человека необходимы макро- и микроэлементы,
а для самозащиты наиболее важен йод.
Этот микроэлемент играет главную роль в организме, обеспечивая его устойчивость к повреждающим факторам внешней среды: радиации, химическим ядам, травмам и так далее.
Из йода на 65% состоит тироксин - гормон щитовидной железы, который повышает сопротивляемость тканей, способность клеток освобождаться от вредных веществ, регулирует интенсивность дыхания и энергетический обмен.
Но этим не ограничивается польза микроэлемента. Пока человек получает достаточное количество энергии, он бодр, полон сил, жизнерадостен и здоров.
Как только хотя бы в одной из энергетических цепочек происходит сбой, самочувствие ухудшается. При серьезных неполадках в энергетическом обмене человек заболевает.
Гипотеза
Предполагается, что йод, будучи активным веществом, при взаимодействии с металлом вступает в химическую реакцию (окисление) и образует новое химической соединение (йодистое железо).
Цель
исследовать взаимодействие йода с металлом
Задачи
Узнать историю открытия йода.
Выявить значение йода в природе и в жизни человека.
Провести в домашних условиях эксперимент по взаимодействию йода с металлом (сталь).
Методы
сбор информации;
анализ литературы;
эксперимент;
наблюдение;
Описание.
Интересные факты о йоде
Йод и кот
Йод — очень редкий элемент земной коры (60-е место среди всех элементов). У йода есть одна особенность — крайняя рассеянность в природе.
Будучи далеко не самым распространенным элементом, йод присутствует практически везде.
Находится в виде иодидов в морской воде Присутствует в живых организмах, больше всего в водорослях.
Известен в природе также в свободной форме, в качестве минерала, но такие находки единичны
Йод получают из золы морских водорослей и буровых нефтяных вод.
Нахождение йода в природе
Лазурит
Схема круговорота йода в природе
Дождь в горах
Море
В.О.Мохнач, известный российский учёный, охарактеризовал значение йода такими словами: " Этот элемент входит в состав тироксина (гормона щитовидной железы), который жизненно необходим в качестве регулятора роста организма и стимулятора процессов обмена веществ. Трудно даже себе представить, какую форму приняла бы жизнь позвоночного животного, если бы в природе отсутствовал этот элемент".
Если бы они употребляли йод,
то никогда бы не вымерли.
В пищу необходимо использовать:
овощи, фрукты, крупы, морепродукты
Каким образом наш организм получает йод
Сколько надо йода
Для того чтобы обеспечить поступление в организм необходимых количеств йода, используют йодированную поваренную соль, хлеб а также обогащенные йодом биологически активные добавок к пище.
В домашних условиях мы часто используем «йодную настойку», обладающую дезинфицирующим действием. Следует иметь в виду, что обрабатывать йодной настойкой можно только небольшие раны, так как йод может травмировать ткани и увеличить сроки их заживления.
Йод химически активный элемент, поэтому обращение с йодом требует осторожности.
Рассмотрим в ходе эксперимента взаимодействие йода с металлом.
1. Берём стальную пластину, очищаем до металлического блеска, обезжириваем поверхность бензином.
Затем нагреваем пластину до t 40-45 С и наносим тонкий слой парафина на одну сторону пластины, остужаем до комнатной температуры.
ПРАКТИЧЕСКАЯ ЧАСТЬ.
Проведем эксперемент, с
целью узнать как взаимодействует
йод с металлом.
2. Острым предметом по парафину наносим надпись на поверхность.
3. Заполняем надпись раствором йода, по мере высыхания повторяем.
4. Через 24 часа смываем парафин и на поверхности пластины получаем результаты опыта
Практическое применение результатов исследования
Маркировка деталей на производстве
Маркировка деталей на производстве
В ходе эксперимента сделаны выводы:
1. Йод ,как и все химические элементы группы галогенов, является активным окислителем.
2. Йод в процессе взаимодействия со стальной пластиной вступил в реакцию окисления, в результате чего мы получили (йодистое железо) ожидаемый результат.
В ходе данного исследования мы научились проводить химический эксперимент
в домашних условиях.
Сделали вывод , что раствор йода химически активен с металлами, поэтому его производят и хранят только в стеклянной таре.
Выяснили, что свойства йода применяются в промышленности для получения высокочистого титана, циркония и др.металлов (йодное рафинирование металлов).
Также йод применяют в йодных лампах накаливания, в пищевых добавках, красителях, в медицине и фотографии.
Выявили, что йод имеет огромное значение как в природе так и в жизни человека.
ЗАКЛЮЧЕНИЕ
Исследовательская работа
Взаимодействие йода
с металлом
Автор: Юртаев Григорий Антонович МБОУ «Лицей №2», 1 а класс.
Благодарю за внимание!
КООРДИНАЦИОННЫЙ ЦЕНТР НАЦИОНАЛЬНОЙ ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫ «ИНТЕЛЛЕКТУАЛЬНО-ТВОРЧЕСКИЙ ПОТЕНЦИАЛ РОССИИ» МЕЖРЕГИОНАЛЬНЫЙ ФЕСТИВАЛЬ ИССЛЕДОВАТЕЛЬСКИХ РАБОТ «ОТКРЫТИЕ МИРА»
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Как проверить золото йодом?

На сегодняшний день золото остается одним из самых ценных металлов на рынке, поэтому ежедневно возрастает число случаев продажи поддельных ювелирных украшений. Благо современные технологии позволяют определять подлинность того или иного золотого изделия очень точно и быстро. Однако бывают такие ситуации, когда идти в специальный сервис нет времени или возможности, тогда вы можете определить подлинность золота и в домашних условиях.


Для чего это необходимо?
На самом деле большинство способов позволит вам довольно точно определить, настоящее перед вами золото или все-таки подделка. Это поможет вам сэкономить и время, и деньги. Одним из таких способов является проверка йодом. При такой проверке он влияет на химические соединения изделия и оказывает реакцию.
Проверять золото йодом очень удобно, так как только этот металл вступает в такую реакцию. После нанесения вещества на ювелирное изделие на настоящем золоте появится темное пятно, оно может немного отличаться по цвету у разных проб, к примеру, у 375 пробы это темно-зеленое пятно, а у 585 пробы цвет следа темно-коричневый. Однако это в любом случае будет темное пятно.
Если же изделие никак не реагирует на йод или остается светлое пятно, тогда перед вами какой угодно металл, например медь или бронза, но не золото.

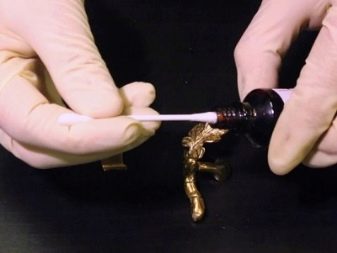
Процедура проверки
Важно! Для начала следует знать, что для этого способа проверки не подходят изделия с драгоценными камнями.
Если вас заинтересовал такой способ проверки, тогда вам придется приобрести несколько вещей:
- йод;
- ватная палочка или спичка с ваткой (губкой) на конце;
- небольшой кусок наждачной бумаги или любой другой абразив;
- если вы проверяете маленькие детали или элементы украшения, вам понадобятся лупа (чтобы заметить чернение) и пинцет.
После подготовки всего необходимого процесс проверки в домашних условиях займет у вас не более 5 минут.
- Для начала возьмите само изделие. В данной проверке абсолютно не играет роли «возраст» золота и срок последней его очистки. Чаще всего проверяют на подлинность золото 585 пробы, так как в некоторых случаях украшения из него имеют необычный красноватый оттенок, но это совсем не значит, что изделие поддельное. Тут дело в том, что в сплав добавляют довольно много лигатуры.
- Затем нужно слегка потереть украшение с внутренней стороны для более точной реакции с йодом. Роли здесь также и не играет размер «протертого» места, поэтому постарайтесь пространство взаимодействия сделать не очень большим и менее заметным.
- Далее при помощи ватной палочки или другого приспособления надо нанести небольшое количество йода на протертое место. Не старайтесь нанести вещества много – так реакция, конечно, будет выражена более ярко, но вам это пятно еще и выводить.
- Ну и теперь только остается ждать реакции металла. Если место, куда вы капнули йодом, темнеет или, вообще, чернеет, значит, перед вами подлинное золото. Если вещество оставляет след, но не темный, а светлый, или же не окрашивает место взаимодействия вовсе, значит, перед вами какой-то из других металлов, а может и вовсе не металл.

Как избавиться от пятна?
Если вы определили, что ваше золотое изделие действительно подлинное, перед вами встает еще один вопрос о том, как же теперь избавиться от этого темного пятна. На самом деле сделать это так же легко, как и проверить золото йодом. Вообще, это пятно исчезает и самостоятельно со временем, но если вам нужно убрать его срочно, то вы можете воспользоваться одним из способов. Начнем с того, что пятно убрать не получится при помощи порошка или мыльного раствора.
Известь и сода
Самым старым и проверенным уже несколькими поколениями является способ очистки известью, содой и солью. Вам необходимо взять 80–90 г извести, 30 г соли и 70 г соды. Все это нужно замешать в 1 л воды. А затем опустить в эту воду изделие из золота примерно на 1 час.

С помощью нашатырного спирта
Некоторые используют метод очистки золота от пятна при помощи нашатырного спирта, однако здесь есть ряд минусов.
- уксус не всегда идеально удаляет пятна, в некоторых случаях след все равно остается.
- держать золото в нем нужно довольно долго, чтобы получить хороший результат.
Ну и запах после нашатыря сохранится в квартире еще около трех дней.
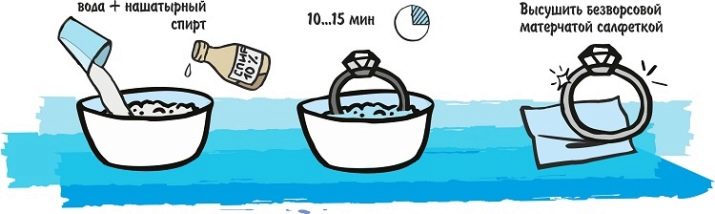
Уксус
Еще вам может помочь уксусная эссенция или просто столовый уксус. При использовании этого метода следует защитить все открытые участки кожи и глаза, так как вещество может спровоцировать химический ожог. Далее возьмите кусок ваты или ватный диск, смочите его в эссенции и натирайте пятно до того момента, пока оно полностью не исчезнет. Затем промойте золото в обычной воде и хорошо высушите.

Гипосульфит
Также для очистки можно использовать специальное вещество – гипосульфит, приобрести его можно в любой аптеке. Для очистки размешайте 1 столовую ложку гипосульфита в стакане теплой или прохладной воды. В этот раствор опустите украшение на полчаса-час. Затем промойте в воде и высушите.

Coca-Cola
Еще одним проверенным временем способом очищения является погружение изделия с пятном от йода в емкость с Coca-Cola. Помимо устранения пятна, вы еще получите очистку самого изделия от грязи и жира. Если пятно никак не удается устранить, не стоит отчаиваться, вы всегда можете отнести украшения к специалистам. Мастера из ювелирных салонов могут убрать это пятно при помощи специальных современных средств всего за пару минут.
Также следует знать, что проверять изделие йодом следует только в том случае, если украшение сделано из цельного сплава металла. Позолоченное украшение успешно проверить вряд ли получится, так как во время ошкуривания вы можете просто стереть слой позолоты и тогда изделие нужно будет нести в сервис на дополнительную процедуру золочения. Поэтому перед проверкой посмотрите на бирку изделия или просто сразу отнесите украшение к специалисту.
Хоть способ проверки золота йодом является одним из самых точных и быстрых в домашних условиях, но 100% достоверности результата вы не получите. Поэтому, если вам нужна гарантированная оценка изделия, отнесите его мастеру.
А чтобы не задумываться о поддельности изделия, покупайте их в сертифицированных магазинах, которым вы доверяете, и где украшения проверяют мастера.

О том, как проверить золото йодом в домашних условиях, смотрите в следующем видео.
Читайте также:
