Водород восстанавливает металлы из оксидов
Обновлено: 03.05.2024
Вторым восстановителем НВ в доменной печи, является водород. Он образуется в горне при разложении влаги дутья и природного газа, если последний вдувают в доменную печь, а также летучих кокса. Количество водорода в газе составляет 1 – 2% если печь работает на увлажненном дутье. При вдувании природного газа содержание водорода в газе повышается до 6 – 12% и роль его в восстановительных процессах значительно возрастает.
Восстановление оксидов железа водородом протекают по уравнениям:
при температуре ниже 570° С
при температуре выше 570° С
FeO + n'H2 = Fe + (n' - l)H2 + H2O - 6620 ккал. (61)
Реакция восстановления Fe2О3 до Fe3О4 идет необратимо, т. е. до полного использования Н2 или Fe2О3. Реакции восстановления Fe3О4 и FeO обратимы. Направление протекания реакции зависит от отношения Н2/Н2Огаз в газе и от температуры. Равновесный состав газовой смеси для реакций (57) – (61) зависит только от температуры, так как они идут без изменения объема газообразных веществ. На рисунке 26 показано равновесие газовых смесей Н2 и Н2Огаз с оксидами железа и железом в зависимости от температуры. Равновесные кривые делят диаграмму на три поля: Fe, FeO и Fe3О4.
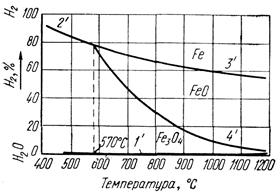
Рисунок 26 - Кривые равновесия газовых смесей Н2 и Н2Огаз с оксидами железа и железом
Отличие диаграммы на рисунке 26 от диаграммы на рисунке 25 состоит в том, что равновесные кривые 2' и 3' с повышением температуры изображены нисходящими линиями, т. к. восстановление водородом Fe3О4 до Fe по реакции (58) и FeO до Fe по реакции (61) идет с поглощением тепла в отличие от аналогичных реакций восстановления оксидом углерода, где реакция восстановления FeO до Fe идет с выделением тепла. Для сопоставления восстановительной способности СО и Н2 совместим диаграммы равновесных газовых смесей Н2 - Н2Огаз и СО – СО2 с оксидами железа и железом.
При температуре 810° С равновесные кривые 3 и 4 диаграммы на рисунке 25 пересекаются с соответствующими равновесными кривыми 3' и 4' на рисунке 26 (см. рисунок 27). В точках пересечения равновесных кривых отношение Н2/Н2Огаз равно отношению СО/СО2, т. е. восстановительная способность Н2 и СО, или их химическое сродство к кислороду, одинакова. При температуре ниже 810°С отношение Н2/Н2Огаз в равновесной смеси выше отношения СО/СО2, следовательно, для восстановления оксидов железа и железа водородом, его концентрация в газовой смеси должна быть выше, чем концентрация окиси углерода при восстановлении оксидом углерода. Это значит, что при температурах ниже 810° С химическое сродство водорода к кислороду выражено слабее, чем у оксида углерода, и он обладает меньшей восстановительной способностью.

Рисунок 27 - Кривые равновесия газовых смесей Н2 – Н2Огаз и СО – СО2 с оксидами железа и железом
При температуре выше 810 °С, наоборот, отношение Н2/Н2Огаз в равновесной смеси ниже отношения СО/СО2, т. е. восстановительная способность водорода выше, чем восстановительная способность окиси углерода.
В связи с тем что ниже 810° С сродство к кислороду у окиси углерода больше, чем у водорода, СО может взаимодействовать с водяным паром, образующимся при восстановлении, например:
FeО +CO→ Fe + CО2 . (62)
Аналогичные реакции можно написать для Fe2O3 и Fe3О4.
Выше 810° С сродство к кислороду у окиси углерода меньше, чем у водорода, однако взаимодействие водорода с СО не получает развития по той причине, что при 900– 1000 °С и водяной пар, и диоксид углерода активно взаимодействуют с углеродом, превращаясь в водород и оксид углерода.
Таким образом, водород в доменной печи как при умеренных, так и при высоких температурах является промежуточным реагентом или переносчиком кислорода от оксидов железа к оксиду углерода или углероду.
Получение металлов из оксидов действием водорода
О способности оксидов восстанавливаться водородом, можно судить в первом приближении по термодинамическим данным (табл. 1). Термодинамические расчеты и эксперимент подтверждают, что водород наиболее легко восстанавливает металлы из тех оксидов, которые образуются с выделением небольшого количества тепла (оксиды меди, железа, кобальта). Металлы, оксиды которых имеют большие теплоты образования по абсолютному значению (оксиды алюминия, магния, титана, циркония), с помощью водорода практически не получаются.
Восстановление металлов из оксидов водородом - гетерогенный равновесный процесс, выгодно отличающийся от металлотермических реакций тем, что пары воды можно легко удалить из реакционного пространства, сместив тем самым равновесие в сторону продукта.
Изучение кинетики реакции восстановления металлов из их оксидов показало, что процесс этот заключается в адсорбции водорода на активных центрах оксида с последующей десорбцией паров воды. Роль этих активных центров могут выполнять следы различных примесей, всегда имеющиеся в исходных оксидах, например, оксиды легко восстанавливаемых металлов или примеси некоторых металлов. Наличие этих примесей может менять характер восстановления: например, ускорять его, или даже изменять константу равновесия.
При решении вопроса о том, возможно ли восстановление металла из данного оксида, следует учитывать также скорость установления равновесия, особенно при невысоких температурах.Чем медленнее устанавливается равновесие, тем больше времени потребуется затратить для получения металла.
| Таблица 1 – Термодинамические константы оксидов (298 К) | |||
| оксид | DН°обр., кДж/моль | DG°обр., кДж/моль | S°, Дж/(моль×K) |
| CuO | -162 | -129,4 | 42,63 |
| Bi2O3 | -577,8 | -497,3 | |
| CrO3 | -585,76 | -506,26 | 71,96 |
| PbO | -219,3 | -189,1 | 66,2 |
| Pb3O4 | -723,4 | -606,2 | 211,3 |
| PbO2 | -276,6 | -218,3 | 74,89 |
| CoO | -239,3 | -213,4 | 43,9 |
| NiO | -239,7 | -251,6 | 37,99 |
| MnO2 | -521,5 | -466,7 | 53,1 |
| GeO2 | -554,7 | -500,8 | 55,27 |
| Fe2O3 | -822,2 | -740,3 | 87,4 |
| SnO2 | -580,8 | -519,9 | 52,3 |
| SnO | -286 | -256,9 | 56,5 |
| ZnO | -350,6 | -320,7 | 43,64 |
| Cr2O3 | -1140,6 | -1056 | 81,2 |
| TiO2 | -943,9 | -888,6 | 50,33 |
| B2O3 | -1254 | -1193,7 | 80,8 |
| Al2O3 | -1676 | -1582 | 50,92 |
| MoO3 | -745,2 | -668,1 | 77,74 |
| WO3 | -842,7 | -763,9 | 75,94 |
| Li2O | -595,8 | -562,1 | 37,89 |
| Na2O | -416,0 | -377,1 | 75,27 |
| K2O | -363,2 | -322,1 | 94,1 |
Иногда получить металл совсем не удается, хотя с термодинамической точки зрения реакция вполне вероятна. Так, оксиды меди, кобальта, никеля (теплота образования которых не превышают 750 кДж/моль по абсолютному значению), легко восстанавливаются при температуре 350-500°С. Некоторые оксиды этого ряда (СrО3, МоО3, MnO2, WO3) при этой температуре не восстанавливаются водородом до металла. Объясняется это тем, что восстановление водородом элементов, которые могут существовать в различных степенях окисления, протекает ступенчато. Сначала из высших оксидов сравнительно легко образуются оксиды в промежуточной степени окисления, а затем при более высоких температурах из них получаются соответствующие металлы. Однако этого не всегда можно добиться. В частности, при восстановлении марганца из двуокиси можно получить лишь оксид марганца (II), из которого получить металл очень трудно. Как правило, с уменьшением степени окисления металла прочность оксидов возрастает, а их способность к восстановлению уменьшается.
Количество водорода, необходимое для восстановления металла из его оксида, нужно вычислять не по стехиометрическому уравнению, а на основании константы равновесия, которую устанавливают экспериментально и по которой определяют процент использования водорода. Как правило, при высоких температурах для восстановления металла требуется водорода несколько больше, чем при низких температурах. На практике при низких температурах восстановление не проводят, потому что скорость реакции очень мала. Применение избыточного количества водорода с целью смещения равновесия дает незначительный эффект и приводит к непроизводительным затратам водорода.
Необходимо также учитывать величину поверхности соприкосновения оксида с водородом. Сильно прокаленные оксиды, имеющие крупнокристаллическую структуру, вступают в реакцию с водородом труднее, чем мелкодисперсные. При малой поверхности соприкосновения водород, для более полного его использования, следует пропускать медленнее.
Большинство металлов, получаемых описанным методом, прочно удерживает следы растворенного кислорода; его остатки удаляются с большим трудом и часто только при сплавлении металла в атмосфере сухого водорода. Однако после такой переплавки в металле обычно содержится некоторое количество растворенного водорода, удалить который можно только повторной длительной выдержкой расплавленного металла в глубоком вакууме.
Физические свойства и химическая активность получаемых металлов зависят от температуры восстановления. Металлы, получаемые при низких температурах, имеют большую поверхность и очень реакционноспособны. Некоторые из них получаются пирофорными и на воздухе часто самовозгораются. Повышение температуры восстановления приводит к укрупнению частичек металла и уменьшение их поверхности; внутренняя структура частичек металла делается упорядоченной, дефектность уменьшается, в результате чего химическая активность металла сильно снижается.
Если температура восстановления близка к температуре плавления, металлы получаются в виде плотной губки. В сплавленном состоянии металлы получаются при более высоких температурах, чем их температуры плавления.
Если температура восстановления выше 600 – 650 о С, то реакцию проводят в трубчатых электрических печах. В этом случае оксиды помещают в фарфоровую или кварцевую лодочку, которую вставляют в реактор (фарфоровая или кварцевая трубка). Концы трубки закрывают резиновыми или хорошими корковыми пробками, в которые вставляют с одного конца трубку, подводящую водород, а с другого – трубку, отводящую пары воды и непрореагировавший водород. При температуре 550-600 о С и ниже реакцию можно вести не в лодочке, а прямо в стеклянной трубке или трубке с перетяжками.
Окончание реакции восстановления оксидов определить довольно трудно. Об этом можно судить по изменению цвета или по уменьшению массы оксида, но только в том случае, если он имеет постоянный и известный состав. Практически водород пропускают в избытке в течение 20 – 30 мин, после чего реакцию считают доведенной до конца. Когда восстановление проводят в прозрачных трубках и при температуре, несколько превышающей точку плавления металла, об окончании реакции можно судить по образованию металлических корольков (особенно хорошо это видно при получении свинца, висмута, сурьмы). Если восстанавливаются малостойкие оксиды, то в конце трубки собираются капельки воды, что также можно считать признаком окончания реакции.
Малостойкие оксиды, например платины, могут при нагревании в атмосфере водорода быстро разлагаться, при этом в реакторе образуется гремучая смесь, что иногда приводит к взрыву.
Для измерения температур ниже 500 о С можно использовать термометр, для более высоких температур применяют термопару. Так как при восстановлении водородом не требуется очень точного соблюдения температурного режима, термопару можно поместить вне реакционной трубки, с ее наружной стороны, но в непосредственной близости от лодочки.
Собранную установку необходимо обязательно проверить на герметичность. Для этого через установку пропускают ток водорода, а трубку, отводящую водород, погрузить на 3-4 см в воду. Если водород пробулькивает через слой воды, то прибор герметичен.
Другой способ проверки герметичности (лучший в том случае, когда водород получают в аппарате Киппа). Через установку пропускают водород, а затем закрывают выходное отверстие газоотводной трубки. При полной герметичности прибора ток водорода скоро прекращается, об этом можно судить, наблюдая за счетчиком пузырьков.
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
Химические свойства основных оксидов

Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи . При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2 — . Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:

Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe 2+ можно окислить до иона Fe 3+ ).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO

Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
CuO + CO = Cu + CO2

4.2. Восстановление водородом .
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.

4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например , оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.

4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например , аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей.
Например , оксид железа (II) можно окислить кислородом до оксида железа (III):
Водород: химия водорода и его соединений
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1sАтом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
вода H2O и др. летучие водородные соединения (HCl, HBr)
кислые соли (NaHCO3 и др.)
основания NaOH, Cu(OH)2
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Читайте также:
