Водородная деполяризация металла при коррозии
Обновлено: 05.07.2024
При коррозии с водородной деполяризацией катодная реакция коррозионного процесса описывается следующими реакциями:
H2O + е → Надс + 20Н – → ½ Н2 + 2 ОН – нейтральная и щелочная среда.
Для того чтобы коррозия с водородной деполяризацией была возможна, необходимо, чтобы было выполнено термодинамическое условие электрохимической коррозии:
.(4.1)
Равновесный потенциал металла ( ) можно определить по уравнению
где Е – стандартный потенциал водородного электрода;
а – активность водородных ионов;
Р – парциальное давление водорода в коррозионной среде.
При Р = 1, учитывая, что = 0, уравнение значительно упрощается:
Соотношение (4.1) выполняется для отрицательных металлов, включая железо, в электролитах с любым рН. Для более положительных в сравнении с железом металлов, стоящих в ряду активности левее водорода, оно выполняется только в кислых средах. Металлы, стоящие в ряду активности правее водорода, ни в каких средах не корродируют по коррозии с водородной деполяризацией. Для производственной практики это коррозия металлов в кислых грунтах, кислых сточных водах, коррозия оборудования на производствах, связанных с применением кислот (травильные участки заводов ОЦМ, гальванические цеха) и т.д.
Как уже отмечалось выше, при электрохимической коррозии на поверхности металла протекает две сопряженные реакции: анодный процесс ионизации металла и катодный процесс восстановления окислителя (ей). В целом скорость коррозии будет зависеть от скорости каждой из этих реакций. Однако, если коррозия идет с образованием растворимых соединений металла, то анодная реакция в этом случае часто протекает быстро с малой поляризацией и скорость коррозии определяется, в основном, замедленностью катодной реакции. Рассмотрим, от каких факторов в этом случае будет зависеть скорость коррозии.
Катодный процесс коррозии с водородной деполяризацией состоит из следующих стадий:
1. Диффузия гидратированных ионов водорода или молекул воды к поверхности корродирующего металла.
2. Разряд водородных ионов или молекул воды:
3. Растворение и диффузия части атомов водорода в металле.
4. Молизация водородных атомов путем рекомбинации:
или электрохимической десорбции:
5. Диффузия и перенос конвекцией водорода от катодных участков вглубь, а затем его диффузия в воздух.
6. Образование и отрыв пузырьков от поверхности металла:
Первая стадия – диффузия деполяризатора к поверхности металла при выделении водорода является быстрой в связи с большой подвижностью водородных ионов и высокой концентрацией молекул воды в двойном электрическом слое. В реальных условиях коррозии наиболее часто замедленными стадиями являются: разряд, электрохимическая десорбция и отвод пузырьков в газовую фазу. Возможность замедленной стадии рекомбинации при рассмотрении коррозионных процессов можно не учитывать, так как рекомбинационная теория водородного перенапряжения справедлива, в основном, для благородных металлов (Pt,Pd,Ro), термодинамически не способных к коррозии с водородной деполяризацией. В величину перенапряжения всегда вносит свой вклад стадия 5.
Кинетические зависимости при замедленности стадий разряда и электрохимической десорбции сходны между собой. Рассмотрим влияние различных факторов на коррозию в случае замедленной стадии разряда.
Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим.

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой.


Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого.
© cyberpedia.su 2017-2020 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!
Водородная деполяризация
Процессы коррозии металлов, у которых катодная деполяризация осуществляется водородными ионами, называются коррозией металлов с водородной деполяризацией. Водородная деполяризация - катодная реакция восстановления ионов водорода.
В кислых средах протекает реакция (4.22), в щелочных:
С водородной деполяризацией корродирует оборудование, соприкасающиеся с растворами кислот, например стальные железнодорожные цистерны для перевозки кислот, металлические баки и аппараты на химических заводах, травильные отделения прокатных цехов и цехов гальванических покрытий.
Коррозия металлов с водородной деполяризацией возможна при условии:
- обратимый потенциал водорода в данных условиях, - стандартный потенциал водородного электрода при всех температурах (обратимый потенциал водородного электрода при ан+ = 1 и = 1 атм).
В табл. 4.3 приведены значения обратимого потенциала водородного электрода при 25 о С и различных значениях рН среды и парциального давления водорода.
| , атм | рН среды/потенциал | ||
| 5∙10 –7 (в атмосфере) | 0,186 | -0,228 -0,414 | -0,641 -0,828 |
Водородная деполяризация протекает с большим торможением и при более отрицательных потенциалах чем кислородная (рис. 4.12, кривая GFH), что обуславливает возникновение перенапряжения выделения водорода, ηH2, в уравнении Тафеля:
где константа “b3” не зависит от материала, константа “а3” зависит от природы и состояния поверхности материала катода и численно равна величине перенапряжения при плотности тока, равной единице. В логарифмической шкале кривая перенапряжения будет прямой с константой “b3”, равной тангенсу угла наклона прямой к оси абсцисс, константа “а3” равна величине ординаты lg i = 0 (при плотности тока i = 1).
Перенапряжение водорода зависит от природы металла (рис. 4.16).
Рис. 4.16. Перенапряжение выделения водорода на технически чистых металлах в 1 М H2SO4 при 25 0 С: а – в координатах б – в координатах .
Катодный процесс выделения водорода состоит из следующих стадий:
1) диффузии и миграции гидратированных ионов H + к поверхности катода;
2) разряда ионов водорода H + ∙H2O + e = Hадс + H2O (4.67)
с образованием адсорбированных атомов водорода;
3) рекомбинации (молизации) атомов водорода Hадс +Hадс = H2 (4.68)
и/или растворения и диффузии части Hадс атомов в металле;
4) образование и отрыв пузырьков H2 от поверхности металла.
В кислых растворах перенапряжение диффузии из-за замедления транспорта H + к катодным участкам незначительно. Это объясняется высокой поверхностью гидрати-рованных протонов H + ∙H2O, а также перемешиванием раствора водородом, выделяющимся на катоде. Основную роль в торможении процесса выделения водорода относят к стадии (4.67) замедленного разряда и стадии (4.68) замедленной рекомбинации.
Согласно теории замедленного разряда, наиболее замедленной стадией катодной реакции, ответственной за перенапряжение, является стадия разряда водородных ионов (4.67). По этой теории коэффициент b3 в уравнении (4.66) равен при 25 0 С:
что находится в достаточно хорошем соответствии с опытными данными (рис. 4.16). Теория объясняет также зависимость перенапряжения водорода от pH раствора и строения двойного электрического слоя на катоде.
Теория замедленной рекомбинации (Тафель, 1905) основана на представлении о химической природе торможения реакции (4.68), так как в этой реакции не участвуют электроны. Эта теория также дает логарифмическую зависимость от iк. Однако теория замедленной рекомбинации дает заниженную величину b3.
Современное понимание природы металла в перенапряжении выделения водорода основано на представлении о способности газов к хемосорбции (“химической” реакции между молекулами и поверхностью твердого вещества). При самопроизвольной хемосорбции H2 на металле возникает выигрыш энергии за счет теплоты образования связи Hадс – Me. В отсутствии хемосорбции водорода затраты энергии на выделение водорода в виде значительного перенапряжения велики. Прочная хемосорбция водорода на переходных металлах (Pt, Pd, Ti, W, Ni, Fe) сильно снижает величину .
Поляризацию вследствие замедленной диффузии водородных ионов к катодной поверхности называют ионной концентрационной поляризацией водорода, значение которой:
где: - активность водородных ионов в объеме раствора; - активность водородных ионов у поверхности катода; - предельная диффузионная плотность тока по водородным ионам.
Поляризация, обусловленная замедленной диффузией молекулярного водорода от катодных участков в глубь раствора, называется газовой концентрационной поляризацией:
где: - концентрация молекулярного водорода у катодной поверхности; - его концентрация в объеме раствора; и - парциальные давления водорода у катодной поверхности и в атмосфере соответственно.
В отличие от ионной, газовая концентрационная поляризация постоянно сопровождает процесс водородной деполяризации. К началу выделения пузырьков водорода (парциальное давление водорода в пузырьке: = ратм = 1 атм) в атмосферу воздуха, где парциальное давление водорода составляет = 5 . 10 -7 атм, её значение составляет 0,186 В, и дальше не меняется.
Особенности процессов с водородной деполяризацией
Замедленность катодного процесса заметно влияет на скорость коррозии металлов с водородной деполяризацией. Наиболее затрудненными стадиями катодного процесса, в зависимости от условий коррозии, являются разряд водородных ионов и диффузия водорода (диффузионно-кинетический контроль). Относительное значение первой стадии увеличивается с ростом катодной плотности тока (преобладание кинетического контроля).
Характерные особенности коррозии металлов с водородной деполяризацией:
1) меньшая, чем при коррозии с кислородной деполяризацией, зависимость от перемешивания электролита,
3) большая зависимость от рН раствора,
2) большая зависимость от природы и содержания катодных примесей: чем ниже перенапряжение водорода на катодных примесях и чем больше их содержание, тем больше скорость коррозионного процесса,
4) протекание процесса с ускорением (с увеличением скорости коррозии во времени), что обусловлено облегчением протекания катодной реакции разряда водородных ионов в результате увеличения числа микрокатодов на поверхности корродирующего металла за счет обнажения новых катодных участков по мере растворения металла;
5) возможность появления водородной хрупкости металла.
Основные способы борьбы с коррозией металлов в кислотах:
- применение устойчивых металлов и сплавов (платина, меди и бронз), пассивирующихся сталей, нержавеющих хромистых и хромоникелевых сталей, свинца (серная кислота), железа и магниевых сплавов (фтористоводородная кислота); сталей, чистых по катодным примесям;
- использование замедлителей коррозии и ингибиторов;
- нанесение защитных покрытий: металлических (кремний, никель, свинец, плакирование), неметаллических органических (полиэтилен, фторопласт, эпоксидные смолы), неорганических (эмали) и др.;
- электрохимическая защита металлических конструкций анодной поляризацией.
Пример 4.3.Определить электрохимическую поляризацию катода при коррозии цинка с водородной деполяризацией в неподвижном 0,1 m растворе HCI при 298К и катодной плотности тока 50 А/м 2 , если плотность тока обмена катодной реакции io = 10 -6 А/м 2 , коэффициент перехода α = 1/2. Как изменится величина электрохимической поляризации при перемешивании раствора?
3) ( )к = –(0,709 + ln50) = –0,909 В
4) При перемешивании раствора тонкий слой электролита вблизи поверхности металла остается неподвижны, поэтому характеристики электрохимической реакции восстановления водорода, в том числе и поляризация при заданной скорости процесса останутся постоянными.
Пример 4.4. Рассчитать ионную (подвод ионов водорода) концентрационную поляризацию катода, считая его макрокатодом, при коррозии цинка по условиям предыдущего примера, если средний коэффициент активности электролита =0,796, эквивалентная электропроводность иона водорода = 325,7 Ом -1 см 2 , а число переноса водородного иона t+ = 0,876. Эффективная толщина диффузионного слоя δd = 0,075 см. Сравнить величины электрохимической и концентрационной поляризаций. Как изменится результат при переходе от макро- к микрокатоду при δd = const.
Решение. 1) Ионная концентрационная поляризация катода равна:
2) Предельная диффузионная плотность тока: id = . ;
3) = . n . = 0,1 . 0,796/1000 см 3 = 7,96∙10 -5 г-ион/см 3 .
4) Коэффициент диффузии D = =
5) Подставляем в выражение для расчета id:
id = = 54,1 мА/см 2 = 541 А/м 2 .
6) Находим = ln (1– ) = –2,49 . 10 -3 В = –2,49 мВ
7) Наиболее затрудненной является электрохимическая реакция (ΔEэ/х =–0,909B), в то время как концентрационная поляризация мала (ΔEконц =–2,49 мВ). При переходе от макро- к микрокатоду величина электрохимической поляризации практически не изменится, так как концентрация ионов водорода на поверхности металла остается постоянной, близкой к объемной. Величина концентрационной поляризации (при δd = const ) несколько уменьшится в результате облегчения подвод ионов водорода за счет боковых путей диффузии к катоду.
Электрохимическая коррозия
Электрохимическая коррозия металла может проявиться в тех случаях, когда имеет место граница раздела фаз металл-электролит. Факт проявления коррозии не зависит от природы электролита, будь это сверхчистая вода или расплавленная соль. Не имеет существенного значения и количество электролита - в предельном случае это может быть пленка влаги толщиной в несколько десятков миллимикрон.
Схема процесса коррозии.Анодный процесс при коррозии всегда заключается в ионизации металла. Металл переходит в раствор в виде гидратированных ионов, при этом в металле остается соответствующее число электронов.
Примерами анодных реакций могут быть:
Fe - 2ē = Fe 2+ - окисление железа
Al - 3ē = Al 3+ - окисление алюминия
В общей форме реакция выглядит так:
Me – nē = Me n+ , где Me - металл.
Катодный процесс - поглощение появившихся в металле избыточных электронов с помощью так называемых деполяризаторов, которыми могут являться атомы, молекулы, ионы раствора, подвергающиеся восстановлению на всей поверхности металла или отдельных ее участках.
Примерами катодных реакций могут быть следующие:
2Н + + 2ē → 2Н → Н2 - восстановление ионов водорода в кислой среде.
О2 + 4Н + + 4ē → 2Н2О - восстановление растворенного кислорода в кислой среде.
О2+2Н2О + 4ē → 4ОН - - восстановление растворенного кислорода в нейтральной или щелочной среде.
В общей форме уравнение катодной реакции выглядит так:
D + ē → D, где D – деполяризатор.
Поляризация и ее виды. Коррозия металлов с кислородной и водородной деполяризацией.При прохождении через электрод электрического тока извне происходит смещение его потенциала. Численная величина изменения потенциала вследствие прохождения тока называется поляризацией.
Причина возникновения поляризации состоит в том, что переход зарядов из металла в раствор и перемещение ионов в электролите встречают определенное сопротивление. В зависимости от вызывающих его факторов различают три вида по-
ляризации: концентрационную, активационную и оммическую.
Причиной концентрационной поляризации является разность концентраций ионов в приэлектродном пространстве, следствием чего является изменение потенциала электрода.
Возникновение активационной поляризации обусловлено сопротивлением, возникающим во время катодной реакции присоединения электронов деполяризатором или торможением
при переходе катионов из металлической решетки в раствор. В электрохимии эти процессы называют стадиями, считается, что самая замедленная стадия определяет скорость процесса. Преодоление такого сопротивления требует добавочной активационной энергии, поэтому и поляризация называется активационной.
Омической поляризацией называется падение потенциала JR, вызываемое электрическим сопротивлением слоя электролита вблизи электрода или слоя продуктов реакции, а также обоих этих слоев одновременно.
В зависимости от направления сдвига потенциала электрода при прохождении постоянного тока различает анодную и катодную поляризации. Анодной поляризацией называется сдвиг потенциала в положительную сторону, катодной поляризацией - его перемещение в отрицательную сторону.
На практике всегда стремятся к увеличению поляризации в коррозионном элементе. Благодаря поляризации металлов скорость коррозии уменьшается в сотни, а то и в тысячи раз.
Явление, противодействующее поляризации электрода, принято называть деполяризацией. Деполяризация (анодная и катодная) ускоряет процесс коррозии.
Среди большого количества реакций катодной поляризации в коррозионных процессах наибольшее значение имеют реакции, в которых в роли, деполяризатора выступает кислород (кислородная деполяризация) или ионы водорода: водородная поляризация).
С водородной деполяризацией протекает коррозия всех
металлов, стоящих левее водорода в ряду напряжений, в кислых средах. В нейтральных средах с водородной деполяризацией протекает коррозия активных металлов, а в щелочных средах - амфотерных металлов.
С кислородной деполяризацией протекает коррозия металлов малой и средней активности в нейтральных средах и в любых средах металлов малой активности, т.е. стоящих в ряду
напряжений после водорода. С кислородной деполяризацией протекает атмосферная и почвенная коррозия. Существенное влияние на скорость коррозии оказывает скорость доставки кислорода к металлу путем диффузии или конвекции, а также такие факторы как перемешивание электролита, глубина погружения корродирующего металла, растворимость кислорода в растворе и т.д.
Причины возникновения гальванопар.В процессах электрохимической коррозии можно выделить следующие типы возникновения гальванических пар (т.е. разности потенциалов на поверхности металлов):
1. Практически любой металл содержит примеси других металлов или соединения того же металла. В среде электролита система из основного металла и металла примеси образует большое число гальванопар. Участки с более электроотрицательными потенциалами окажутся анодами (по отношению к внутреннему участку цепи) и будут растворяться, a нa более электроположительных участках (катодах) будут происходить процессы восстановления. Таким образом, одной из причин электрохимической коррозии является возникновение микро - и макрогальваничесхих элементов на поверхности металла.
На рис. 69 представлена схема коррозии железа с включением меди.
Рис.69. Схема коррозии железа с включением меди
Электрохимическая система этой гальванопары в электролите изображается, как и в случае гальванического элемента, схемой
железо - анод, медь - катод
На аноде: Fe - 2ē = Fe 2+
На катоде: 2Н + + 2ē = Н2
В результате железо разрушается в месте контакта, а на меди выделяется водород.
2. Гальванопары могут возникать и в результате неравномерности аэрации, т.е. неравномерного доступа кислорода к различным участкам поверхности металла. На рис. 70 показана схема коррозии железа при неравномерном доступе кислорода.
Участки поверхности металла, к которым быстрее диффундирует кислород - катодные, к которым затрудняется доступ кислорода – анодные.
На катоде: O2 + 2Н2O + 4ē = 4ОН - (в нейтральной среде)
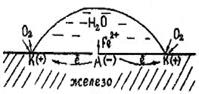
Рис. 70. Схема коррозии железа при неравномерной аэрации
В ходе коррозии химический состав раствора вблизи металлической поверхности подвергается непрерывным изменениям. Результатом этих изменений являются вторичные реакции. Из приведенной выше схемы видно, что вблизи катодного участка происходит подщелачивание и ионы железа могут вступить в реакцию с ионами OН - с образованием гидроокиси железа: Fe 2+ + 2OH - → Fe (OH)2
Труднорастворимая гидроокись железа выпадает в осадок. Если процесс протекает в воздушной среде, то гидроокись железа (II) окисляется кислородом воздуха в гидроокись железа (III):
Гидроксиды железа неустойчивы и постепенно могут переходить в соответствующие оксиды. Продукты электрохимической коррозии железа, состоящие из гидратированных оксидов, называются ржавчиной.
3. Возникновение разности потенциалов может наблюдаться для одного и того же металла, части которого контактируют с электролитом разной концентрации. В растворе с меньшей концентрацией поверхность металла заряжается отрицательно (анод), а в более концентрированном растворе - положительно (катод).
4. Часто детали изделия, выполненные из одного и того же металла и различающиеся только по температуре эксплуатации могут подвергаться электрохимической коррозии. Такие контакты встречаются в промышленных устройствах, соприкасающихся с нагретыми газами или жидкостями, например, в паровых котлах, змеевиках и т.д.
5. Различный уровень механических напряжений в одной и той же детали приводит к возникновению микрогальванопар. Если согнутая металлическая пластинка погружена в коррозионную среду, то на растянутом слое через некоторое время начнут возникать трещины (анод), внутренний слой останется без изменения (катод).
Факторы, влияющие на коррозию.На скорость коррозии влияют различные факторы: природа металла, его структу-
ра и состояние поверхности, химический состав и свойства среды, температура электролита, природа поверхностных оксидных пленок, условия работы изделия, влажность, пыль и др. Например, состав электролита определяет электропроводность и активную концентрацию ионов, участвующих в процессе.
Ускоряют коррозионные процессы во всех случаях и для всех металлов ионы Н + , Сl - , Br - , I - , понижая потенциал растворения металлов. Для амфотерных металлов такую роль играют ионы ОН - .
Присутствие в электролите ионов или полярных молекул, которые могут выступать как лиганды при комплексообразовании и растворять пассивирующие пленки (Сl - , СN - , NH3), значительно ускоряет коррозионные процессы.
С увеличением температуры скорость коррозии металлов, как правило, возрастает, причем эта зависимость носит экспоненциальный характер. Скорость коррозии стали в НСl, идущая с выделением водорода, удваивается при увеличении температуры на 10°. Однако часто зависимость скорости коррозии от температуры имеет сложный характер (например, в случае, когда процесс коррозии протекает с кислородной деполяризацией). Такое явление наблюдается при коррозии стали в природных водах.
X Международная студенческая научная конференция Студенческий научный форум - 2018

Машины и аппараты, изготовленные из металлов и сплавов, при эксплуатации в природных или технологических средах, подвержены коррозии.
Коррозия – самопроизвольное разрушение материалов вследствие их физико-химического взаимодействия с окружающей средой (агрессивной атмосферой, морской водой, растворами кислот, щелочей, солей, различными газами и т.п.).
Актуальность темы работы: коррозия металлов наносит государству большой экономический ущерб и может приводить к аварийным ситуациям, угрожающим жизни и здоровью людей.
Разработка эффективных методов защиты металлов от коррозии приведет к уменьшению материальных потерь в результате коррозии трубопроводов, деталей машин, судов, мостов, морских конструкций и т.д. Не менее важной задачей является повышение надежности оборудования, которое в результате коррозии может разрушаться с катастрофическими последствиями, к примеру, паровые котлы, металлические контейнеры, сосуды высокого давления, мосты, детали самолётов. Надёжность является важнейшим условием при разработке оборудования АЭС и систем захоронения радиоактивных отходов. Большое значение имеет сохранность металлического фонда, мировые ресурсы которого ограничены. Кроме того, человеческий труд, затрачиваемый на проектирование и реконструкцию металлического оборудования, пострадавшего от коррозии, может быть направлен на решение других общественно полезных задач.
Цель работы: изучить сущность электрохимической коррозии металлов и способы защиты металлов от коррозии.
- изучить виды коррозии металлов;
- изучить механизм электрохимической коррозии;
- изучить методы защиты металлов от коррозии;
- провести экспериментальное исследование процесса коррозии металлов.
Теоретическаячасть
Электрохимическая коррозия – взаимодействие металла с коррозионной средой, при котором ионизация металла и восстановление окислителя протекают раздельно, но являются сопряженными процессами, сопровождающимися протеканием электрического тока. Электрохимическая коррозия следует законам электрохимической кинетики, и её скорость зависит от величины электродного потенциала. Электрохимическая коррозия может иметь место только в электропроводных системах материал – среда, т.е. для металлических материалов – в растворах и расплавах электролитов.
Причиной ее возникновения является химическая, энергетическая и другие виды неоднородности поверхности любого металла или сплава, т.е. разделение на катодные и анодные участки. Последние, имея очень малые размеры и чередуясь друг с другом, в токопроводящей среде представляют собой совокупность огромного числа короткозамкнутых микрогальванических элементов, поэтому электрохимическую коррозию часто называют гальванической коррозией.
Процессы электрохимической коррозии протекают в водных растворах. При соприкосновении металлической поверхности с раствором электролита происходит взаимодействие металла с заряженными частицами раствора и переход ионов металла в раствор. Согласно теории А.Н. Фрумкина, при взаимодействии металла и раствора протекают два сопряженных процесса:
1. Переход ионов из металла в раствор с образованием гидратированных ионов (анодный процесс): Me + mН2O = Меn + · mН2O + ne
2. Переход ионов из раствора с выделением их на поверхности металла в виде нейтральных атомов, входящих в состав кристаллической решетки металла (катодный процесс): Меn + · mН2O + ne = Ме + mН2O
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют его электрохимическому разрушению.
Отличительными особенностями электрохимического процесса коррозии являются следующие:
– одновременное протекание двух раздельных процессов − окислительного (растворение металла) и восстановительного (выделение водорода, восстановление кислорода, выделение металла из раствора и др.);
– процесс растворения металла сопровождается направленным перемещением электронов в металле и ионов в электролите, т.е. возникновением электрического тока;
– продукты коррозии образуются в результате вторичных реакций.
Окислительно−восстановительные процессы, протекающие при электрохимической коррозии, могут быть представлены в виде следующих реакций:
Ме − nē→ Меn + (анодный процесс) (1)
R(ox) + nē → Rn - (катодный процесс), (2)
где R(ox) – окислитель;
Rn - (red) – восстановленная форма окислителя;
nē – количество переданных электронов.
В качестве примера электрохимической коррозии можно привести процесс окисления (ржавления) железа под воздействием воды:
А(–) Fe − 2ē → Fе 2+ (анодный процесс – растворение железа) К(+) H2O + ½О2 +2ē → 2OH - (катодный процесс – восстановление кислорода)
Fe 2+ + 2OH - → Fe(OH)2 (образование продуктов коррозии)
Реакции (1) и (2) протекают сопряженно, но подчиняются своим кинетическим закономерностям. При этом необходимо соблюдение условий стационарности процесса, т.е. равенства скоростей окисления металла и восстановления окислителя. Данные реакции могут быть территориально разделены – протекать на разных участках поверхности. Из условий стационарности вытекает, что достаточно затормозить одну из сопряженных реакций, чтобы скорость всего процесса уменьшилась.
Виды электрохимической коррозии:
Коррозия в кислой среде.
Железо в кислой среде окисляется до Fe 2+ .
Процессы окисления-восстановления на электродах:А (–) Fe 0 - 2ē → Fe 2+ │1 - процесс окисления на аноде К (+) 2Н + + 2ē → Н2↑ │1 - процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в гальванической паре реакцию: Fe 0 + 2H + → Fe 2+ + Н2↑
Уравнение электрохимической коррозии в молекулярной форме:Fe + H2SO4 → FeSO4 + Н2↑
Схема коррозионного элемента: А (–) Fe | Fe 2+ ||2H + | H2 (+) К
Коррозия в атмосфере влажного воздуха.
Процессы окисления-восстановления на электродах: А (–) Fe 0 - 2ē → Fe 2+ │2 - процесс окисления на аноде К (+) 2H2O + О2 + 4ē → 4OH - │1 - процесс восстановления на катоде
Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в гальванической паре реакцию:2Fe 0 + 2H2O + О2 → 2Fe 2+ + 4OH -
Уравнение электрохимической коррозии в молекулярной форме:2Fe + 2H2O + О2 → 2Fe(OH)2↓
Схема коррозионного элемента:
Коррозия в морской воде.
А (–) Fe 0 -2ē → Fe 2+
Схема коррозионного элемента: А (–) Fe | Fe 2+ ||2H2O | H2; 2OH - (+) К
Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри металла.
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере. В этом случае железо будет анодом (E°= –0,44В), а медь – катодом (E°=+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите:
А (–) Fe – 2ē → Fe 2+ – окисление
К (+) 2H + + 2ē → H2↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
К (+) 2H2O + O2 + 4ē → 4OH - – восстановление
Схема короткозамкнутого гальванического элемента:
У поверхности металла в электролите протекают следующие реакции:
Методы защиты металлов от коррозии
При разработке методов защиты от коррозии используют различные способы снижения скорости коррозии, которые выбираются в зависимости от характера коррозии и условий ее протекания. Выбор того или иного способа определяется его эффективностью, а также экономической целесообразностью.
В зависимости от причин, вызывающих коррозию, различают следующие методы защиты.
1) Легирование. Применяется для изменения или улучшения физических и химических свойств металлов, сплавов. В особенности, для придания металлам и сплавам повышенной коррозионной стойкости. Металл, подвергшийся легированию, называется легированным.
2) Наиболее распространены неметаллические защитные покрытия –эмали, лаки, краски, пластмассы, различные смолы, полимеры. Защитное действие этих покрытий сводится в основном к изоляции металлов от окружающей среды. Достоинство этого способа защиты – простота технологии их нанесения. Недостаток – легко разрушаются из-за хрупкости и растрескивания при тепловых и механических ударах; эти покрытия защищают до тех пор, пока сохраняется их целостность.
3) Металлические защитные покрытия.
Классифицируя металлопокрытия по способу защиты основного металла, их обычно подразделяют на катодные и анодные.
Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент:
на аноде: Cr – 2ē → Cr 2+
Cr 2+ + 2 OH – → Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении целостности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае (например, в атмосфере влажного воздуха).
на аноде: Fe – 2ē → Fe 2+
Fe 2+ + 2 OH – → Fe(OH)2
Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
4) Электрохимическая защита - перевод металла в коррозионно-устойчивое состояние путём торможения катодных и анодных реакций коррозионного процесса электрохимическими методами. Различают три вида электрохимической защиты: катодная, протекторная и анодная.
Катодная защита. Суть катодной защиты заключается в том, что защищаемое изделие подключается к отрицательному полюсу источника электрического напряжения, т.о. становится катодом. В качестве противоэлектрода используется металлический лом или графит.
Протекторная защита. Суть протекторной защиты состоит в следующем. К изделию, подвергающемуся электрохимической коррозии, присоединяют деталь-протектор из более активного металла, чем металлы изделия: протектор является анодом и будет разрушаться, а изделие останется неизменным.
Анодная защита. Анодная защита используется только для тех металлов, которые при анодной нагрузке способны образовывать на своей поверхности пассивные оксидные или солевые пленки, защищающие металл от коррозии, например, железо в серной кислоте. Анодная защита отличается от катодной тем, что защищаемая конструкция присоединяется к положительному полюсу внешнего источника тока.
5) Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
Данные способы защиты находят широкое применение в промышленности в силу многих своих преимуществ – уменьшения потерь материалов, увеличения толщины покрытия, наносимого за один слой, уменьшения расхода растворителей, улучшение условий производства окрасочных работ и т.д. Защита от коррозии является одной из важнейших проблем, имеющей большое значение для народного хозяйства.
Задачи практической части работы:
- исследовать влияние различных сред на коррозию железа;
- изучить электрохимическую коррозию при контакте металлов;
- ознакомиться с защитными свойствами анодных и катодных покрытий.
Опыт 1. Изучение влияния среды на коррозию железа
Посуда и реактивы: пять химических пробирок, пять железных гвоздей, водопроводная вода, дистиллированная вода, 0,1н раствор хлорида натрия, 0,1н раствор гидроксида натрия, 0,1н раствор соляной кислоты.
Порядок выполнения работы
Пять одинаковых железных гвоздей опускают в пять пробирок. В первую пробирку приливают 0,1н раствор NaCl, во вторую – 0,1н раствор NaOH, в третью – 0,1н раствор HCl, в четвертую – дистиллированную воду, в пятую – водопроводную воду. Закрывают пробирки пробками и в течение месяца наблюдают за происходящими изменениями.
Читайте также:
