Восстановление металла на катоде
Обновлено: 04.10.2024
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
На аноде окисляются хлорид-ионы до молекулярного хлора:
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Электролиз
Электролиз расплавов и растворов

Электролиз расплавов и растворов встречается в заданиях на ЕГЭ, а значит, если вы планируете сдавать экзамен по химии, эту тему нужно знать на отлично. Наша статья поможет узнать или повторить, что такое электролиз, его правила и схема протекания.
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:

Электролиз расплава
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
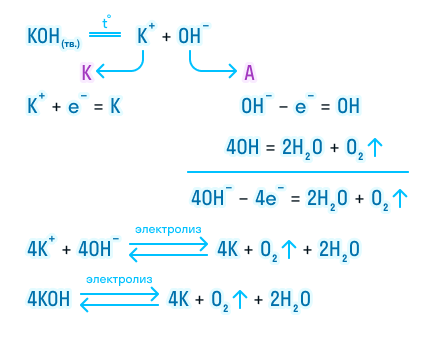
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH - как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:

Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
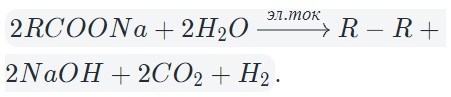
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Сущность электролиза. Электролиз расплавов. Анодное окисление и катодное восстановление
Сущность электролиза. Электролиз расплавов. Анодное окисление и катодное восстановление. Электролиз с растворимыми и нерастворимыми электродами. Законы Фарадея. Выход по току. Электролитическое получение и рафинирование металлов. Основы гальванических методов нанесения покрытий.
Электролизом называют совокупность процессов, имеющих место при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов и расплава или раствора электролита.
Простейшим электрохимическим процессом такого рода является электролиз расплавов. Рассмотрим, например, электролиз расплава хлористого магния. При прохождении через расплав тока катиона магния под действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются.
Анионы хлора перемещаются к положительному электроду и, отдавая избыточные электроны, окисляются:
Складывая уравнения процессов, протекающих у электродов, получаем суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава хлористого магния:
Mg 2+ + 2Cl - = Mg + Cl2
Эта реакция не может протекать самопроизвольно, энергия, необходимая для ее осуществления, поступает от внешнего источника тока.
Рекомендуемые материалы
Электрод, на котором происходит окисление, называется анодом; электрод, на котором происходит восстановление, называется катодом. Однако, в отличие от гальванического элемента, при электролизе катод заряжен отрицательно, а анод – положительно, то есть распределение знаков заряда электродов противоположно тому, которое имеет место при работе гальванического элемента.
Следовательно, на отрицательном электроде (катоде) происходит катодное восстановление ионов магния до металлического магния, а на положительном электроде (аноде) идет анодное окисление ионов хлора до газообразного хлора.
При электролизе водных растворов электролитов необходимо иметь в виду, что кроме ионов электролита, в растворе находятся ионы Н + и ОН - , являющиеся продуктами диссоциации воды. В электрическом поле ионы водорода перемещаются к катоду, а ионы гидроксила к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. Аналогично, у анода может происходить разряд как анионов электролита, так и анионов гидроксила. Молекулы воды могут также подвергаться электрохимическому восстановлению или окислению. Из нескольких возможных процессов будет проткать тот, осуществление которого сопряжено с минимальной затратой энергии.
Рассматривая катодные процессы, необходимо учитывать потенциал восстановления ионов водорода. Этот потенциал зависит от концентрации ионов водорода и в случае нейтральных растворов (при рН = 7) равен –0,41в. Поэтому, если катионом электролита является металл, электродный потенциал которого значительно положительнее, чем –0,41в, то будет происходить восстановление иона металла. Такие металлы находятся после олова включительно. Наоборот, если катионом является металл, имеющий потенциал значительно более отрицательный, чем –0,41в, то металл восстанавливаться не будет, а будет происходить выделение водорода по схеме 2Н+ + 2е = Н2. К таким металлам относятся металлы начала ряда напряжений, приблизительно до титана. Наконец, если потенциал металла близок к значению 0,41в (это металлы средней части ряда напряжений – цинк, хром, железо, кадмий, никель), то в зависимости от условий электролиза возможно как восстановление металла, так и выделение водорода; нередко наблюдается одновременно и то, и другое.
Кислородсодержащие анионы разряжаются труднее, чем анион гидроксила. Поэтому на аноде будет происходить окисление ионов гидроксила по схеме: 4ОН - - 4е = О2 + 2Н2О в щелочной среде и 2Н2О – 4е = О2 + 4Н + в кислой или нейтральной среде.. При электролизе водных растворов бескислородных кислот и их солей у анода разряжаются их анионы (кроме плавиковой кислоты и фторидов).
Например, при электролизе водного раствора хлористого натрия на катоде выделяется водород, а на аноде хлор;
Катод Na + (-2,7в) 2Cl - (+1,36) Анод
Н + (-0,41) ОН - (+1,22)
2Н + + 2е = Н2 2Сl- -2e = Cl2
(или в нейтральной и щелочной среде
4H2O + 4e = 4OH - +4H +
4H + = 2H2)
В растворе накапливается щелочь NaOH
Выделение хлора противоречит взаимному расположению потенциалов систем, Эта аномалия связана со значительным перенапряжением кислорода на аноде, так как материал анода оказывает тормозящее действие на процесс выделения кислорода.
при электролизе раствора сернокислой меди на катоде происходит выделение меди, а на аноде выделение кислорода;
Катод Сu 2+ (+0,337) SO4 2- (+2,01) Анод
Н + (-0,41) ОН - (1,23)
Cu 2+ +2e = Cu 4ОН - -4е = О2 + 2Н2О
(или в нейтральной и кислой среде
В растворе накапливается серная кислота
при электролизе раствора сернокислого натрия на катоде выделяется водород, а на аноде кислород.
Катод Na + SO4 2- Анод
(или в нейтральной и щелочной среде 4ОН - -4е = О2 + 2Н2О
4H2O + 4e = 4OH - +4H + (или в нейтральной и кислой среде
4H + = 2H2) 2Н2О – 4е = 4Н + + О2
В данном случае фактически происходит электролитическое разложение воды, а сернокислый натрий просто увеличивает электропроводность раствора.
Характер катодного процесса, как мы уже видели, определяется, прежде всего, положением соответствующего металла в ряду напряжений.
При рассмотрении анодных процессов следует учитывать, из какого материала изготовлен анод. Различают электролиз с инертным анодом и электролиз с активным анодом.
Инертным называется анод, материал которого не претерпевает окисления в ходе электролиза. В качестве материала для инертных анодов чаще всего применяют графит, уголь или платину.
Активный анод окисляется в процессе электролиза. В случае активного анода число конкурирующих анодных процессов возрастает до трех:
1. Электрохимическое окисление воды с выделением кислорода;
2. Разряд аниона
3. Электрохимическое окисление металла анода (так называемое анодное растворение металла).
Из всех этих возможных процессов будет идти тот, который энергетически наиболее выгоден. Если потенциал металла анода располагается в ряду стандартных потенциалов раньше обеих других электрохимических систем, то будет наблюдаться анодное растворение металла. В противном случае будет происходить выделение кислорода или разряд аниона.
Рассмотрим, например, электролиз раствора никеля с никелевым электродом. На катоде происходит, в основном, разряд ионов никеля и выделение металла, так как потенциал никеля (- 0,250 в) значительно больше –0,41в. На аноде происходит окисление никеля, так как потенциал никеля намного меньше потенциала окисления воды (+1,23в), а тем более потенциала окисления сульфат-иона (+2,01в).
Катод Ni 2+ SO4 2- Анод (Ni)
Ni 2+ + 2e = Ni Ni –2e = Ni 2+
Таким образом, в данном случае электролиз сводится к растворению металла анода и выделению его на катоде. Этот процесс называется электролитическим рафинированием и применяется для электролитической очистки никеля (и других металлов).
Законы электролиза были установлены выдающимся английским физиком М. Фарадеем в 30-х годах девятнадцатого века.
1. Масса образующегося при электролизе вещества пропорциональна количеству прошедшего через раствор электричества.
Этот закон вытекает из сущности электролиза. В месте соприкосновения металла с раствором происходит взаимодействие ионов или молекул раствора с электронами металла, так что электролитическое образование вещества является результатом этого процесса. Поэтому количество образовавшегося вещества всегда будет пропорционально числу прошедших по цепи электронов, или количеству электричества. Или, математически, m = kQ.
2. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств веществ.
Например, при электролизе хлорида меди (II) каждый ион меди получает от катода два электрона, и в то же время два хлорид-иона отдают аноду два электрона, превращаясь в атомы хлора. Следовательно, число выделившихся атомов меди всегда будет вдвое меньше количества выделившихся атомов хлора, то есть массы меди и хлора будут относиться друг к другу как их эквивалентные массы.
Измерениями установлено, что для превращения одного эквивалента вещества необходимо количество электричества, равное округленно 96500 кулоном электричества. Эту величину называют числом Фарадея и обозначают буквой F.
Два закона Фарадея объединяются в один соотношением:
M = ЭIt/F (время измеряют в секундах)
Во многих случаях на практике вследствие побочных процессов выделенная на электродах масса вещества Mфакт. Меньше, чем рассчитанная по закону Фарадея Mтеор. Для характеристики истинного количества вещества, выделяющегося на электродах, введено понятие выхода по току Вт, которое рассчитывают по формуле:
Вт = Мфакт./Мтеор (х100%)
Рассмотрим примеры решения задач, связанных с процессами электролиза:
1. При электролизе водного раствора азотнокислого серебра с платиновым анодом в течение 25 минут при силе тока 3А на катоде выделилось 4,8 г серебра. Рассчитайте выход по току. Эквивалентная масса серебра равна 107,87. (Ответ: 95,24%)
2. Определите время, необходимое для получения 1 кг металлического натрия при электролизе расплава едкого натра при силе тока 2500А, если выход по току равен 35%. Эквивалент натрия равен 23. (Ответ: 1час 20 минут).
3. Через раствор нитрата никеля в течение 2,45 часа пропускали ток силой 3,5А. Определите, на сколько граммов за это время уменьшилась масса никелевого анода. (Ответ: 9,39г)
4. Через раствор сульфата цинка пропускали ток в течение 30 минут. При этом выделилось 0,25г цинка. Амперметр при этом показывал 0,4А. Какова ошибка в показаниях амперметра? (Ответ: 2,44%).
5. Какие вещества и в каком количестве выделятся на угольных электродах при электролизе раствора йодистого натрия в течение 2,5 часов, если сила тока равна 6А?
Электролизом водных растворов солей получают и очищают многие металлы. Электролитическое выделение металлов из руд называется электроэкстракцией, а очистка металлов от примесей при помощи электролиза называется электрорафинированием. Такое производство тяжелых и цветных металлов получило общее название гидрометаллургии. Методом электроэкстракции получают, главным образом, цинк, медь и кадмий. Электролитическому рафинированию подвергают мель, никель, свинец, олово, серебро, золото.
Электролизом расплавов в промышленности получают алюминий, магний, натрий, литий, кальций, титан и другие металлы, потенциалы выделения которых из водных растворов солей более отрицательны, чем потенциал водорода. При электролизе водных растворов щелочных металлов выделяют хлор, водород, а также получают каустическую соду (едкий натр). В результате электролиза водных растворов щелочей получают водород и кислород высокой чистоты.
На электролизе водных растворов солей основано также электроосаждение – выделение металла на катоде в виде плотного или порошкообразного осадка.
Процессы гальваностегии представляют собой нанесение путем электролиза на поверхность металлических изделий слоев других металлов для защиты их от коррозии, придания им твердости или в декоративных целях. Это так называемые гальванические покрытия. При нанесении гальванопокрытий катодом служит обрабатываемое изделие, а анодом – или металл покрытия, или нерастворимый электрод. На катоде происходит выделение металла покрытия. Важнейшими гальванотехническими процессами являются хромирование, цинкование и никелирование. Гальванопластикой называют процессы получения точных металлических копий с рельефных предметов электроосаждением металла. Путем гальванопластики изготовляют матрицы для изготовления различных пластмассовых изделий (например, пуговиц), матрицы для тиснения кожи и бумаги, типографские клише, радиотехнические схемы.
К гальванотехнике относится также оксидирование, или анодирование – покрытие поверхности металлического изделия слоем его оксида путем анодного окисления металла.
Путем электросинтеза получают пероксид водорода, перманганат калия, храматы, хлораты и гипохлориты, а также некоторые органические вещества, например, анилин из нитробензола.
Велико значение электролиза и в лабораторной практике. В основе таких методов анализа, как электровесовой, вольамперометрический и кулонометрический лежит процесс электролиза.
Электролиз
Электролиз (греч. elektron - янтарь + lysis — разложение) - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
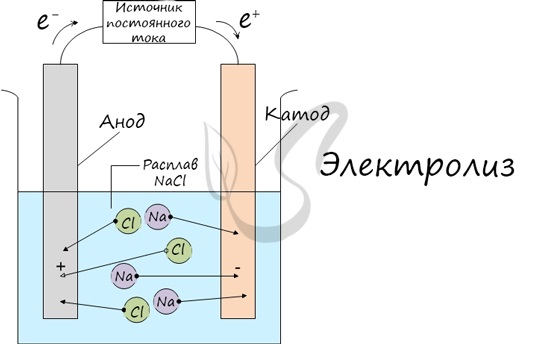
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы - положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
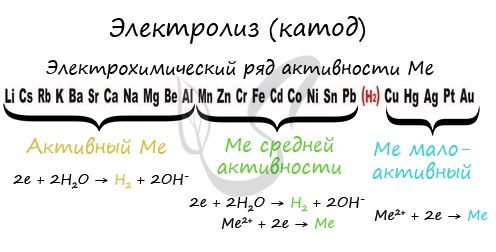
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) - на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды - выделяется водород.
В случае, если на катод поступают ионы водорода - H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + - 2e = H2
К аноду притягиваются анионы - отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl - , Br - , I - , F - , S 2- , CH3COO - .

При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- - на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор - если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор - самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ - CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
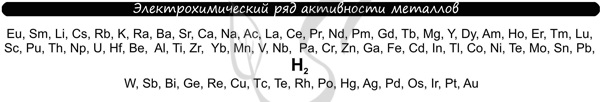
Теперь вы точно будете знать, что выделяется на катоде ;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись "NaOH", не подвергая его дальнейшему электролизу)
Натрий - активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген - хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно :) Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача - получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
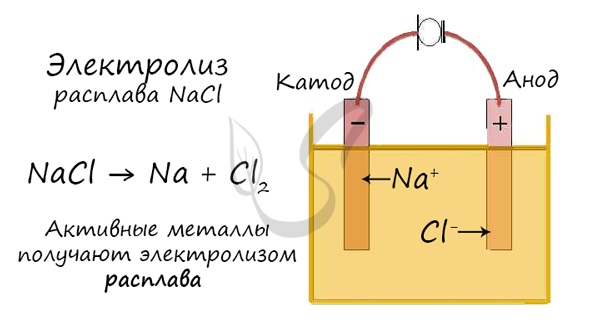
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
