Воздействие щелочи на металл
Обновлено: 19.05.2024
Цель работы: изучение влияния природы металлов на процесс их взаимодействия с различными кислотами и щелочами.
Металлическими свойствами обладает большинство элементов, входящих в периодическую систему Д. И. Менделеева. Металлы характеризуются рядом физических свойств: металлическим блеском, обусловленным способностью их отражать лучи света; высокой тепло- и электропроводностью; пластичностью; легко подвергаются механической деформации; некоторые из них имеют большую прочность при растяжении или при сжатии. Все физические свойства обусловливаются особенностями их внутренней структуры. Атомы и ионы располагаются в узлах кристаллической решетки, а электроны – электронный газ– в пространстве между ними. Устойчивость кристалла обеспечивается силами притяжения между положительными ионами и электронным газом. При обыкновенной температуре все металлы (за исключением ртути) – твердые вещества. Металлы способны взаимодействовать между собой, образуя сплавы. [1 – 4].
В соответствии с особенностями электронной структуры и положением в периодической системе различают s-, p-, d-иf-семейства металлов. Кs-семейству относятся металлы, у которых происходит заполнение электронами внешнегоs-подуровня. Это элементы главных подгруппIиIIгрупп – щелочные и щелочноземельные металлы. Дляp-металлов главных подгрупп характерно последовательное заполнение внешнегоp- подуровня. Металлические свойства у них выражены слабее. Наиболее многочисленны металлыd-семейства, у которых происходит заполнениеd- подуровней (переходные металлы). Металлы, у которых заполняютсяf-подуровни, образуют две группы, очень похожие между собой, - лантаноиды и актиноиды.
Внешние электроны в атомах металлов находятся на значительном расстоянии от ядра и связаны с ним сравнительно слабо. Металлы отличаются небольшими значениями энергии ионизации, т. е. энергия, которую надо затратить для отрыва электронов от нейтрального атома и перевода его в положительный ион.
Н. Н. Бекетов установил химический ряд активности металлов (электрохимический ряд напряжений металлов), в котором металлы расположены в порядке убывания их активности:
Li, K, Mg, Al… Fe… Sn, Pb, H, Cu, Ag, Au
Чем левее расположен в ряду напряжений металл, тем он активнее, тем больше его восстановительная способность, тем легче он окисляется. Характеристикой восстановительной способности металлов является также величина стандартных электродных потенциалов: чем меньше значение стандартного электродного потенциала, тем активнее металл и тем выше его восстановительная способность. Каждый металл этого ряда вытесняет все следующие за ним металлы из растворов их солей.
Химические свойства металлов весьма разнообразны. Общим свойством для всех металлов является их способность отдавать свои электроны, проявляя восстановительные свойства [1 -4].
Восстановительная способность металлов проявляется при взаимодействии с различными веществами (кислотами, щелочами, водой и др.).
Концентрированная соляная кислота, разбавленные растворы серной и соляной кислот взаимодействуют только с металлами, стоящими в ряду напряжений до водорода, вытесняя его из разбавленных растворов этих кислот. Металлы d-семейства, имеющие две степени окисления, при действии разбавленных сернойH2SO4и соляной НСlкислот образуют соли с низшей степенью окисления металла:

Zn+HCIразб =ZnCI2+H2

Fe + H2SO4 разб = FeSO4 + H2
Медь взаимодействует с соляной кислотой в присутствии кислорода воздуха:
Концентрированная серная кислота окисляет почти все металлы, за исключением благородных. Металлы средней и малой активности, включая серебро, окисляются ею лишь при нагревании, образуя соли с высшей степенью окисления металла. В концентрированной серной кислоте окислителем является сульфат-ион SO4 2- . В зависимости от активности металла и условий проведения реакции (температуры, концентрации кислоты) могут образовываться следующие продукты:H2S(с активными металлами),S(с металлами средней активности),SО2(с малоактивными металлами). Например:

Мg+ Н2SO4 конц.MgSO4+H2S+ Н2О

Сu+ 2Н2SO4 конц.СuSO4+SO2+ 2H2O
Цинк может восстанавливать концентрированную кислоту до SO2,S,H2S.

Zn+ 2Н2SO4 конц. ZnSO4 +SO2 + 2H2O

3Zn+ 4Н2SO4 конц. 3ZnSO4 +S + 4H2O

4Zn+ 5Н2SO4 конц. 4ZnSO4+H2S+ 4H2O
Азотная кислота является более сильным окислителем. Особенностью ее взаимодействия с металлами является то, что металлы не вытесняют водород даже из ее разбавленных кислот, в этом случае происходит восстановление азотной кислоты. Состав продуктов зависит от активности металла и концентрации, причем доля продуктов с низкими степенями окисления азота возрастает по мере разбавления кислоты. Продуктами восстановления могут быть NO2,NO,N2O,N2иNH4NО3. Чем активнее металл и чем меньше концентрация кислоты, тем полнее восстанавливается азот. При взаимодействии неактивных металлов (расположенных правее железа) с концентрированной азотной кислотой выделяетсяNO2, с разбавленной –NO, например:
При взаимодействии активных металлов (щелочных, щелочноземельных, цинка) с концентрированной азотной кислотой выделяется N2O, с очень разбавленной –NH4NО3, например:
Если металлы p-иd-семейства имеют две степени окисления, то при действии разбавленной азотной кислоты они образуют, главным образом, соли с высшей степенью окисления металла.
Реакционная способность некоторых металлов невелика, т. к. их поверхность покрыта оксидной пленкой устойчивой к действию растворов кислот и щелочей. Например, оксидная пленка на поверхности свинца разрушается при действии разбавленной азотной кислоты и нагревании.
При действии концентрированной азотной или серной кислот на поверхности некоторых металлах образуется плотная оксидная пленка, устойчивая к действию окислителей и предохраняющая металлы от дальнейшего разрушения. Это явление называется пассивацией. Например, концентрированная серная кислота пассивирует Fe,Be,Co,Bi,Nb, а концентрированная азотная –Al,Cr,Fe,Nb,Be,Coи другие [1 – 3].
При нагревании концентрированные кислоты окисляют эти металлы:

2Fe + 6H2SO4 концFe2(SO4)3 + 3SO2 + 2H2O
Смесь концентрированных азотной и соляной кислот (“царская водка”) окисляет самые благородные металлы – золото и платину.
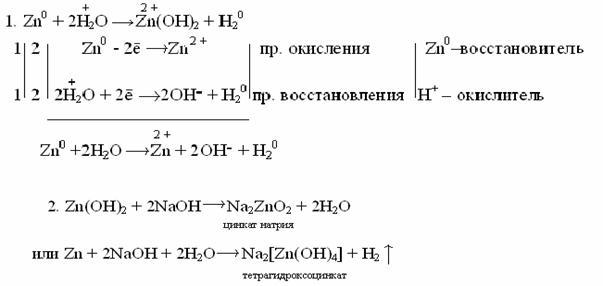
Некоторые металлы (Be,Al,Zn,Sn,Pbи др.) способны растворяться в растворах щелочей. При взаимодействии указанных металлов или их гидроксидов с растворами щелочей образуются комплексные соединения (гидрооксосоли), в которых лигандами являются ионы гидроксила.
При сплавлении таких металлов и их гидроксидов со щелочами образуются соли слабых кислот.
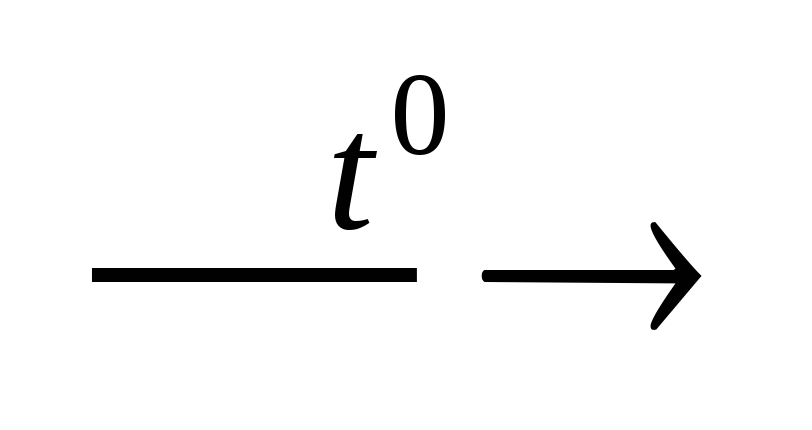
Ве+2NaOHNa2BeO2+H2

Zn(OH)2+ 2NaOHNa2ZnO2+H2О
Взаимодействие металлов со щелочами
Со щелочами взаимодействуют только те металлы, оксиды и гидроксиды которых обладают амфотерными свойствами. Происходит образование комплексной соли металла и выделяется газообразный водород из щелочи:
| 2NaOH + Zn 0 Na2ZnO2 + H20↑, |
| Zn 0 – 2e → Zn +2 , 2H + + 1e → H2 0 . |
69). Виды коррозии:
Коррозия под напряжением
Коррозия при трении
Если коррозия охватывает всю поверхность металла, то такой вид разрушения называется - сплошной коррозией. К сплошной коррозии относится разрушение металлов и сплавов под действием кислот, щелочей, атмосферы. Сплошная коррозия может быть равномерной, т. е. разрушение металла происходит с одинаковой скоростью по всей поверхности, и неравномерной, когда скорость коррозии на отдельных участках поверхности неодинакова. Примером равномерной коррозии может служить коррозия при взаимодействии меди с азотной, железа - с соляной, цинка - с серной кислотами, алюминия - с растворами щелочей. В этих случаях продукты коррозии не остаются на поверхности металла. Аналогично коррозируют железные трубы на открытом воздухе. Это легко увидеть, если удалить слой ржавчины; под ним обнаруживается шероховатая поверхность металла, равномерно распределенная по всей трубе.
При местной коррозии на поверхности металла обнаруживаются поражения в виде отдельных пятен, язв, точек. В зависимости от характера поражений местная коррозия бывает в виде пятен, т. е. поражений, не сильно углубленных в толщу металла; язв - поражений, сильно углубленных в толщу металла; точек, иногда еле заметных глазу, но глубоко проникающих в металл. Коррозия в виде язв и точек очень опасна для таких конструкций, где важно поддерживать условия герметичности и непроницаемости (емкости, аппараты, трубопроводы, применяемые в химической промышленности).
70). Химическая коррозия - это вид коррозионного разрушения металла, связанный с взаимодействием металла и коррозионной среды, при котором одновременно окисляется металл и происходит восстановление коррозионной среды. Химическая коррозия не связана с образованием, а также воздействием электрического тока.
Движущей силой (первопричиной) химической коррозии является термодинамическая неустойчивость металлов. Они могут самопроизвольно переходить в более устойчивое состояние в результате процесса:
Металл + Окислительный компонент среды = Продукт реакции
При этом термодинамический потенциал системы уменьшается.
По знаку изменения термодинамического потенциала можно определить возможность самопроизвольного протекания химической коррозии. Критерием обычно служит изобарно-изотермический потенциал G. При самопроизвольном протекании химического процесса наблюдается убыль изобарно-изотермического потенциала. Поэтому, если:
Δ GТ > 0, то процесс химической коррозии невозможен;
Δ GТ = 0, то система находится в равновесии.
По механизму коррозионного процесса различают два основных типа коррозии: химическую и электрохимическую.
Под химической коррозией подразумевают взаимодействие металлической поверхности с окружающей средой, не сопровождающееся возникновением электрохимических (электродных) процессов на границе фаз.
Механизм химической коррозии сводится к реактивной диффузии атомов или ионов металла сквозь постепенно утолщающуюся пленку продуктов коррозии (например окалины) и встречной диффузии атомов или ионов кислорода. По современным воззрениям этот процесс имеет ионно-электронный механизм, аналогичный процессам электропроводности в ионных кристаллах. Примером химической коррозии является взаимодействие металла с жидкими неэлектролитами или сухими газами в условиях, когда влага на поверхности металла не конденсируется, а также воздействие на металл жидких металлических расплавов. Практически наиболее важным видом химической коррозии является взаимодействие металла при высоких температурах с кислородом и др. газообразными активными средами (H S, SO , галогены, водяные пары, CO и др.). Подобные процессы химической коррозии металлов при повышенных температурах носят также название газовой коррозии. Многие ответственные детали инженерных конструкций сильно разрушаются от газовой коррозии (лопатки газовых турбин, сопла ракетных двигателей, элементы электронагревателей, колосники, арматура печей и т.д.). Большие потери от газовой коррозии (угар металла) несет металлургическая промышленность. Стойкость против газовой коррозии повышается при введении в состав сплава различных добавок (хрома, алюминия, кремния и др.). Добавки алюминия, бериллия и магния к меди повышают ее сопротивление газовой коррозии в окислительных средах. Для защиты железных и стальных изделий от газовой коррозии поверхность изделия покрывают алюминием (алитирование).
Методы защиты от коррозии:
Современная защита металлов от коррозии базируется на следующих методах:
повышение химического сопротивления конструкционных материалов,
изоляция поверхности металла от агрессивной среды,
понижение агрессивности производственной среды,
снижение коррозии наложением внешнего тока (электрохимическая защита).
Эти методы можно разделить на две группы. Первые два метода обычно реализуются до начала производственной эксплуатации металлоизделия (выбор конструкционных материалов и их сочетаний еще на стадии проектирования и изготовления изделия, нанесение на него защитных покрытий). Последние два метода, напротив, могут быть осуществлены только в ходе эксплуатации металлоизделия (пропускание тока для достижения защитного потенциала, введение в технологическую среду специальных добавок-ингибиторов) и не связаны с какой-либо предварительной обработкой до начала использования.
При применении первых двух методов не могут быть изменены состав сталей и природа защитных покрытий данного металлоизделия при непрерывной его работе в условиях меняющейся агрессивности среды. Вторая группа методов позволяет при необходимости создавать новые режимы защиты, обеспечивающие наименьшую коррозию изделия при изменении условий их эксплуатации. Например, на разных участках трубопровода в зависимости от агрессивности почвы можно поддерживать различные плотности катодного тока или для разных сортов нефти, прокачиваемой через трубы данного состава, использовать разные ингибиторы.
Однако в каждом случае приходится решать каким из средств или в каком их сочетании можно получить наибольший экономический эффект.
Широко применяются следующие основные решения защиты металлических конструкций от коррозии:
1. Защитные покрытия
Металлические покрытия.
По принципу защитного действия различают анодные и катодные покрытия. Анодные покрытия имеют в водном растворе электролитов более отрицательный электрохимический потенциал, чем защищенный металл, а катодные - более положительный. Вследствие смещения потенциала анодные покрытия уменьшают или полностью устраняют коррозию основного металла в порах покрытия, т.е. оказывают электрохимическую защиту, в то время как катодные покрытия могут усиливать коррозию основного металла в порах, однако ими пользуются, т.к. они повышают физико-механические свойства металла, например износостойкость, твердость. Но при этом требуются значительно большие толщины покрытий, а в ряде случаев дополнительная защита.
Металлические покрытия разделяются также по способу их получения (электролитическое осаждение, химическое осаждение, горячее и холодное нанесение, термодиффузионная обработка, металлизация напылением, плакирование).
Неметаллические покрытия
Данные покрытия получают нанесением на поверхность различных неметаллических материалов - лакокрасочных, каучуковых, пластмассовых, керамических и др.
Наиболее широко используются лакокрасочные покрытия, которые можно разделить по назначению (атмосферостойкие, ограниченно атмосферостойкие, водостойкие, специальные, маслобензостойкие, химически стойкие, термостойкие, электроизоляционные, консервационные) и по со составу пленкообразователя (битумные, эпоксидные, кремнийорганические, полиуретановые, пентафталевые и др.) (см. Приложение № 2)
Покрытия, получаемые химической и электрохимической обработкой поверхности
Эти покрытия представляют собой пленки нерастворимых продуктов, образовавшихся в результате химического взаимодействия металлов с внешней средой. Посколько многие из н их пористы, они применяются преимущественно в качестве подслоев под смазки и лакокрасочные покрытия, увеличивая защитную способность покрытия на металле и обеспечивая надежное сцепление. Методы нанесения - оксидирование, фосфатирование, пассивирование, анодирование.
2. Обработка коррозионной среды с целью снижения коррозионной активности.
Примерами такой обработки могут служить: нейтрализация или обескислороживание коррозионных сред, а также применение различного рода ингибиторов коррозии, которые в небольших количествах вводятся в агрессивную среду и создают на поверхности металла адсорбционную пленку, тормозящую электродные процессы и изменяющую электрохимические параметры металлов.
3. Электрохимическая защита металлов.
Путем катодной или анодной поляризации от постороннего источника тока или присоединением к защищаемой конструкции протекторов, потенциал металла смещается до значений, при которых сильно замедляется или полностью прекращается коррозия.
4. Разработка и производство новых металлических конструкционных материалов повышенной коррозионной устойчивости путем устранения из металла или сплава примесей, ускоряющих коррозионный процесс (устранение железа из магниевых или алюминиевых сплавов, серы из железных сплавов и т.д.), или введения в сплав новых компонентов, сильно повышающих коррозионную устойчивость (например хрома в железо, марганца в магниевые сплавы, никеля в железные сплавы, меди в никелевые сплавы и т.д.).
5. Переход в ряде конструкций от металлических к химически стойким материалам
(пластические высокополимерныме материалы, стекло, керамика и др.).
6. Рациональное конструирование и эксплуатация металлических сооружений и деталей (исключение неблагоприятных металлических контактов или их изоляция, устранение щелей и зазоров в конструкции, устранение зон застоя влаги, ударного действия струй и резких изменений скоростей потока в конструкции и др.).
71).Коррозия является электрохимической, если при выходе из металлической решётки образующийся катион вступает в связь не с окислителем, а с другими компонентами коррозионной среды; окислителю же передаются электроны, освобождающиеся при образовании катиона. Такой процесс возможен в тех случаях, когда в окружающей среде существуют два типа реагентов, из которых одни (сольватирующие или комплексообразующие) способны соединяться устойчивыми связями с катионом металла без участия его валентных электронов, а другие (окислители) могут присоединять валентные электроны металла, не удерживая около себя катионы. Подобными свойствами обладают растворы или расплавы электролитов, где сольватированные катионы сохраняют значительную подвижность. Таким образом, при электрохимической коррозии удаление атома из металлической решётки (что составляет суть любого коррозионного процесса) осуществляется в результате двух независимых, но сопряжённых, связанных между собой электрическим балансом, электрохимических процессов: анодного - переход сольватируемых катионов металла в раствор, и катодного - связывание окислителем освобождающихся электронов. Отсюда следует, что процесс электрохимической коррозии можно замедлить не только путём непосредственного торможения анодного процесса, но также воздействуя на скорость катодного. Наиболее распространены два катодных процесса: разряд водородных ионов (2е + 2H+ = H2) и восстановление растворённого кислорода (4e+O2+4H+ = 2H2O или 4e+O2+2H2O =4ОН-), которые часто называют соответственно водородной и кислородной деполяризацией.
Механизм: Поверхность металла, находящегося во влажном воздухе, адсорбирует влагу из атмосферы и покрывается тонкой пленкой воды, содержащей атмосферные газы (О2, СО2, SO2 и др.) и, следовательно, обладающей заметной ионной проводимостью. Ионы металла переходят в раствор, образуется двойной электрический слой, и разность потенциалов. Если в контакте находятся два различных металла, то возникает гальванический элемент, работа которого проводит к разрушению материала анода. Роль второго металла могут выполнять микрокристаллы примесей, содержащихся в основном металле. Так, железо и его сплавы практически всегда содержат различные соединения железа с углеродом (например, Fe3C – цементит). Кристаллы железа исполняют роль анода, на котором протекает реакция:
а кристаллы цементита – роль катода, на котором идет процесс восстановления растворенного кислорода воздуха:
Далее возможно протекание побочных процессов:
Микроскопические кристаллы железа и примесей образуют огромное количество гальванических элементов, работа которых будет сопровождаться разрушением металла и образованием ржавчины xFeO . yFe2O3 . zH2O. Рыхлый слой ржавчины не предохраняет металл от дальнейшей коррозии, и процесс идет до полного разрушения материала.
Реакция восстановления кислорода протекает по приведенной выше схеме в щелочной или нейтральной среде. В кислой среде:
и выделение водорода
Коррозия с участием кислорода называется коррозией с поглощением кислорода или коррозией с кислородной деполяризацией. Коррозия с участием ионов водорода называется коррозий с выделением водорода или коррозией с водородной деполяризацией.
Условия, способствующие электрохимической коррозии.
1. Положение металла в ряду активности металлов: чем они дальше расположены друг от друга, тем быстрее происходит коррозия.
2. Чистота металла: примеси ускоряют коррозию.
3.Неровности поверхности металла, трещины.
4.Грунтовые воды, морская вода, среда электролита.
6.Действие микроорганизмов (грибы, бактерии и лишайники воздействуют на металл с высокой коррозионной стойкостью).
Коррозия металлов иногда сопровождается образованием тонкой и плотной пленки соединений, защищающей его от дальнейшего разрушения. Это явление носит название пассивации и характерно для алюминия, хрома, кадмия, титана и др. Вещества, благоприятствующие образованию защитной пленки, носят название пассиваторов. Например, фосфорная кислота, гидрофосфаты, серная кислота с концентрацией выше 93% являются пассиваторами железа.
Напротив, вещества, ускоряющие коррозию, называются активаторами коррозии, например хлорид-ионы являются активаторами коррозии железа.
Имея тенденцию отдавать электроны, в силу отрицательного электродного потенциала большинство металлов, в процессе коррозии окисляются. Если на защищаемый объект подать некий дополнительный положительный потенциал = поддержать на нем некий отрицательный потенциал порядка десятой доли вольта, то вероятность окислительной реакции падает почти до нуля. Данный способ защиты подразумевается обычно, когда говорят окатодной защите.
Если в точку вероятной коррозии поместить некое количество вещества, имеющего более низкий электродный потенциал (например, цинк или магний для защиты железа), то окислительная реакция будет идти на нем. Следует обеспечить хороший электрический контакт между этим дополнительным защитным анодом (sacrificial anode) и защищаемым металлом. Догадались, зачем цинкуют трубы? А листы железа для кровли? Естественно, когда защитный анод растворится целиком, все пойдет своим чередом.
Под пассивной защитойпонимают покрытие защищаемого образца диэлектриком для предотвращения возникновения гальванической цепи. Например, можно покрасить металлическую конструкцию масляной краской и т.д.
Протекторная защита осуществляется присоединением к защищаемому металлу большого листа, изготовленного из другого, более активного металла -протектора. В качестве протектора при защите стальных изделий обычно применяют цинк или сплавы на основе магния. При хорошем контакте между металлами защищаемый металл (железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду напряжений, железо поляризуется катодно, а цинк - анодно. В результате этого на железе идет процесс восстановления того окислителя, который присутствует в воде (обычно растворенный кислород), а цинк окисляется.
Воздействие щелочи на металл
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H 2 ↑
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e - → Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2 ↑
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e - → 2Al 3+ - окисление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 )2 .
Действие щелочей на металлы
Щелочи действуют только на металлы, образующие амфотерные оксиды и гидроксиды. При этом выделяется водород и образуется соль очень слабой кислоты данного металла. Следует отметить, что образование водорода является результатом взаимодействия атомов металла с ионами водорода воды, а не водорода, входящего в состав щелочи.
Таким образом, реакция идет в две стадии:
Тема 14: ХИМИЯ МЕТАЛЛОВ И ЭЛЕКТРОТЕХНИЧЕСКИЕ МАТЕРИАЛЫ
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Характерным химическим свойством металлов является их восстановительная способность. Они вступают в реакцию как с простыми веществами – неметаллами, так и со сложными веществами – водой, кислотой, щелочами и другими веществами.
Взаимодействие металлов с кислотами
ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ СЕРНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ АЗОТНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
ДЕЙСТВИЕ ЩЕЛОЧЕЙ НА МЕТАЛЛЫ
ДЕЙСТВИЕ ХЛОРОВОДОРОДНОЙ КИСЛОТЫ НА МЕТАЛЛЫ
Металл взаимодействует с хлороводородной кислотой, если энергия его ионизации меньше энергии ионизации водорода, а таковыми являются активные металлы, стоящие в ряду напряжений до водорода. При растворении в хлороводородной кислоте активных металлов образуется соль этого металла (хлорид) и выделяется водород. В этом случае в качестве окислителя выступает ион водорода (Н + ) кислоты, который оттягивает электрон от атома восстановителя (металла).

Можно рассчитать ЭДС этой реакции.
ЭДС = Еокис-ля – Евос-ля = 0 – (-0,76) = 0,76 В.
Потенциалы находятся в ряду напряжений металлов.
Действие серной кислоты на металлы
Разбавленная серная кислота растворяет только активные металлы, т.е. реакции идут аналогично реакциям с хлороводородной кислотой. В результате реакции образуется соль металла (сульфат) и выделяется водород.
1 2 2H + + 2ē → H2 0 процесс восстановления Н + - окислитель
Fe + 2H + → Fe 2+ + H2
ЭДС = 0 – (-0,44) = 0,44 В
Концентрированная серная кислота растворяет металлы, стоящие в ряду напряжений металлов до серебра (включительно). Не растворяется золото и платиновые элементы (Рt, Os, Ru, Ir, Rh, Pd).
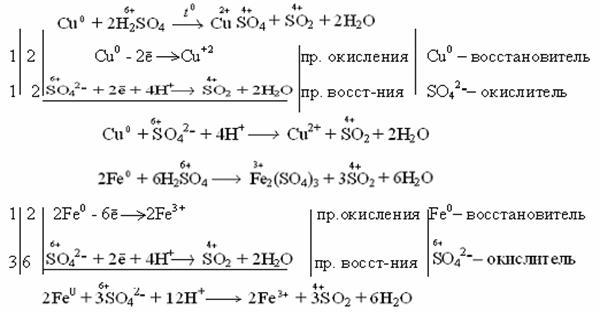
Например: неактивные и малоактивные металлы (Cu, Ag, Fe, Ni) восстанавливают серу +6 до серы +4 (SO2). Реакция идет при нагревании.
Как видно из реакций, разбавленная серная кислота окисляет железо до +2, а концентрированная до +3.
Более активные металлы восстанавливают серу +6 до свободной серы (S 0 ) и сероводородной кислоты (H2S), где сера имеет степень окисления -2.
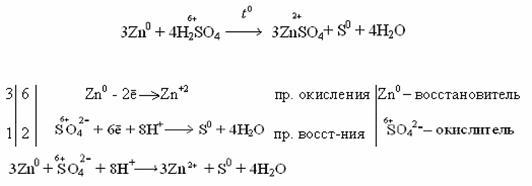
Действие азотной кислоты на металлы
Азотная кислота, являясь сильным окислителем, действует почти на все металлы (кроме Au, Pt, Ru, Rh, Ir, Os, Ta), превращая их в нитраты, а некоторые – в оксиды (пассивирование металлов).
Особенность действия азотной кислоты на металлы заключается в том, что она окисляет металлы без выделения водорода даже из разбавленного раствора кислоты, в отличие от серной. Глубина восстановления азота из азотной кислоты зависит от концентрации последней и от активности взаимодействующего с ней металла. Чем больше разбавлена кислота и чем активнее металл, тем глубже идет восстановление. Азот кислоты восстанавливается
ÜРазберем некоторые примеры взаимодействия азотной кислоты с металлами.
При взаимодействии концентрированной азотной кислоты с неактивными металлами выделяется NO2:

Разбавленная азотная кислота с малоактивными и неактивными металлами (Pb, Cu, Ni, Ag, Fe) образует NO:
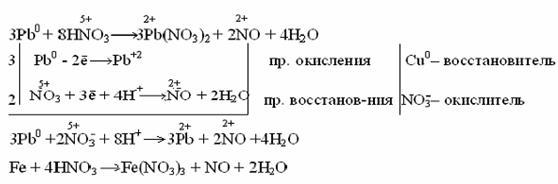
Очень разбавленная азотная кислота восстанавливается до аммиака (NH3) при взаимодействии с очень активным металлом, образующим в кислой среде ион аммония NH4 + :
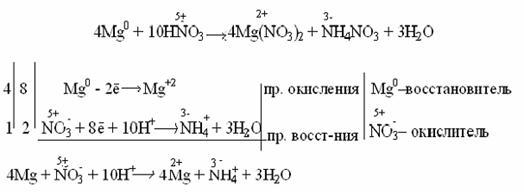
Концентрированная кислота пассивирует некоторые металлы (Al, Cr, Fe), что выражается в покрытии металлов тонкой оксидной пленкой:
Поэтому концентрированную азотную кислоту перевозят в алюминиевых цистернах, а разбавленную – в цистернах из кислотоупорной стали.
Металлы способны вытеснять друг друга из растворов солей. Возможность прохождения таких реакций определяется положением металлов в ряду напряжений: более активные металлы вытесняют из растворов их солей менее активные.
Читайте также:
