Все металлы имеют плотность
Обновлено: 17.05.2024
Металлы – химические элементы, расположенные в левой и нижней части Периодической системы Д.И. Менделеева.
Особое строение кристаллических решеток металлов придает им ряд общих свойств.
К одним из наиболее важных физических свойств металлов относятся плотность, твердость и температура плавления. Эти свойства у металлов весьма различны.
Например, наименьшую плотность имеют щелочные металлы, а наибольшую – осмий. Металлы, плотность которых меньше пяти, условно принято называть легкими металлами, а металлы с плотностью больше пяти – тяжелыми.
По твердости металлы сравнивают с алмазом, твердость которого принята за 10. Самыми мягкими являются щелочные металлы, а самым твердым – хром.
Все металлы обладают металлическим блеском. Это свойство объясняется тем, что металлы хорошо отражают от своей поверхности световые лучи. Металлы отражают также радиоволны, что используется в радиотелескопах, улавливающих радиоизлучения искусственных спутников Земли, и в радиолокаторах, обнаруживающих самолеты на больших расстояниях.
Металлы – хорошие проводники электричества и теплоты. Это зависит от наличия в металлических решетках свободных электронов, которые в электрическом поле перемещаются от отрицательного к положительному полюсу. Электрическая проводимость и теплопроводность металлов неодинакова. Она увеличивается от ртути к серебру.
Из наиболее доступных металлов хорошей электрической проводимостью обладают медь и алюминий, поэтому они используются в качестве проводников электрического тока.
Многие металлы пластичны и обладают хорошей ковкостью, что также объясняется особенностью металлической связи. Так как ионы в металлической решетке друг с другом непосредственно не связаны, отдельные слои их могут свободно перемещаться один относительно другого. Самые хрупкие металлы находятся в V, VI и VII группах Периодической системы Д.И. Менделеева.
Распространенность металлов в природе
Самым распространенным металлом в земной коре является алюминий. За ним следуют железо, кальций, натрий, калий, магний и титан. Содержание остальных металлов незначительно. Так, например, хрома в земной коре всего лишь 0,3, никеля – 0,2, а меди – 0,01%.
Металлы встречаются в природе как в свободном, так и в виде различных соединений.
Краткая характеристика химических свойств и плотность металлов
Наиболее общими химическими свойствами металлов является способность их атомов при химических реакциях отдавать валентные электроны и превращаться в положительно заряженные ионы.
Наиболее энергично металлы реагируют с кислородом и серой, электроотрицательность которых велика:
В этих реакциях окислителем является соответствующий неметалл.
Металлы могут окисляться также ионами водорода и ионами других металлов. Например, в ходе реакций взаимодействия металлов с водой, с кислотами и растворами солей:
Zn + 2HCl = Zn + H2;
Примеры решения задач
| Задание | При полном сгорании кислородсодержащего органического вещества массой 13,8 г получили 26,4 г углекислого газа и 16,2 г воды. Найдите молекулярную формулу вещества, если относительная плотность его паров по водороду равна 23. |
| Решение | Составим схему реакции сгорания органического соединения обозначив количество атомов углерода, водорода и кислорода за «x», «у» и «z» соответственно: |
Определим массы элементов, входящих в состав этого вещества. Значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел: Ar(C) = 12 а.е.м., Ar(H) = 1 а.е.м., Ar(O) = 16 а.е.м.
Рассчитаем молярные массы углекислого газа и воды. Как известно, молярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (M = Mr):
M(CO2) = Ar(C) + 2×Ar(O) = 12+ 2×16 = 12 + 32 = 44 г/моль;
M(H2O) = 2×Ar(H) + Ar(O) = 2×1+ 16 = 2 + 16 = 18 г/моль.
m(C) = [26,4 / 44]×12 = 7,2г;
m(H) = 2×16,2 / 18 ×1= 1,8 г.
Определим химическую формулу соединения:
x:y:z = m(C)/Ar(C) : m(H)/Ar(H) : m(O)/Ar(O);
x:y:z = 7,2/12 :1,8/1 : 4,8/16;
x:y:z = 0,6 : 1,8 : 0,3 = 2 : 6 : 1.
Значит простейшая формула соединения C2H6O, а его молярная масса равна 46 г/моль [M(C2H6O) = 2×Ar(C) + 6×Ar(H) + Ar(O)= 2×12 + 1×6 + 16 = 24 + 6 + 16 = 46 г / моль].
Значение молярной массы органического вещества можно определить при помощи его плотности по водороду:
Msubstance = 2 × 23 = 46 г/моль.
Чтобы найти истинную формулу органического соединения найдем отношение полученных молярных масс:
Значит молекулярная формула вещества будет иметь вид C2H6O.
| Задание | Массовая доля фосфора в одном из его оксидов равна 56,4%. Плотность паров оксида по воздуху равна 7,59. Установите молекулярную формулу оксида. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
ω (O) = 100% – ω (P) = 100% – 56,4% = 43,6%.
Обозначим число атомов фосфора в молекуле через «х», число атомов кислорода через «у».
Найдем соответствующие относительные атомные массы элементов азота и водорода (значения относительных атомных масс, взятые из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Ar(P) = 31; Ar(O) = 16.
Процентное содержание элементов разделим на соответствующие относительные атомные массы. Таким образом мы найдем соотношения между числом атомов в молекуле соединения:
x:y = ω(P)/Ar(P) : ω (O)/Ar(O);
x:y = 56,4/31 : 43,6/16;
x:y = 1,82 : 2,725 = 1 : 1,5 = 2 : 3.
Значит простейшая формула соединения фосфора и кислорода имеет вид P2O3.
Значение молярной массы газа можно определить при помощи его плотности по воздуху:
Mgas = 29 × 7,59 = 220 г/моль.
Чтобы найти истинную формулу соединения фосфора и кислорода найдем отношение полученных молярных масс:
M(P2O3) = 2 ×Ar(P) + 3 × Ar(O) = 2 ×31 + 3 × 16 = 62 + 48 = 110г/моль.
Значит индексы атомов фосфора и кислорода должны быть в 2 раза выше, т.е. формула вещества будет иметь вид P4O6.
Физические свойства металлов: твердость, плотность и др.

Металлы имею такие физические свойства, как твердость, температуру плавления, плотность, пластичность, электропроводность, теплопроводность и цвет.
Твёрдость:
Все металлы, кроме ртути и, условно, франция, при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью.
Таблица твёрдости металлов по шкале Мооса:
| Твёрдость | Металл |
| 0.2 | Цезий |
| 0.3 | Рубидий |
| 0.4 | Калий |
| 0.5 | Натрий |
| 0.6 | Литий |
| 1.2 | Индий |
| 1.2 | Таллий |
| 1.25 | Барий |
| 1.5 | Стронций |
| 1.5 | Галлий |
| 1.5 | Олово |
| 1.5 | Свинец |
| 1.5 | Ртуть |
| 1.75 | Кальций |
| 2.0 | Кадмий |
| 2.25 | Висмут |
| 2.5 | Магний |
| 2.5 | Цинк |
| 2.5 | Лантан |
| 2.5 | Серебро |
| 2.5 | Золото |
| 2.59 | Иттрий |
| 2.75 | Алюминий |
| 3.0 | Медь |
| 3.0 | Сурьма |
| 3.0 | Торий |
| 3.17 | Скандий |
| 3.5 | Платина |
| 3.75 | Кобальт |
| 3.75 | Палладий |
| 3.75 | Цирконий |
| 4.0 | Железо |
| 4.0 | Никель |
| 4.0 | Гафний |
| 4.0 | Марганец |
| 4.5 | Ванадий |
| 4.5 | Молибден |
| 4.5 | Родий |
| 4.5 | Титан |
| 4.75 | Ниобий |
| 5.0 | Иридий |
| 5.0 | Рутений |
| 5.0 | Тантал |
| 5.0 | Технеций |
| 5.0 | Хром |
| 5.5 | Бериллий |
| 5.5 | Осмий |
| 5.5 | Рений |
| 6.0 | Вольфрам |
| 6.0 | β-Уран |
Температура плавления:
Температуры плавления чистых металлов лежат в диапазоне от −38,83 °C (ртуть) до 3422 °C (вольфрам).
Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
В зависимости от температуры плавления металлы делятся на: легкоплавкие (до 600 °C); среднеплавкие (от 600 до 1600 °C); тугоплавкие (выше 1600 °C).
Таблица температуры плавления легкоплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Ртуть | -38,83 |
| Франций | 25 |
| Цезий | 28,44 |
| Галлий | 29,7646 |
| Рубидий | 39,3 |
| Калий | 63,5 |
| Натрий | 97,81 |
| Индий | 156,5985 |
| Литий | 180,54 |
| Олово | 231,93 |
| Полоний | 254 |
| Висмут | 271,3 |
| Таллий | 304 |
| Кадмий | 321,07 |
| Свинец | 327,46 |
| Цинк | 419,53 |
Таблица температуры плавления среднеплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Сурьма | 630,63 |
| Нептуний | 639 |
| Плутоний | 639,4 |
| Магний | 650 |
| Алюминий | 660,32 |
| Радий | 700 |
| Барий | 727 |
| Стронций | 777 |
| Церий | 795 |
| Иттербий | 824 |
| Европий | 826 |
| Кальций | 841,85 |
| Лантан | 920 |
| Празеодим | 935 |
| Германий | 938,25 |
| Серебро | 961,78 |
| Неодим | 1024 |
| Прометий | 1042 |
| Актиний | 1050 |
| Золото | 1064,18 |
| Самарий | 1072 |
| Медь | 1084,62 |
| Уран | 1132,2 |
| Марганец | 1246 |
| Бериллий | 1287 |
| Гадолиний | 1312 |
| Тербий | 1356 |
| Диспрозий | 1407 |
| Никель | 1455 |
| Гольмий | 1461 |
| Кобальт | 1495 |
| Иттрий | 1526 |
| Эрбий | 1529 |
| Железо | 1538 |
| Скандий | 1541 |
| Тулий | 1545 |
| Палладий | 1554,9 |
| Протактиний | 1568 |
Таблица температуры плавления тугоплавких металлов и сплавов:
| Название металла | Температура плавления, о С |
| Лютеций | 1652 |
| Титан | 1668 |
| Торий | 1750 |
| Платина | 1768,3 |
| Цирконий | 1855 |
| Хром | 1907 |
| Ванадий | 1910 |
| Родий | 1964 |
| Технеций | 2157 |
| Гафний | 2233 |
| Рутений | 2334 |
| Иридий | 2466 |
| Ниобий | 2477 |
| Молибден | 2623 |
| Тантал | 3017 |
| Осмий | 3033 |
| Рений | 3186 |
| Вольфрам | 3422 |
Плотность:
В зависимости от плотности металлы делят на лёгкие (плотность от 0,53 до 5 г/см³) и тяжёлые (от 5 до 22,6 г/см³).
Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца ), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность:
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними.
Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются.
Пластичность зависит и от чистоты металла . Так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность:
Все металлы хорошо проводят электрический ток, обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля.
Серебро, медь и алюминий имеют наибольшую электропроводность. По этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также и натрий. В экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность:
Теплопроводность металлов зависит от подвижности свободных электронов.
Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла. Широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет у большинства металлов примерно одинаковый — светло-серый, иногда с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Металлы подразделяются на цветные и черные.
Чёрные металлы – железо и сплавы на его основе (стали, ферросплавы, чугуны). К чёрным металлам также зачастую относят марганец и, иногда, – хром и ванадий.
Цветные металлы — это особый класс нержавеющих металлов и сплавов, в составе которых нет железа. Металлы называются цветными, потому что каждый из них имеет определенный окрас. К цветным металлам относятся медь, молибден, свинец, цинк, олово, никель, кадмий, кобальт, алюминий, титан, магний, висмут, вольфрам, ртуть, золото, платину, серебро, палладий, родий, рутений, осмий, иридий.
Плотность металлов и сплавов

В таблице представлена плотность металлов и сплавов, а также коэффициент К отношения их плотности к плотности стали. Плотность металлов и сплавов в таблице указана в размерности г/см 3 для интервала температуры от 0 до 50°С.
Дана плотность металлов, таких как: бериллий Be, ванадий V, висмут Bi, вольфрам W, галлий Ga, гафний Hf, германий Ge, золото Au, индий In, кадмий Cd, кобальт Co, литий Li, марганец Mn, магний Mg, медь Cu, молибден Mo, натрий Na, никель Ni, олово Sn, палладий Pd, платина Pt, рений Re, родий Rh, ртуть Hg, рубидий Rb, рутений Ru, свинец Pb, серебро Ag, стронций Sr, сурьма Sb, таллий Tl, тантал Ta, теллур Te, титан Ti, хром Cr, цинк Zn, цирконий Zr.
Плотность алюминиевых сплавов и металлической стружки: алюминиевые сплавы: АЛ1, АЛ2, АЛ3, АЛ4, АЛ5, АЛ7, АЛ8, АЛ9, АЛ11, АЛ13, АЛ21, АЛ22, АЛ24, АЛ25. Насыпная плотность стружки: стружка алюминиевая мелкая дробленая, стальная мелкая, стальная крупная, чугунная. Примечание: плотность стружки в таблице дана в размерности т/м 3 .
Плотность бронзы различных марок: бронзы безоловянные, обрабатываемые давлением: БрА5, 7, БрАМц9-2, БрАЖ9-4, БрАЖМц10-3-1,5, БрАЖН10-4-4, БрКМц3,1, БрКН1-3, БрМц5; бронзы бериллиевые: БрБ2, БрБНТ1,9, БрБНТ1,7; бронзы оловянные деформируемые: Бр0Ф8,0-0,3, Бр0Ф7-0,2, Бр0Ф6,5-0,4, Бр0Ф6,5-0,15, Бр0Ф4-0,25, Бр0Ц4-3, Бр0ЦС4-4-2,5, Бр0ЦС4-4-4; бронзы оловянные литейные: Бр03Ц12С5, Бр03Ц7С5Н1, Бр05Ц5С5; бронзы безоловянные литейные: БрА9Мц2Л, БрА9Ж3Л, БрА10Ж4Н4Л, БрС30.
Плотность сплавов никеля и цинка: никелевые и медно-никелевые сплавы, обрабатываемые давлением: НК0,2, НМц2,5, НМц5, НМцАК2-2-1, НХ9,5, МНМц43-0,5, НМЦ-40-1,5, МНЖМц30-1-1, МНЖ5-1, МН19, 16, МНЦ15-20, МНА 13-3, МНА6-1,5, МНМц3-12; цинковые сплавы антифрикционные: ЦАМ9-1,5Л, ЦАМ9-1,5, ЦАМ10-5Л, ЦАМ10-5.
Плотность стали, чугуна и баббитов: сталь конструкционная, стальное литье, сталь быстрорежущая с содержанием вольфрама 5…18%; чугун антифрикционный, ковкий и высокопрочный, чугун серый; баббиты оловянные и свинцовые: Б88, 83, 83С, Б16, БН, БС6.
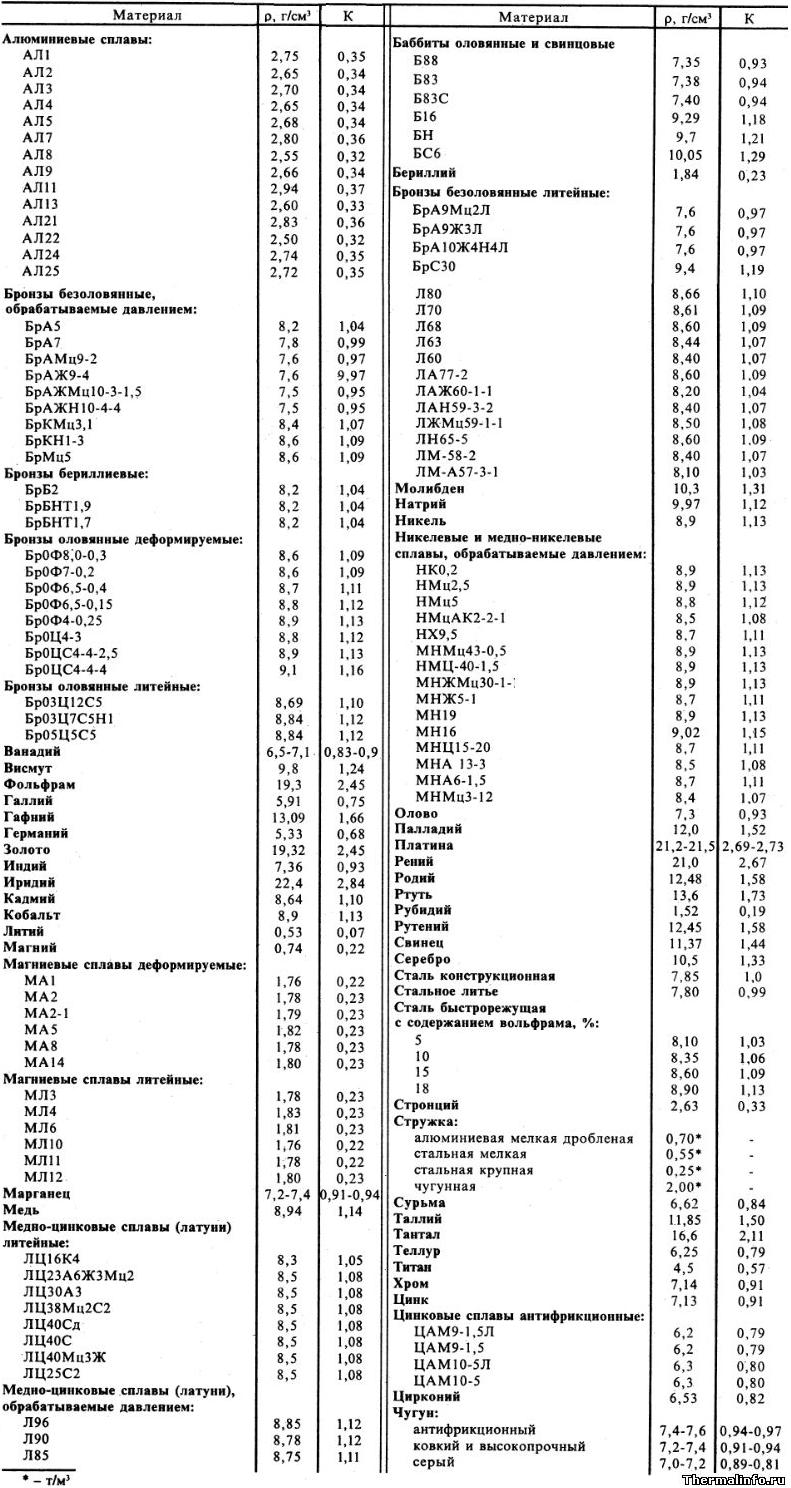
Приведем показательные примеры плотности различных металлов и сплавов. По данным таблицы видно, что наименьшую плотность имеет металл литий, он считается самым легким металлом, плотность которого даже меньше плотности воды — плотность этого металла равна 0,53 г/см 3 или 530 кг/м 3 . А у какого металла наибольшая плотность? Металл, обладающий наибольшей плотностью — это осмий. Плотность этого редкого металла равна 22,59 г/см 3 или 22590 кг/м 3 .
Следует также отметить достаточно высокую плотность драгоценных металлов. Например, плотность таких тяжелых металлов, как платина и золото, соответственно равна 21,5 и 19,3 г/см 3 . Дополнительная информация по плотности и температуре плавления металлов представлена в этой таблице.
Сплавы также обладают широким диапазоном значений плотности. К легким сплавам относятся магниевые сплавы и сплавы алюминия. Плотность алюминиевых сплавов выше. К сплавам с высокой плотностью можно отнести медные сплавы такие, как латуни и бронзы, а также баббиты.
Источник:
Цветные металлы и сплавы. Справочник. Издательство «Вента-2». НН., 2001 — 279 с.
Плотность металлов
Читайте также:
