Выделение водорода из металла
Обновлено: 17.05.2024
On the basis of the thermodynamic analysis of the hydrogen bubbles formation it is shown that they can have a direct effect on forming of the structure of metals and alloys during solidification of castings.
Похожие темы научных работ по нанотехнологиям , автор научной работы — Стеценко В. Ю.
Влияние сорбции и десорбции водорода и кислорода на процессы модифицирования и кристаллизации сплавов
Thermodynamics of process of hydrogen release at hardening of metals and alloys
Текст научной работы на тему «Термодинамика процесса выделения водорода при затвердевании металлов и сплавов»
/хтггг г: кгтшлтггп / ее
в. ю. стеценко, итм нан Беларуси
ТЕРМОДИНАМИКА ПРОЦЕССА ВЫДЕЛЕНИЯ ВОДОРОДА ПРИ ЗАТВЕРДЕВАНИИ МЕТАЛЛОВ И СПЛАВОВ
При затвердевании сплавов происходит выделение пузырьков водорода на границах раздела фаз . Для алюминиевых сплавов этот процесс идет с высокой интенсивностью, поскольку растворимость водорода при переходе алюминия из жидкого состояния в твердое уменьшается в 19,2 раза [1] .В настоящее время общепризнанным является утверждение, что выделившийся на границе раздела твердой и жидкой фаз молекулярный водород не оказывает влияния на формирование структуры отливки при ее затвердевании . Считается, что пузырьки водорода зарождаются и растут преимущественно на неметаллических включениях (НВ), которые плохо смачиваются расплавом 3 . Это положение хорошо согласуется с общепринятой (классической) концепцией зародышеобразова-ния новых фаз в расплавах, где абсолютизируется роль НВ
Установлено, что обработка расплавов алюминиевых сплавов АЛ32, ВАЛ5, АЛ2, АЛ9 электрическим током способствует их дегазации по водороду и модифицирует микроструктуру отливки [1] Увеличение содержания НВ в сплавах АЛ23-1, АЛ27-1 и АЛ4Д в 1,5 раз приводит к снижению скорости удаления водорода в 2 раза [1] . Хлорирование расплава заэвтектического силумина приводит к его рафинированию от НВ, дегазации по водороду и значительно модифицирует микроструктуру отливки [8] . Дегазирующие таблетки для расплавов алюминиевых сплавов, кроме рафинирующе-дегазирующего эффекта, оказывают модифицирующее действие на основные структурные составляющие заготовок [9]. Отсюда следует, что именно дегазация, а не рафинирование расплава от НВ вызывает модифицирование структуры алюминиевых сплавов . Также известно, что пузырьки водорода не флотируют НВ из расплава при его затвердевании, т е не дают рафинирующего эффекта
Это можно объяснить тем, что пузырьки водорода при затвердевании алюминиевых сплавов термодинамически предпочитают зарождаться и расти на кристаллах (дендритах) фаз, которые хорошо смачиваются жидким металлом Поэтому целью настоящей работы являются термодинамические исследования процесса выделения водорода в расплаве и на подложках различной смачиваемости и кривизны . Это также позволит установить механизм воздействия этого процесса на структуро-образование в металлах и сплавах при их затвердевании
Процесс образования пузырька водорода объемом Vп состоит из двух основных стадий . На первой стадии происходит выделение из пересыщенного расплава молекулярного водорода по реакции 2[Н] = Н2 . Если удельную объемную энергию Гиб-бса этой реакции обозначить gг, то полная энергия Гиббса будет равна gГVП . На второй стадии процесса молекулярный водород будет образовывать пузырек . При этом совершается работа против сил внешнего давления Ев, металлостатического давления рм и капиллярного давления ^пк- При этом также затрачивается межфазная поверхностная энергия Пп- Поэтому энергия Гиббса образования пузырька водорода СП будет определяться следующим уравнением:
Капиллярное давление рассчитывается по формуле Лапласа:
где с12 - удельная межфазная поверхностная энергия на границе «расплав-пузырек»; г - радиус кривизны этой границы . Металлостатическое давление определяется по формуле:
где р - плотность расплава; g - константа, равная 9,81 Н-кг-1; h - высота столба жидкого металла над пузырьком . Обозначим Р = ^в + ^м. Тогда формула (1) преобразуется в основную для термодинамических расчетов гомогенного и гетерогенного процессов образования пузырьков водорода в расплаве при его затвердевании:
Энергия Гиббса процесса гомогенного образования пузырька водорода GП0 будет определяться следующим уравнением:
Выделение водорода из стали 40ХГМ при комнатной температуре Текст научной статьи по специальности «Химические технологии»
Похожие темы научных работ по химическим технологиям , автор научной работы — Фоминых Е. А., Токовой O. K., Мирзаев Д. А., Воробьев Н. И., Шабуров Д. В.
Влияние водорода на свойства высокопрочной коррозионностойкой стали внс65-ш (18х13н4к4с2ам3-ш) и пути устранения водородной хрупкости
Текст научной работы на тему «Выделение водорода из стали 40ХГМ при комнатной температуре»
УДК 669,721 :669.017.3
ВЫДЕЛЕНИЕ ВОДОРОДА ИЗ СТАЛИ 40ХГМ ПРИ КОМНАТНОЙ ТЕМПЕРАТУРЕ
Е.А. Фоминых, O.K. Токовой, Д.А. Мирзаев,
Н.И. Воробьев, Д.В. Шабуров, В.И. Хяккинен
Общеизвестно, что водород обладает аномально высокой диффузионной подвижностью по сравнению с другими элементами. Имеющиеся литературные данные [1, 2] свидетельствуют о том, что водород, растворенный в стали, выделяется из нее даже при комнатной температуре, а также при эксплуатации готовых изделий. В заготовках большого сечения диффузионный выход водорода из центральных зон, в силу кинетических затруднений, практически невозможен. Накапливаясь в различных несплошностях структуры в молекулярном виде, он создает избыточное давление, которое, суммируясь с внутренними напряжениями любого происхождения (термические, структурные, деформационные), может превысить предел прочности стали и вызвать внутренние хрупкие трещины - флокены. Ввиду того, что в крупных изделиях структура по сечению может быть различной (в т. ч. дефектной), ее водородо-проницаемость будет разной. Таким образом, возможны разные скорости транспорта водорода по сечению, что может увеличивать неравномерность распределения водорода по сечению изделия из металла.
Целью данной работы явилось изучение в лабораторных условиях кинетики выделение водорода го образцов стали 40ХГМ с различной структурой при комнатной температуре.
Исследование1 проводили на стали 40ХГМ имеющей следующий химический состав: %С 0,41; %Мп 0,63; %Сг 1,05; %Мо 0,18; %Si 0,32; %S 0,023; %Р 0,013.
Для исследования были отобраны пробы после двух способов деформации: от крупной поковки сечением 550 мм и от катаной заготовки диаметром 180 мм. Место, а также схема отбора проб показаны на рис. 1. Исследуемые образцы диаметром 24 мм и длиной 90 мм насыщали водородом при температуре 1000 °С в течение 3 часов. Схема установки показана на рис. 2. Концентрация водорода в образце после насыщения так же, как и в работе [3] составляла около 4. 5 см3/100 г металла. Затем образцы извлекали из печи и охлаждали водой из спреера. Свидетельством того, что в ходе такой обработки происходит поступление водорода в металл, является его последующее выделение в виде газовых пузырьков с поверхности образца металла. На фотографии (рис. 3) сопоставлены два
образца, помещенные в стакан с дистиллированной водой. Видно, что на поверхности наводоро-женного образца (слева) появляются пузырьки газа, в то время как на образце, не обработанном в среде водорода, они отсутствуют.
Рис. 1. Схема вырезки образцов из поковок
Кинетику выделения водорода из образцов стали при комнатной температуре (30 °С) изучали в установке, показанной на рис. 4. После полного охлаждения образца его помещали в емкость с водой для нагрева до температуры исследования. Предварительно все элементы установки термо-статировали. Затем образец помещали в стеклянный реактор 7, уравновешивали давление в измерительной системе, приближая его к атмосферному, соединяли систему с датчиком давления 3 и включали самописец. Одновременно с записью давления в системе по барометру фиксировали изменение атмосферного давления для последующей корректировки данных. Опыты продолжались до тех пор, пока не прекращалось увеличение давления в системе.
Решение уравнения Фика
ґд2с 1де дг2 г дг
для диффузионного выделения водорода из цилиндрического образца длиной I и радиусом г
1 В работе принимал участие Д. С. Зуев.
Фоминых Е.А., Токовой O.K., Мирзаев Д.А., Выделение водорода из стали 40 ХГМ
Рис. 2. Схема установки для насыщения образцов водородом:
1 - баллон с аргоном; 2 - редуктор; 3 - маностат; 4 - силикагель; 5 - ангидрон; 6 - тиристорный блок управления; 7 - вольтметр; 8 - токоподвод; 9 - склянка Тищенко с маслом; 10 - реакционная трубка; 11 - образец; 12 - трубчатая печь; 13 - термопара; 14 - потенциометр; 15 - печь с железной стружкой; 16 - печь с медной проволокой; 17 - краны; 18 - склянка Тищенко с концентрированной серной кислотой; 19 - аппарат Кила
Рис. 3. Выделение водорода из образца поковки (пояснения в тексте)
представляли в виде бесконечного ряда функций, зависящих от переменных г и т [4]. Однако вскоре после начала выделения все члены ряда, кроме первого, резко уменьшаются. Наступает основной «регулярный» режим диффузии. В этом режиме средняя по объему концентрация водорода С(т) зависит только от времени
где Сн - начальная концентрация водорода. Разность Сн - С представляет количество водорода, вышедшего из образца. Она пропорциональна Р лавлению водорода в системе. После выделения
Рис. 4. Схема установки для определения давления выделившегося водорода:.
1 - самописец (диск - 250); 2 — токоподвод; 3 - датчик давления «Метран»; 4 - кран; 5 - резиновый шланг; 6 - образец металла; 7 - стеклянный реактор; 8 - термостат
всего водорода давление достигнет предельного значения Из уравнения (2) следует
где р.! =2,405 - первый корень функции Бесселя нулевого порядка: 70 (ц„ ) = 0.
Уравнение (3) позволяет вычислить коэффициент диффузии водорода в металле при комнатной температуре, так как в координатах
f 2, 2 ^ ZL+B. ;2 -2 г0
ставляет собой тангенс угла /3 наклона прямой к оси абсцисс.
Результаты опытов и их обсуждение
Результаты опытов представлены на рис. 5 в обычных координатах. Всего было изучено 6 образцов, из них три образца кованного и три образца катаного металла. Экспериментальные данные
представляли в координатах -lnfl- ^
(рис. 6), после чего методом наименьших квадратов рассчитывали тангенс угла наклона прямой, а затем по уравнению (4) - коэффициент диффузии водорода. На рис. 6 для примера показана экспериментальная прямая, полученная при исследовании кованой заготовки (коэффициент корреляции г = 0,99), расчетная величина коэффициента диффузии водорода по которой составила 5,85-10~5 см2/с.
В табл. 1 сведены результаты всех опытов. Полученные значения превышают результаты, полученные экстраполяцией высокотемпературной зависимости на комнатную температуру. Так, например по Сайксу [5] это значение составляет
Рис. 5. Кинетические кривые выделения водорода:. 1-3 - кованый металл; 4-6 - катаный металл
Рис. 6. К расчету коэффициента диффузии водорода Он
Фоминых ЕЛ,, Токовой О.К., Мирзаев Д.А., Воробьев Н.И., Шабуров Д.В., Хяккинен В.И.
Выделение водорода из стали 40 ХГМ ________при комнатной температуре
Результаты расчета коэффициента диффузии водорода (см2/с) в стали 40ХГМ
при температуре 30 °С
Способ деформации металла Номер образца Средние данные
1,7110 5 см2/с, а по Гельду - Рябову [6] - 1,06-10~5 см2/с. Наряду с этим имеются данные [7], что эффективный (то есть измеренный) коэффициент диффузии водорода в железе при комнатной температуре имел значение около 2-10“7 см2/с.
Различие в подвижности водорода в кованном и катаном металле и более высокие значения по сравнению с литературными данными [5. 7] может быть связано со структурой образцов промышленного металла.
Более рыхлая структура кованого металла и ее явная направленность (рис. 7) по сравнению с катаной заготовкой, облегчает выделение водорода. Как видно (см. рис. 7) в строении излома имеется определенная направленность, что видимо, облегчает удаление водорода. Это предположение подтверждает и макрокартина выделения пузырьков
водорода из образцов заготовки. Если на поверхности образцов из катаного металла они расположены достаточно равномерно, то выделение пузырьков водорода из кованых образцов стали 40ХГМ происходило неравномерно и соответствовало направленности излома.
Другим направлением исследования выделения водорода из образцов поковок при комнатной температуре является определение инкубационного периода роста флокенов.
Полагая, что вырезанные образцы (диаметр 24 мм, длина 90 мм) являются моделью поковки диаметром 550 мм в масштабе 1:22,9 с целью обеспечения условий подобия модели оригиналу использовали следующий подход [8].
Для определения времени выделения водорода из поковки совокупность величин, характери-
Рис. 7. Излом образца поковки: а - общий вид излома; б - фрагмент излома, *170; стрелками показаны сульфиды марганца
Приведение величин к безразмерному виду
Величина Единица измерения Масштаб Представляемая единица Безразмерная величина Операция с единицами
т с - - T=tD/12 с м2 * с м2
Р кг/м3 Р кг О. II & кг м3 м3 кг
h м h м L\ = l\H\ = 1 1 м м
1, м - - L, = lJh 1 м м
D м2/с D с fl=D/D м2 с с м2
зующих физическую систему оригинала и модели представляли в виде
т = Ц1 (D,p,lu(5) где D - коэффициент диффузии водорода; р -плотность поковки; /j. /, - геометрические размеры. Для приведения совокупности (5) к безразмерному виду (табл. 2) выделили три параметра (р, 1, D), содержащие независимые основные единицы (кг, м, с), которые использовали в качестве масштабов. Согласно тг-теореме [9] получили 2 безразмерных комплекса
т = п-к = 5-3 = 2, где п = 5 - число размерных величин; к = 3 - число независимых единиц.
Представленный в табл. 2 безразмерный комплекс Т является аналогом общеизвестного критерия подобия Фурье (Fo = DtII2).
Запишем совокупность (5) в безразмерном
Приняв константу геометрического подобия ТН = 1/22,9, вычислим значение основных параметров модели
В уравнениях (7) и (8) штрихами помечены параметры, относящиеся к модели. Уравнение (8) позволяет произвести пересчет времени выделения водорода из поковки, с модели на оригинал.
Если согласно опытам, среднее время выделения водорода из образца поковки составляет 5-6 часов, то для оригинала эта величина составит т = 524,4-(5. 6) часов = 2612. 3134 часов или -108. 130 суток.
Следует заметить, что в течение первых 0,5. 1,0 часа проведенных опытов (рис. 5) нарастание давления происходило с максимальной скоростью, то есть линейно, а затем постепенно уменьшалось и через 5. 6часов стабилизировалось на постоянном уровне. Можно предположить, что в это время происходило максимальное увеличение
давления и в микропустотах внутри заготовки, вызывающее при определенных условиях растрескивание металла и образование флокенов.
Расчет по уравнению (8) т = 524,4 • (0,5.. .1) = =262,2. 524,4 часа -11. 22 суток позволяет оценить этот период для больших промышленных поковок в 11. 22 суток. Таким образом, можно предполагать, что инкубационный период роста флокенов в поковках диаметром 500. 600 мм составляет от 11 до 22 суток.
Методом десорбции газа с поверхности образца из стали 40ХГМ определили коэффициент диффузии водорода в кованом и катаном металле при комнатной температуре. Средняя величина коэффициента диффузии водорода в кованой и катаной заготовке составляет, соответственно, 5,87-10~5 и 3,0210~5 см2/с. Установлена зависимость этой величины от неоднородности структуры образца. Расчеты показали, что инкубационный период роста флокенов в поковках диаметром 500.. .600 мм составляет от 11 до 22 суток.
1. Морозов А.Н. Водород и азот в стали. -М.: Металлургия, 1968. - 281 с.
2. Клячко Ю.А., Атласов А.Г., Шапиро М.М. Анализ газов, неметаллических включений и карбидов в стали. - М.: Металлургиздат, 1953. — 595 с.
3. Мороз Л.С., Чечулин Б.Б. Водородная хрупкость металлов. - М.: Металлургия, 1967. - 255 с.
4. Шьюмон П. Диффузия в твердых телах. — М.: Металлургия, 1966.
5. Гелъд П.В., Рябов P.A. Водород в металлах и сплавах. - М.: Металлургия, 1974. -272 с.
6. Рябов Р.А. Поведение водорода в сплавах на основе железа. - Автореф. докт. дис. - Свердловск: УПИ, 1974.-46 с.
7. Гелъд П.В., Рябов Р.А., Кодес Е.С. Водород и несовершенства структуры металла. - М. : Металлургия, 1979. - 221 с.
8. Марков Б.Л., Кирсанов А.А. Физическое моделирование в металлургии. - М.: Металлургия, 1984.-117 с.
9. Гухман A.A. Введение в теорию подобия. — М.: Высшая школа, 1973. - 295 с.
Урок 24. Выделение водорода в реакциях кислот с металлами
В уроке 24 «Выделение водорода в реакциях кислот с металлами» из курса «Химия для чайников» познакомимся с рядом активности металлов, а также больше узнаем о кислотах в химических реакциях.

Характерное химическое свойство кислот — выделение из них водорода в реакциях с некоторыми металлами. Атомы металлов замещают атомы водорода в молекулах кислот, в результате чего водород выделяется в виде газа. В пробирку с хлороводородной кислотой опустим кусочек цинка. На поверхности металла образуются, а затем выделяются из раствора пузырьки газа. Соберем этот газ в пробирку и поднесем ее к пламени спиртовки (рис. 100). Мы услышим хлопок. Это свидетельствует о наличии в пробирке водорода.
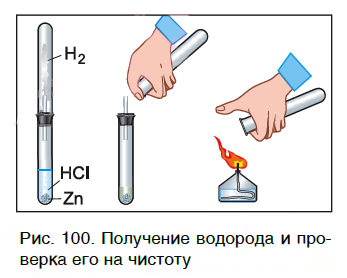
Каплю образовавшегося раствора поместим на стеклянную пластинку и подогреем ее в пламени спиртовки. После испарения воды на пластинке остается вещество белого цвета. Опытным путем можно установить, что состав этого вещества выражается формулой ZnCl2.
Теперь мы можем записать уравнение реакции цинка с кислотой:
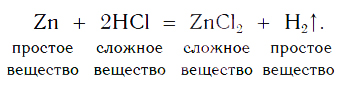
На рисунке 101 дана схема этой реакции. Из уравнения и поясняющей его схемы видим, что атомы цинка замещают атомы водорода в кислоте. В результате из простого вещества цинка и сложного вещества хлороводородной кислоты образуются два новых: сложное вещество ZnCl2 и простое вещество водород Н2.
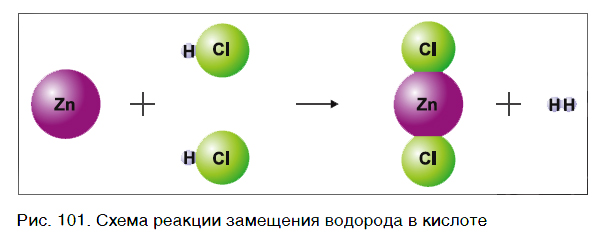
Так же протекают реакции алюминия, железа, других металлов и с раствором серной кислоты:
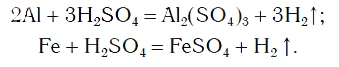
Эти химические реакции подтверждают, что кислоты являются сложными веществами, состоящими из атомов водорода,
способных замещаться на атомы металла, и кислотных остатков.
Вытеснительный ряд металлов
При проведении опыта вы убедились, что алюминий энергично вытесняет водород из раствора хлороводородной кислоты. С железом реакция вытеснения водорода протекает менее энергично, а с медью вовсе не идет.
По интенсивности вытеснения водорода из кислот металлы можно разместить в ряд:
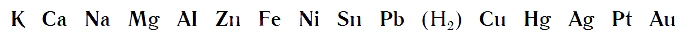
Его называют рядом активности или вытеснительным рядом металлов.
Чем левее расположен металл в вытеснительном ряду до водорода (Н2), тем активнее он вытесняет водород из кислот. Металлы, стоящие в ряду правее водорода, из кислот водород не вытесняют.
Зная расположение металлов в вытеснительном ряду, заранее можно предсказать:
- Будут ли реагировать металлы с кислотами с выделением водорода;
- Насколько активно будут протекать эти реакции.
Для получения водорода из кислот в лаборатории или школьном кабинете химии необходимо брать металлы, которые в вытеснительном ряду стоят до водорода. Но не каждый металл подходит для этих целей. Активные металлы натрий и калий реагируют с кислотами со взрывом, а реакции кислот с оловом и свинцом протекают медленно. Наиболее подходящими металлами для практического получения водорода являются цинк и алюминий. Как вы убедились, при проведении реакций этих металлов с раствором хлороводородной кислоты они протекают спокойно и достаточно быстро.
Краткие выводы урока:
- Кислоты — сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- Металлы, стоящие в вытеснительном ряду до водорода, вытесняют его из кислот.
- В лаборатории водород получают в реакции металлов с кислотами.
Надеюсь урок 24 «Выделение водорода в реакциях кислот с металлами» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Ученым из Гарварда удалось получить металлический водород

Изображение алмазных наковален, сжимающих образец молекулярного водорода. При высоком давлении водород переходит в атомарное состояние, как показано справа. Источник: Dias & Silvera, 2017
В 1935 году ученые Юджин Вигнер и Бэлл Хантингтон предсказали возможность перевода водорода в металлическое состояние под воздействием огромного давления — 250 тысяч атмосфер. Немного позже эта точка зрения была пересмотрена, специалисты повысили оценку давления, которое требуется для фазового перехода. Все это время условия перехода считались достижимыми, и ученые пробовали «взять планку», необходимую для перехода водорода в новую фазу. Впервые металлический водород пытались получить в 1970-х. Повторные попытки были предприняты в 1996, 2008 и 2011 году. Ранее сообщалось, что в 1996 году ученым из Германии удалось на долю микросекунды перевести водород в металлическое состояние, хотя не все согласны с этим.
Что касается давления, необходимого для получения металлического водорода, то с развитием квантовой механики и физики вообще стало понятно, что давление должно быть примерно в 20 раз более высоким, чем считалось ранее — не 25 ГПа, а 400 или даже 500 ГПа. Считается, что большие количества металлического водорода присутствуют в ядрах планет-гигантов — Юпитера, Сатурна и крупных внесолнечных планет. Благодаря гравитационному сжатию под газовым слоем должно находиться ядро из металлического водорода. Понятно, что для того, чтобы получить гигантское давление, нужны особые технологии и методы. Добиться желаемого получилось благодаря использованию двух алмазных наковален.
Прочность наковальни была усилена напылением из оксида алюминия, которое оказалось непроницаемым для атомов водорода. Образец водорода был сжат между заостренными концами двух алмазных наковален и при давлении в 495 ГПа ученые добились перехода образца в металлическую фазу.

Источник: Dias & Silvera, 2017
Во всяком случае, образец сначала потемнел, а затем стал отражать свет. При относительно низких показателях давления образец был непрозрачным, ток он не проводил. Эксперимент, проведенный Исааком Силвера (Isaac Silvera) и Ранга Диас (Ranga Dias), был повторным. Впервые добиться перехода водорода в металлическую фазу ученым удалось в середине 2016 года. Но результаты эксперимента нуждались в подтверждении, повторном опыте. Поскольку результаты изначального опыта подтвердились, их можно считать корректными.
К текущему результату ученые шли несколько лет. Только на то, чтобы достичь давления, при котором водород разбивается на индивидуальные атомы, у Силвера и Диас ушло три года. Давление, о котором идет речь — 380 ГПа.
После этого увеличение давления подразумевало необходимость усиления прочности алмазных наковален, которые использовались в эксперименте. Для этого стали напылять тончайшую пленку из оксида алюминия. Без усиления прочности алмазы, которые являются наиболее твердыми минералами на Земле, начинают разрушаться при увеличении давления выше показателя в 400 ГПа.
Учеными была проделана большая работа по изучению алмазов. Причин разрушения могло быть несколько — от дефектов структуры кристалла до влияния самого сжатого до огромной плотности водорода. Для того, чтобы решить первую проблему, специалисты тщательным образом проверяли структур кристалла под микроскопом с большим увеличением. «Когда мы просмотрели на алмаз под микроскопом, мы обнаружили дефекты, которые делают этот минерал уязвимым к внешним факторам», — заявил Силвера. Вторая проблема была решена при помощи напыления, противодействующего утечке атомов и молекул водорода.
Пока что сложно сказать, какую форму металла получили англичане — твердую или жидкую. Сами они затрудняются сказать, хотя считают, что водород перешел в фазу жидкого металла, поскольку это предсказано расчетами. В чем они уверены, так это в том, что образец водорода после сжатия стал в 15 раз более плотным, чем до начала этой процедуры. Температура водорода, который поместили в алмазную наковальню, составила 15К. После перехода элемента в металлическую фазу его нагрели до 83 К, и он сохранил свои металлические свойства. Расчеты показывают, что металлический водород может быть метастабильным, то есть сохранять свои свойства даже после того, как внешние факторы, которые привели к переходу элемента в металлическую фазу, будут ослаблены.
Зачем человеку металлический водород? Считается, что в таком состоянии он проявляет свойства высокотемпературного сверхпроводника. Кроме того, метастабильные соединения металлического водорода могут использоваться в качестве компактного, эффективного и чистого ракетного топлива. Так, при переходе металлического водорода в молекулярную фазу высвобождается примерно в 20 раз больше энергии, чем при сжигании килограмма смеси кислорода и водорода — 216 Мдж/кг.
«Для получения металлического водорода нам понадобилось огромное количество энергии. А если вы снова переведете атомарный металлический водород в молекулярное состояние, вся эта энергия высвободится, так что мы можем получить самое мощное ракетное топливо в мире, что совершит революцию в ракетостроении», — заявили авторы исследования. По их мнению, новое топливо, при условии его использования, позволит легко достичь других планет. Времени на путешествие к ним будет затрачено гораздо меньше, чем в настоящее время, с использованием современных технологий.
Читайте также:
