Взаимодействие металлов друг с другом
Обновлено: 05.07.2024
Металлы (от лат. «metallum» — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Металлы широко распространены в природе и могут встречаться в различном виде: в самородном состоянии (Ag, Au, Rt, Cu), в виде оксидов (Fe3O4, Fe2O3, (NaK)2O×AlO3), солей (KCl, BaSO4, Ca3(PO4)2), а также сопутствуют различным минералам (Cd – цинковые руды, Nb, Tl – оловянные и т.д.).
Физические свойства металлов
Всем металлам присущи металлический блеск (однако In и Ag отражают свет лучше других металлов), твердость (самый твердый металл – Cr, самые мягкие металлы – щелочные), пластичность (в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe наблюдается уменьшение пластичности), ковкость, плотность (самый легкий металл – Li, самый тяжелый – Os), тепло – и электропроводность, которые уменьшаются в ряду Ag, Cu, Au, Al, W, Fe.
В зависимости от температуры кипения все металлы подразделяют на тугоплавкие (Tкип > 1000 С) и легкоплавкие (Tкип < 1000 С). Примером тугоплавких металлов может быть – Au, Cu, Ni, W, легкоплавких – Hg, K, Al, Zn.
Среди металлов присутствуют s-, p-, d- и f-элементы. Так, s- элементы – это металлы I и II групп Периодической системы (ns 1 , ns 2 ), р- элементы – металлы, расположенные в группах III – VI (ns 2 np 1-4 ). Металлы d-элементы имеют большее число валентных электронов по сравнению с металлами s- и p-элементами. Общая электронная конфигурация валентных электронов металлов d-элементов – (n-1)d 1-10 ns 2 . Начиная с 6 периода появляются металлы f-элементы, которые объединены в семейства по 14 элементов (за счет сходных химических свойств) и носят особые названия лантаноидов и актиноидов. Общая электронная конфигурация валентных электронов металлов f-элементов – (n-2)f 1-14 (n-1)d 0-1 ns 2 .
Химические свойства металлов
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом:
2Na + Cl2 = 2NaCl (хлорид натрия)
2K +S = K2S (сульфид калия)
2Na + H2 = NaH (гидрид натрия)
3Ca + 2P = Ca3P2 (фосфид кальция)
Металлы взаимодействуют друг с другом, образуя интерметаллические соединения:
Щелочные и некоторые щелочноземельные металлы (Ca, Sr, Ba) взаимодействуют с водой с образованием гидроксидов:
В ОВР металлы являются восстановителями – отдают валентные электроны и превращаются в катионы. Восстановительная способность металла — его положение в электрохимическом ряду напряжений металлов. Так, чем левее в ряду напряжений стоит металл, тем более сильные восстановительные свойства он проявляет.
Металлы, стоящие в ряду активности до водорода способны реагировать с кислотами:
Получение металлов
Щелочные, щелочноземельные металлы и алюминий получают электролизом расплавов солей или оксидов этих элементов:
Тяжелые металлы получают восстановлением из руд при высоких температурах и в присутствии катализатора (пирометаллургия) (1) или восстановлением из солей в растворе (гидрометаллургия) (2):
Cu2O + C = 2Cu + CO (1)
Некоторые металлы получают термическим разложением их неустойчивых соединений:
Примеры решения задач
| Задание | При взаимодействии 6,0 г металла с водой выделилось 3,36 л водорода (н.у.). Определите этот металл, если он в своих соединениях двухвалентен. |
| Решение | Т.к. металл двухвалентен, его реакция с водой будет описываться уравнением, которое в общем виде будет выглядеть следующим образом: |
Согласно написанному выше уравнению, количества вещества металла и выделяющегося в ходе реакции водорода будут равны:
Лекция 15. Общие химические свойства металлов
С химической точки зрения металл – это элемент, который во всех соединениях проявляет положительную степень окисления.Из известных в настоящее время 109 элементов 86 являются металлами. Основной отличительной особенностью металлов является наличие в конденсированном состоянии свободных, не связных с определенным атомом электронов. Эти электроны способны перемещаться по всему объему тела. Наличие свободных электронов определяет всю совокупность свойств металлов. В твердом состоянии большинство металлов имеет кристаллическую высокосимметричную структуру одного из типов: кубическую объемноцентрированную, кубическую гранецентрированную или гексагональную плотноупакованную (рис. 1).
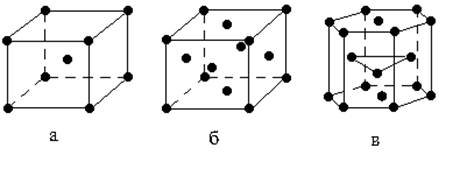
Рис. 1. Типичная структура кристалла металлов: а – кубическая объемноцентрированная; б–кубическая гранецентрированная; в – плотная гексагональная
Существует техническая классификация металлов. Обычно выделяют следующие группы: черные металлы (Fe); тяжелые цветные металлы(Cu, Pb, Zn, Ni, Sn, Co, Sb, Bi, Hg, Cd), легкие металлы с плотностью менее 5 г/см 3 (Al, Mg, Ca и т.д.), драгоценные металлы (Au, Ag и платиновые металлы) и редкие металлы (Be, Sc, In, Ge и некоторые другие).
В химии металлы классифицируются по их месту в периодической системе элементов. Различают металлы главных и побочных подгрупп. Металлы главных подгрупп называют непереходными. Эти металлы характеризуются тем, что в их атомах происходит последовательное заполнение s– и p– электронных оболочек.
Типичными металлами являются s–элементы (щелочные Li, Na, K, Rb, Cs, Fr и щелочноземельные Be, Mg, Ca, Sr, Ba, Ra металлы). Данные металлы расположены в Iа и IIа подгруппах (т. е., в главных подгруппах I и II групп). Этим металлам отвечает конфигурация валентных электронных оболочек ns 1 или ns 2 (n – главное квантовое число). Для данных металлов характерно:
а) металлы имеют на внешнем уровне 1 – 2 электрона, поэтому проявляют постоянные степени окисления +1, +2;
б) оксиды этих элементов носят основной характер (исключение –бериллий, т.к. малый радиус иона придает ему амфотерные свойства);
в) гидриды имеют солеобразный характер и образуют ионные кристаллы;
г) возбуждение электронных подуровней возможно только у металлов IIА группы с последующей sp–гибридизацией орбиталей.
К p–металлам относятся элементы IIIа (Al, Ga, In, Tl), IVа (Ge, Sn, Pb), Vа (Sb, Bi) и VIа (Ро) групп с главными квантовыми числами 3, 4, 5, 6. Данным металлам отвечает конфигурация валентных электронных оболочек ns 2 p z (z может принимать значение от 1 до 4 и равно номеру группы минус 2). Для данных металлов характерно:
а) образование химических связей осуществляется s – и p–электронами в процессе их возбуждения и гибридизации (sp–и spd), однако сверху вниз по группам способность к гибридизации падает;
б) оксиды p– металлов амфотерные или кислотные (основные оксиды только у In и Tl);
в) гидриды p–металлов имеют полимерный характер (AlH3)n или газообразный (SnH4 ,PbH4 и т. д.), что подтверждает сходство с неметаллами, открывающими эти группы.
В атомах металлов побочных подгрупп, называемых переходными металлами, происходит застраивание d– и f– оболочек, в соответствии с чем их делят на d–группу и две f–группы лантаноиды и актиноиды.
К переходным металлам относят 37 элементов d–группы и 28 металлов f–группы. К металлам d–группы относят элементы Ib (Cu, Ag, Au), IIb (Zn, Cd, Hg), IIIb (Sc, Y, La, Ac), IVb (Ti, Zr, Hf, Db), Vb (V, Nb, Ta, Jl), VIb (Cr, Mo, W, Rf), VIIb (Mn, Tc, Re, Bh) и VIII групп (Fe, Co, Ni, Ru, Rh, Pd, Os, Ir, Rt, Hn, Mt, Db, Jl, Rf, Bh, Hn, Mt). Этим элементам отвечает конфигурация 3d z 4s 2 . Исключения составляют некоторые атомы, в том числе атомы хрома с полузаполненной 3d 5 –оболочкой (3d 5 4s 1 ) и меди – с полностью заполненной 3d 10 –оболочкой (3d 10 4s 1 ). Эти элементы обладают некоторыми общими свойствами:
1. все они образуют сплавы между собой и другими металлами;
2. наличие частично заполненных электронных оболочек обусловливает способность d–металлов образовывать парамагнитные соединения;
3. в химических реакциях они проявляют переменную валентность (за немногими исключениями), а их ионы и соединения, как правило, окрашены;
4. в химических соединениях d–элементы электроположительны. "Благородные" металлы, обладая высоким положительным значением стандартного электродного потенциала (Е>0), взаимодействуют с кислотами необычным образом;
5. ионы d–металлов имеют вакантные атомные орбитали валентного уровня (ns, np, (n–1) d), поэтому они проявляют акцепторные свойства, выступая в качестве центрального иона в координационных (комплексных) соединениях.
Химические свойства элементов определяются их положением в Периодической системе элементов Менделеева. Так, металлические свойства сверху вниз в группе возрастают, что обусловлено уменьшением силы взаимодействия между валентными электронами и ядром вследствие увеличения радиуса атома и за счет возрастания экранирования электронами, расположенными на внутренних атомных орбиталях. Это приводит к облегчению ионизации атома. В периоде металлические свойства уменьшаются слева направо, т.к. это связано с увеличением заряда ядра и тем самым с увеличением прочности связи валентных электронов с ядром.
В химическом отношении атомы всех металлов характеризуются сравнительной легкостью отдачи валентных электронов (т.е. малой величиной энергии ионизации) и низким значением сродства к электрону (т.е. малой способностью удерживать избыточные электроны). Как следствие этого низкое значение электроотрицательности, т.е., способность образовывать только положительно заряженные ионы и проявлять в своих соединениях только положительную степень окисления. В связи с этим металлы в свободном состоянии являются восстановителями.
Восстановительная способность разных металлов неодинакова. Для реакций в водных растворах она определяется значением стандартного электродного потенциала металла (т.е. положением металла в ряду напряжений) и концентрацией (активностью) его ионов в растворе.
Взаимодействие металлов с элементарными окислителями (F2, Cl2, O2, N2, S и т.д.). Например, реакция с кислородом, как правило, протекает следующим образом
где n – валентность металла.
Взаимодействие металлов с водой. Металлы, обладающие стандартным потенциалом менее –2,71 В, вытесняют водород из воды на холоде с образованием гидроксидов металлов и водорода. Металлы со стандартным потенциалом от –2,7 до –1,23 В вытесняют водород из воды при нагревании
Остальные металлы с водой не реагируют.
Взаимодействие с щелочами. С щелочами могут реагировать металлы, дающие амфотерные оксиды, и металлы, обладающие высокими степенями окисления, в присутствии сильного окислителя. В первом случае металлы образуют анионы своих кислот. Так, реакция взаимодействия алюминия с щелочью запишется уравнением
в котором, лигандом является ион гидроксида. Во втором случае образуются соли, например K2CrO4 .
Взаимодействие металлов с кислотами. С кислотами металлы реагируют различно в зависимости от численного значения стандартного электродного потенциала (Е) (т.е. от положения металла в ряду напряжения) и окислительных свойств кислоты:
· в растворах галогеноводородов и разбавленной серной кислоты окислителем является только ион Н + , и поэтому с этими кислотами взаимодействуют металлы, стандартный потенциал которых меньше стандартного потенциала водорода:
Me + 2n H + = Me n+ + n H2;
· концентрированная серная кислота растворяет почти все металлы независимо от положения их в ряду стандартных электродных потенциалов (кроме Au и Pt). Водород при этом не выделяется, т.к. функцию окислителя в кислоте выполняет cульфат–ион (SO4 2– ). В зависимости от концентрации и условий проведения опыта cульфат–ион восстанавливается до различных продуктов. Так, цинк в зависимости от концентрации серной кислоты и температуры реагирует следующим образом:
– при очень высокой температуре 4Zn + 5H2SO4(конц.) = 4ZnSO4 + H2S +4H2O;
· в разбавленной и концентрированной азотной кислоте функцию окислителя выполняет нитрат–ион (NO3 – ), поэтому продукты восстановления зависят от степени разбавления азотной кислоты и активности металлов. В зависимости от концентрации кислоты, металла (величины его стандартного электродного потенциала) и условий проведения опыта нитрат–ион восстанавливается до различных продуктов. Так, кальций в зависимости от концентрации азотной кислоты реагирует следующим образом:
Концентрированная азотная кислота не реагирует (пассивирует) с железом, алюминием, хромом, платиной и некоторвми другими металлами.
Взаимодействие металлов друг с другом. При высоких температурах металлы способны реагировать друг с другом с образованием сплавов. Сплавы могут быть твердыми растворами и химическими (интерметаллическими) соединениями (Mg2Pb, SnSb, Na3Sb8, Na2K и др.).
Свойства металлического хрома (…3d 5 4s 1 ). Простое вещество хром представляет собой блестящий на изломе серебристый металл, который хорошо проводит электрический ток, имеет высокую температуру плавления (1890°С) и кипения (2430°С), большую твердость (в присутствии примесей, очень чистый хром мягок) и плотность (7,2 г/см 3 ).
При обычной температуре хром устойчив к действию элементарных окислителей и воде благодаря плотной окисной пленке. При высоких температурах хром взаимодействует с кислородом и другими окислителями.
Cr + Cl2(газ) ® CrCl3 (малиновый цвет)
С металлами при сплавлении хром образует интерметаллиды (FeCr2, CrMn3). При 600°С хром взаимодействует с парами воды:
В электрохимическом отношении металлический хром близок к железу:. Поэтому он может растворяться в неокисляющих (по аниону) минеральных кислотах, таких как галогеноводородные:
Сr + 2HCl ® CrCl2(голубой цвет) + H2.
На воздухе идет быстро следующая стадия:
Окисляющие (по аниону) минеральные кислоты растворяют хром до трехвалентного состояния:
В случае с HNO3(конц) происходит пассивация хрома – на поверхности образуется прочная пленка оксида – и металл не реагирует с кислотой. (Пассивный хром имеет высокий окислительно-восстановительный потенциал = + 1,3 В.)
Основная область применения хрома – металлургия: создание хромистых сталей. Так, в инструментальную сталь вводят 3 – 4% хрома, шарикоподшипниковая сталь содержит 0,5 – 1,5% хрома, в нержавеющей стали (один из вариантов): 18 – 25% хрома, 6 – 10% никеля, < 0,14% углерода, ~0,8% титана, остальное – железо.
Свойства металлического железа (…3d 6 4s 2 ). Железо – белый блестящий металл. Образует несколько кристаллических модификаций, устойчивых в определенном температурном интервале.
Химические свойства металлического железа определяются его положением в ряду напряжений металлов: .
При нагревании в атмосфере сухого воздуха железо окисляется:
В зависимости от условий и от активности неметаллов железо может образовывать металлоподобные (Fe3C, Fe3Si, Fe4N), солеподобные (FeCl2, FeS) соединения и твердые растворы (с C, Si, N, B, P, H).
В воде железо интенсивно корродирует:
При недостатке кислорода образуется смешанный оксид Fe3O4:
Разбавленная соляная, серная и азотная кислоты растворяют железо до двухвалентного иона:
Более концентрированная азотная и горячая концентрированная серная кислоты окисляют железо до трехвалентного состояния (выделяются NO и SO2 соответственно):
Очень концентрированная азотная кислота (плотность 1,4 г/см3) и серная (олеум) пассивируют железо, образуя на поверхности металла оксидные пленки.
Железо используют для получения железоуглеродистых сплавов. Велико биологическое значение железа, т.к. оно – составная часть гемоглобина крови. В организме человека содержится около 3 г железа.
Химические свойства металлического цинка (…3d 10 4s 2 ). Цинк – синевато-белый, пластичный и тягучий металл, но выше 200°С становится хрупким. Во влажном воздухе он покрывается защитной пленкой основной соли ZnCO3×3Zn(OH)2 или ZnO и дальнейшего окисления не происходит. При высоких температурах взаимодействует:
Исходя из величин стандартных электродных потенциалов, цинк вытесняет кадмий, который является его электронным аналогом, из солей: Cd 2+ + Zn ® Cd + Zn 2+ .
Благодаря амфотерности гидроокиси цинка металлический цинк способен растворяться в щелочах:
В разбавленных кислотах:
В концентрированных кислотах:
Значительная часть цинка расходуется для цинкования железных и стальных изделий. Широкое промышленное использование имеют сплавы цинка с медью (нейзильбер, латунь). Цинк широко используется при изготовлении гальванических элементов.
Химические свойства металлической меди (…3d 10 4s 1 ). Металлическая медь кристаллизуется в кубической гранецентрированной кристаллической решетке. Это ковкий мягкий, вязкий металл розового цвета с температурой плавления 1083°С. Медь находится на втором месте после серебра по электро- и теплопроводности, что обусловливает значение меди для развития науки и техники.
Медь реагирует с поверхности с кислородом воздуха при комнатной температуре, цвет поверхности становится темнее, а в присутствии CO2, SO2 и паров воды покрывается зеленоватой пленкой основных солей (CuOH)2CO3, (CuOH)2SO4.
Медь непосредственно соединяется с кислородом, галогенами, серой:
В присутствии кислорода металлическая медь взаимодействует с раствором аммиака при обычной температуре:
Находясь в ряду напряжений после водорода , медь не вытесняет его из разбавленных соляной и серной кислот. Однако в присутствии кислорода воздуха медь растворяется в этих кислотах:
Окисляющие кислоты растворяют медь с переходом ее в двухвалентное состояние:
Со щелочами медь не взаимодействует.
С солями более активных металлов медь взаимодействует, и эта окислительно-восстановительная реакция лежит в основе некоторых гальванических элементов:
Cu SO4 + Zn® Zn SO4 + Cu; E о = 1,1 B
Mg + CuCl2 ® MgCl2 + Cu; E о = 1,75 B.
Медь образует с другими металлами большое число интерметаллических соединений. Наибольшую известность и ценность имеют сплавы: латунь Cu–Zn (18 – 40% Zn), бронза Cu–Sn (колокольная – 20% Sn), инструментальная бронза Cu–Zn–Sn (11% Zn, 3 – 8% Sn), мельхиор Cu–Ni–Mn–Fe (68% Cu, 30% Ni, 1% Mn, 1% Fe).
Нахождение металлов в природе и способы получения.Вследствие высокой химической активности, металлы в природе находятся в виде различных соединений, и только малоактивные (благородные) металл – платина, золото и т.п. – встречаются в самородном (свободном) состоянии.
Наиболее распространенными природными соединениями металлов являются оксиды (гематит Fe2O3, магнетит Fe3O4, куприт Cu2O, корунд Al2O3, пиролюзит MnO2 и др.), сульфиды (галенит PbS, сфалерит ZnS, халькопирит CuFeS, киноварь HgS и т.д.), а также соли кислородосодержащих кислот (карбонаты, силикаты, фосфаты и сульфаты). Щелочные и щелочноземельные металлы встречаются преимущественно в виде галогенидов (фторидов или хлоридов).
Основная масса металлов получается путем переработки полезного ископаемого – руды. Поскольку металлы, входящие в состав руд находятся в окисленном состоянии, то их получение осуществляется путем реакции восстановления. Предварительно руду очищают от пустой породы
Образовавшийся концентрат оксида металла очищают от воды, а сульфиды, для удобства последующей переработки, переводят в оксиды путем обжига, например:
Для разделения элементов полиметаллических руд пользуются методом хлорирования. При обработке руд хлором в присутствии восстановителя образуются хлориды различных металлов, которые вследствие значительной и различной летучести могут быть легко отделены друг от друга.
Восстановление металлов в промышленности осуществляется посредством различных процессов. Процесс восстановления безводных соединений металлов при высоких температурах называют пирометаллургией. В качестве восстановителей используют металлы, более активные, чем получаемый, либо углерод. В первом случае говорят о металлотермии, во втором – карботермии, например:
Особое значение углерод приобрел как восстановитель железа. Углерод для восстановления металлов применяется обычно в виде кокса.
Процесс восстановления металлов из водных растворов их солей относится к области гидрометаллургии. Получение металлов осуществляется при обычных температурах, причем в качестве восстановителей могут быть использованы сравнительно активные металлы или электроны катода при электролизе. Электролизом водных растворов солей могут быть получены только сравнительно малоактивные металлы, расположенные в ряду напряжений (стандартных электродных потенциалов) непосредственно перед водородом или после него. Активные металлы – щелочные, щелочноземельные, алюминий и некоторые другие, получают электролизом расплава солей.
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
1. Взаимодействие металлов с неметаллами.
а) Взаимодействие металлов с водородом.
С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
Например:
Образуются нестехиометрические соединения с ионной кристаллической структурой.
б) Взаимодействие металлов с кислородом.
Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
Пример:
в) Взаимодействие металлов с галогенами.
Все металлы реагируют с галогенами с образованием галогенидов.
Пример:
В основном это ионные соединения: MeHaln
г) Взаимодействие металлов с азотом.
С азотом взаимодействуют щелочные и щелочноземельные металлы.
д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды. Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой.
С водой реагируют металлы, имеющие более отрицательный потенциал, чем окислительно-восстановительный потенциал воды.
Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей.
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей.
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
1 Zn 0 + 4OH – – 2e = [Zn(OH)4] 2– окисление
Zn 0 – восстановитель
1 2H2O + 2e = H2 + 2OH – восстановление
Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
5. Взаимодействие металлов с кислотами.
Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
По активности металлы условно делятся на активные, средней активности и малоактивные.
Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H + . При взаимодействии с металлами выделяется кислород (H2↑). С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
H2S↑ – c активными металлами
H2SO4 +6е S 0 ↓ – с металлами средней активности
SO2↑ – c малоактивными металлами
HNO3 +4,5e N2O, N2 – с металлами средней активности
NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe 2+ , Cr → Cr 2+ . При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe 3+ , Cr → Cr 3+ , при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Общие представления о химической устойчивости металлов. Металлы и их сплавы – важнейшие конструкционные материалы. Чтобы иметь представление о химической устойчивости этих материалов, необходимо знать свойства металлов, их поведение в различных средах. Химические свойства металлов объясняются следующими особенностями.
Все металлы – восстановители, что обусловлено строением их атомов. Внешние электроны в атомах металлов находятся на значительном удалении от ядра и связаны с ним сравнительно слабо – атомы металлов характеризуются низкими энергиями ионизации и близким к нулю или отрицательным сродством к электрону. Именно поэтому металлы легко отдают валентные электроны, выступая в качестве восстановителей и превращаясь в положительные ионы и, как правило, не способны присоединять электроны – проявлять окислительные свойства.
Все металлы по восстановительным свойствам разделены на три группы:
1) активные металлы (в «Ряду напряжений» находятся от Li до Al включительно);
2) металлы средней активности (в ряду напряжений находятся от Al до H2);
3) малоактивные металлы (в ряду напряжений стоят после водорода).
Будучи восстановителями, металлы могут взаимодействовать с окислителями. Важнейшим окислителем, входящим в состав воздуха, является кислород. С кислородом взаимодействуют почти все металлы, кроме Ag, Au, Hg и платиновых металлов, причём щелочные и щелочноземельные взаимодействуют очень активно, так что уже при обычной температуре рубидий и цезий самовозгораются:
Хотя процессы взаимодействия других металлов с кислородом протекают менее активно, их окисление всегда термодинамически выгодно, т.к. сопровождается уменьшением свободной энергии Гиббса. Образующиеся при этом оксиды во многих случаях придают химическую устойчивость изделиям из металла.
Термодинамическая возможность реакции металла с тем или иным окислителем определяется условием или ЭДС реакции (Е = jо - jв ) положительна. Сравнение ряда потенциалов окислителей:
| F2/2F | Cl2/2Cl | Br2/2Br | O2/OH | H2O, H/H2 |
| +2,87 | +1,356 | +1,087 | +1,23 (рН=0) | 0,0 (рН=0) |
| +0,82 (рН=7) | -0,41 (рН=7) |
с электродными потенциалами металлов позволяет сделать следующие выводы. Все металлы окисляются фтором и могут окисляться хлором. Большинство металлов (кроме платины и золота) могут окисляться бромом и кислородом в кислой среде. В нейтральной среде кислород не может окислять золото, платиновые металлы, ртуть, серебро. Ионы водорода в кислой среде могут окислять многие металлы, кроме платиновых, ртути, золота, серебра, меди, рения, сурьмы и висмута. Реальная возможность окисления того или иного металла определяется не только термодинамикой, но и кинетикой процесса. Взаимодействие многих металлов с окислителями тормозится пассивными пленками на поверхности металлов.
Взаимодействие металлов с водой. Окислителем в этом случае является катион водорода (ион гидроксония Н3О+), присутствующий в результате равновесной реакции Н2О D Н+ + ОН.
Для того чтобы выяснить, какие металлы окисляются катионами водорода, концентрация которых обусловлена диссоциацией молекул воды, необходимо определить окислительно-востановительный потенциал водородного электрода в воде. При 25 о С и рН = 7 , Е = . ЭДС реакции будет положительна (Е > 0), если < - 0,41В. Значит, все металлы, имеющие стандартный электродный потенциал меньший, чем – 0,41В (в «Ряду напряжений» стоят до кадмия включительно), могут окисляться катионами водорода, т.е. восстанавливать водород из воды.
Чтобы процесс мог протекать до конца, необходимо, чтобы образующиеся гидроксиды Me(OH)n были растворимы в воде. В противном случае, вследствие образования малорастворимых оснований, покрывающих металл, реакция практически прекращается.
2Na + 2H2O ® 2 Na + + H2 + 2OH.
Процесс термодинамически возможен, т.к. < - 0,41B, но из-за образования малорастворимого Zn(OH)2, предохраняющего цинк от воздействия воды, практически не идёт.
Процесс термодинамически не возможен, т.к. > - 0,41B.
Приведённые выше расчёты указывают лишь на возможность осуществления процесса, а не на обязательное его протекание. В действительности существуют ограничения, которые препятствуют реализации такой возможности, а иногда полностью её исключают. Например, пассивацию поверхности металла малорастворимым соединением, в частности основанием, мы уже рассмотрели. На возможность реального осуществления реакции влияет реальное состояние поверхности (наличие оксидных плёнок). Так, в соответствии с электродными потенциалами металлы Be, Mg, Al, Ti и др. должны взаимодействовать с водой (восстанавливать катионы водорода из воды). Однако оксидные поверхностные слои, не растворимые в воде, исключают возможность такого взаимодействия. Нерастворимость TiO2 ни в воде, ни в разбавленных растворах кислот и щелочей обусловливает высокую химическую пассивность титана.
Взаимодействие металлов с растворами щелочей. Только амфотерные металлы Be, Al, Zn, Pb, Sn могут взаимодействовать с растворами щелочей по ионно-молекулярной схеме:
где n, m – степень окисления металла и заряд комплексного иона, соответственно.
В качестве примера рассмотрим взаимодействие бериллия с раствором гидроксида натрия. Схема процесса:
в-ль ок-ль продукт продукт
Схемы полуреакций и ионно-молекулярное уравнение:
1 Be + 4OH– 2eˉ = [Be(OH)4] 2-
Для определения металлов, восстанавливающих водород из щелочных растворов, т.е. для расчёта ЭДС реакции нельзя пользоваться потенциалами окислительно-восстановительных систем , т.к. металл, окисляясь, переходит в значительно более сложный ион – [Me(OH)n] m - . В подобных случаях надо рассматривать потенциал системы [Me(OH)n] m - /Ме.
Кроме того, концентрация [H + ] в щелочном растворе зависит от концентрации щелочи. Например, для 1М раствора NaOH [OH] = 1 моль/л; при 25 0 С [H + ] = = 10 -14 моль/л. Отсюда .
Взаимодействие металлов с растворами кислот.Минеральные кислоты HCl, H3PO4, H2SO4 разбавленная и др., за исключением HNO3 любой концентрации и H2SO4 концентрированной, являются окислителями металлов за счёт катионов водорода.
Для перечисленных кислот взаимодействие с металлами идёт по схеме:
Ме + 2Н + ® Ме n + + H2
Определим ЭДС данной ОВР в общем виде в стандартных условиях:
Чтобы металл мог восстанавливать катионы Н + до Н2 при взаимодействии с перечисленными минеральными кислотами, необходимо, чтобы его стандартный электродный потенциал был меньше нуля вольт и образующаяся соль была растворимой в воде (реакция будет идти до конца; в противном случае поверхность металла запассивируется).
, процесс термодинамически возможен.
1 Zn – 2eˉ = Zn 2+
Zn + 2H + = Zn 2+ + H2
, процесс возможен, но образующаяся в начальный момент малорастворимая соль PbSO4 покрывает металл пассивирующей солевой плёнкой и реакция практически прекращается.
Особенности взаимодействия металлов с растворами азотной кислоты. В азотной кислоте сильным окислителем является нитрат- ион NO, поэтому при её взаимодействии с металлами водород Н2 не выделяется, а протекает восстановление NO. Каким будет продукт восстановления - зависит от концентрации кислоты и активности металла.
Чем активнее металл и чем меньше концентрация кислоты, тем в большей степени восстанавливается азот (понижается его степень окисления). Азотная кислота как сильный окислитель окисляет металлы до высоких степеней окисления, взаимодействует со всеми металлами, стоящими в «Ряду напряжений», по серебро включительно.
В зависимости от концентрации кислоты и активности металла получаются следующие продукты:
Все металлы, в зависимости от их окислительно-восстановительной активности объединяют в ряд, который называется электрохимическим рядом напряжения металлов (так как металлы в нем расположены в порядке увеличения стандартных электрохимических потенциалов) или рядом активности металлов:
Li, K, Ва, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Рt, Au
Наиболее химически активные металлы стоят в ряду активности до водорода, причем, чем левее расположен металл, тем он активнее. Металлы, занимающие в ряду активности, место после водорода считаются неактивными.
Взаимодействие с простыми веществами
Металлы способны реагировать с простыми веществами, такими как кислород (реакция горения), галогены, азот, сера, водород, фосфором и углеродом. В реакцию взаимодействия с кислородом вступают все металлы (исключение составляют Au, Pt), в результате чего возможно образование трех различных продуктов — пероксидов, оксидов и надпероксидов:
K + O2 = KO2 (надпероксид калия)
Металлы средней активности (начиная с Al) и неактивные металлы реагируют с кислородом только при нагревании:
В реакцию взаимодействия с азотом способны вступать только активные металлы, в результате чего образуются азиды, причем при н.у. с азотом реагирует только литий, остальные активные металлы – только при нагревании:
Только активные металлы способны взаимодействовать с углеродом и водородом, причем в случае реакции с водородом – это только щелочные и щелочноземельные металлы:
С серой реагируют все металлы кроме Au и Pt:
Также металлы способны взаимодействовать с галогенами и фосфором:
Все реакции взаимодействия с простыми веществами носят окислительно-восстановительный характер, металлы в них окисляются, проявляя свойства восстановителей, т.е. демонстрируют способность отдавать электроны:
Fe -2e = Fe 2+ процесс окисления, железо — восстановитель
S +2e = S 2- процесс восстановления, сера – окислитель
Взаимодействие металлов друг с другом
Взаимодействие металлов с водой
Активные металлы (щелочные и некоторые щелочноземельные металлы — Ca, Sr, Ba) способны взаимодействовать с водой с образованием гидроксидов:
Металлы, характеризующиеся средней активностью (начиная с Al) вступают в реакцию с водой в более жестких условиях (наличие щелочной или кислотной среды и др. условия); при этом образуется соответствующий оксид и выделяется водород:
Неактивные металлы с водой не реагируют.
Реакции взаимодействия металлов с водой также относятся к ОВР и металлы в них являются восстановителями.
Взаимодействие металлов с кислотами
Неактивные металлы взаимодействуют с кислотами при особых условиях. Так, концентрированная серная кислота способна растворять медь (1), а при взаимодействии меди с концентрированной азотной кислотой в зависимости от её концентрации (60% или 30%) образуются различные продукты реакции (2, 3):
Взаимодействие металлов с солями
Более активные металлы способны взаимодействовать с солями, образованными менее активными металлами, и вытеснять их (металлы) из солей:
Читайте также:
