Взаимодействие различных металлов с соляной кислотой рисунок
Обновлено: 20.05.2024
1) В три пробирки налейте соляную кислоту. В первую пробирку положите кусочек магния, во вторую — кусочек цинка, в третью — кусочек меди. Что наблюдаете? Какая из реакций протекает быстрее?
2) Налейте в одну пробирку соляной кислоты, в другую — такое же количество уксусной кислоты (концентрация кислот должна быть одинаковой). Опустите в каждую пробирку по две гранулы цинка. Определите, какая реакция протекает быстрее.
Влияние концентрации реагирующих веществ
В две пробирки поместите по одной грануле цинка. В одну пробирку прилейте 1 мл 30 %-ной соляной кислоты, в другую — 1 мл 10 %-ной соляной кислоты. Где более интенсивно проходит реакция? Почему?
Влияние поверхности соприкосновения реагентов
В одну пробирку опустите кусочек мела, в другую насыпьте немного порошка мела. Налейте в пробирки по 1,5 мл соляной кислоты одинаковой концентрации. Есть ли разница в скорости выделения газа?
Влияние температуры
В две пробирки опустите по одной грануле цинка. Налейте в каждую пробирку по 1 мл соляной кислоты одинаковой концентрации. Одну пробирку опустите в стакан с горячей водой. Сравните интенсивность выделения пузырьков водорода в пробирках и сделайте вывод о влиянии температуры на скорость химической реакции.
Влияние катализатора
В пробирку налейте 1 мл пероксида водорода и внесите тлеющую лучинку, не прикасаясь к жидкости. Что наблюдаете? Добавьте к пероксиду водорода несколько кристалликов оксида марганца (IV) MnO2 и снова внесите тлеющую лучинку. Что наблюдаете? Какую роль играет MnO2?
Влияние природы реагирующих веществ
При добавлении кусочка магния в соляную кислоту, выделяется газ:
Mg + 2HCl ⟶ MgCl2 + H2↑
При добавлении кусочка цинка в соляную кислоту, выделяется газ:
Zn + 2HCl ⟶ ZnCl2 + H2↑
При добавлении кусочка меди в соляную кислоту, изменений не наблюдается:
Cu + HCl ⇸
Быстрее протекает реакция с магнием, чем с цинком, т. к. магний в ряду напряжений металлов располагается левее цинка.
В пробирке с соляной кислотой наблюдается более интенсивное выделение газа, чем в пробирке с уксусной кислотой, значит реакция цинка с соляной кислотой протекает быстрее, чем реакция цинка с уксусной кислотой.
Цинк быстрее реагирует с 30%-ной соляной кислотой, чем с 10%-ной кислотой потому, что чем больше концентрация кислоты, тем больше число столкновений молекул хлороводорода с атомами цинка.
Zn + 2HCl ⟶ ZnCl2 + H2↑
Быстрее выделения газа протекает при реакции соляной кислоты с порошком мела, чем с цельным кусочком мела.
2HCl + CaCO3 ⟶ CaCl2 + H2O + CO2↑
Реакция цинка с соляной кислотой сопровождается выделением водорода, в нагретой пробирке процесс выделения газа протекает более интенсивно, чем не в нагретой.
Вывод: при повышении температуры скорость химической реакции возрастает.
При внесении тлеющей лучинки в пробирку с перекисью водорода видимых изменений не наблюдается. После добавления оксида марганца (IV) в пероксид водорода наблюдается бурное выделение газа:
2H2O2 MnO₂ ⟶ 2H2O + O2
При повторном внесении тлеющей лучины, наблюдается её воспламенение.
Так как по окончании реакции чёрный порошок оксид марганца (IV) не израсходовался, то значит оксид марганца (IV) в данной реакции является катализатором.
Взаимодействие различных металлов с соляной кислотой рисунок
ОТНОШЕНИЕ МЕТАЛЛОВ К КИСЛОТАМ
Чаще всего в химической практике используются такие сильные кислоты как серная H 2 SO 4 , соляная HCl и азотная HNO 3 . Далее рассмотрим отношение различных металлов к перечисленным кислотам.
Соляная кислота ( HCl )
Соляная кислота – это техническое название хлороводородной кислоты. Получают ее путем растворения в воде газообразного хлороводорода – HCl . Ввиду невысокой его растворимости в воде, концентрация соляной кислоты при обычных условиях не превышает 38%. Поэтому независимо от концентрации соляной кислоты процесс диссоциации ее молекул в водном растворе протекает активно:
Образующиеся в этом процессе ионы водорода H + выполняют роль окислителя, окисляя металлы, расположенные в ряду активности левее водорода. Взаимодействие протекает по схеме:
Me + HCl соль + H 2 ↑
При этом соль представляет собой хлорид металла ( NiCl 2 , CaCl 2 , AlCl 3 ), в котором число хлорид-ионов соответствует степени окисления металла.
Соляная кислота является слабым окислителем, поэтому металлы с переменной валентностью окисляются ей до низших положительных степеней окисления:
Fe 0 → Fe 2+
Co 0 → Co 2+
Ni 0 → Ni 2+
Cr 0 → Cr 2+
Mn 0 → Mn 2+ и др .
2 Al + 6 HCl → 2 AlCl 3 + 3 H 2 ↑
2│ Al 0 – 3 e - → Al 3+ - окисление
3│2 H + + 2 e - → H 2 – восстановление
Соляная кислота пассивирует свинец ( Pb ). Пассивация свинца обусловлена образованием на его поверхности трудно растворимого в воде хлорида свинца ( II ), который защищает металл от дальнейшего воздействия кислоты:
Pb + 2 HCl → PbCl 2 ↓ + H 2 ↑
Серная кислота ( H 2 SO 4 )
В промышленности получают серную кислоту очень высокой концентрации (до 98%). Следует учитывать различие окислительных свойств разбавленного раствора и концентрированной серной кислоты по отношению к металлам.
Разбавленная серная кислота
В разбавленном водном растворе серной кислоты большинство ее молекул диссоциируют:
Образующиеся ионы Н + выполняют функцию окислителя.
Как и соляная кислота, разбавленный раствор серной кислоты взаимодействует только с металлами активными и средней активности (расположенными в ряду активности до водорода).
Химическая реакция протекает по схеме:
1│2Al 0 – 6e - → 2Al 3+ - окисление
Металлы с переменной валентностью окисляются разбавленным раствором серной кислоты до низших положительных степеней окисления:
Mn 0 → Mn 2+ и др .
Свинец ( Pb ) не растворяется в серной кислоте (если ее концентрация ниже 80%) , так как образующаяся соль PbSO 4 нерастворима и создает на поверхности металла защитную пленку.
Концентрированная серная кислота
В концентрированном растворе серной кислоты (выше 68%) большинство молекул находятся в недиссоциированном состоянии, поэтому функцию окислителя выполняет сера, находящаяся в высшей степени окисления ( S +6 ). Концентрированная H 2 SO 4 окисляет все металлы, стандартный электродный потенциал которых меньше потенциала окислителя – сульфат-иона SO 4 2- (0,36 В). В связи с этим, с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Процесс взаимодействия металлов с концентрированной серной кислотой в большинстве случаев протекает по схеме:
Me + H 2 SO 4 (конц.) соль + вода + продукт восстановления H 2 SO 4
Продуктами восстановления серной кислоты могут быть следующие соединения серы:
Практика показала, что при взаимодействии металла с концентрированной серной кислотой выделяется смесь продуктов восстановления, состоящая из H 2 S , S и SO 2. Однако, один из этих продуктов образуется в преобладающем количестве. Природа основного продукта определяется активностью металла: чем выше активность, тем глубже процесс восстановления серы в серной кислоте.
Взаимодействие металлов различной активности с концентрированной серной кислотой можно представить схемой:

Алюминий ( Al ) и железо ( Fe ) не реагируют с холодной концентрированной H 2 SO 4 , покрываясь плотными оксидными пленками, однако при нагревании реакция протекает.
Ag , Au , Ru , Os , Rh , Ir , Pt не реагируют с серной кислотой.
Концентрированная серная кислота является сильным окислителем, поэтому при взаимодействии с ней металлов, обладающих переменной валентностью, последние окисляются до более высоких степеней окисления, чем в случае с разбавленным раствором кислоты:
Fe 0 → Fe 3+ ,
Cr 0 → Cr 3+ ,
Mn 0 → Mn 4+ ,
Sn 0 → Sn 4+
Свинец ( Pb ) окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца Pb ( HSO 4 )2 .
Реакция металлов с соляной кислотой: признак взаимодействия цинка, железа и меди
Известно доказанный факт, что соляная кислота взаимодействует с активными металлами. При этом часть веществ способна реагировать на такое соединение, другая часть остается нетронутой.
Неактивные металлы не могут реагировать на вещество: к ним относят золото, серебро, ртуть.
Соляная кислота представляет собой соединение хлора и водорода. Путем растворения в воде газообразного вещества под названием хлороводород получается данное соединение.
Ионы водорода при таком уравнении исполняют роль окислителя, что вызывает реакцию у активных металлов.
Какие вещества вступают в реакцию с соляной кислотой
На вступительных экзаменах по химии часто можно встретить задание на определение веществ, которые способны реагировать на соляную кислоту.
Кроме того, задание «составьте уравнение» нередко вызывает страх в глазах выпускников.
Чтобы не путаться с химическими задачами, рекомендуется подробнее изучить информацию о взаимодействии с данным соединением.
Все существующие вещества можно поделить на металлы, вытесняющие водород из соединения, не вытесняющие водород, а также активные и неактивные металлы.

В реакцию с соляной кислотой вступают такие вещества:
- Химические основания. Соляная кислота способна нейтрализовать основания. Как известно, они состоят из атома металла, на который и воздействует кислота.
Кроме перечисленных веществ и соединений, HCl также способна реагировать на нитрат серебра – при таком взаимодействии образуется осадок белого цвета творожистого типа.
Признак взаимодействия с цинком, железом и другими металлами
Если курс школьной химии был успешно забыт, можно вспомнить о том, какие бывают признаки взаимодействия металлов, вступающих в реакцию с соляной кислотой.
Чтобы экспериментальные опыты не вызвали несчастного случая, рекомендуется заранее открыть все окна, вооружиться защитной одеждой, чтобы кожа рук была закрыта.
Также рекомендуется использовать перчатки и повязку на лицо.
Обратите внимание! Ниже будет рассказано о том, какие признаки говорят о вступлении в реакцию элементов с соединением.
Чтобы не проводить наглядные опыты, можно воспользоваться теоретической информацией.

Рассмотрим, что происходит, если добавить немного кислоты на определенный вид металла:
| Металл | Признак взаимодействия |
| Цинк | Если опустить этот металл серебристого цвета в пробирку с указанным веществом, можно постепенно наблюдать выделение небольшого количества пузырьков и водорода. |
Как составить уравнение реакции
Одно из самых распространенных заданий на экзаменах и в контрольных работах – составить уравнение на реакцию HCl, в данном случае – соляной, с другими веществами или соединениями.

Чтобы не запутаться в решении, предлагаем несколько советов и шпаргалок для легкого запоминания:
- Запомните буквенное обозначение данного вещества – соляная кислота в химии обозначается как HCl: если вещество разбавленное, это указывается в скобках рядом.
- Как уже было сказано выше, вещество способно реагировать с активными металлами, стоящими до водорода в электрохимическом ряду; кроме того, она реагирует на основания, оксиды, гидроксиды и карбонаты.
- Химические основания обозначаются как OH, оксиды – O, гидроксиды – OH2, карбонаты – CO3.
- Уравнение реакции всегда будет иметь знак +, потому как в процессе взаимодействия происходит соединение нескольких компонентов.
- HCl может идти первым или вторым слагаемым, после прибавления металла, вещества идет знак =, после этого описывается реакция, где указаны продукты распада.
- Например, при реакции кислоты серы с сульфатом магния получается такое уравнение: Mg+H2SO4 = MgSO4+H2.
- Соляная кислота и гидроксид бария дают такое уравнение: 2HCl + Ba(OH)2 = BaCl2 + 2H2O.
- При реакции соединения водорода, хлора и мела образуется хлорид кальция: СаСО3 + 2HCl = CaCl2 + СО2 + Н2О.
- Раствор карбоната натрия с кислотой выглядит так: HCl+Na2CO3=2NaCl+H2O+CO2.
Составить уравнение несложно, важно изначально правильно обозначить буквенные символы каждого элемента или вещества.
Важно! Необходимо правильно определить коэффициенты атомов в уравнении – их количество до знака = должно быть таким же, как и после знака =.
Для правильного уравновешивания формулы пользуются правилами школьного курса химии, основанными на математическом принципе расстановки коэффициентов.

Тема 31. Реакции замещения.
1. Признаки реакций замещения:
- вступают в реакцию два вещества – простые и сложные;
- образуются в результате реакции также два вещества – новое простое и новое сложное.
2. Два правила ряда активности металлов:

-металлы, стоящие в ряду активности до H2, вытесняют его из растворов кислот;
- металлы, стоящие в ряду активности до металла соли, вытесняют его из растворов солей.
1. Запишите уравнения реакций замещения.
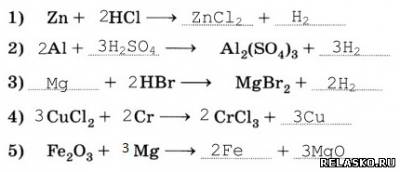
2. Запишите уравнения возможных реакций.
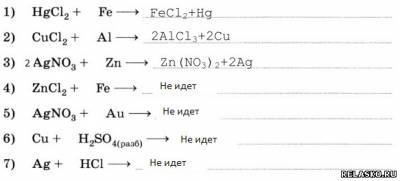
3. Напишите уравнения реакций замещения:

4. Допишите уравнение реакции
Дайте характеристику записанной реакции по следующим признакам:
1) число и состав исходных веществ и продуктов реакции – замещение;
2) тепловой эффект – экзотермическая;
3) направление протекания – необратимая;
4) участие катализатора – некаталитическая.
5. 39 г технического цинка, содержащего 20% примесей, растворили в избытке соляной кислоты. Найдите объём полученного водорода (н. у.) и количество вещества соли.

6. Железо массой 1,12 г полностью прореагировало с раствором сульфата меди (II). Найдите массу образовавшегося осадка меди. Какое количество вещества сульфата железа (III) при этом получилось?

7. Придумайте рисунки «Взаимодействие различных металлов с соляной кислотой» и «Взаимодействие различных кислот с цинком», иллюстрирующие зависимость скорости протекания реакций от природы металла и кислоты.
1. Признаки реакций обмена:
- вступают в реакцию два сложных вещества;
- образуются в результате реакции два новых сложных вещества.
2. Условия протекания реакции обмена до конца:
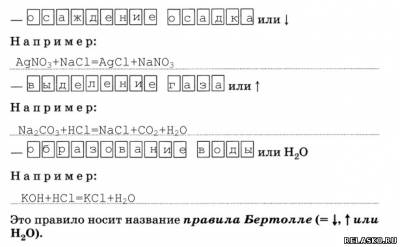
3. Частный случай реакций обмена – это реакция между щёлочью и кислотой, которая носит название реакции нейтрализации.
Например: NaOH+HCl=NaCl+H2O
1. Запишите уравнения реакций обмена между:

2. Составьте уравнения реакций, идущих до конца.
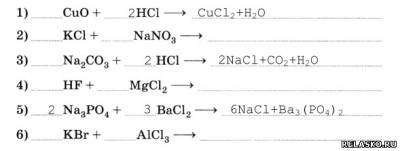
3. Напишите уравнения реакций обмена, протекающих:

4. Установите соответствие между типом и уравнением химической реакции.
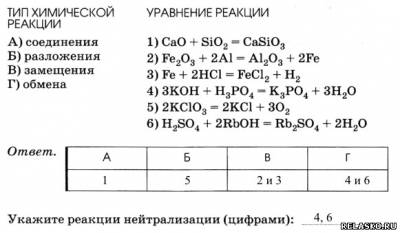
5. Определите массу соли и количество вещества воды, полученных при взаимодействии гидроксида меди (II) с 58,8 г серной кислоты.

6. Запишите уравнения реакций со следующими продуктами:

7. Запишите уравнения 3-4 реакций обмена, в результате которых образуется сульфат железа (II).

1. Реакции разложения воды:
- под действием электрического тока называют электролизом;
- под действием света называют фотолизом.
Уравнение реакции: 2Н2О = 2Н2 + О2
2. Реакции соединения воды с оксидами:
металлов идут с образованием щелочей, например: неметаллов идут с образованием кислоты, например:3. Реакции замещения водорода в молекуле воды на металл идут с образованием щёлочи:
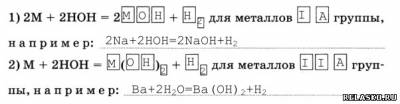
4. Реакции обмена — это реакции разложения веществ водой, или реакции гидролиза, например:
1. «Химическим антонимом» реакции разложения воды является её синтез из соответствующих простых веществ. Напишите уравнение этого процесса:
Придумайте и решите задачу, если известен объём одного из исходных веществ (н. у.), а требуется найти массу воды.
При взаимодействии 11,2 л углекислого газа с гидроксидом натрия, образовались соль и вода. Найти массу воды.

2. Запишите уравнения возможных реакций соединения с водой:
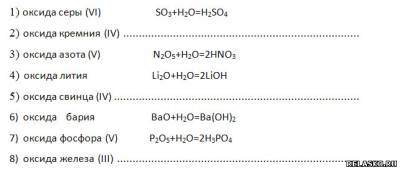
Распределите образовавшиеся гидроксиды на две группы.

3. Запишите уравнения реакций замещения с водой:

4. Запишите уравнения реакций гидролиза:

5. Запишите название продуктов гидролиза органических веществ, используя свои знания по теме «Пищеварительная система» из курса биологии.
1) Белки + вода→аминокислота.
2) Крахмал + вода→глюкоза.
3) Жиры + вода→глицерин + оксокислота.
6. Найдите массу фосфорной кислоты, которая образуется при растворении в воде 2,5 моль оксида фосфора (V).

7. Найдите массу щёлочи, которая образуется при растворении в воде 1,5 моль натрия.

1. Растворы — это гомогенные смеси, состоящие из 2 или более однородных частей, то есть частиц растворённого вещества, растворителя и продуктов их взаимодействия.
2. Две точки зрения на растворы и растворение.
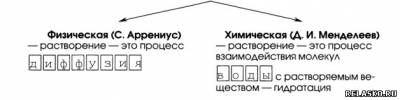
3. Гидратация — это взаимодействие молекул вещества с водой.
Кристаллогидраты — это соли, в состав которых входит вода.
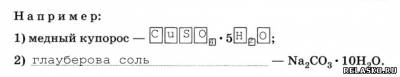
4. Различают растворы
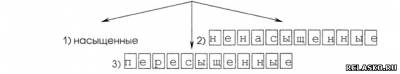
Дайте определение каждого типа растворов.
1) раствор, в котором при данной температуре вещество больше не растворяется.
2) раствор, в котором при данной температуре меньше раств. вещества, чем в насыщенном.
3) раствор, в котором больше вещества, чем в насыщенном.
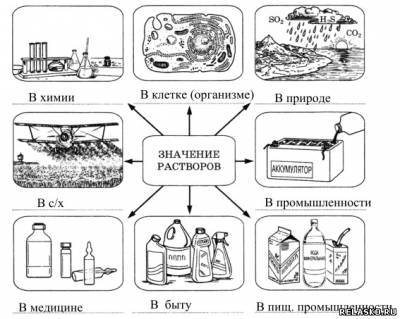
1. Подпишите схему «Значение растворов».
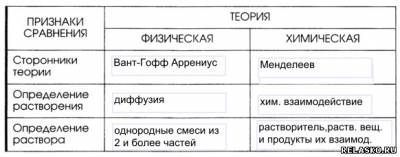
2. Заполните таблицу «Теории растворов».
3. Сформулируйте основные положения физико-химической теории растворов, которая принята в настоящее время.
1) При добавлении соли в воду происходит процесс химического взаимодействия.
2) В растворе одновременно находятся и растворённое вещество, и растворитель, и продукты их взаимодействия.
3) Растворение также процесс, в результате которого имеют место и тепловые явления.
4. Составьте формулы кристаллогидратов.

5. Заполните текст формулами и названиями соединений, числовыми значениями.
Примечание. Воспользуйтесь данными графиков растворимости веществ (см. рис. 126 в учебнике) и таблицей растворимости.

6. Установите соответствие между действием, которое нужно совершить для получения раствора, и типом раствора. Из букв, соответствующих правильным ответам, вы составите название раствора сахара в воде: сироп.
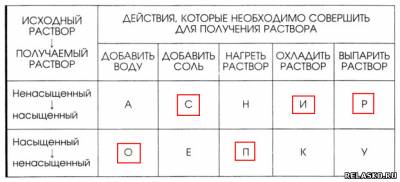
7. Растворимость хлорида калия в воде при 60 °С равна 50 г. Определите массовую долю соли в растворе, насыщенном при указанной температуре.

8. По графику (см. рис. 126 в учебнике) определите растворимость сульфата калия при 80 °С. Рассчитайте массовую долю соли в растворе, насыщенном при указанной температуре.

9. Навеску 161 г глауберовой соли Na2S04 • ЮН20 растворили в 180 л воды. Вычислите массовую долю сульфата натрия в полученном растворе. Сколько ионов каждого вида в нём находится?

10. Заполните таблицу «Научные достижения Д. И. Менделеева и С. Аррениуса».
Химические свойства кислот
От производства лекарств до приготовления пищи — кислоты помогают человеку во многих областях жизни. В этом материале мы рассмотрим типичные свойства и реакции кислот с другими химическими веществами.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами.
Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
Реакция не проходит
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
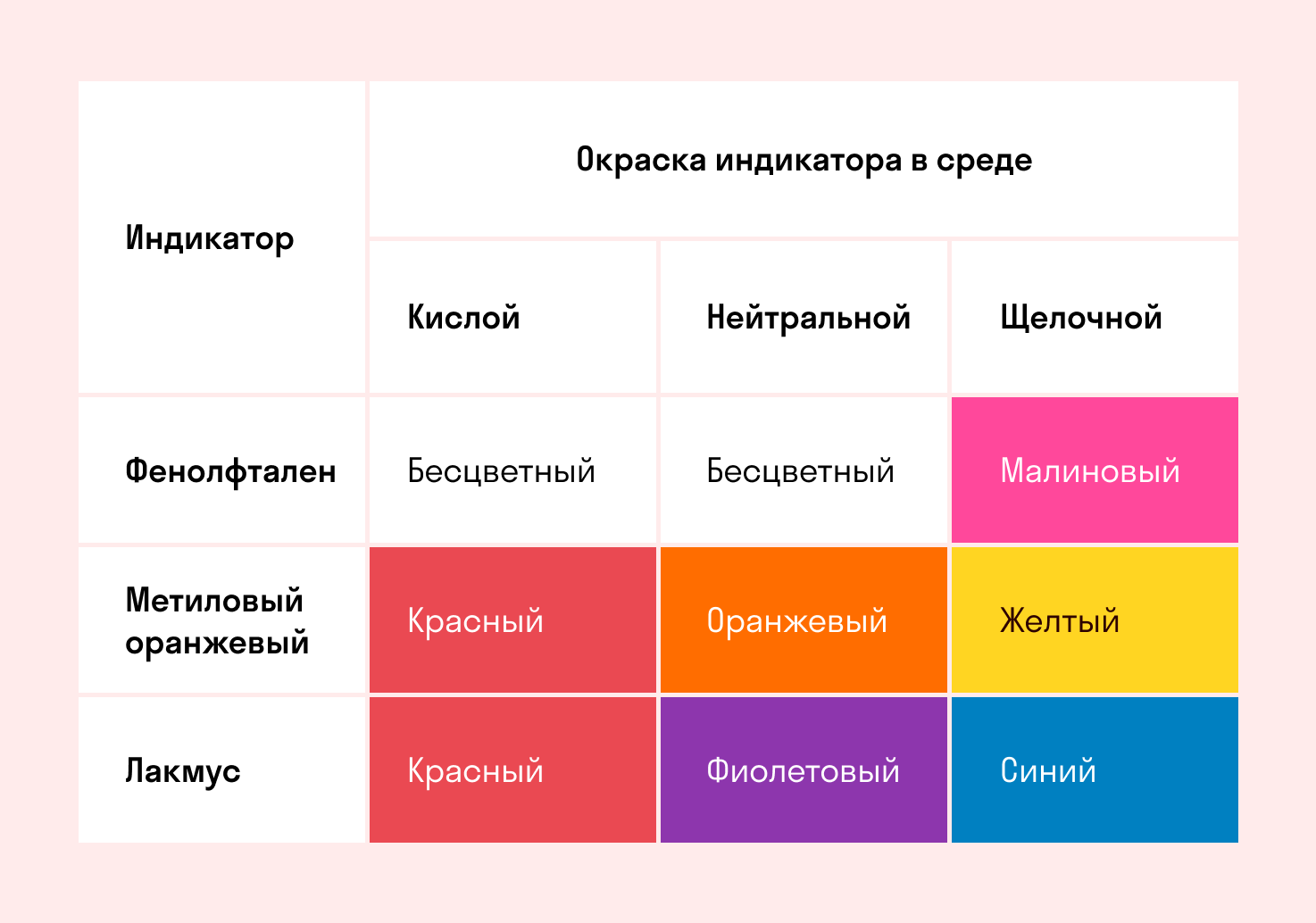
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Читайте также:
