Взаимодействие щелочных и щелочноземельных металлов с водой
Обновлено: 20.05.2024
У атомов ЩМ на внешнем электронном уровне находится только один электрон на s-подуровне, легко отрывающийся при протекании химических реакций. При этом из нейтрального атома ЩМ образуется положительно заряженная частица – катион с зарядом +1:
Семейство ЩМ является наиболее активным среди прочих групп металлов в связи с чем в природе обнаружить их в свободной форме, т.е. в виде простых веществ невозможно.
Простые вещества щелочные металлы являются крайне сильными восстановителями.
Взаимодействие щелочных металлов с неметаллами
с кислородом
Щелочные металлы реагируют с кислородом уже при комнатной температуре, в связи с чем их требуется хранить под слоем какого-либо углеводородного растворителя, такого как, например, керосина.
Взаимодействие ЩМ с кислородом приводит к разным продуктам. С образованием оксида, с киcлородом реагирует только литий:
Натрий в аналогичной ситуации образует с кислородом пероксид натрия Na2O2:
а калий, рубидий и цезий – преимущественно надпероксиды (супероксиды), общей формулы MeO2:
с галогенами
Щелочные металлы активно реагируют с галогенами, образуя галогениды щелочных металлов, имеющих ионное строение:
2Li + Br2 = 2LiBr бромид лития
2Na + I2 = 2NaI иодид натрия
2K + Cl2 = 2KCl хлорид калия
с азотом
Литий реагирует с азотом уже при обычной температуре, с остальными же ЩМ азот реагирует при нагревании. Во всех случаях образуются нитриды щелочных металлов:
с фосфором
Щелочные металлы реагируют с фосфором при нагревании, образуя фосфиды:
3Na + P = Na3Р фосфид натрия
3K + P = K3Р фосфид калия
с водородом
Нагревание щелочных металлов в атмосфере водорода приводит к образованию гидридов щелочных металлов, содержащих водород в редкой степени окисления – минус 1:
Н2 + 2K = 2KН -1 гидрид калия
Н2 + 2Rb = 2RbН гидрид рубидия
с серой
Взаимодействие ЩМ с серой протекает при нагревании с образованием сульфидов:
S + 2Na = Na2S сульфид натрия
Взаимодействие щелочных металлов со сложными веществами
с водой
Все ЩМ активно реагируют с водой с образованием газообразного водорода и щелочи, из-за чего данные металлы и получили соответствующее название:
2HOH + 2Na = 2NaOH + H2↑
2K + 2HOH = 2KOH + H2↑
Литий реагирует с водой довольно спокойно, натрий и калий самовоспламеняются в процессе реакции, а рубидий, цезий и франций реагируют с водой с мощным взрывом.
с галогенпроизводными углеводородов (реакция Вюрца):
со спиртами и фенолами
ЩМ реагируют со спиртами и фенолами, замещая водород в гидроксильной группе органического вещества:
Щелочноземельные металлы
В периодической системе элементов металлы в основном располагаются в главных подгруппах I—Ill групп, а также в побочных подгруппах.
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s 1 , во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s 2 . Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s 2 p 1 . Они относятся к p-элементам.
В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.
Оксиды типа R2O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R2O2, которые являются сильными окислителями.
Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.

Физические свойства
В свободном состоянии все металлы – серебристо-белые вещества. Магний и щелочноземельные металлы – ковкие и пластичные, довольно мягкие, хотя тверже щелочных. Бериллий отличается значительной твердостью и хрупкостью, барий при резком ударе раскалывается.
В кристаллическом состоянии при обычных условиях бериллий и магний имеют гексагональную кристаллическую решетку, кальций, стронций – кубическую гранецентрированную кристаллическую решетку, барий – кубическую объемоцентрированную кристаллическую решетку с металлическим типом химической связи, что обуславливает их высокую тепло- и электропроводность.
Металлы имеют температуры плавления и кипения выше, чем у щелочных металлов, причем с увеличением порядкового номера элемента температура плавления металла изменяется немонотонно, что связано с изменением типа кристаллической решетки.
Бериллий и магний покрыты прочной оксидной пленкой и не изменяются на воздухе. Щелочноземельные металлы очень активны, их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Некоторые физические свойства бериллия, магния и щелочно-земельных металлов приведены в таблице.
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см 3 .
Химические свойства щелочных металлов
| Свойство | Be | Mg | Ca | Sr | Ba |
| Плотность, кг/м 3 | |||||
| Температура плавления,°С | |||||
| Температура кипения,°С |
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
4. Взаимодействие с кислотами – сильными окислителями
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности.
| РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ | |
| NaOH | Едкий натр (каустическая сода) |
| NaCl | Поваренная соль |
| NaNO3 | Чилийская селитра |
| Na2SO4∙10H2O | Глауберова соль |
| Na2CO3∙10H2O | Сода кристаллическая |
| KOH | Едкое кали |
| KCl | Хлорид калия (сильвин) |
| KNO3 | Индийская селитра |
| K2CO3 | Поташ |
Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов
Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
Щелочные и щелочноземельные металлы

Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Общее описание
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
Электронная конфигурация щелочных металлов – ns 1 , щелочноземельных металлов – ns 2 .
Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II. За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях. Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Физические свойства
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.

Рис. 2. Разрезание натрия ножом.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см 3 ).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Химические свойства
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
Взаимодействие
Щелочные металлы
Щелочноземельные металлы
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида.
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются.
Реагируют при нагревании с серой, водородом, фосфором:
С азотом реагирует только литий, с углеродом – литий и натрий:
Реагируют при нагревании:
Бурно реагируют с образованием галогенидов:
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются.
Менее активно, чем щелочные металлы, реагируют при комнатной температуре:
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли.
Из всех металлов реагирует только бериллий:
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы:
2Mg + ZrO2 → Zr + 2MgO

Рис. 3. Реакция калия с водой.
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Что мы узнали?
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются. Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы. Со щелочами реагирует только бериллий .
Химические свойства щелочных и щелочноземельных металлов

Химические свойства щелочных и щелочноземельных металлов схожи. На внешнем энергетическом уровне щелочных металлов находится один электрон, щелочноземельных – два. При реакциях металлы легко расстаются с валентными электронами, проявляя свойства сильного восстановителя.
Щелочные
В I группу периодической таблицы входят щелочные металлы:
Они отличаются мягкостью (можно разрезать ножом), низкими температурами плавления и кипения. Это наиболее активные металлы.
Химические свойства щелочных металлов представлены в таблице.
Реакция
Особенности
Уравнение
Быстро окисляются на воздухе. Литий образует оксид при температуре выше 200°C. Натрий образует смесь – 80 % пероксида (R2O2) и 20 % оксида. Остальные металлы образуют надпероксиды (RO2)
Реагирует только литий при комнатной температуре
Реакция проходит бурно
При нагревании. Образуют сульфиды, гидриды, фосфиды, силициды. С углеродом реагируют только литий и натрий, образуя карбиды
Спокойно реагирует только литий. Натрий горит жёлтым пламенем. Калий реагирует со вспышкой. Цезий и рубидий взрываются
С соляной, фосфорной, разбавленной серной кислотами реагируют с взрывом. При реакции с концентрированной серной кислотой выделяется сероводород, с концентрированной азотной кислотой образует оксид азота (I), с разбавленной азотной кислотой – азот
– 2Na + 2HCl → 2NaCl + H2;
Могут реагировать с органическими кислотами и спиртами.
Щелочноземельные
Во II группе таблицы Менделеева находятся щелочноземельные металлы:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
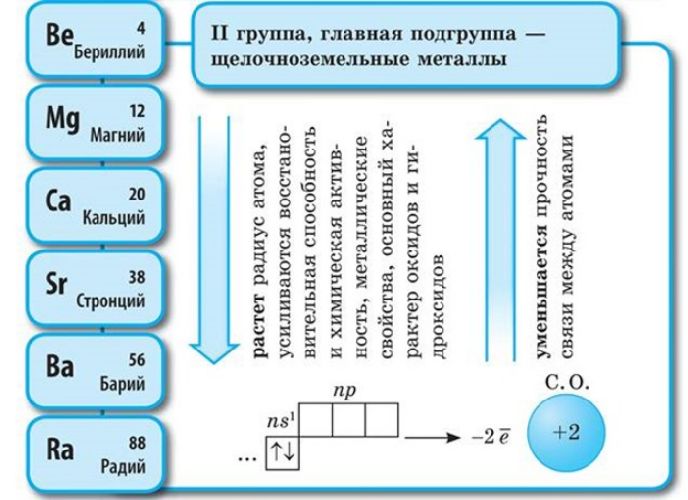
Рис. 2. Щелочноземельные металлы.
В отличие от щелочных металлов они более твёрдые. Ножом можно разрезать только стронций. Наиболее плотный металл – радий (5,5 г/см 3 ).
Бериллий взаимодействует с кислородом только при нагревании до 900°С. С водородом и водой не реагирует при любых условиях. Магний окисляется при температуре 650°С и взаимодействует с водородом под высоким давлением.
В таблице отражены основные химические свойства щелочноземельных металлов.
Образуют оксидные плёнки. При нагревании до 500°С самовоспламеняются
При высокой температуре образуют гидриды
С галогенами и неметаллами
Реагируют при нагревании
При комнатной температуре
Реагируют все металлы с образованием солей
Реагирует только бериллий
Замещают менее активные металлы в оксидах. Исключение – бериллий
Ионы щелочных и щелочноземельных металлов в солях легко обнаружить по изменению цвета пламени. Соли натрия горят жёлтым пламенем, калия – фиолетовым, рубидия – красным, кальция – кирпично-красным, бария – жёлто-зелёным. Соли этих металлов используют для создания фейерверков.
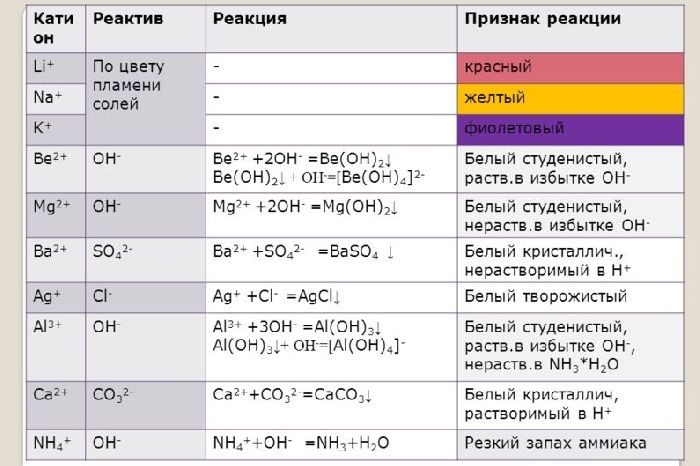
Рис. 3. Качественная реакция.
Щелочные и щелочноземельные металлы – активные элементы периодической таблицы, вступающие в реакции с простыми и сложными веществами. Щелочные металлы более мягкие, бурно реагируют с водой и галогенами, легко окисляются на воздухе, образуя оксиды, пероксиды, надпероксиды, взаимодействуют с кислотами и аммиаком. При нагревании вступают в реакцию с неметаллами. Щелочноземельные металлы реагируют с неметаллами, кислотами, водой. Бериллий не взаимодействует с водородом и водой, но реагирует со щелочами и с кислородом при высокой температуре.
Читайте также:
