Взаимодействие уксусной кислоты с металлами уравнение
Обновлено: 18.05.2024
Цель работы: Получить уксусную кислоту и изучить её свойства.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.
Ход работы: Внимание. Работа с кислотами!! Соблюдайте ТБ!
Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:

Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не собёрётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Опыт 2. Взаимодействие уксусной кислоты с металлами.
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.
Опыт 3. Взаимодействие уксусной кислоты с основаниями.
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю фенолфталеина. Что наблюдаете? Почему?
Затем добавьте к содержимому пробирки уксусную кислоту. Почему происходит обесцвечивание? Запишите УХР, назовите продукты.
Опыт 4. Взаимодействие уксусной кислоты с солями слабых неорганических кислот.
В пробирку налейте 1 мл карбоната натрия и по каплям добавьте уксусную кислоту. Что наблюдаете? Почему?
Запишите УХР, назовите продукты.
Опыт 5 Моющая способность мыла
5.1) Налейте в пробирку 2—3 мл раствора мыла и прибавьте к нему соляной кислоты до образования хлопьев. Что собой представляет этот осадок? Составьте уравнение реакции. Проверьте, растворяется ли осадок в растворе щелочи. Объясните это явление.
5.2) К 2—3 мл раствора мыла в пробирке прилейте раствор хлорида кальция. Что наблюдаете? Напишите уравнение реакции. Какое свойство мыла иллюстрируется данным опытом?
Оформите работу в виде таблицы
Название опыта. Что делали.
УХР. Наблюдения. Выводы
Сделайте общий вывод о проделанной работе.
Опыт 1 . Получение уксусной кислоты.
В пробирку поместили немного ацетата натрия и добавили раствор H2SO4 (1:1). Пробирку закрыли пробкой с газоотводной трубкой, конец которой поместили в другую, чистую пробирку.

Исходную пробирку нагрели. Наблюдаем конденсацию уксусной кислоты в приемнике, чувствуется резкий характерный запах уксусной кислоты.
Опыт 2 . Растворимость карбоновых кислот в воде
В одну пробирку налили 2 мл воды и добавили 3 капли уксусной кислоты, полученный раствор перемешали. В другую пробирку налили 2 мл воды и добавили чуть-чуть бензойной кислоты, содержимое перемешали, бензойная кислота в воде не растворилась. Тогда эту пробирку нагрели. Наблюдаем растворение бензойной кислоты. После охлаждения пробирки осадок вновь выпадает. Прибавили к осадку немного раствора гидроксида натрия. Наблюдаем вновь растворение осадка.

Различие растворимостей кислот объясняется природой вещества.
Опыт 3 . Взаимодействие уксусной кислоты с металлами
В пробирку налили немного уксусной кислоты и добавили 1 гранулу цинка. Пробирку нагрели. Наблюдаем выделение пузырьков газа водорода и растворение гранулы цинка.



Полученную кислоту разделили на 2 части. В первую пробирку поместили лакмусовую бумажку, наблюдаем ее покраснение. Затем прильем немного раствора гидроксида натрия. Помещенная в полученный раствор лакмусовая бумажка синеет. Во вторую пробирку добавили немного порошка магния, наблюдаем выделение газа.
Все кислоты, как органические, так и неорганические реагируют с металлами, стоящими в ряду напряжений до водорода. С металлами, стоящими после водорода, кислоты не будут реагировать, в том числе и уксусная кислота.
Опыт 4 . Получение сложного эфира
В пробирку налили 2 мл изоамилового спирта, 2 мл уксусной кислоты и чуть-чуть концентрированной серной кислоты. Пробирку закрыли пробкой с газоотводной трубкой и нагрели на водяной бане. После охлаждения в пробирку добавили немного воды. При этом выделяется слой изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции, произошла реакция этерификации.

В реакционную смесь добавляют концентрированную серную кислоту, как водоотнимающее средство, чтобы сместить равновесие вправо.
Опыт 5. Взаимодействие уксусной кислоты с оксидами металлов.

В пробирку с уксусной кислотой добавили немного оксида кальция, наблюдаем его растворение.
Опыт 6. Взаимодействие муравьиной кислоты с с аммиачным раствором оксида серебра.
4. При прилипании в пробирку с аммиачным раствором муравьиной кислоты, смесь нагрели.

Наблюдаем образование налета серебра на стенках пробирки и выделение газа. Муравьиная кислота окисляется оксидом серебра.
Опыт 7. Моющая способность мыла
В пробирку с водой добавили стружек хозяйственного мыла и нагрели. К полученному мыльному раствору добавили раствор НСl. Наблюдаем образование хлопьев:
7. При добавлении к мыльному раствору раствора СаСl наблюдаем образование хлопьев:
Эта реакция иллюстрирует, что моющая способность мыла уменьшается в жесткой воде.
8. При приливании в пробирку с олеиновой кислотой (растительным маслом) бромной воды наблюдаем ее обесцвечивание – признак не предельности.
Презентация Лабораторная работа Карбоновые кислоты- химические свойства

Лабораторная работа №5
Химические свойства карбоновых кислот.

Перед началом эксперимента внимательно ознакомьтесь с инструкциями

Цель работы: Объяснить химические свойства карбоновых кислот.
Реактивы и оборудование: ацетат натрия, серная кислота (конц.), уксусная кислота, магний (порошок), цинк, гидроксид натрия, карбонат натрия, фенолфталеин, универсальная индикаторная бумага, прибор для получения и собирания кислоты, спиртовка, пробирку, вата, спички.

Сделайте общий вывод о проделанной работе.

Опыт 1. Получение уксусной кислоты.
В пробирку с ацетатом натрия прибавить 1- 2 мл концентрированной серной кислоты. Закрыть пробирку пробкой с газоотводной трубкой, конец которой опустите в другую пробирку вход в пробирку прикрыть ваткой, смотрите рисунок:
Смесь в пробирке осторожно нагревайте до тех пор, пока в приёмнике – пробирке не собёрётся 1 -2 мл жидкости. Прекратите нагревание, закройте спиртовку.
Опустите в пробирку с образовавшейся жидкости универсальную индикаторную бумагу. Как изменился цвет индикатора? Почему? Запишите уравнение диссоциации уксусной кислоты.
Опишите запах, образовавшейся жидкости? Соблюдайте осторожность при определении запаха! Составьте уравнение данной химической реакции.
Ход работы

Собрали прибор, как это показано на рисунке.
В пробирку поместили немного ацетата натрия и добавили рас-
твор H2SO4 (1:1). Пробирку закрыли пробкой с газоотводной
трубкой, конец которой поместили в другую, чистую пробирку.
Исходную пробирку нагрели.
Наблюдаем конденсацию уксусной
кислоты в приемнике, чувствуется резкий характерный запах
уксусной кислоты.

Опыт 2б. Взаимодействие уксусной кислоты с металлами.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с металлами»
В одну пробирку положите гранулу цинка, в другую порошок магния. В обе пробирки прилейте 1 мл уксусной кислоты. Что наблюдаете? Сравните скорость этих реакций? Запишите соответствующие уравнения химических реакций, назовите продукты, укажите тип реакции.

Во вторую пробирку добавили немного порошка магния, наблюдаем выделение газа. Составьте уравнение в молекулярном и ионном виде, назовите продукты реакции.
Взаимодействие уксусной кислоты с металлами
Уксусной кислоте, как и неорганическим кислотам, присущи общие свойства кислот. Убедимся в том, что эта кислота способна реагировать с металлами. В две пробирки поместим кусочки магния и цинка. Прильем к ним раствор уксусной кислоты. В пробирке с магнием идет энергичная реакция – выделяется водород. В пробирке с цинком, менее активным металлом, выделение водорода едва заметно.
2СН3СООН + Мg = H2 + ( CH3COO)2 Mg
2СН3СООН + Zn = H2 + ( CH3COO)2 Zn
При взаимодействии металлов с раствором уксусной кислоты образуется водород и соли уксусной кислоты. Соли уксусной кислоты называются ацетатами.
Оборудование: штатив для пробирок, пробирка, горелка, зажим для пробирок.
Техника безопасности. Соблюдать правила работы с кислотами.

Опыт 2а. Свойства карбоновых кислот.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с основаниями»
В пробирку налейте 1 мл гидроксида натрия и добавьте 1 каплю лакмуса.
Что наблюдаете?
Почему?
Почему происходит
обесцвечивание?
Запишите УХР,
назовите продукты.

Полученную кислоту разделили на 2 части. В первую пробирку
поместили лакмусовую бумажку, наблюдаем ее покраснение. (кислая среда) Затем прильем немного раствора гидроксида натрия. Помещенная в полученный раствор лакмусовая бумажка синеет (щелочная среда).

Опыт 2в. Взаимодействие уксусной кислоты с солями слабых неорганических кислот.
Посмотрите видео-опыт «Взаимодействие уксусной кислоты с карбонатом натрия»
В пробирку налейте 1 мл карбоната натрия и по каплям добавьте уксусную кислоту. Что наблюдаете? Почему?
Запишите УХР, назовите продукты.
1).Na2CO3 + 2 CH3COOH ---> 2CH3COONa + H2O + CO2
2Na(+) + CO3(-2) + 2 CH3COO(-) +2H(+) ---> 2CH3COO(-) +2Na(+) + H2O + CO2 CO3(-2) +2H(+) ---> H2O + CO2

1).Na2CO3 + 2 CH3COOH ---> 2CH3COONa + H2O + CO2
2Na(+) + CO3(-2) + 2 CH3COO(-) +2H(+) ---> 2CH3COO(-) +2Na(+) + H2O + CO2 CO3(-2) +2H(+) ---> H2O + CO2
Уксусная кислота – слабая кислота, однако она способна вытеснять более слабые кислоты из их солей, например, из солей угольной кислоты. Приготовим пробирку с раствором карбоната натрия, приливаем уксусную кислоту, начинается реакция с выделением углекислого газа, так как в растворе появилась угольная кислота. Она неустойчива и разлагается на углекислый газ и воду. Уксусная кислота вытеснила угольную кислоту из ее соли.

Опыт 3. Получение уксусно- этилового эфира
Посмотрите видео-опыт «Получение уксусно- этилового эфира»
В пробирку налейте 1 мл уксусной кислоты ,этилового спирта и концентрированной серной кислоты .Пробирку закрываем газоотводной трубкой, смесь нагреваем . Что наблюдаете? Почему? Обратите внимание на запах.
Запишите УХР, назовите продукты.

Проведем реакцию этерификации в приборе для получения галоидоалканов. В реакционную колбу поместим этиловый спирт, уксусную кислоту и концентрированную серную кислоту. Серная кислота используется как водоотнимающее средство. Так как реакция этерификации обратима, необходимо удалять воду. В холодильник нальем насыщенный раствор поваренной соли. В этом растворе растворимость эфира минимальна. При нагревании смеси образуется летучий уксусноэтиловый эфир.
Он конденсируется в холодильнике. Он легче воды и раствора соли. Поэтому он образует верхний слой жидкости. Для лучшей видимости прибавим в холодильник подкрашенную воду. Эфир растворяет краситель, и верхний слой становится хорошо заметен.
СН3СООН + С2Н5ОН = H2О + CH3COOС2Н5
Оборудование: прибор для получения галоидоалканов, штатив, горелка, огнезащитная прокладка, мерный цилиндр, мерная пробирка, 1 – электронагреватель; 2 – колба круглодонная; 3 – ловушка Дина - Старка; 4 – холодильник Либиха.

УРОК ОКОНЧЕН
СПАСИБО ЗА УРОК
Краткое описание документа:
Лабораторная работа для СПО
Химические свойства Карбоновых кислот
1. Перечислите способы применения уксусной, стеариновой кислот и метаналя (формальдегида).
2. Что образуется при окислении альдегидов?
3. Почему при взаимодействии альдегидов с гидрокисдом меди (II) появляется желтый, а затем красный осадок? Напишите уравнения соответствующих реакций.
4. Как называется реакция взаимодействия альдегидов с оксидом серебра (I) и с гидроксидом меди? Напишите соответствующие реакции.
5. Как уксусная кислота реагирует с магнием и цинком? Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
6. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот? Изобразите электронную формулу уксусной кислоты (с пояснениями, как происходит перекрывание и сдвиг электронных облаков при образовании химических связей в карбоксильной группе).
- Цель работы, рабочее задание
- Порядок проведения опытов
- Химические реакции, подтверждающие опыты
- Выводы
- Ответы на контрольные вопросы
Рабочие листы и материалы для учителей и воспитателей
Более 3 000 дидактических материалов для школьного и домашнего обучения
Лабораторный опыт 3 ГДЗ Рудзитис Фельдман 10 класс (Химия)
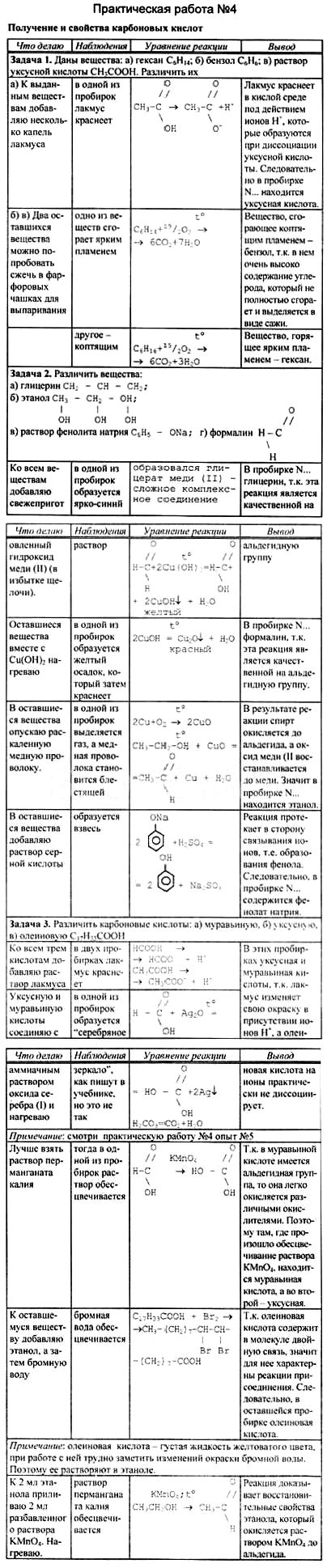
1. Получение уксусной кислоты. Поместите в пробирку 2—Зг ацетата натрия и прибавьте 1,5—2 мл концентрированной серной кислоты. Пробирку закройте пробкой с газоотводной трубкой, конец которой опустите в другую пробирку (рис. 31). Смесь нагревайте на пламени до тех пор, пока в пробирке-приемнике не будет 1,0—1,5мл жидкости.
1. Какое вещество образовалось в пробирке-приемнике? Какие свойства уксусной кислоты это подтверждают? 2. Составьте уравнение соответствующей реакции.
2. Взаимодействие уксусной кислоты с некоторыми металлами. B две пробирки налейте по 1 мл раствора уксусной кислоты.
B первой пробирке происходит бурная реакция, а во второй реакция протекает спокойно (иногда она начинается только при нагревании).
Задание для самостоятельного вывода. Как уксусная кислота реагирует с магнием и цинком? Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
3. Взаимодействие уксусной кислоты с основаниями. Налейте в пробирку 1 — 1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавлении уксусной кислоты малиновая окраска фенолфталеина исчезает.
4. Взаимодействие уксусной кислоты со спиртами. B пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл изоамилового спирта. Затем осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте на водяной бане.
После охлаждения добавьте к содержимому пробирки несколько миллилитров воды. При этом образуются маслянистые капли нерастворимого в воде изоамилового эфира уксусной кислоты с характерным запахом грушевой эссенции.
Задания для самостоятельных выводов. 1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот? 2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями? При помощи каких опытов это можно доказать? 3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами? Напишите уравнение соответствующей реакции.
5. Окисление муравьиной кислоты оксидом cepe6pa(l). B чистую пробирку налейте 2 мл свежеприготовленного раствора с массовой долей нитрата cepe6pa(l) 0,02. Добавьте немного разбавленного раствора аммиака до растворения появившегося осадка. Затем добавьте несколько капель муравьиной кислоты и пробирку со смесью нагрейте в колбе с горячей водой.
Задание для самостоятельного вывода. Почему из всех карбоновых кислот только для муравьиной кислоты характерна реакция «серебряного зеркала»? Напишите уравнение соответствующей реакции.
*Цитирирование задания со ссылкой на учебник производится исключительно в учебных целях для лучшего понимания разбора решения задания.
Химические свойства спиртов

Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
- слабые кислотные свойства, замещение водорода на металл;
- замещение группы ОН
- отрыв воды (элиминирование) – дегидратация
- окисление
- образование сложных эфиров — этерификация
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция практически не идет.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами. При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |

Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
Многоатомные спирты также реагируют с активными металлами:

1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
| Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, этанол реагирует с бромоводородом. |

Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами.
| Например, этиленгликоль реагирует с бромоводородом: |

2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |

2.3. Этерификация (образование сложных эфиров)
Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

Многоатомные спирты вступают в реакции этерификации с органическими и неорганическими кислотами.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием ацетата этиленгликоля: |

2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
| Например, глицерин под действием азотной кислоты образует тринитрат глицерина (тринитроглицерин): |
3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре (больше 140 о С) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
В качестве катализатора этой реакции также используют оксид алюминия.
| Отщепление воды от несимметричных спиртов проходит в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода. |
| Например, в присутствии концентрированной серной кислоты при нагревании выше 140 о С из бутанола-2 в основном образуется бутен-2: |
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации этанола при температуре до 140 о С образуется диэтиловый эфир: |

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
Продукты окисления многоатомных спиртов зависят от их строения. При окислении оксидом меди многоатомные спирты образуют карбонильные соединения.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, этанол окисляется оксидом меди до уксусного альдегида |
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
Третичные спирты окисляются только в жестких условиях.
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов, вторичные до кетонов, а метанол окисляется до метаналя.
| Например, при окислении пропанола-1 образуется пропаналь |

| Например, пропанол-2 окисляется кислородом при нагревании в присутствии меди до ацетона |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот, вторичные спирты окисляются до кетонов, метанол окисляется до углекислого газа.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
Третичные спирты окисляются только в жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов. При этом происходит разрыв углеродной цепи и могут образоваться углекислый газ, карбоновая кислота или кетон, в зависимости от строения спирта.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Первичный спирт R-СН2-ОН | R-COOH/ R-CHO | R-COOK/ R-CHO |
| Вторичный спирт R1-СНОН-R2 | R1-СО-R2 | R1-СО-R2 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |

| Например, при взаимодействии этанола с перманганатом калия в серной кислоте образуется уксусная кислота |

| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |

4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и первичных спиртов образуются альдегиды, при дегидрировании вторичных спиртов образуются кетоны.
Читайте также:






