Карбидная фаза в легированных сталях
Обновлено: 10.05.2024
атомного радиуса углерода к атомному радиусу металла меньше 0,59. В легированной стали эти фазы представлены карбидами TiC, NbC, ZrC, VC, Mo2C, W2C, WC.
Карбиды этой группы имеют сравнительно простую (обычно кубическую или гексагональную) кристаллическую решетку, построенную из ионов металлического элемента с внедренными в нее ионами углерода. Соответственно их называют фазами внедрения. Фазы внедрения обладают исключительно высокой температурой диссоциации— 1200° и более. Заметим, что к числу фаз внедрения относятся также нитриды и гидриды металлов переходных групп.
Природа фаз внедрения до настоящего времени еще окончательно не выяснена. На первый взгляд, можно было бы считать, что фазы внедрения представляют собой химические соединения, поскольку они возникают при определенном стехиометрическом составе, который может быть описан формулой, например, VC, TiC, WC, Mo2N, Zr4H и т. д.
С другой стороны, кристаллическое строение фаз внедрения исключает возможность их отнесения к категории обычных химических соединений. Действительно, химическое соединение в металлических сплавах имеет кристаллическую решетку, составленную из закономерно расположенных атомов или ионов, образующих соединение элементов. Между тем, кристаллическая решетка фаз внедрения совершенно отлична от решеток химических соединений и строится по принципу внедрения. В то же время фазы внедрения не могут считаться твердыми растворами внедрения обычного типа, поскольку кристаллическая решетка, составленная из ионов металлического элемента, отлична в большинстве случаев от решетки чистого металла.
На основании теоретических обобщений Я. С. Уманский предполагает, что водород, углерод и азот в фазах внедрения отдают часть своих валентных электронов недостроенной d-оболочке металлов переходных групп. Изменение энергетического состояния электронных оболочек металлов и растворения в них по типу внедрения ионов металлоидов приводит к созданию
огромных внутренних давлений. Между тем известно, что под влиянием высоких давлений у многих металлов возникают аллотропические превращения. Отсюда Я. С. Уманский делает вывод, что растворение металлоидов в металлах переходных групп сопровождается появлением таких высоких внутренних давлений (200 000—400 000 кг/см 2 ), в результате которых возникают аллотропические превращения. Фазы внедрения в этом случае представляют собой твердые растворы внедрения в новых аллотропических формах металлов-растворителей. Соответственно природе твердых растворов и особенностям ионизации атомов металлоидов в фазах внедрения действуют в основном силы металлической связи, что и определяет металлический характер их свойств (высокая электропроводность, положительный коэффициент электрического сопротивления и т. п.). Все карбиды способны в той или иной мере растворять отдельные металлические элементы. В частности, теперь уже известно, что карбид железа при комнатной температуре растворяет по типу замещения в неограниченной пропорции марганец, до 25% атомных Сг, до 2—3% Мо, до 0,8—1,0% W, до 0,5% V, сотые доли процента титана и, вероятно, ниобий и цирконий. Карбид марганца (МпзС) растворяет в неограниченной пропорции железо. Карбиды FезС и Мп3С полностью взаимно растворимы. Карбиды хрома обладают способностью растворять железо. Так, например, Сr7С3 растворяет при комнатной температуре до 55% Fe; Сг23С6 — до 35% Fe. Двойные карбиды Fe3Мо3С и Fe3W3C обладают широкой взаимной растворимостью. Кроме того, каждый из указанных карбидов способен растворять вольфрам и молибден.
Фазы внедрения обладают способностью растворять в широких пределах металлический компонент, что всегда сопровождается уменьшением параметров решеток. Отсюда можно сделать вывод, что твердые растворы металлических компонентов в фазах внедрения строятся по типу вычитания. Фазы внедрения, имеющие кристаллические решетки одинакового типа, взаимно растворимы. Так, например, определенной взаимной растворимостью отличаются TiC и VC, NbC и TiC, TiC и TiN и ряд других фаз. Соответственно, химический состав присутствующих в стали фаз внедрения, повидимому, никогда не отвечает приписываемой им стехиометрической формуле, наоборот, носит переменный характер, поскольку между отдельными карбидами — фазами внедрения, а также между фазами внедрения и металлическим компонентом наблюдается взаимная растворимость в некоторых пределах.
Поэтому в легированной стали редко встречаются карбиды, точно соответствующие стехиометрическому составу. Наоборот, в подавляющем числе случаев карбидная фаза представляет собой твердые растворы, составы которых только в той или иной
степени приближаются к стехиометрическому составу карбидов-растворителей. Конкретный состав карбидной фазы в легированной стали зависит не только от содержания в ней легирующих элементов и углерода, но и от условий, в которых протекало ее образование. В частности, чем в менее равновесных условиях происходило карбидообразование, тем ниже будет содержание легирующих элементов в карбидной фазе.
Остановимся на описании вариантов химического состава карбидов в отожженной (равновесной) стали, поскольку такое состояние является исходным при дальнейшей термической обработке. Рассмотрим сначала вероятный состав карбидной фазы в стали, легированной только одним карбидообразующим элементом. В этом случае состав карбидной фазы, получающейся в равновесных условиях, может быть установлен путем рассмотрения тройных диаграмм состояния соответствующих сплавов.
Ввиду того, что наибольший интерес представляет карбидная фаза в стали при комнатных температурах, ограничимся рассмотрением более простых изотермических сечений соответствующих пространственных диаграмм состояния в участках, прилегающих к чистому железу. На рис. 20 показано сечение участка диаграммы состояния Fe — Мп — С при комнатной температуре. Из рисунка видно, что при всех возможных в конструкционной стали вариантах содержания углерода и марганца карбидная фаза будет представлять собой легированный марганцем цементит (Fe, Мп)3С.
На рис. 21 приведено сечение при комнатной температуре части диаграммы состояния Fe — Сг — С. Из диаграммы видно, что если содержание в стали хрома не превышает примерно 2%, то образуется легированный цементит (Fe, Сг)зС.
При большем содержании хрома образуется карбид на базе григонального карбида хрома Сг7С3 с формулой (Сг, Fe)7C3.
На рис. 22 показано сечение при комнатной температуре участка диаграммы состояния Fe — Mo — С. Из рисунка видно, что если содержание молибдена в стали не превосходит 0,8°/о, то наиболее вероятной формой карбидов будет Fe3C[(Fe, Мо)3С], которую можно рассматривать как твердый раствор на базе цементита. Так как содержание молибдена в конструкционной стали никогда не превосходит 0,8%, то очевидно, что в ней он будет растворяться в цементите.
Сечение диаграммы системы Fe — W — С приведено на рис. 23. Эта диаграмма имеет черты сходства с диаграммой состояния системы Fe — Mo — С.
Сечение диаграммы F — V — С (рис. 24) свидетельствует о том, что растворимость ванадия в Fe3C при среднем содержании в стали углерода достигает примерно 0,5%. Следовательно,
в основном только в тех случаях, когда количество ванадия в конструкционной стали превосходит 0,5%, возможно образование специальных карбидов, богатых ванадием.
Таким образом, карбидообразующие элементы марганец, хром, молибден, вольфрам и ванадий при содержании их в количестве, не превышающем обычные пределы в конструкционной стали 1,8% Сг; 1 2 3 . 7 8 9 10 11 12 . 20 21 22
Автор: Администрация
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
Микроструктурный анализ легированных СТАЛЕЙ
Цель работы:изучить микроструктуры легированных сталей; установить взаимосвязь между структурой сплава и его свойствами.
Введение
Легированными сталями называются стали, содержащие в своем составе, кроме железа и углерода, специально введенные элементы, которые способны изменить ее строение, а следовательно, и свойства. Для легирования стали наиболее часто применяют хром, никель, марганец, кремний, вольфрам, ванадий, молибден, титан и др.
Все элементы, которые растворяются в железе, влияют на температурный интервал существования его аллотропических (полиморфных) модификаций, т. е. сдвигают точки А3 и А4 по температурной шкале.
К первой группе легирующих элементов, которые повышают точку А4 и снижают точку А3, расширяя тем самым область существования g-модификации железа (рис. 1, а) и сужая область существования a-модификации относят: Mn, Ni, Со, Pt.
Ко второй группе элементов, которые понижают А4 и повышают А3, сужая область существования g-модификации железа и расширяя область существования a-модификации, относятся: Cr, W, Mo, V, Si, Al, Ti, Be, Sn, Sb (рис. 1, б)
Легирующие элементы Ni и Mn, смещают линии PSK, GS и SE диаграммы Fe – Fe3C в сторону более низких температур, а элементы
Рисунок 1 – Влияние легирующих элементов на полиморфизм железа
Cr, Mo, W, V, Si, Ti смещают эти же линии в сторону более высоких температур.
Легирующие элементы оказывают значительное влияние на эвтектоидную концентрацию углерода (точка S диаграммы состояния Fe–Fe3C) и предельную растворимость углерода в g-железе (точка Е). Такие элементы, как Ni, Co, Si, W, Mo, Cr, Mn, сдвигают точки S и Е влево, в сторону меньшего содержания углерода, а V, Ti, Nb наоборот – смещают их вправо, т.е. повышают концентрацию углерода в эвтектоиде. Например, при содержании в стали 5 % Cr, концентрация углерода в эвтектоиде (точка S) снижается с 0,81 % до 0,5 %, а предельная растворимость углерода в аустените (точка E) – с 2,14 % до 1,3 %. При 10 % Cr – точке S будет соответствовать 0,25 ¸ 0,3 % С, а точке Е – 0,1 % С.
Характеристика фазовых составляющих
Легированных сталей
В промышленных легированных сталях, которые являются многокомпонентными системами, легирующие элементы могут находиться:
а) в форме раствора в железе;
б) в карбидной фазе – в виде раствора в цементите или в виде самостоятельных соединений с углеродом – специальных карбидов;
в) в форме интерметаллических соединений с железом или между собой.
Таким образом, легирующие элементы преимущественно растворяются в основных фазах железоуглеродистых сплавов (феррит, аустенит, цементит) или образуют специальные карбиды.
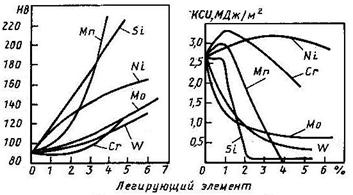
Легированный феррит – твердый раствор легирующих элементов в a-железе (ОЦК – решетка). Легированный феррит отличается от обычного феррита тем, что в нем атомы железа в кристаллической решетке объемно-центрированного куба частично замещены атомами легирующего элемента, что приводит к искажению решетки и как следствие, к изменению свойств – повышению прочности, твердости и снижению пластичности феррита (рис. 2). По микроструктуре легированный феррит ничем не отличается от обычного феррита, т.е. представляет собой однородные зерна с четкими очертаниями межфазовых границ.
 |
Легированный аустенит – твердый раствор легирующих элементов в решетке g-железа (ГЦК – решетка), он может устойчиво существовать при высоких температурах, а в высоколегированных сталях даже при комнатной температуре. Легированный аустенит характеризуется повышенной прочностью при нормальных и повышенных температурах, обладает низким пределом текучести при сравнительно высоком пределе прочности, он – парамагнитен. Аустенит легко наклепывается, т. е. сильно упрочняется под действием холодной пластической деформации. В микроструктуре легированных сталей аустенит представляет собой светлые однородные зерна с видимыми очертаниями границ, иногда с наличием линий сдвига или двойников.
а) твердость, б) ударная вязкость
Рисунок 2 – Влияние легирующих элементов на свойства
Легированный цементит – твердый раствор легирующих элементов в цементите железа. Легированный цементит отличается от цементита железа тем, что в нем атомы железа в октаэдрической решетке цементита частично замещены атомами легирующего элемента, например, Mn, Cr, W и Mo (при малом их содержании в стали). Пример: (Fe, Mn)3C, (Fe, Cr)3C.
Легированный цементит более тверд и дисперсен, чем нелегированный. При рассмотрении под микроскопом после обычного стандартного травления он ничем не отличается от цементита железа.
Карбидная фаза в легированных сталях. По отношению к углероду все легирующие элементы подразделяют на две группы:
I. Графитизирующие элементы: Si, Ni, Cu, Аl (находятся в твердом растворе).
II. Карбидообразующие элементы. Их можно расположить по возрастающей степени сродства к углероду и устойчивости карбидных фаз, следующим образом:
Fe ® Mn ®Cr ® Mo ® W ® Nb ® V ® Zr ® Ti.
Специальные карбиды – соединение легирующих элементов с углеродом. Карбиды, образующиеся в легированных сталях, можно разделить на две группы.
К первой группе относятся карбиды типа М3С, М7С3, М23С6 и М6С (М4С), имеющие сложные кристаллические решетки. Карбиды типа М3С, М23С6 сравнительно легко растворяются в решетке аустенита при нагреве, а остальные относятся к труднорастворимым. Специальные карбиды всех легирующих элементов содержат в своем составе железо, а при наличии нескольких карбидообразующих элементов – и эти элементы. Примеры карбидов: Cr23C6, Cr7C3, Fe3W3C, Fe3Mo3C, (Fe, Mn)3C, (Fe, Cr)3C, (Cr, Fe)7C, (Cr, Mn, Fe)23C6 и др.
Ко второй группе относятся карбиды типа МС, M2C (фазы внедрения): VC, TiC, NbC, TaC, WC, W2C, Mo2C, имеющие простую кристаллическую решетку и труднорастворимые в аустените при нагреве. Для растворения таких карбидов, как TiC, NbC сталь необходимо нагреть до очень высоких температур, примерно 1300 0 С.
Твердость специальных карбидов обычно выше твердости цементита (> 800 – 900 HV). По микроструктуре они слабо отличаются от цементита, а для выявления вида этих карбидов применяют специальные реактивы и методы травления. Специальные карбиды обычно более дисперсны, чем цементит. Некоторые из них имеют специфическую внешнюю форму, например, карбид титана имеет форму кубиков.
Интерметаллические соединения. При высоком содержании легирующие элементы образуют с железом или друг с другом интерметаллические соединения. Примеры соединений: Fe7Mo6, Fe7W6, Fe3Nb2, Fe3Ti, Fe3CrMo, Ni3Ti, Ni3Al, Co2Ti и др.
Взаимодействие легирующих элементов с углеродом и азотом в стали. Карбиды и нитриды в стали
Добавленные в сталь легирующие элементы могут образовывать твердые растворы или химические соединения с железом и между собой. В большинстве случаев для сталей важную роль имеет взаимодействие ЛЭ с углеродом и азотом. Способность ЛЭ к образованию карбидов или нитридов в стали, где основу составляет железо, определяется их сродством к С и N. Если сродство ЛЭ к С и N больше, чем у железа, то будет образовываться карбид на основе ЛЭ, а не цементит.
Так как закономерности образования карбидов и нитридов в стали имеют одинаковый характер и углерод чаще применяется при легировании, чем азот, обычно рассматривают закономерности карбидообразования.
Все легирующие элементы можно разделить на две группы: карбидообразующие и не образующие карбидов в стали.
Карбиды и нитриды относятся к фазам внедрения, которые и образуются между d-переходными металлами и соответственно углеродом и азотом. Активность карбидообразующих элементов тем больше и устойчивость карбидных фаз тем выше, чем менее достроена d-электронная оболочка у данного металла. На рис. 77 приведен фрагмент таблицы Д. И. Менделеева, где расположены карбидо- и нитридообразующие элементы.
Co и Ni, представленные на рис. 77, не образуют карбиды и нитриды в стали, так как они имеют более совершенное электронное строение, чем железо.
В периодах сродство к углероду возрастает справа налево (Fe Ti), а в группах – сверху вниз (Cr W). Таким образом, самым активным из представленных в таблице элементов будет Hf. С увеличением содержания легирующего элемента в стали образуется карбид более высокого класса (с бóльшим содержанием ЛЭ). Например, для хрома: (Cr,Fe)3C Cr7C 3Cr23C6.
Рис. 77. Структуры d–переходных металлов, карбидов и нитридов, образуемых в стали
В некоторых карбидах легирующих элементов может растворяться железо. Так, например, в карбидах Cr3c и Мn3С железо растворяется неограниченно. Карбиды Cr7C3 и Mn23C6 образуют ограниченные твердые растворы с железом.
Прочность связи между атомами металла и неметалла в карбидах и нитридах характеризуются теплотой образования 298К, кДж/(г-атом) и свободной энергией образования фаз ( 298к, кДж/(г-атом), температурой их плавления и структурно-нечувствительными упругими свойствами. Наиболее высокие значения из указанных свойств имеют карбиды и нитриды элементов IV и V групп. По мере увеличения номера группы свойства изменяются в сторону уменьшения прочности связи атомов в карбиде и нитриде или, как говорят, прочности или стойкости карбидов и нитридов.
Следовательно, переходные металлы по их сродству к углероду и азоту, прочности и стойкости карбидов и нитридов, их устойчивости к распаду можно расположить в следующий убывающий ряд: Hf, Zr, Тi, Та, Nb, V, Мо, Сr, Мn, Fе.
Карбид Сr7С3 образуется чаще всего в конструкционных сталях с относительно невысоким содержанием хрома (до 3 – 4%). Этот карбид имеет сложную гексагональную решетку с 80 атомами на одну элементарную ячейку (56 атомов металла и 24 атома углерода).
В сталях этот карбид может содержать от 30 до 50 % Сr, т. е. его формула должна быть в пределах Fе4Сr3С3 и Fе2Сr5С3. Обычно такой карбид обозначают (Сr, Fе)7С3 или Me7C3.
Карбид Сr23С6 образуется в высоколегированных хромистых сталях при большом содержании хрома (выше 5 – 8 %). Он имеет сложную г. ц. к. решетку, элементарная ячейка которой содержит 116 атомов, в том числе металла 92 атома и углерода – 24. В сталях карбид Сr23С6 в чистом виде не встречается, часть атомов хрома в нем замещается карбидообразующими элементами, входящими в состав стали (Fе, Мо, W).
В зависимости от характера легирования атомы металла могут содержать два или несколько элементов. Так, в высокохромистых сталях содержание железа в карбиде может повышаться до 35 %, т. е. часть атомов хрома замещается железом, при этом формула карбида имеет, например, вид Fе8Сr15С6. При меньшем содержании хрома возможно образование карбида Fе12Сr11С6. В общем виде такой карбид в сталях принято обозначать формулой (Сr, Fе)23С6 или Me23C6. В сталях с молибденом формула карбида будет Fе20Мо2С6, а в сталях с несколькими легирующими элементами (Сr, Мо, W и др.) все они могут входить в состав карбида.
Железо широко замещает в этом карбиде хром, но так как размер атомов железа несколько меньше размера атомов хрома, то начиная с определенного момента (после замещения ~30% Сr) эти узлы становятся слишком “просторными”, и для устойчивости решетки необходимо присутствие крупных атомов W (или Мо). Атомы W (Мо) занимают также определенные позиции в решетке карбида Ме23С6, поэтому их максимальное число в элементарной ячейке составляет 8 из 92 атомов металла. Дальнейшее увеличение в стали концентрации вольфрама и молибдена в выделяющейся фазе сверх этого предела приводит к переходу Ме23С6 Þ Ме6С, как к следующему карбиду, который может вместить большее количество W и Mo.
Этот карбид образуется только при сложном легировании, поэтому он является комплексным карбидом. Его преимущество перед другими карбидами на основе Mo, W и других тугоплавких элементов заключается в том, что он имеет более низкую температуру диссоциации, что позволяет переводить Мо и W при нагреве при закалке в твердый раствор (аустенит).
Однако этот карбид метастабильный и при высокой температуре и длительных выдержках он превращается в стабильные карбиды типа МеС или Ме2С. По этой причине высоколегированные стали, содержащие в больших количествах Cr, W, Mo и V не подвергают смягчающему отжигу с нагревом и длительной выдержкой при температурах 1100. 1200 о С. При закалке из этой области температур длительность выдержки строго регламентирована.
Л 5.2. Влияние легирующих элементов на С–образные кривые.
Влияние легирующих элементов на критические точки и свойства стали
Легирующие элементы значительно влияют на температурное положение критических точек в сталях. В частности, они могут интенсивно смещать точку Ас1. Подобное влияние легирующих элементов связано с двумя факторами.
| Рис. 78. Влияние легирующих элементов на положение критической точки Ас1 (а) и содержание углерода в эвтектоиде (б) |
Как известно, критическая температура Ас1 в углеродистой стали отвечает превращению эвтектоидной смеси перлита +Fе3С в аустенит путем фазового перехода a®g, диссоциации карбида и растворению углерода в g-железе. С одной стороны, легирующие элементы изменяют температуру –прeвращения для феррита, входящего в состав эвтектоида (перлита), и, с другой стороны, влияют на температуру диссоциации эвтектоидных карбидов и последующее растворение углерода и легирующих элементов в g-железе. Как правило, карбидообразующие элементы повышают температуру диссоциации карбидов, и, если при этом они также повышают температуру -превращения, то влияние их на точку Ас1 сказывается особенно сильно (рис. 78).
Некарбидообразующие элементы, растворяясь в цементите, несколько понижают температуру диссоциации карбида. При этом никель и марганец понижают температуру -перехода и, следовательно, снижают точку Ас1. Своеобразно влияние хрома на точку Ас1. Он до 12–13 % сравнительно слабо повышает точку Ас1, а при содержании его более 14 % наблюдается резкое повышение температуры Ас1. Подобное влияние объясняется тем, что при содержании хрома до 12 – 13 % он понижает температуру -перехода, а наблюдаемое при этих содержаниях хрома повышение точки Ас1 обусловлено более сильным влиянием диссоциации эвтектоидных карбидов при этих температурах. Закономерности влияния элементов на критические точки в основном сохраняются и в сталях, содержащих одновременно несколько легирующих элементов.
Легирующие элементы значительно влияют и на положение эвтектоидной точки S (рис. 79), и на предельную концентрацию углерода в аустените (точку Е). Некарбидообразующие элементы (никель, кобальт, кремний), растворяясь в феррите и замещая часть атомов железа в его решетке, тем самым уменьшают содержание железа в эвтектоиде и смещают точку S в сторону меньших концентраций углерода. Аналогично влияют и карбидообразующие элементы, которые в большом количестве растворяются в феррите. Их карбиды участвуют в образовании эвтектоида (например, Мп и Сr). Такие элементы, как Мо и W, сначала уменьшают, а затем увеличивают содержание углерода в эвтектоиде.
Имеются сведения, что сильные карбидообразующие элементы Тi, Nb и V, незначительно растворяющиеся в феррите и образующие стойкие карбиды, которые не участвуют в образовании эвтектоида, уменьшают количество эвтектоида в стали и увеличивают содержание углерода в эвтектоиде, т. е. смещают точку S в сторону больших концентраций углерода. В то же время, если Тi, Nb и V растворены в аустените, то они снижают содержание углерода в эвтектоиде.
Большинство легирующих элементов понижает предел растворимости углерода в -железе и, следовательно, смещает точку Ена диаграмме Fе–Fе3С в сторону меньших концентраций углерода.
| Рис. 79. Изменение содержания углерода в эвтектоиде и эвтектике при легировании |
Легирующие элементы смещают не только критические точки равновесных систем, но и изменяют кинетику распада аустенита. Кинетика распада аустенита определяет поведение стали при термической обработке. Влияние же легирующих элементов на кинетику превращения аустенита очень велико.
Элементы, которые только растворяются в феррите или цементите, не образуя специальных карбидов, оказывают лишь количественное влияние на процессы превращения (изменяют длительность инкубационного периода). Они или ускоряют превращение (к таким элементам относится только кобальт), или замедляют его (большинство элементов, в том числе марганец, никель, медь и др.).
| Рис. 80. Диаграммы изотермического превращения аустенита: доэвтектоидной (а), эвтектоидной (б) и заэвтектоидной (с) углеродистой стали |
Карбидообразующие элементы вносят не только количественные, но и качественные изменения в кинетику изотермического превращения. Так, легирующие элементы, образующие растворимые в аустените карбиды, при разных температурах по-разному влияют на скорость распада аустенита: при 700 – 500 о С (образование перлита) – замедляют превращение, а при 500 – 400 о С – весьма значительно замедляют превращение; при 400 – 300 о С (образование бейнита) – ускоряет превращение при малых концентрациях и замедляют при больших.
Таким образом, в сталях, легированных карбидообразующими элементами (хром, молибден, вольфрам), наблюдаются два максимума скорости изотермического распада аустенита, разделенных областью высокой устойчивости переохлажденного аустенита. Изотермический распад аустенита имеет два явно выраженных интервала превращений – превращение в пластинчатые кристаллиты (перлитное превращение) и превращение в игольчатые кристаллиты (бейнитные превращения).
Диаграммы изотермического распада представлены на рис. 80 и 81. Видно, что увеличение содержания углерода понижает температуры начала и конца мартенситного превращения; форма кривых начала и конца перлитного превращения принципиально не изменяется.
При легировании карбидообразующими элементами диаграмма приобретает другой вид (рис. 81). Причины изменения формы диаграммы подробно изучаются в дисциплине “Теория термической обработки”. Следует обратить внимание на тот факт, что положение бейнитной области зависит от содержания углерода и ЛЭ-карбидообразователя.
В легированных сталях в зависимости от положения линий начала перлитного превращения и точки Мн можно получить стали перлитного, мартенситного, бейнитного или аустенитного классов. Увеличение инкубационного периода при легировании позволяет создавать стали с высокой прокаливаемостью.
| Рис. 81. Схемы диаграмм изотермического распада аустенита, легированного карбидообразующими элементами: а – малоуглеродистая сталь; б – высокоуглеродистая сталь |
Легирующие элементы не влияют на кинетику мартенситного превращения, которая, по-видимому, похожа во всех сталях. Их влияние сказывается исключительно на положении температурного интервала мартенситного превращения, а это в свою очередь отражается и на количестве остаточного аустенита, которое фиксируется в закаленной стали.
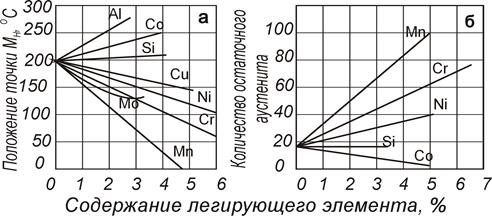 Рис. 82. Влияние ЛЭ на Мн и содержание остаточного аустенита в стали с 1 % углерода |
Некоторые элементы повышают мартенситную точку и уменьшают количество остаточного аустенита (алюминий, кобальт), другие не влияют на нее (кремний), но большинство снижает мартенситную точку и увеличивает количество остаточного аустенита (рис. 82). Из диаграммы видно, что 5% Мn снижает мартенситную точку до 0 о С, следовательно, при таком (или большем) содержании этого легирующего элемента можно зафиксировать аустенитное состояние посредством быстрого охлаждения..
Л 5.3. Влияние легирования на вязкость, прочность, Тх , размер зерна.
Карбидная фаза в легированных сталях
В сталях карбиды образуются только металлами, расположенными в периодической системе элементов левее железа (см. рис. 279). Эти металлы, как и железо, относятся к элементам переходных групп, имеют менее достроенную -электронную полосу. Чем левее расположен в периодической системе карбидообразующий элемент, тем менее достроена его -полоса.
Имеется достаточно оснований предполагать, что в процессе карбидообразования углерод отдает свои валентные электроны на заполнение электронной полосы атома металла, тогда как у металла валентные электроны образуют металлическую связь, обусловливающую металлические свойства карбидов.
Многочисленные опыты показывают, что чем левее в периодической системе расположен элемент, т. е. чем менее достроена у него электронная полоса, тем более устойчив карбид. Эти обстоятельства позволяют сформулировать положения, характеризующие в общем виде условия карбидообразования в сталях: только элементы с -электронной полосой, заполненной меньше, чем у железа, являются карбидообразующими; активность их как карбидообразователей тем сильнее и устойчивость образующихся карбидных фаз тем больше, чем менее достроена -полоса у металлического атома.
Это положение позволяет указать условия образования карбидов в стали при наличии нескольких карбидообразующих элементов, последовательность растворения в аустените различных карбидов и другие факторы, важные для теории легирования, практики производства и применения легированных сталей.
В соответствии со сказанным карбиды в сталях будут образовывать следующие элементы: титан, ванадий, хром, марганец, цирконий, ниобий, молибден, гафний, тантал, вольфрам.
В природе известны карбиды никеля и кобальта, но в сталях, т. е. в сплавах на основе железа, эти металлы карбидов не образуют, так как на -полосе кобальт
1 Из курса физики известно, что электроны располагаются вокруг ядра атома в виде отдельных электронных оболочек. Чем дальше от ядра отстоит оболочка, тем выше уровень энергии электронов этой оболочки. Каждая оболочка в свою очередь расщепляется на ряд уровней энергии или полос, получивших обозначения (по направлению от ядра атома) На каждой полосе может располагаться ограниченное число электронов. Так, например, на -полосе может разместиться не более 10 электронов. При последовательном переходе от атома водорода к другим элементам периодической системы число электронов возрастает в соответствии с их атомным номером, причем электроны сначала занимают все места с наименьшими уровнями энергии, т. е. последовательно все места в первой оболочке, затем во второй и т. д. Однако у некоторых элементов, получивших наименование элементов переходных групп, на внешней (валентной) оболочке уже появляются 1 или 2 электрона еще до того, как достроена -полоса предыдущей оболочки. К этим элементам относятся многие металлы, в том числе железо и карбидообразующие элементы.
Сформулированное выше положение является частным случаем условий образования карбидов или нитридов в сплавах. Карбидо- и нитридообразующим элементом в сплаве является такой элемент, у которого менее достроена -полоса, чем у основного металла.
Иногда, правда очень редко, в металлических сплавах образуются карбиды бора, алюминия, кремния и других элементов, по приведенной классификации относящихся к «некарбидообразующим» элементам. Дело в том, что карбиды совершенно отличны от рассматриваемых карбидов. Это соединения с ковалентной связью, не обладающие металлическими свойствами.
имеет 7, а никель 8 электронов, т. е. больше чем железо, имеющее на d-полосе 6 электронов. Поэтому углерод отдает свои электроны железу и карбиды никеля или кобальта не образуются.
Элементы с полностью заполненной -полосой (медь, цинк, серебро и т. д.) ни при каких условиях карбидов в сплавах не образуют.
Вместе с тем в соответствии с высказанным выше положением, активность карбидообразования и устойчивость карбидов в легированных сталях будет возрастать при переходе от элементов марганца и хрома к элементам молибден, ванадий, вольфрам и титан и др. имеющим менее достроенные -полосы, чем у марганца и хрома. Это значит, например, что при наличии в стали одновременно хрома и ванадия следует ожидать в первую очередь образования карбидов ванадия.
Приняв атомный радиус углерода равным 0,079 нм легко подсчитать, что у всех карбидообразующих элементов, кроме железа, марганца и хрома, отношения атомных радиусов углерода к металлу меньше 0,59.
Выше указывалось (гл. IV, что если у металла переходной группы и у металлоида с малым атомным радиусом (углерод, азот, водород) отношение атомных радиусов меньше 0,59, то возможно образование особых видов соединений, которые называются «фазами внедрения» (см. с. 99).
У большинства карбидообразующих элементов соотношение поэтому между ними и углеродом возможно образование фаз внедрения.
Установлено, что в сталях могут образовываться следующие карбидные соединения:
Однако в сталях в чистом виде перечисленные карбиды не существуют. Карбиды всех легирующих элементов содержат в растворе железо, а при наличии нескольких карбидообразующих элементов — и эти элементы. Так, в хромомарганцовистой стали вместо чистого карбида хрома образуется карбид содержащий в растворе железо и марганец.
Так как карбиды, имеющие одинаковую химическую формулу, взаимно растворяются, то, например, при наличии в стали одновременно титана и ниобия будут образовываться не два разделенных вида карбидов, а один общий карбид, в который «на равных основаниях» входят и титан и ниобий. Поэтому возможных вариантов карбидообразования меньше, чем это указано выше, и фактически мы встречаемся в сталях лишь с карбидами шести видов:
где под М подразумевается сумма карбидообразующих элементов (металлических). Соотношения между металлическими элементами и углеродом (для недефектной решетки) указываются формулой.
Карбиды, отнесенные в I группу, имеют сложную кристаллическую структуру. Типичным представителем карбидов этого типа
является цементит, кристаллическая структура которого была показана на рис. 133.
Особенность строения карбидов II группы как фаз внедрения заключается в том, что они имеют простую кристаллическую решетку и кристаллизуются обычно со значительным дефицитом по углероду.
Следует отметить, что фазы внедрения трудно растворимы в аустените. Это значит, что при нагреве (даже очень высоком) они могут не перейти в твердый раствор. В этом их отличие от карбидов
I группы, которые при нагреве легко растворяются в аустените.
Рис. 283. Диаграммы изотермического распада аустенита: а — углеродистая (1) и легированная некарбидообразующими элементами (2) стали; б — углеродистая (1) и легированная карбидообразующими элементами (2) стали
Все карбидные фазы обладают высокой температурой плавления и высокой твердостью. Фазы внедрения в этом отношении превосходят карбиды I группы.
Легирующие элементы, которые вводятся в сталь для получения требуемой структуры и свойств, могут образовывать с железом следующие фазы:
легированный цементит или самостоятельные специальные карбиды;
Рис. 91. Схемы влияния легирующих элементов на полиморфизм железа
Влияние легирующих элементов на полиморфные превращения железа. Все элементы, за исключением углерода, азота, водорода, и отчасти бора образуют с железом твердые растворы замещения. Они растворяются в железе и влияют на положение точек определяющих температурную область существования а- и -железа. Легирующие элементы по влиянию на температурную область существования полиморфных модификаций железа можно разделить на две группы.
К элементам первой группы относятся никель и марганец, которые понижают температуру точки и повышают температуру точки . В результате этого по диаграмме состояния железолегирующий элемент наблюдается расширение области -фазы и сужение области существования -фазы (рис. 91, а). Как видно из рис. 91, а, под влиянием легирующих элементов температурная точка повышается до линии солидус, а температурная точка при повышенной концентрации легирующего элемента снижается До нормальной температуры. Следовательно, сплавы, имеющие Концентрацию легирующего элемента больше указанной на рис. 91, а (точка ), не испытывают фазовых превращений и при всех температурах представляют собой твердый раствор легирующего элемента в -железе. Такие сплавы называют аустенитными.
Рис. 92. Диаграммы состояния
Сплавы, частично претерпевающие превращение называют полуаустенитными.
На рис. 92, а, приведена диаграмма состояния сплавов иллюстрирующая описанные изменения в положении критических точек
Элементы второй группы понижают температуру критической точки и повышают температуру точки Это приводит к тому, что при определенной концентрации легирующих элементов (см. точку у на рис. 91, б) критические точки а точнее их интервалы, сливаются, и область у-фазы полностью замыкается. При содержании легирующего элемента большем, чем указано на рис. (точка сплавы при всех температурах состоят из твердого раствора легирующего элемента в -железе. Такие сплавы называют ферритными, а сплавы, имеющие лишь частичное превращение, — полуферритными. На рис. приведена диаграмма состояния сплавов характерная для этой группы элементов.
Рис. 93. Схема влияния легирующих элементов на точку и содержание углерода в эвтектоиде перлите — точка
Легирующие элементы оказывают большое влияние на точку соответствующую температуре перехода перлита в аустенит (рис. 93, а). Никель и марганец снижают температуру и другие элементы повышают температуру (см. рис. 93, а). Легирующие элементы уменьшают эвтектоидную концентрацию углерода (рис. 93, б) и предельную растворимость углерода в аустените, сдвигая точки и Е на диаграмме состояния влево. Как видно из рис. 94, где приведены вертикальные разрезы тройной диаграммы состояния перитектическое, эвтектическое и эвтектоидное превращения протекают не при постоянной температуре, как в двойных системах, а в некотором интервале температур. В системе -фаза о увеличением содержания марганца существует и в области более низких температур. В системе с возрастанием концентрации хрома область существования -фазы сужается. Состав карбидной фазы в марганцовистых сталях соответствует соединению в котором часть атомов железа замещена атомами марганца. В хромистых сталях образуются и специальные хромистые карбиды, состав и структура которых зависят от содержания углерода и хрома. При низком содержании углерода и высоком содержании хрома образуются ферритные стали, не претерпевающие полиморфного превращения (рис. 94, б).
Структура и свойства легированного феррита и аустенита. Основой большинства современных легированных сталей является феррит, легированный одним или несколькими элементами. Легирование феррита сопровождается его упрочнением.
В первом приближении можно считать, что при легировании феррита несколькими элементами их влияние на его упрочнение может быть просуммировано! где — концентрация легирующего элемента, растворенного в феррите, по массе; — коэффициент упрочнения феррита, т. е. прирост при растворении в нем по массе легирующего элемента. Коэффициент имеет следующие значения:
Наиболее сильно повышает от марганец и кремний (рис. 95, а), а хром, находящийся в твердом растворе, по данным разных авторов, снижает или несколько повышает прочность феррита (рис. 95, а). Чем мельче зерно феррита, тем выше его прочность (см. рис. 80, а). Все легирующие элементы, за исключением никеля, при содержании их в растворе выше определенного предела снижают ударную вязкость трещиностойкость и повышают порог хладноломкости Содержание легирующих элементов, выше которого ударная вязкость снижается, а порог
(кликните для просмотра скана)
Рис. 95. Влияние легирующих элементов изменение предела текучести феррита (а) и хромоникелевого аустенита (б) (по данным Пиккеринга)
хладноломкости повышается, для ванадия и хрома для кремния для марганца Никель при увеличении его концентрации в твердом растворе понижает порог хладноломкости
При высоком содержании в стали или аустенит может существовать при низких температурах (см. рис. 91, а). Он является основной составляющей (матрицей) многих коррозионно-стойких жаропрочных и немагнитных сталей. Аустенит наиболее сильно упрочняет углерод, растворимость которого в нем достигает при нормальной температуре и азот. Легирующие элементы, растворяясь в у-железе, повышают прочность аустенита при нормальной и высоких температурах (рис. 95, б). Для легированного аустенита характерны низкий предел текучести при сравнительно высоком пределе прочности. Аустенит легко наклепывается, т. е. быстро и сильно упрочняется под действием холодной деформации. Аустенит парамагнитен, обладает большим коэффициентом теплового расширения.
Карбидная фаза в легированных сталях. По отношению к углероду легирующие элементы подразделяют на две группы:
1) графитизирующие элементы: (находятся в твердом растворе);
2) карбидообразующие элементы: (расположены по возрастающей степени сродства к углероду и устойчивости карбидных фаз).
При малом содержании в стали таких карбидообразующих элементов, как и последние растворяются в
Рис. 96. Изотермические сечения тройных диаграмм состояния:
цементите, замещая в нем атомы железа. Состав цементита в этом случае может быть выражен формулой где М — легирующий элемент. Так, при растворении марганца в цементите образуются карбид при растворении хрома — карбид
Марганец может заместить в решетке цементита все атомы железа хром — до 25 ат. %, молибден — до 3 ат. % и вольфрам лишь до Более сильные карбидообразующие элементы практически не растворяются в цементите и образуют самостоятельные специальные карбиды.
При повышенном содержании хрома, вольфрама, молибдена в зависимости от содержания углерода в стали могут образовываться специальные карбиды. На рис. 96 приведены изотермические сечения (при части тройных диаграмм состояния показаны фазовые области, в которых существуют разные карбидные фазы.
Если содержание хрома не превышает то образуется легированный цементит При повышенном содержании хрома образуется специальный карбид при еще большем содержании хрома — карбид (рис. 96, а).
При введении вольфрама и молибдена в сталь в количестве, превышающем предел насыщения цементита этими элементами, образуются сложные карбиды (рис. 96, б и в).
Специальные карбиды, образуемые легирующими элементами, способны растворить железо и другие металлические элементы.
Так, например, карбид при температуре растворяет до образуя сложный карбид а карбид до образуя карбид
Приняты следующие обозначения карбидов: (карбиды цементитного типа), (карбиды, имеющие кристаллическую решетку карбидов хрома), (карбиды с решеткой, в которой атомы металла расположены по типу карбидов вольфрама или молибдена), и, наконец, (карбиды по типу кубической гранецентрированной решетки). Под символом М подразумевается сумма металлических элементов, входящих в состав карбида.
Карбиды, образующиеся в легированных сталях, можно разделить на две группы. К первой группе относятся карбиды типа имеющие сложные кристаллические решетки. Карбиды этой группы сравнительно легко растворяются в аустените при нагреве.
Ко второй группе относятся карбиды типа Эти карбиды относятся к фазам внедрения. В отличие от карбидов первой группы фазы внедрения в реальных условиях нагрева стали почти не растворяются в аустените.
Интерметаллические соединения. При высоком содержании легирующие элементы образуют с железом или друг с другом интерметаллические соединения. Примером таких соединений могут служить и др. В сплавах образуются твердая и хрупкая -фазы, отвечающие соединению (см. рис. 92, б), . В сплавах может образовываться хрупкая -фаза состава и др.
Читайте также:
