Вводят в сталь для устранения вредного действия серы
Обновлено: 19.05.2024
Содержание постоянных примесей обычно ограничивается следующими верхними пределами: 0,8 % Мn; 0,5 % Si; 0,05 % Р; 0,05 % S. При большем их содержании сталь следует относить к легированным, куда эти элементы введены специально.
Марганец
Его вводят в любую сталь для раскисления:
FeO + Mn -> MnO +Fe,
т.е. для устранения оксида железа. Марганец хорошо растворяется в феррите и цементите. Он повышает прочность стали, практически не снижая пластичности, резко уменьшает красноломкость, т.е. хрупкость при высоких температурах вызванную влиянием серы.
Кремний
Его вводят в сталь для раскисления:
2FeO + Si -> 2Fe + SiO2.
Кремний полностью растворим в феррите; сильно повышает предел текучести стали, что снижает способность стали к пластической деформации. В сталях, предназначенных для холодной штамповки, вытяжки, содержание кремния должно быть минимальное.
Фосфор
Железные руды, топливо, флюсы содержат какое-то количество фосфора, которое в процессе производства чугуна остается в нем в той или иной степени и затем переходит в сталь. Фосфор хорошо растворяется в феррите и аустените, а при высоком содержании образует фосфид Fe3Р (15,62 % Р). Растворяясь в феррите, фосфор искажает кристаллическую решетку и увеличивает пределы прочности и текучести стали, сильно уменьшает пластичность и вязкость; каждые 0,01 % Р повышают порог хладноломкости на 20…25 0 С. Фосфор является вредной примесью в сталях.
Как и фосфор, сера попадает в металл из руд, а также из печных газов — продукт горения топлива (SO2). Сера весьма ограниченно растворима в феррите, и практически любое ее количество образует с железом сернистое соединение — сульфид железа FeS, который входит в состав эвтектики, имеющей температуру плавления 988 0 С. Она располагается преимущественно по границам зерен. При нагреве стали до температуры прокатки, ковки (1000…1200 0 С) эвтектика расплавляется, нарушая связь между зернами. В процессе деформации в этих местах образуются надрывы и трещины. Это явление носит название красноломкости. Введение марганца в сталь уменьшает вредное влияние серы, так как при введении его в жидкую сталь идет образование сульфида марганца, имеющего температуру плавления
FeS + Mn -> MnS + Fe.
Частицы MnS располагаются в виде отдельных включений и при деформации вытягиваются в строчки вдоль прокатки.
Сернистые соединения сильно снижают механические свойства стали при статическом и циклическом нагружении, особенно вязкость, пластичность, предел выносливости. Сера является вредной примесью в сталях.
Азот и кислород
Содержатся в стали в небольших количествах, зависящих от способа производства. Они могут в газообразном состоянии находиться в различных несплошностях , в a-твердом растворе, присутствовать в стали в виде хрупких неметаллических включений: оксидов (FeO, SiO2, Al2O3 и др.) нитридов (Fe2N, Fe4N, Mn4N и др.). Азот, кислород и их соединения резко повышают порог хладноломкости, уменьшают ударную вязкость, понижают сопротивление хрупкому разрушению.
Водород
С железом гидридов не образует. Поглощенный при выплавке водород не только охрупчивает сталь, но приводит к образованию флокенов- тонких трещин овальной или округлой формы. Кроме того, водород в металл может попасть в процессе нанесения гальванических покрытий, сварке, при контакте с водородсодержащими средами. Для снижения водородной хрупкости (удаления водорода) металл нагревается до 150…180 0 С, желательно в вакууме при давлении порядка 10 -2 …10 -3 мм рт. ст.
Улучшение качества стали
Для удаления из жидкой стали растворенных в ней газов и неметаллических включений применяют ее вакуумную обработку. Для этого ковш с жидкой сталью помещают в герметически закрытую камеру, где создается разряжение 267…667 Па (2…5 мм рт. ст.). Бурно выделяющиеся газы увлекают с собой и выносят из металла неметаллические включения. В течение 10…15 минут количество растворенных газов уменьшается в 3…5 раз, количество неметаллических включений- в 2…3 раза.
Для защиты металла от окисления разливку стали ведут в инертной атмосфере, например, аргона, под слоем синтетического шлака. Для получения сталей особо высокого качества применяют электрошлаковый переплав (ЭШП), плазменнодуговой переплав, электроннолучевой переплав, электродуговой вакуумный переплав. Металл хорошо очищается (рафинируется) от газов и неметаллических включений обработкой шлаком и направленной кристаллизацией жидкого расплава, созданием глубокого вакуума.
Влияние серы на свойства стали, возможности десульфурации и поведение серы в условиях окислительной плавки
Сера имеет неограниченную растворимость в жидком железе и ограниченную – в твердом железе. При кристаллизации стали по границам зерен выделяются сульфиды железа, которые могут образовать легкоплавкую эвтектику с железом, вызывающую явление красноломкости при нагревании слитков перед прокаткой или ковкой. Красноломкость проявляется сильнее в литой стали в виде трещин или рванин, потому что сульфиды и оксисульфиды скапливаются по границам первичных зерен.
В процессе горячей деформации (прокатки, ковки) сульфидные включения легко деформируются и вытягиваются в строчки по направлению деформации. Строчечные сульфидные включения нарушают сплошность структуры металла, и, если нагрузка на готовое изделие направлена поперек оси деформации (перпендикулярно сульфидным строчкам), металлическая матрица разрушается по границе раздела с сульфидами; в результате снижается пластичность стали в поперечных образцах. В случае испытания образцов металла при низких температурах сульфиды резко снижают пластичность и повышают порог хладноломкости. В частности, низкое содержание серы (и соответственно малое количество сульфидов) очень важно иметь в стали, применяемой при производстве труб большого диаметра для газопроводов, прокладываемых по Крайнему Северу ([S]
В то же время большое количество конструкционных сталей используется для изготовления изделий, у которых основные нагрузки – в направлении вдоль оси прокатки. В таком случае особо низкого содержания серы в металле не требуется, так как сера оказывает благоприятное влияние на обрабатываемость стали на металлорежущих станках (сера увеличивает хрупкость стружки и не дает возможности образования так называемой витой стружки). Поэтому в большинстве марок электростали допустимый верхний предел содержания серы составляет 0,035 % и лишь в высококачественных сталях он не должен превышать 0,020 %. Более низкое содержание серы в стали обычно оговаривается техническими условиями на поставку конкретной марки стали.
Сера попадает в металлический расплав с шихтовыми материалами. Передельный чугун содержит от 0,025 до 0,070 % серы, в чугунном ломе ее примерно столько же, в ломе углеродистых сталей – 0,030…0,050% серы. Кокс, применяемый для науглероживания расплава, содержит до 2 % серы. Некоторое количество серы может перейти в металл из мазута, если мазут используется в топливокислородных горелках. Обычно содержание серы в металле после расплавления выше допустимого для готовой стали, поэтому в процессе плавки и внепечной обработки требуется удалить из металла избыточное количество серы (осуществить десульфурацию металла).
Суть процесса десульфурации металла заключается в переводе серы из металла в десульфурирующую фазу (чаще всего это шлак). На скорость и степень («глубину») десульфурации металла влияют: активность серы в металле и шлаке, наличие поверхностно-активных примесей на поверхности раздела металл-десульфурирующая фаза, величина поверхности контакта металл-шлак, состав и свойства шлака (прежде всего основность, окисленность и вязкость), а также, особо подчеркиваем, количество шлака или другой десульфурирующей фазы.
Активность серы в жидкой стали повышают углерод, кремний, алюминий. Поэтому в полном металлургическом цикле (интегрированные заводы) выгоднее удалять серу из чугуна (в доменной печи или в чугуновозных ковшах, миксерах и т.д.), а при выплавке сталей с повышенным содержанием углерода, кремния и алюминия удается получать металл с более низким содержанием серы. Активность серы в шлаке определяется прежде всего основностью шлака.
Сера является поверхностно-активным элементом, ее концентрация на поверхности раздела фаз существенно выше, чем в объеме металла. Поэтому при проведении десульфурации металла необходимо добиваться увеличения поверхности контакта металла с десульфурирующей фазой (перемешивание металла со шлаком, вдувание в расплав порошков шлакообразующих компонентов и т,п.). Если в металлическом расплаве имеется несколько поверхностно-активных элементов, то поступление серы на поверхность раздела фаз затруднено. Кислород, присутствующий в металле, также является поверхностноактивным элементом, поэтому в окислительных условиях поверхность контакта металл-шлак занята кислородом и десульфурация металла усложняется. При небольших концентрациях кислорода в металле (меньше 0,01 %) адсорбция серы больше, чем адсорбация кислорода, степень удаления серы из металла резко увеличивается.
Самый простой и дешевый способ десульфурации стали – десульфурация основным шлаком. Переход серы из металла в шлак может быть описан следующими схемами:
[FeS] + (CaO) = (CaS) + (FeO) – при записи в молекулярной форме;
[S] + О 2- = S 2- + [О] – при записи в ионной форме.
Вторая схема объясняет взаимосвязь процессов раскисления металла и удаления из него серы. Исходя из этих схем для условий металлургической практики можно утверждать, что, чем выше активность СаО в шлаке и ниже активность FeO и серы в нем, тем выше десульфурирующая способность такого шлака; лучшему переходу серы из металла в шлак способствует меньшее содержание кислорода в металле (меньшая окисленность металла). Степень использования десульфурирующей способности шлака обычно характеризуют величиной полученного в процессе десульфурации коэффициента распределения серы между шлаком и металлом ϒs = (S) / [S], равной отношению концентраций серы в шлаке и металле. Сравнивая его с так называемым «равновесным» коэффициентом распределения, определенным для подобных шлаков в лабораторных условиях для случая равновесия между шлаком и металлом, можно судить о глубине десульфурации.
Многочисленные исследования, проведенные в промышленных и лабораторных условиях, подтвердили влияние основности и окисленности шлака на величину полученного коэффициента распределения серы (рис. 3.2).
Условия окислительного периода плавки (высокая окисленность шлака и металла) не способствуют проведению глубокой десульфурации металла, поэтому в большинстве случаев электрометаллурги стараются удалить основную часть серы при наличии раскисленного металла и шлака: при использовании классической технологии и ее более поздних модификаций в восстановительный период плавки и во время выпуска металла вместе со шлаком; при использовании современной технологии путем внепечной обработки на установках типа ковш-печь, путем продувки твердыми десульфурирующими реагентами и т.д. Учитывая довольное высокое содержание серы в шихте, по нашему мнению, не следует отвергать возможность частичной десульфурации металла в окислительных условиях в конце плавления и в окислительный период плавки (кратность шлака 0,05…0,07), особенно в современных печах, использующих вспененные постоянно обновляющиеся шлаки, обеспечивающие довольно большую величину удельной поверхности контакта шлак-металл. Наши данные (рис. 3.3) свидетельствуют о возможности получения заметных значений коэффициента распределения серы в окислительный период плавки в 100-тонной печи, особенно при повышении основности шлака, и соответственно о возможности удаления в это время до 20 % серы, содержащейся в шихте.

Кроме того, видно (рис. 3.4), что десульфурирующая способность шлаков окислительного периода полностью не использовалась и фактическая концентрация серы в металле в конце окислительного периода превышала равновесную со шлаком (рассчитанную по формуле Морозова). Причины этого – небольшая длительность окислительного периода и повышенная окисленность металла.
Десульфурация металла шлаком
Сера, как правило, является вредной примесью в металле.
Полнота десульфурации металла определяется равновесным распределением серы между шлаком и металлом и кинетикой процесса перехода серы в шлак.
Переход серы из металла в шлак по реакции
не может протекать без одновременного перехода других ионов, необходимого для компенсации избыточных зарядов на границе металл – шлак.
Реакция (1) является процессом восстановления серы.
Отсюда → вывод о необходимости для успешной десульфурации восстановительных условий, т.е. безокислительного шлака с малым содержанием оксидов железа.
(Fe 2+ ) = [Fe] + 2e , (3)
Тогда суммарные уравнения десульфурации металла
[S] + (O 2– ) = (S 2– ) + [O] , (4)
[Fe] + [S] = (Fe 2+ ) + (S 2– ). (5)
При молекулярной записи нужно учесть различия в энергиях взаимодействия анионов О 2– и S 2– с катионами шлака.
Крупные анионы S 2– наиболее устойчивы в окружении слабых катионов, представленных в обычном шлаке катионами Са 2+ при наличии в нем СаО.
Сильные анионы О 2– преимущественно связаны с сильными катионами Fe 2+ .
Тогда реакции десульфурации могут быть записаны в виде:
[S] + (CaO) = (CaS) + [O] , (6)
[FeS] + (CaO) = (FeO) + (CaS) . (7)
Удаление серы из металла в шлак идет за счет реагентов, образующих более прочные и существенно менее растворимые, чем FeS, в железе сульфиды CaS, MgS, MnS, Na2S .
Из уравнений (6) и (7) следует, что для смещения равновесия вправо, то есть для более полной десульфурации, необходимо
– увеличивать в шлаке содержание CaO (повышать основность шлака),
– уменьшать содержание FeO (понижать окислительную способность шлака). Иначе, для удаления серы необходим основной восстановительный процесс.
Из уравнений для констант равновесия
получим выражения для коэффициента распределения серы между шлаком и металлом
где g – коэффициент пересчета на (S) в мас.%.
Выражения (9) позволяют более строго прогнозировать влияние состава шлака на полноту десульфурации, величину LS..
1) Повышение основности при введении CaO и других основных оксидов ведет к увеличению концентрации ионов О 2– и .
Однако полнота десульфурации при этом различна.
Так, частичная замена СаО на MnO или MgO ухудшает десульфурацию. Это связано с энергетической неравноценностью катионов Ca 2+ , Mn 2+ и Mg 2+ .
Иначе, замена слабых катионов Са 2+ на более сильные Mn 2+ или Mg 2+ приводит к усилению взаимодействия катионов с анионами О 2– и S 2– , причем в большей степени с сильными анионами О 2– , чем с S 2– . Это проявляетcя в понижении и . За счет большего уменьшения по сравнению с отношение / уменьшается и падает значение .
2) Увеличение содержания SiO2 и других оксидов, связывающих О 2– в комплексные ионы, ведет к уменьшению и .
При этом влияние SiO2, Al2O3, P2O5 неодинаково, что также связано с энергетической неравноценностью катионов, образующих оксид. Чем сильнее катион взаимодействует с О 2– , тем меньше активность и меньше полнота перехода серы из металла в шлак.
Вывод о связанном с увеличением отрицательном влиянии повышения концентрации (FeO) на полноту десульфурации, также вытекает из выражения (9).
3) Влияние состава металла на полноту десульфурации металла связано с двумя обстоятельствами:
а) изменением величин коэффициентов активностей и ;
б) изменением состава шлака за счет химических реакций рафинирования и раскисления металла.
Наличие в железе P, Al, а также, что более важно для практики, Si и C, значительно повышающих коэффициент активности серы в металле , увеличивает .. С этим связаны значительно более благоприятные условия десульфурации чугуна по сравнению со сталью.
Марганец, напротив, уменьшает , что должно приводить к уменьшению . Однако марганец, как Si и Al, является раскислителем (или восстановителем). Понижая концентрацию кислорода в металле [O] и восстанавливая железо из шлака (уменьшая ), марганец, как и другие раскислители, согласно уравнениям (9) способствует более глубокой десульфурации.
Наличие в металле элементов с меньшим, чем у железа, сродством к кислороду и одновременно слабо влияющих на , практически не изменяет полноту десульфурации.
4) Данные о влиянии температуры на полноту десульфурации металла противоречивы. Роль температуры следует связывать с кинетикой процесса, которая в производственных условиях определяет результаты десульфурации.
При кинетическом анализе рассматриваемого процесса его можно представить состоящим из следующих стадий:
1. Диффузии атомов серы из объема металла к границе металл – шлак;
2. Собственно электрохимической реакции и перехода образовав-шегося иона S 2– в пограничный слой шлака;
3. Диффузии ионов серы в объем шлака;
4. Параллельных процессов диффузии в металле и шлаке и перехода через границу шлак – металл частиц (Fe, Si, Mn, C, O), сопровождающих десульфурацию.
Имеющиеся данные указывают, что собственно реакция протекает достаточно быстро, а лимитирующими стадиями являются диффузионные процессы.
Подтверждением этому служит зависимость скорости десульфурации от перемешивания расплавов, величины поверхности их контакта, вязкости шлака и толщины его слоя.
Если учесть, что вязкость шлака сильно зависит от температуры, то понятно, почему десульфурация стали более эффективна при повышенных температурах.
Влияние указанных факторов и других, связанных с составом шлака и меняющих его свойства, можно выявить из уравнения для скорости десульфурации, полученного методами диффузионной кинетики для гетерогенных процессов:
где – коэффициент диффузии серы в шлаке; Fм–ш – поверхность раздела металл–шлак; – толщина непромешиваемого слоя шлака; [S] и (S)V – концентрация серы в металле и объеме шлака; – коэффициент распределения серы между металлом и шлаком.
Из уравнения (10) следует:
1. В начале процесса, когда , можно значением пренебречь.
Тогда скорость пропорциональна концентрации , что соответствует реакции I порядка.
2. Коэффициент диффузии возрастает с ростом температуры. Значит, при ↑Т→V ↑.
Это связано и с повышением жидкотекучести или уменьшением вязкости шлака.
По данным Есина и Шихова повышение Т на 60 о увеличивает V в 1,1–1,2 раза, но это не связано с термичностью реакции или, иначе, с термодинамическими факторами. Экзотермический тепловой эффект реакции перехода (хотя и слабый) должен был соответствовать уменьшению с ростом Т, а напрямую из уравнения (10), и уменьшению скорости V.
Раскисление стали
К концу окислительного рафинирования при уменьшении концентрации [C] ниже 0,15 % содержание кислорода в металле резко увеличивается.
Рис. Зависимость [O] от [C] при 1600 0 С и РCO = 1 атм:
1 – равновесные концентрации;
2 – одна из возможных кривых с фактическими
Оно превышает равновесное для реакции обезуглероживания и на несколько порядков выше растворимости кислорода в твердом железе.
Поэтому при кристаллизации такого металла возникают нежелательные явления:
– образование газовых пузырей СО, снижающих плотность слитка;
– выделение по границам зерен металла включений оксидов железа, их растворов с сульфидами и легкоплавких эвтектик (это приводит к красноломкости стали).
Необходимо удаление из жидкой стали избыточного кислорода, что и называют раскислением.
Раскисление можно осуществить тремя способами:
– обрабатывая металл раскислительным шлаком с пониженным содержанием оксидов железа;
– вводя в металл элементы-раскислители;
– снижая парциальное давление СО над металлом.
Эти способы называются:
При диффузионном раскислении кислород переходит (диффундирует) в шлак,
а при вакуумировании – в виде СО в газовую фазу.
В этих случаях в металле не образуются и не остаются в нем включения, что является основным достоинством этих способов раскисления.
Вместе с тем эти способы требуют:
– наличия либо небольшого количества шлака в агрегате для уменьшения сложностей преобразования его из окислительного в восстановительный,
– либо проведения раскисления в других агрегатах.
Поэтому наиболее распространенным способом раскисления является осаждающее, когда в сталь вводят элементы, обладающие более высоким сродством к кислороду, чем железо (Mn, Si, Al, Ti, Ca и др.).
Соединяясь с кислородом, они создают простые или сложные оксиды, образующие одну или несколько самостоятельных фаз в виде мелкой взвеси, которая из-за малой плотности частично всплывает в шлак, а частично остается в затвердевшем металле в виде неметаллических включений, обычно ухудшающих его качество.
Раскислительная способность элемента определяется равновесной концентрацией кислорода, растворенного в железе, при определенной концентрации этого элемента при данной температуре. Чем меньше [O] при заданном содержании [Me], тем выше раскислительная способность вещества.
Реакцию раскисления можно записать в общем виде:
Константа равновесия реакции . (2)
Из уравнения (3) видно, что раскислительная способность элемента определяется его природой (величиной константы равновесия) и температурой.
Значения можно найти из известных выражений температурных зависимостей для реакций образования различных оксидов из элементов, растворенных в железе.
Чем выше химическое сродство элемента к кислороду, т.е. меньше алгебраическая величина , тем больше , тем выше раскислительная способность элемента.
Из выражений (2) и (3) следует, что с увеличением содержания раскислителя в железе [Me] уменьшается остаточное содержание [O].
Однако такой качественный вывод не всегда верен.
Ее анализ требует учета, по крайней мере, двух закономерностей.
1. В различных интервалах концентраций [Me] идет образование продуктов раскисления в разных состояниях, или различных продуктов раскисления.
· жидкие растворы оксида раскислителя с другими оксидами (шлак);
· химические соединения (сложные оксиды) – силикаты, алюминаты и другие;
· чистые оксиды, например, корунд Al2O3, кристобалит SiO2 и другие.
Только в последнем случае ; в других случаях , и это должно приводить к пониженным значениям [O].
Отсюда вытекает принципиально разный вид зависимости [O] от [Me] в разных интервалах концентраций [Me].
Отсюда также понятна эффективность использования комплексных раскислителей, таких как силикомарганец, силикокальций и других. При наличии двух-трех элементов-раскислителей в сплаве продукты раскисления, как правило, оказываются в растворе с пониженными активностями, что обусловливает снижение [O] по сравнению с применением каждого элемента-раскислителя в отдельности.
2. Изменение концентрации [Me] приводит к изменению коэффициентов активностей и . Согласно данным о параметрах взаимодействия элементы-раскислители уменьшают , и это должно приводить к увеличению значения [O].
В связи с двояким влиянием концентрации раскислителя [Me] –
из-за уменьшения , зависимость [O] от [Me] имеет экстремальный характер с минимумом [O] при определенном для каждого раскислителя значении его концентрации,
Выше этого значения с увеличением [Me] наблюдается повышение остаточной концентрации кислорода.
Таким образом, соотношение между и может оказаться решающим, и различие элементов по раскислительной способности может быть иным, чем это следует из простого сравнения химического сродства их к кислороду, определяемого значениями .
Результаты раскисления определяются во многом и кинетикой процесса.
С кинетической точки зрения осаждающее раскисление состоит из следующих стадий:
1) растворение раскислителя и равномерное распределение его в объеме металла;
2) химическая реакция;
3) удаление из металла продуктов раскисления.
Химическая реакция между раскислителем и кислородом в расплаве при температурах жидкой стали проходит практически мгновенно.
Поэтому время, необходимое для раскисления, определяется скоростью растворения раскислителя и распределения его в металле. В связи с этим для ускорения процесса раскислители вводят в сталь в виде сплавов, температура начала плавления которых ниже температуры металла. При этом более эффективны раскислители с большой плотностью.
Для продуктов раскисления – оксидов, напротив, желательна меньшая плотность. Такие продукты раскисления быстрее всплывают в шлак. Для оценки скорости всплывания сферических частиц малого размера в неподвижной среде можно использовать формулу Стокса:
где g – ускорение силы тяжести, – коэффициент динамической вязкос-ти среды (расплавленной стали); r – радиус частиц; – плотности металла (стали) и частиц (неметаллических включений).
Формула показывает, что повышение температуры стали, ведущее к снижению ее вязкости, должно ускорять удаление неметаллических включений в шлак.
Основными же факторами, определяющими скорость подъема частиц, являются размер и форма неметаллических включений. В момент своего образования продукты реакции – зародыши новой фазы имеют весьма малые размеры. Затем происходит их укрупнение вследствие коалесценции (слияния капелек) и коагуляции (слипания мельчайших кристалликов). Слипание твердых частиц имеет небольшое развитие. Жидкие частицы укрупняются несравненно быстрее и поэтому, имея большие размеры и сферическую (глобулярную) форму, быстро удаляются из раскисляемого металла.
Для более полного удаления из стали неметаллических включений желательно и необходимо применять такие раскислители, которые образуют продукты взаимодействия с кислородом с температурой плавления ниже температуры жидкой стали. Этому условию не удовлетворяют чистые оксиды (MnO, SiО2, Al2O3 и др.), но удовлетворяют их легкоплавкие растворы и некоторые химические соединения, например, силикаты железа, марганца и др., получающиеся при применении комплексных раскислителей.
Таким образом, выбор раскислителей определяется не только сродством их к кислороду, но и необходимостью эффективного осуществления реакции раскисления и удаления неметаллических включений из металла.
Пример . Рассчитать равновесную концентрацию кислорода в расплавленном железе [%О] , раскисленном Si и Mn, остаточные концентрации которых равны 0,2 и 1,0 %(мас) при Т = 1873К. Считать, что продукты раскисления образуют совершенный раствор.
Полученный результат сравнить с данными расчетов по раскислению железа только кремнием с образованием SiO2(ТВ) и только марганцем с образованием MnO(ТВ).
Решение. Реакции раскисления железа кремнием и марганцем:
Константы равновесия реакций (3)
Здесь в I приближении считаем металлический раствор идеальным.
и – молярные доли компонентов в совершенном оксидном растворе, причем
Подставляем в выражение (5) и из (3) и (4).
Из табличных данных для реакций
вычисляем для Т = 1873К и
Из выражения (6) определяем
При раскислении железа только кремнием с образованием SiO2(ТВ) по реакции
При раскислении железа только марганцем с образованием MnO(ТВ) по реакции
Совместное раскисление кремнием и марганцем приводит к меньшим концентрациям кислорода в расплавленном железе
Количественно проявилась эффективность использования комплексного раскислителя, такого как силикомарганец.
При наличии двух элементов-раскислителей в сплаве продукты раскисления оказываются в растворе с пониженными активностями, что обусловливает снижение [O] по сравнению с применением каждого элемента-раскислителя в отдельности.
УДАЛЕНИЕ СЕРЫ ИЗ МЕТАЛЛА
11.6.1. Раствор серы в железе.При растворении серы в металле выделяется тепло:
ΔGº= -72 000-10,25 T,
что является показателем определенных связей между серой и железом в растворе. Несмотря на относительно низкую температуру испарения (445 °С), сера в элементарном виде в газовую фазу практически не переходит, что также свидетельствует о сильных связях серы с железом. Об этом же свидетельствует значительное отрицательное отклонение раствора серы в чистом железе от закона Генри. На диаграмме состояния сплавов Fe-S при 50ат.% S наблюдается максимум, характерный для образования химического соединения (в данном случае FeS), поэтому предполагается наличие сильной ионной связи между ионами Fe 2+ и S 2- . Косвенным свидетельством образования достаточно прочных группировок Fe-S является также наблюдаемое значительное повышение вязкости железа при увеличении в нем содержания серы. Серу, растворенную в жидком металле, обычно обозначают [S]. Принято считать, что процесс перехода серы из металла в шлак происходит на границе со шлаком:
[Fe 2+ ] + [S 2 -] ↔ (Fe 2+ ) + (S 2 -) или
Можно также представить процесс как взаимодействие на поверхности контакта металл—шлак с образованием ионов серы в шлаке и атомов кислорода в металле: [S] + (О 2- ) = (S 2- ) +
+ [О]. Иногда это выражение суммируют с уравнением распределения кислорода между металлом и шлаком:
[S] + (О 2 -) = (S 2 -) + [О].
Для упрощения процесс перехода серы из металла в шлак часто условно обозначают
11.6.2. Влияние серы на качество стали.Сера обладает неограниченной растворимостью в жидком железе и ограниченной в твердом. Предельная растворимость серы в -Fе при 1365 ºС составляет 0,05 %, а при 1000 °С — 0,013%. В -Fе растворимость серы снижается до 0,002-0,003 % при комнатной температуре. При кристаллизации стали по границам зерен выделяются застывающие в последнюю очередь сульфиды железа. Железо и сульфид железа образуют низкоплавкую эвтектику (температура плавления 988 °С), которая в присутствии кислорода из-за образования оксисульфидов плавится при еще более низких температурах. Межзеренные прослойки (обычно на микрошлифе они имеют вид нитей) фазы, богатой серой, при нагревании металла перед прокаткой или ковкой размягчаются, и сталь теряет свои свойства, происходит разрушение металла (красноломкость) 1 . Красноломкость особенно сильно проявляется в литой стали (в виде рванин и трещин), так как сульфиды и оксисульфиды в этом случае скапливаются по границам первичных зерен. Если сталь хотя бы однократно подвергалась горячей деформации, то вследствие измельчения зерна и образования при деформации новых зерен красноломкость проявляется в гораздо меньшей степени. Однако и в этом случае стремятся получить в стали минимальное содержание серы, так как вредное влияние серы на механические свойства (в частности, на ударную вязкость) заметно, особенно в направлении, поперечном оси прокатки или ковки.
'Углеродистая сталь приобретает ярко-красный цвет при температуре 900—1000 ºС (цвет каления). Причиной красноломкости может быть также повышенное (более 0,4— 0,5 %) содержание меди; при высоких температурах могут образовываться местные скопления структурно-свободной меди, в результате чего при деформации металла могут возникнуть поверхностные надрывы и трещины.
В катаных или кованых изделиях сульфидные включения обычно вытянуты в виде строчек в направлении горячей пластической деформации, что нарушает сплошность структуры проката или поковки, поэтому в тех случаях, когда нагрузка направлена поперек оси деформации, т. е. перпендикулярно строчкам, стальная матрица разрывается по границам раздела с сульфидами; соответственно снижается пластичность стали в поперечных образцах. Это особенно важно учитывать при изготовлении изделий, подвергающихся знакопеременным нагрузкам или нагрузкам в поперечном (относительно оси прокатки) направлении (трубы для газопроводов высокого давления, резервуары, конструкции для платформ морского бурения и пр.). Степень анизотропии свойств уменьшается по мере снижения содержания серы (рис. 11.12); при снижении содержания серы < 0,003 % степень анизотропии приближается к 1.
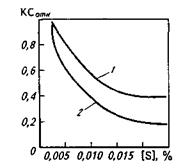
Рис. 11.12.Влияние концентрации серы в стальных бесшовных трубах на относительную ударную вязкость КСОТН, т. е. отношение ударной вязкости на поперечных образцах к ударной вязкости на продольных (Г) и ударной вязкости на вертикальных образцах к ударной вязкости на продольных образцах (2)
Сульфиды отрицательно влияют на результаты испытаний поперечных образцов при пониженных температурах, заметно повышая порог хладноломкости, что, например, особенно важно при разработке технологии производства труб большого диаметра для газопроводов Крайнего Севера. Помимо максимального снижения содержания серы для получения стали с особыми вязкими свойствами принимают специальные меры с целью получить сульфиды в глобулярной форме (а не в виде строчек). Для этого сталь обрабатывают ЩЗМ (кальцием, барием) и РЗМ (лантаном, церием, иттрием и др.).
Активность серы в жидкой стали зависит от состава расплава. Такие примеси, как углерод, кремний, повышают активность серы в жидком расплаве (рис. 11.13). В связи с этим десульфурация чугуна, содержащего большое количество углерода и кремния, при прочих равных условиях происходит легче, чем десульфурация обычной стали.
Сера является поверхностно-активным элементом, в результате чего на поверхности раздела фаз концент рации серы выше, чем в объеме раствора, поэтому наибольший эффект дают такие методы ведения плавки, которые обеспечивают увеличение поверхности контакта металла с десуль-фурирующей фазой (искусственное перемешивание металла со шлаком, вдувание в металл тонкоизмельченных порошкообразных реагентов и т.д.). Приходится, однако, учитывать, что некоторые другие примеси металла также поверхностно-активны. Если в металле присутствует несколько поверхностно-активных примесей, то между ними происходит как бы «борьба за поверхность». В металле, например, всегда содержится какое-то количество кислорода. Кислород также поверхностно-активен, поэтому в тех случаях, когда в металле много кислорода (металл окислен), на поверхности контакта металла с десульфури-рующей фазой присутствует много кислорода и реакция десульфурации идет с трудом. Если содержание кислорода в металле снизить до определенного уровня (< 0,01 %), то адсорбция серы становится большей, чем адсорбция кислорода, и скорость, и степень удаления серы из металла резко возрастают (рис. 11.14).
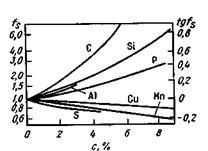
Рис. 11.13.Влияние компонентов расплава на активность серы в жидкой стали
11.6.4. Элементы-десульфураторы.Элементы, у которых величина ΔGº при образовании соединений с серой меньше, чем при соединении серы с железом, могут быть десульфуратора-ми. Такими элементами являются Mn, Mg, Na, Ca, а также РЗМ, например церий. Все эти элементы используют на практике: натрий — в виде соды при внедоменной десульфурации чугуна; магний — в чистом виде
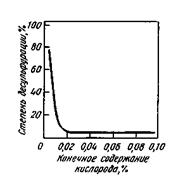
Рис. 11.14.Взаимозависимость окисленнос-
ти металла и десульфурации при продувке
или в виде сплавов (лигатур) с другими металлами при модифицировании чугуна, предназначенного для литья, а также при десульфурации передельного чугуна (в тех случаях, когда нужно иметь чистую шихту); кальций — иногда в виде сплавов с другими металлами, а чаще в виде извести (СаО) или известняка (СаСО3); марганец — в виде сплавов марганца с железом, а также в виде марганцевой руды.
Очень большим химическим сродством к сере обладают РЗМ.
11.6.5. Десульфурация в сталеплавильном агрегате.Самым дешевым и доступным десульфуратором является известь (или известняк). Взаимодействие между известью СаО, растворенной в шлаке, и серой, растворенной в металле, может быть представлено как: 1) переход серы из металла в шлак и взаимодействие серы и СаО в шлаке (FeS) + (СаО) = (CaS) + (FeO);
2) взаимодействие на границе металл-шлак Fe + [S] + (СаО) = (CaS) +(FeO),
Чем выше в шлаке активность СаО и ниже активность FeO и серы, тем меньше остается серы в металле.
Для характеристики способности шлака «извлекать» из металла серу часто используют более простое выражение: s = (S)/[S]. Величину 4S называют обычно коэффициентом распределения серы, имея в виду, что сера хорошо растворяется и в металле, и в основном шлаке, т. е. в данном случае могут быть использованы положения закона распределения. При повыше-
нии температуры значение S обычно возрастает, так как при этом улучшается растворение частичек извести, взвешенных в шлаке, а также ускоряется процесс диффузии серы из объема металла к поверхности металл-шлак.
Соединение CaS очень прочно. Изменение энергии Гиббса при образовании CaS составляет:
ΔGº = -702500 + 193,34Г.
Практически сера, перешедшая из металла в основный шлак, обратно из шлака в металл не переходит (если шлак имеет достаточную основность). В кислых шлаках активность СаО ничтожно мала и в них сера из металла не переходит.
Влияние состава шлака на распределение серы иллюстрирует рис. 11.15, из которого видно, что повысить степень десульфурации (увеличить отношение (S)/[S]) можно двумя способами: либо повысить основность шлака, либо понизить его окисленность. При ведении плавки в окислительных условиях получить малоокисленный шлак (низкие значения a(FеO) ) трудно, поэтому достигаемые значения коэффициента распределения серы в этих условиях обычно малы ( s < 10).
11.6.6. Десульфурация синтетическим шлаком в ковше.Десульфурацию металла можно осуществлять в ковше при помощи синтетических шлаков с высокой активностью СаО
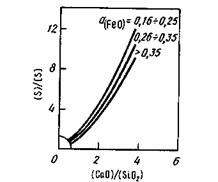
Рис. 11.15.Распределение серы между шлаком и металлом в зависимости от основности шлака и o(Feo)
Шлак выплавляют в отдельном агрегате. Для снижения температуры плавления в состав шлака вводят ряд компонентов (прежде всего А12О3). Основным требованием к химическому составу такого шлака является отсутствие оксидов железа. Удовлетворительные результаты по десульфурации при обработке металла синтетическим шлаком получаются в том случае, если удается при выпуске металла в ковш полностью отсечь (не допустить попадания) тот шлак, который был в агрегате в конце плавки и который содержит большое количество оксидов железа. Для увеличения поверхности контакта металла и шлака, а также степени перемешивания выпуск металла в ковш, в который предварительно залит жидкий синтетический шлак, стремятся организовать с большой высоты. Если условия не позволяют установить отдельный агрегат для приготовления жидкого шлака, то в ковш перед выпуском забрасывают смесь из твердых извести СаО и плавикового шпата CaF2. Расход такой смеси не может быть значительным из-за опасности охладить металл, однако даже небольшое количество смеси (до 1 % от массы металла) приводит к заметному уменьшению содержания серы. При введении в металл раскислителей значения a [O] и a (FeO) снижаются, уменьшается и содержание серы.
Интенсивное перемешивание металла со шлаком при выпуске продолжается всего несколько минут, в течение которых металл выпускают в ковш, поэтому десульфурирующая способность находящегося в ковше шлака при этом полностью не используется. Для более полной десульфурации хорошо раскисленный металл, находящийся в ковше под слоем шлака, подвергают перемешиванию (обычно продувкой инертным газом). Для предотвращения окисления металла атмосферным воздухом (повышения значения a (Feo)) ковш накрывают крышкой.
11.6.7. Удаление серы в газовую фазу.Некоторое количество содержащейся в металле серы в процессе плавки может быть окислено и удалено в газовую фазу. Окисление серы может идти по следующим реакциям:
1) между серой и кислородом, растворенными в металле:
2) между оксидами железа шлака и серой в шлаке
3) на поверхности шлака при взаимодействии с окислительной газовой фазой
4) в случае проникновения кислородной струи в глубь металла
Большого развития эти реакции не получают. В расчетах обычно принимают, что 5—10 % серы от исходного ее содержания в шихте переходит в газовую фазу. В тех случаях, когда в газовой фазе также содержится сера (обычно в результате использования сернистого топлива), может иметь место не удаление, а поглощение ванной серы. Сера может удаляться в газовую фазу также в вакууме (в результате ее испарения). Однако процесс идет очень медленно и может быть ускорен при содержании в расплаве компонентов, повышающих активность серы (углерод, кремний). В газовой фазе в этих случаях обнаруживаются соединения типа CS, COS, CS2, SiS. Однако и при достаточно высоких концентрациях углерода и кремния процесс удаления серы в газовую фазу идет медленно (рис. 11.16), поэтому влиянием его при проведении ориентировочных расчетов можно пренебречь.
11.6.8. Скачивание шлака.ПомимоПОВЫШеНИЯ a (СаО) и снижения a (Feo) существенное значение при десульфурации имеет снижение активности серы в шлаке. Это достигается повышением основности шлака и обновлением шлака. Скачивание шлака, содержащего серу, и наведение нового шлака при помощи чистых от серы добавок (прежде всего СаО) существенно снижают содержание серы в шлаке, и при сохранении постоянства отношения s=(S)/[S]
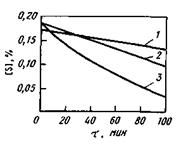
Рис. 11.16.Влияние содержания углерода и
кремния на удаление серы из железа при
плавке в вакууме:
1 — чистое железо; 2— 1,3% С; 3— 1,0% Si
содержание серы в металле [S] соответственно уменьшается. Скорость перехода серы из металла в шлак в данном случае определяется скоростью диффузии, поэтому роль температуры металла и перемешивания ванны возрастает. Если условия не позволяют организовать скачивание шлака, то приходится при помощи введения в шлак не содержащих серу материалов (прежде всего СаО) увеличивать количество шлака и тем самым снижать концентрацию серы в шлаке и ее активность.
Таким образом, основными условиями, необходимыми для успешного проведения операции десульфурации, являются: 1) высокая активность СаО в шлаке; 2) низкая активность оксидов железа в шлаке; 3) низкая активность кислорода в металле (раскислен-ность металла); 4) малая активность (низкое содержание) серы в шлаке; 5) высокая температура; 6) большая площадь контакта металла с десульфу-рирующим шлаком. На практике для обеспечения этих условий используют следующие технологические приемы:
1. Вводят добавки извести (СаО) или известняка (СаСО3).
2. Для получения активного жидко-подвижного шлака и повышения тем самым активности СаО в шлак вводят добавки (А12О3, CaF2, MnO и др.), снижающие его вязкость. Эти добавки ускоряют протекание процесса ошлако-вания введенных кусков извести.
3. Проводят обновление шлака (скачивание его с последующим наведением нового шлака, не содержащего серы).
4. Стремятся использовать для десульфурации те периоды плавки, в которые металл максимально нагрет (при высокой температуре ванны энергично окисляется углерод, получает развитие реакция [С] + (FeO) = СО + Fеж и активность оксидов железа в шлаке понижается, при этом улучшаются условия перемешивания металла со шлаком; при высокой температуре ванны ускоряются процессы ошлакования извести и увеличивается a(СаО) при высокой температуре возрастает интенсивность диффузионных процессов и облегчаются условия диффузии серы из объема металла к поверхности контакта со шлаком).
5. Металл обрабатывают жидкими или твердыми синтетическими шлаками и шлаковыми смесями с высокой a(СаО) и низкой a (Feo)
6. Когда хотят получить сталь с особо низким содержанием серы, вдувают в металл в струе инертного газа высокоосновные шлаковые смеси (СаО + CaF2), а в особых случаях — такие компоненты, как карбид кальция СаС2, или другие сплавы, содержащие кальций, или даже чистый кальций.
7. Используют для десульфурации РЗМ (церий, лантан, неодим и др.).
8. В тех случаях, когда содержание серы в металле должно быть возможно более низким, шихту для плавки специально отбирают, а иногда используют предварительно специально выплавленную чистую (по содержанию серы) шихту (так называемую «шихтовую болванку»).
11.6.9. Роль марганца.Марганец играет особую роль в борьбе с вредным влиянием серы.
Роль марганца в десульфурации проявляется на разных стадиях:
1. При транспортировке чугуна от доменного цеха к сталеплавильному и при выдержке чугуна в миксере определенное развитие получает реакция [Mn] + [S] = (MnS).
2. Марганец, содержащийся в чугуне, быстро окисляется (с выделением тепла), и образующийся при этом оксид марганца МпО ускоряет ошлако-вание кусков извести и в целом ускоряет процесс шлакообразования. Если в чугуне содержится марганец, то в сталеплавильном агрегате в составе шлака всегда имеется МпО; при подаче на шлак струи кислорода МпО окисляется до гаусманита Мп3О4. При взаимодействии Мп3О4 с СаО образуются легкоплавкие соединения и процесс шлакообразования ускоряется. Ускорение шлакообразования ускоряет процесс удаления серы в шлак.
3. Образующийся при окислении марганца МпО непосредственно принимает участие в десульфурации: (МпО) + (FeS) = (MnS) + (FeO).
4. Содержащийся в металле марганец также влияет на процесс десульфурации до момента затвердевания слитка (рис. 11.17).
Практически в готовой стали в большинстве случаев содержится 0,4— 0,8 % Мп, и этот марганец активно взаимодействует с сульфидами железа:
Химическое сродство марганца к сере при понижении температуры возрастает, и постепенно (по мере охлаждения металла и кристаллизации слитка) большая часть серы переходит из FeS в MnS (см. рис. 11.17). При температуре прокатки углеродистой стали (~1100°С) уже при 0,2% Мп около 95 % серы связано в сульфиды марганца. Сульфид MnS имеет температуру плавления, существенно более высокую, чем у сульфида FeS (1610 °С), и при содержании в металле > 0,3 % Мп легкоплавкая сульфидная пленка на границах зерен не образуется
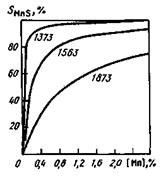
Рис. 11.17.Зависимость доли серы, связанной в MnS, от содержания марганца [Мп]
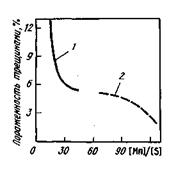
Рис. 11.18.Влияние отношения [Mn]/[S] в готовой стали (1 — Зсп, 2— 17Г1С-У) на пораженность непрерывнолитых заготовок трещинами
Способность марганца уменьшать вредное влияние серы иллюстрирует рис. 11.18. Однако введение марганца не исключает полностью вредного влияния серы на свойства металла. Хрупкие включения MnS, расположенные по границам зерен металла, снижают его пластические свойства и ударную вязкость.
Вводят в сталь для устранения вредного действия серы
Включения серы в сталях можно увидеть.
Сера, как и фосфор, является вредной примесью, попадая в сталь в процессе выплавки (из руды и при сгорании органического топлива). Обычно содержание серы в высококачественной стали ограничено и не превышает 0,02—0,03%. В углеродистой стали обычного качества - не более 0,03—0,04%. При обработке жидкого металла синтетическими шлаками содержание серы можно снизить до 0,005%.
Наличие сульфидов недопустимо для ответственных деталей.
Сера нерастворима в железе, и любое ее количество образует с железом соединение под названием сульфид железа (FeS), который входит в состав эвтектики состава Fe + FeS, образующейся при 988 ºС (рис.1).

Рисунок 1. Фрагмент диаграммы состояния железо-сера.
Обычно сернистая эвтектика, присутствующая в небольшом количестве, коалесцирует, т.е. феррит эвтектики объединяется с ферритом основной массы металла, а соединение FeS располагается по границам зерен в виде цепочки отдельных включений (рис.2,а) или более крупными включениями в виде оторочки по границам зерен (рис.2,б; 3). Такая форма включений серы является особенно вредной, так как при горячей обработке давлением получаются надрывы и трещины. Ну а если вспомнить, что эвтектика имеет наименьшую температуру плавления среди фаз данного сплава, то ясно, что в процессе нагрева стали вокруг оторочек сернистого железа, начиная с температуры 988 ºС, происходит оплавление (т.е. образование расплава в соответствии с диаграммой состояния Fe-S). Поэтому при 800 ºС и выше, т.е. при температуре красного каления, сталь становится хрупкой. О калении на этом сайте сказано в статье «Каленый и закаленный – в чем разница?». Хрупкость стали при температуре красного каления носит название «красноломкость». Поэтому сталь с повышенным содержанием серы не поддается горячей обработке давлением.
 |  |
| а | б |
Рисунок 2. Сульфиды железа в стали 45.

Рисунок 3. Сульфидные включения различной формы в стали 45.
Отдельные обособленные крупные включения сернистого железа (рис.4) уже менее вредны.
 |  |
| а | б |
Рисунок 4. Обособленные включения сульфида железа: нетравленный образец, б – после травления.
Протяженные включения сульфидов железа можно видеть в исходно деформированной стали как в состоянии поставки (нормализация), так и после закалки и отпуска (рис. 5).
 |  |
| а | б |
Рис. 5. Протяженные включения сульфидов железа в нормализованной (а) и в закаленной и отпущенной (б) стали 45
Введение марганца в сталь уменьшает вредное влияние серы, так как при введении его в жидкую сталь протекает реакция образования сульфида марганца:
FeS + Mn MnS + Fe.
Сульфид марганца плавится при 1620 ºС, т.е. при температурах более высоких, чем температура горячей обработки. Сульфид марганца нерастворим также в жидком металле, поэтому невозможно образование легкоплавкой эвтектики с фазой сульфид марганца. Поэтому присутствие сульфида марганца в стали допустимо.
Включения сульфида марганца в сталях, как правило, наблюдаются хорошо. В отсутствие травления (рис.6,а) они имеют вид темных включений. В светлопольном освещении после травления включения светлые (рис.6,б). На том же участке структуры в темном поле (рис.6,в) включения выглядят темными. Здесь употреблен термин «прицельная металлография». Это означает, что один и тот же участок структуры фотографируют, например, до и после травления, чтобы показать особенности структуры. Или до и после какой-нибудь обработки, чтобы заметить изменения в структуре.
 |  |
| а | б |
 | |
| в |
Рисунок 6. Структура стали 1.2312 HASCO (обозначение по DIN 40CrMnMoS86): а – нетравленый шлиф; б – после травления, светлое поле; в – после травления, темное поле; прицельная металлография.
При температурах горячей обработки (800—1200 ºС) сульфид марганца пластичен и под действием внешних сил вытягивается в направлении деформации в виде продолговатых включений (рис.6, а) или цепочек по границам зерна (рис.6, б). Встречаются отдельные крупные включения (рис. 7,а) или в виде сплошной окантовки вокруг зерна (рис. 7,б).
 |  |
| а | б |
Рисунок 6. Крупные (а) и строчечные (б) включения сульфида марганца в структуре стали 1.2312 HASCO.
 |  |
| а | б |
Рисунок 7. Включения сульфида марганца в стали 1.2312 HASCO; без травления.
Сульфиды железа можно наблюдать и в чугуне. Здесь показаны круглые (принято говорить «глобулярные») включения сульфидов в сером феррито-перлитном чугуне на фоне фосфидной эвтектики (рис.8), а также в зернах перлита и феррита (рис.9).

Рисунок 8. Сульфиды в сером чугуне на фоне фосфидной эвтектики.
Читайте также:
