Атомы металла выполняют важные функции входят в состав молекул
Обновлено: 06.07.2024
Молекула хлорида кальция – CaCl2 – содержит один атом кальция и два атома хлора.
Степени окисления
В соответствии с гипотезой Берцелиуса атомы в молекулах сложных веществ имеют положительные или отрицательные заряды, обеспечивающие их взаимное притяжение и устойчивость молекулы. Молекула в целом электронейтральна – сумма всех положительных зарядов равна сумме всех отрицательных. В большинстве учебников эти заряды атомов называют степенями окисления.
Удобно помнить, что в большинстве своих соединений водород имеет степень окисления +1, а кислород -2. Молекула воды Н2О электронейтральна, так как два положительных заряда двух атомов водорода «нейтрализуются» двумя отрицательными зарядами одного атома кислорода.
Знание постоянных степеней окисления водорода и кислорода позволяет рассчитывать степени окисления других элементов, если известна формула молекулы. Это приходится часто делать, поскольку многие элементы в разных соединениях могут проявлять разные степени окисления. Относительным постоянством обладают только водород, кислород, щелочные и щелочно-земельные металлы.
Так электронейтральность молекулы сероводорода Н2S требует, чтобы в ней сера имела заряд -2 (ведь два водорода дали два плюса).
В молекуле оксида серы SO2 сера должна иметь степень окисления +4 (ее заряд должен компенсировать четыре минуса двух атомов кислорода).
В молекуле серной кислоты H2SO4, куда входят два водорода (с «капиталом» +2, четыре кислорода (с «капиталом» -8) сера обязана иметь заряд +6. Любое иное значение не обеспечит электронейтральность H2SO4.
Упражнение 1. Рассчитайте степени окисления выделенных элементов в соединениях: HCl, HClO, NO, N2O5, HNO2, H2SiO3. Закрепите в своем сознании тот факт, что молекула электронейтральна, водород имеетзаряд +1, а кислород -2. Сверьте свои результаты с правильными ответами: -1, +1, +2, +5, +3 и +4, соответственно.
Составление формул химических соединений
Величины степеней окисления обычно учитываются присоставлении формул химических соединений. Это очень помогает, так как уменьшает потребность в заучивании формул.
Еще раз вспомним, что молекулы состоят из атомов. Атомы обозначаются символами элементов. Подстрочные индексы после символа указывают, сколько атомов этого элемента томится в данной молекуле. Атомы имеют положительные или отрицательные заряды, которые и стянули их в молекулу. Молекула же электронейтральна, что достигается тщательнейшим подбором необходимых индексов с учетом степеней окисления элементов.
Пусть элемент А со степенью окисления +3 старается образовать молекулу с элементом В, имеющим степень окисления -4. Расположившись рядом, атомы А и В внимательно посмотрят на заряды предполагаемых партнеров
проведут необходимые расчеты и утвердят индексы для формулы своей молекулы
в которой 12 положительных зарядов четырех атомов А блокируются двенадцатью отрицательными зарядами трех атомов В. В результате получилась простейшая электронейтральная формула.
Если нам неизвестны степени окисления, то формулу молекулы мы не можем составить, и вынуждены выкручиваться за счет памяти, подсматривания или угадывания. Поскольку соединений много, то проще научиться составлять их формулы, чем запоминать. Здесь две трудности – химическая - необходимость знать степени окисления и арифметическая - умение считать в пределах примерно от -12 до +12. Читая дальнейший текст, вы научитесь или вспомните, как узнавать эту степень окисления, столь необходимую для составления химических формул.
Оксиды
Оксиды – это бинарные соединения элементов с кислородом. Иная формулировка - оксиды – это соединения из двух элементов, одним из которых является кислород.
Вам уже, наверно, удалось запомнить, что кислород в оксидах, как и в большинстве сложных соединений, имеет степень окисления -2. Партнер кислорода в оксиде всегда имеет положительный заряд. (Отрицательно заряженные атомы будут отталкиваться от отрицательного кислорода).
Оксиды элементов со степенью окисления +1 будут иметь формулы вида Н2О, Na2O, Cl2O, N2O; со степенью окисления +2 - вида CaO, MgO, CO, NO; со степенью окисления +3 - Al2O3, Cl2O3, N2O3 и т.д.
Скорее всего, вы уже давно думаете о главной загвоздке - степени окисления. Знать бы ее. Это действительно непростой вопрос, так как большинство элементов в зависимости от обстоятельств могут проявлять разную степень окисления. Для ее выяснения есть несколько способов.
Надежную, но неполную информацию дает периодическая таблица. Одна из положительных степеней окисления каждого элемента совпадает с номером группы (вертикального столбца), в которой он находится. Эта степень окисления является высшей, и у многих элементов, кроме первой и второй групп, не единственной. Это позволяет при отсутствии другой информации безошибочно составить формулу хотя бы одного оксида любого элемента.
Упражнение 2. Составьте формулы высших оксидов калия, бария, бора, кремния, фосфора, селена, марганца. Заодно познакомьтесь с символами этих элементов. Сверьте свои результаты с правильными ответами: K2O, BaO, B2O3, SiO2, P2O5, SeO3, Mn2O7.
Полезно также помнить, что большинство металлов, кроме первой группы, способны проявлять степень окисления +2. Однако, железо бывает +2 и +3, медь +1 и +2, золото +1 и +3. Легально всегда можно пользоваться данными о зарядах катионов из таблицы растворимости солей типа табл.2 в приложении 2.
Упражнение 3. Воспользовавшись таблицей растворимости, составьте формулы оксидов лития, стронция, цинка, свинца, железа (Ш) и железа (П). Выувидели, что в двусмысленных случаях (как с Fe) в условии задается конкретизация. Сверьтесь с правильными ответами: Li2O, SrO, ZnO, PbO, Fe2O3, FeO.
Третий и самый надежный способ установить степень окисления - воспользоваться известной или данной формулой соединения- предшественника, как вы это делали в упражнении 1 (стр.72). Пусть надо составить формулу оксида фосфора, соответствующего кислоте Н3РО3. Зная постоянные заряды водорода (+1) и кислорода (-2) и количества их атомов в молекуле, находим из условия ее электронейтральности степень окисления в ней фосфора, равную +3. Соответствующий оксид теперь сможет написать даже мистер Ватсон: Р2О3.
Упражнение 4. Составьте формулы оксидов выделенных элементов, соответствующих соединениям: HClO2, HClO3, HClO4, HCrO2, H2Cr2O7, HNO2, HNO3, H2CO3, HCOOH. Почувствуйте полигамию этих элементов по отношению к своей степени окисления. Сверьтесь с правильными ответами: Cl2O3, Cl2O5, Cl2O7, Cr2O3, CrO3, N2O3, N2O5, CO2, CO.
Еще одна возможность выяснения степени окисления часто вытекает из правильного названия оксида в случае ее неоднозначности: оксид меди (1) – естественно Cu2O, титана (1У) – TiO2, высшего оксида ванадия – V2O5.
Кислоты
Формулы кислот выводим путем примитивного сложения формулы кислотного оксида с молекулой воды:
Обращаем внимание, что в двух последних случаях после сложения найдены простейшие формулы образовавшихся молекул.
Отметим, что степени окисления элементов в этих реакция не меняются.
Полезно также вспомнить, что кислотные оксиды образуют неметаллы в любой степени окисления (три исключения: NO, N2O, CO) и металлы в степени окисления +4 или выше.
Упражнение 5. Составьте формулы ниобиевой, циркониевой и хромовой кислот, соответствующих их высшим оксидам. Здесь нарочно подобраны малознакомые элементы, чтобы можно было убедиться в отсутствии необходимости запоминания формул. Сверьтесь с правильными ответами: HNbO3, H2ZrO3, H2CrO4.
В таблице 1 риложения 2 приведены формулы и названия наиболее употребительных кислот и их нормальных солей.
Основания
Основания имеют общую формулу
Здесь М – металл в степени окисления от +1 до +3. ОН - - гидроксильная группа или гидроксил: ее заряд складывается из степени окисления кислорода (-2) и водорода (+1). Количество гидроксильных групп (х) в молекуле основания равно степени окисления металла. Величины степеней окисления металлов, образующих основания, представлены в таблице растворимости (табл.2 в приложении 2).
Примеры: гидроксид натрия NaOH;
гидроксид магния Mg(OH)2;
гидроксид железа (П) Fe(OH)2;
гидроксид железа (Ш) Fe(OH)3.
Нормальные (средние) соли
Выше рассмотрено составление формул трех основных классов неорганических соединений – оксидов, кислот и оснований. Осталось рассмотреть четвертый и последний класс – соли. На этом изучение азов химической грамотности можно будет считать законченным.
Нормальная соль представляет собой соединение металла с кислотным остатком. Новеньким здесь является то, что партнером положительно заряженного атома металла в соли является не один отрицательный элемент, как в оксидах, а чаще всего группа атомов, называемая кислотным остатком. И конечно, при составлении формулы электронейтральной молекулы соли удобно учитывать заряд сразу всей группы.
Заряд кислотного остатка плавно вытекает из формулы соответствующей кислоты. Кислотный остаток – это «овдовевшая» часть кислоты, которая остается после того, когда молекулу кислоты покидает водород. Поскольку водород уходит вместе со своим положительным зарядом, то кислотный остаток имеет отрицательный заряд, сохраняя надежду на соединение с какой-нибудь положительной частицей.
Вспомним некоторые определения. Нейтральные молекулы кислот, оснований и солей способны в воде распадаться на положительно и отрицательно заряженные частицы. Эти заряженные частицы называютионами. Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Вещества, способные распадаться на ионы называют электролитами.Процесс распада молекул электролитов на ионы называется электролитической диссоциацией.
При диссоциациикислот всегда отщепляются катионы водорода (Н + ).Величина отрицательного заряда кислотного остатка в точности равна количеству ушедших ионов водорода, так как после ухода каждого «плюса» разблокируется один «минус».
Примеры диссоциации кислот:
Отметим, что правильнее было бы брать весь кислотный остаток в скобки и потом проставлять величину его заряда, чтобы не путать со степенью окисления кислорода. Видимо, чтобы не затруднять печатные станки созданием лишних скобок, химики договорились знак заряда иона ставить после цифры. Величины степеней окисления атомов записывают +1; +2; +3; -1; -2; -3 и т.д. Значения зарядов ионов пишут справа вверху формулы иона так: 1+; 2+; 3+; 1-; 2-; 3- и т.д. Цифру 1 часто в этих записях опускают. Никакой принципиальной ошибки при нарушении этих правил, естественно, не возникает.
Нормальные соли состоят из атомов металла и обычных кислотных остатков. Если известны заряды партнеров, то составление формулы сводится к элементарной задаче подбора и расстановки индексов, обеспечивающих электронейтральность сооружаемых молекул. Образно, говоря, при составлении формулы соли катион (металла) припарковывается возле аниона (кислотного остатка). Затем оба партнера «с тревогой» всматриваются в заряды друг друга и вычисляют необходимые индексы для создания электронейтральной частицы (молекулы). Бросив контрольный взгляд на заряды и индексы, следует окончательно убедиться в электронейтральности образованного продукта.
Соли, составленные из вышеуказанных кислотных остатков с одновалентным калием, будут выглядеть так:
с двухвалентным магнием так:
а с трехвалентным алюминием так:
Итак, главная проблема – знание зарядов составных частей – катионов и анионов. Про заряды кислотных остатков (анионов) сказано на предыдущей странице. Заряды катионов металлов в большинстве случае равны 2+, кроме металлов первой группы периодической системы (К + , Na + ), алюминия (Al 3+ ), железа (Fe 2+ и Fe 3+ ) и некоторых других. Чтобы не особенно напрягать свою ленивую память можно просто по-чаще пользоваться таблицей растворимости солей (приложение 2), где указаны заряды достаточно большого количества катионов и анионов. Частое использование этой таблицы обеспечит самозапоминание постоянно встречающихся значений.
Названия солей ряда кислот представлены в табл. 1 приложения 2. Поупражняйтесь в использовании табл.1 и табл. 2 этого приложения, составляя формулы нормальных солей:
Тема №1. Строение и свойства металлов.
Основными элементарными частицами, из которых строятся все вещества, являются протоны, нейтроны и электроны. Протоны имеют положительный заряд, электроны – отрицательный, нейтроны являются нейтральными частицами, не имеющими заряда. Согласно упрощенной модели Нильса Бора атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны, компенсируя положительный заряд ядра. Ядро состоит из протонов и нейтронов. Электроны располагаются вокруг ядра несколькими слоями – оболочками.
Газы, жидкие и твердые тела состоят из атомов, молекул или ионов. Молекулами называют электрически нейтральные частицы, образованные из двух или более связанных ковалентными связями атомов (часто к молекулам причисляют также и свободные атомы). Ион – это электрически заряженная частица (атом или молекула), получаемая в процессе ионизации.
В зависимости от строения внешних электронных оболочек атомов в молекулах могут образовываться различные виды связей.
Ковалентная связь возникает при обобществлении электронов двумя соседними атомами. Иными словами происходит образование общей пары электронов, которые ранее принадлежали отдельным атомам. При образовании общей одной пары электронов от каждого объединяемого атома вносится по одному валентному электрону. Например:
Молекулы, в которых центры положительных и отрицательных зарядов совпадают, являются неполярными. Если же в отдельных молекулах центры противоположных по знаку зарядов не совпадают и находятся на некотором расстоянии друг от друга, то такие молекулы называются полярными или дипольными.
Ионная связь определяется силами притяжения между положительными и отрицательными ионами.
Металлическая связь. Металлы можно рассматривать как системы, построенные из расположенных в узлах решетки положительно заряженных ионов, находящихся в среде свободных электронов
Молекулярная связь (связь Вандер-Вальса). Такая связь существует в некоторых веществах между молекулами с ковалентными внутримолекулярными связями. Межмолекулярное притяжение в этом случае обусловливается согла сованным движением валентных электронов в соседних молекулах. В любой момент времени электроны максимально удалены друг от друга и максимально приближены к положительным зарядам. При этом силы притяжения валентных электронов положительно заряженными остовами соседних молекул оказывается сильнее сил взаимного отталкивания электронов внешних орбит.
Раздела 1. Конструкционные материалы.
Тема №1. Строение и свойства металлов.
Металлы обычно имеют кристаллическое строение. В узлах кристаллической решетки металлов расположены положительно заряженные ионы, а часть валентных электронов, отщепившихся от атомов, становятся свободными. Свободные электроны обобществляются, образуя электронный газ, который взаимодействует с положительными ионами металла и связывает их в прочную систему.
Наиболее распространенными являются три типа кристаллической решетки: кубическая объемноцентрированная (о.ц.к.), кубическая гранецентрированная (г.ц.к.) и гексагональная плотноупакованная (г.п.у.)
Чистые металлы обладают низкой прочностью, поэтому в технике используют редко. Наиболее широко применяют в технике в качестве конструкционных материалов металлические сплавы.
Под сплавом понимают вещество, полученное сплавлением двух или более элементов. Большинство сплавов, кроме сплавов с неорганической растворимостью компонентов в твердом состоянии, можно представить как систему, состоящую из нескольких фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении). Фазой называют однородную по химическому составу и строению часть системы, отделенную от другой части системы поверхностью раздела, при переходе через которую изменяются состав, строение и свойства сплава.
Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов. В зависимости от характера взаимодействия компонентов различают сплавы:
1. Механические смеси (гетерогенная структура) – образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Образуются между элементами значительно различающимися по строению и свойствам, когда сила взаимодействия между однородными атомами больше чем между разнородными. Каждая фаза имеет кристаллическую решетку, соответствующую данному компоненту.
2. Химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными.
3. Твердые растворы – это сплавы, в которых кристаллическая решетка построена из атомов двух или большего числа компонентов, при этом один из них является растворителем, а другой – растворимым. Твердый раствор имеет сильно деформированную кристаллическую решетку, тип которой соответствует типу решетки одному из образующих компонентов.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом. Различные кристаллические формы одного вещества называются полиморфными модификациями. Полиморфные модификации обозначают строчными греческими буквами α, β, γ, δ.
Железо с углеродом образует сплавы: твердые растворы внедрения и химические соединения, которые, в свою очередь, образуют сплавы гетерогенной структуры. В зависимости от содержания углерода С в Fe получают стали (содержание С до 2,14%) или чугуны (С от 2,14% и более).
В углеродистых сталях эти компоненты взаимодействуют, образуя, в зависимости от их количественного соотношения и температуры, разные фазы, представляющие собой однородные части сплава. Это взаимодействие заключается том, что углерод может растворяться как в жидком (расплавленном) железе, так и в различных его модификациях в твердом состоянии.
Кроме того, он может образовывать с железом химическое соединение. Таким образом, в углеродистых сталях различают следующие фазы:
Феррит – твердый раствор углерода и других примесей в α-железе (кристаллическая решетка – о.ц.к.). Предельная растворимость углерода – 0,02% в низкотемпературном феррите и 0,1% в высокотемпературном. Имеет невысокую прочность и твердость (НВ=800 МПа; σ = 250 МПа) и высокую пластичность.
Аустенит – твердый раствор углерода и других примесей в γ-железе (кристаллическая решетка – г.ц.к.). Предельная растворимость углерода – 2,14%. Механические свойства: НВ=1600-2000 МПа; σ = 500-800 МПа; δ = 40-50%.
Цементит – химическое соединение железа с углеродом – карбид железа Fe3C2, содержащий 6,67% углерода. Имеет очень высокую твердость (НВ=8000 Мпа) и очень малую пластичность.
Перлит – эвтектоидная механическая смесь двух фаз: феррита и цементита, которая образуется из аустенита с содержанием С 0,8 % при постоянной температуре t = 727 о С.
Как следует из приведенных выше характеристик, главной составляющей стали, определяющей ее свойства, является углерод. С увеличением содержания углерода возрастают прочность и твердость стали, снижаются показатели пластичности (относительное удлинение и относительное сужение), а также ударная вязкость. При 0,8 % углерода прочность стали достигает максимального значения, после чего она начинает снижаться.
ACD – линия ликвидуса. Показывает температуру начала затвердевания сталей и чугунов.
AECF – линия солидуса. Показывает температуру конца затвердевания сплавов.
При охлаждении твердых сплавов в них происходят фазовые и структурные изменения, связанные с аллотропическими превращениями Fe и изменением растворимости в нем углерода. Эти изменения (фазовые превращения) в сплавах Fe-С характеризуют линии GSE, PSK, GPQ.
Задания части 2 ЕГЭ по теме «Строение и функции белков»
Из-за высокой температуры происходит денатурация белков организма, нарушается обмен веществ.
2. Найдите ошибки в приведенном тексте, исправьте их. Укажите номера предложений, в которых сделаны ошибки, объясните их. (1) Большое значение в строении и жизнедеятельности организмов имеют белки. (2) Это биополимеры, мономерами которых являются азотистые основания. (3) Белки входят в состав плазматической мембраны. (4) Многие белки выполняют в клетке ферментативную функцию. (5) В молекулах белка зашифрована наследственная информация о признаках организма. (6) Молекулы белка и тРНК входят в состав рибосом.
2) Мономерами белков являются аминокислоты.
5) Наследственная информация зашифрована в нуклеиновых кислотах.
6) В состав рибосом входят молекулы белка и рРНК.
3. Почему ферменты слюны активны в ротовой полости, но теряют свою активность в желудке?
Ферменты слюны расчитаны на работу в щелочной среде (в ротовой полости щелочная среда). Когда ферменты слюны попадают в желудок, где среда кислая, они денатурируют (изменяют свою форму) и перестают подходить к своим субстратам (углеводам пищи) как ключ к замку. Из-за этого реакции, катализируемые ферментами слюны, останавливаются.
4. Замораживание ферментов, в отличие от действия высоких температур, не приводит к потере их активности при возвращении в нормальные условия. Чем это объясняется?
1) ферменты являются белками, поэтому нагревание приводит к их необратимой денатурации и потере активности;
2) низкие температуры вызывают обратимую денатурацию белков, и в нормальных условиях они восстанавливают свою структуру и активность
5. Как называются мономер белка, короткая молекула белка, молекула белка в третичной структуре?
Мономер белка называется аминокислота, короткая молекула белка называется пептид (полипептид), молекула белка в третичной структуре называется глобула.
6. Найдите три ошибки в приведенном тексте «Ферменты». Укажите номера предложений, в которых сделаны ошибки, исправьте их. Дайте правильную формулировку. (1) Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых системах. (2) Большинство ферментов являются полисахаридами. (3) Один фермент может ускорять разные типы биохимических реакций. (4) Ферменты становятся активными и ускоряют реакции в строго определенных химических средах. (5) По окончании биохимических реакций ферменты частично входят в состав образовавшихся веществ. (6) Активность ферментов зависит от температуры. (7) Эффективность ферментов в клетках значительно выше эффективности неорганических катализаторов.
2 – большинство ферментов является белками;
3 – один фермент ускоряет только один тип биохимических реакций (или одну определенную реакцию);
5 – по окончании биохимической реакции фермент освобождается и остается в неизменном виде
7. Найдите три ошибки в приведённом тексте «Белки». Укажите номера предложений, в которых сделаны ошибки, исправьте их. (1) Белки отличаются друг от друга количеством и последовательностью мономеров. (2) Первичная структура белка зашифрована в гене последовательностью аминокислот. (3) Аминокислотные звенья соединяются между собой в единую цепь водородными связями. (4) Первичная структура белка определяет его форму, свойства и функции. (5) Вторичная структура белка имеет вид спирали или сложной, складчатой структуры. (6) Третичная структура имеет вид клубка, или глобулы, при этом образуются дисульфидные, ионные и другие связи, гидрофобные взаимодействия. (7) Четвертичная структура некоторых белков содержит атомы металлов, например магния, в молекуле гемоглобина.
2 - первичная структура белка зашифрована в гене последовательностью нуклеотидов;
3 - аминокислотные звенья соединяются между собой в единую цепь пептидными связями;
7 - молекула гемоглобина содержит атомы железа (атомы магния входят в состав хлорофилла)

8. Рассмотрите предложенную схему. Запишите в ответе пропущенный термин, обозначенный на схеме знаком вопроса.
9. Чем отличаются ферменты от неорганических катализаторов?
1) Ферменты – вещества белковой природы.
2) Каждый фермент ускоряет только одну химическую реакцию.
3) Ферменты ускоряют химические реакции в сотни тысяч и миллионы раз. Это намного быстрее, чем при использовании неорганического катализатора.
4) Ферменты активны только при определенных условиях – температуре и кислотности среды, не повреждающих структуру белка.
10. Найдите три ошибки в приведённом тексте. Укажите номера предложений, в которых они допущены, объясните их. (1) Белки — это нерегулярные биополимеры, мономерами которых являются нуклеотиды. (2) Остатки мономеров соединены между собой пептидными связями. (3) Последовательность мономеров, удерживаемая этими связями, формирует первичную структуру белковой молекулы. (4) Следующая структура — вторичная, удерживается слабыми гидрофобными связями. (5) Третичная структура белка представляет собой скрученную молекулу в виде глобулы (шара). (6) Удерживается такая структура водородными связями.
1) Мономерами белков являются аминокислоты.
4) Вторичная структура удерживается водородными связями.
6) Третичная структура белка удерживается ковалентными дисульфидными, ионными, гидрофобными и другими связями.
11. Найдите три ошибки в приведённом тексте. Укажите номера предложений, в которых они допущены, объясните их. (1) Быстрое протекание химических реакций в организме обеспечивают ферменты. (2) Один фермент катализирует несколько разных реакций. (3) Так, например, фермент, расщепляющий белки, может расщеплять и жиры. (4) По химической природе ферменты — это только белковые молекулы. (5) Они не изменяются по своему химическому составу в результате реакции. (6) Каждая молекула фермента может осуществлять несколько тысяч операций в минуту.
2) Один фермент катализирует одну реакцию.
3) Фермент специфичен по отношению к субстрату и взаимодействует только с определённым веществом.
4) Ферменты могут образовывать комплексы с небелковыми компонентами — витаминами, металлами.
Строение и функции белков
Белки (протеины) составляют 50% от сухой массы живых организмов.
Белки состоят из аминокислот. У каждой аминокислоты есть аминогруппа и кислотная (карбоксильная) группа, при взаимодействии которых получается пептидная связь, поэтому белки еще называют полипептидами.
Структуры белка
Первичная – цепочка из аминокислот, связанных пептидной связью (сильной, ковалентной). Чередуя 20 аминокислот в разном порядке, можно получать миллионы разных белков. Если поменять в цепочке хотя бы одну аминокислоту, строение и функции белка изменятся, поэтому первичная структура считается самой главной в белке.
Вторичная – спираль. Удерживается водородными связями (слабыми).
Третичная – глобула (шарик). Четыре типа связей: дисульфидная (серный мостик) сильная, остальные три (ионные, гидрофобные, водородные) – слабые. Форма глобулы у каждого белка своя, от нее зависят функции. При денатурации форма глобулы меняется, и это сказывается на работе белка.
Четвертичная – имеется не у всех белков. Состоит из нескольких глобул, соединенных между собой теми же связями, что и в третичной структуре. (Например, гемоглобин.)
Денатурация
Это изменение формы глобулы белка, вызванное внешними воздействиями (температура, кислотность, соленость, присоединение других веществ и т.п.)
- Если воздействия на белок слабые (изменение температуры на 1°), то происходит обратимая денатурация.
- Если воздействие сильное (100°), то денатурация необратимая. При этом разрушаются все структуры белка.
Функции белков
Их очень много, например:
- Ферментативная (каталитическая) – белки-ферменты ускоряют химические реакции за счет того, что активный центр фермента подходит к веществу по форме, как ключ к замку (комплементарность, специфичность).
- Строительная (структурная) – клетка, если не считать воду, состоит в основном из белков.
- Защитная – антитела борются с возбудителями болезней (иммунитет).
Дополнительные материалы
Задания части 1
Выберите один, наиболее правильный вариант. Водородные связи между СО- и NН-группами в молекуле белка придают ей форму спирали, характерную для структуры
1) первичной
2) вторичной
3) третичной
4) четвертичной
Выберите один, наиболее правильный вариант. Четвертичная структура молекулы белка образуется в результате взаимодействия
1) участков одной белковой молекулы по типу связей S-S
2) нескольких полипептидных нитей, образующих клубок
3) участков одной белковой молекулы за счет водородных связей
4) белковой глобулы с мембраной клетки
Выберите один, наиболее правильный вариант. Последовательность и число аминокислот в полипептидной цепи – это
1) первичная структура ДНК
2) первичная структура белка
3) вторичная структура ДНК
4) вторичная структура белка
Выберите один, наиболее правильный вариант. Первичная структура белка образована связью
1) водородной
2) макроэргической
3) пептидной
4) ионной
Выберите один, наиболее правильный вариант. В основе образования пептидных связей между аминокислотами в молекуле белка лежит
1) принцип комплементарности
2) нерастворимость аминокислот в воде
3) растворимость аминокислот в воде
4) наличие в них карбоксильной и аминной групп
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Выберите только особенности строения белковой молекулы.
1) содержит атомы фосфора
2) состоит из аминокислот
3) мономеры удерживаются пептидными связями
4) состоит из одинаковых по строению мономеров
5) изменяет форму под действием температуры
6) четвертичная структура состоит из нескольких молекул
3. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Какие из перечисленных ниже признаков относятся к характеристикам молекул белков?
1) состоят из нуклеотидов
2) выполняют только структурную и двигательную функции
3) могут иметь форму глобулы
4) содержат в составе азот и серу
5) всегда нерастворимы в воде
6) являются нерегулярными полимерами
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Какие из перечисленных ниже веществ относятся к белкам?
1) крахмал
2) коллаген
3) фибриноген
4) тестостерон
5) гемоглобин
6) сахароза
БЕЛКИ КРОМЕ
1. Все перечисленные признаки, кроме двух, можно использовать при описании яичного белка альбумина. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) состоит из аминокислот
2) пищеварительный фермент
3) денатурирует обратимо при варке яйца вкрутую
4) мономеры связаны пептидными связями
5) молекула образует первичную, вторичную и третичную структуры
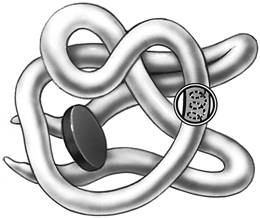
БЕЛКИ КРОМЕ РИС
1. Перечисленные ниже признаки, кроме двух, используются для описания строения, функций изображенного органического вещества. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) имеет структурные уровни организации молекулы
2) входит в состав клеточных стенок
3) является биополимером
4) служит матрицей при трансляции
5) состоит из аминокислот

2. Все перечисленные ниже признаки, кроме двух, используются для описания изображённой на рисунке структуры. Определите два признака, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) вторичная структура молекулы белка
2) удерживается только пептидными связями
3) определяется методом рентгеноструктурного анализа
4) представляет собой глобулу
5) может выполнять ферментативные функции

3. Все перечисленные ниже характеристики, кроме двух, используют для описания изображенной на рисунке молекулы органического вещества клетки. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) денатурация
2) репликация
3) транскрипция
4) аминокислоты
5) водородные связи
СТРУКТУРЫ БЕЛКА
Установите соответствие между характеристикой и структурой белка: 1) первичная, 2) третичная. Запишите цифры 1 и 2 в порядке, соответствующем буквам.
А) молекула в форме глобулы или фибриллы
Б) строгая последовательность аминокислотных остатков
В) аминокислотные остатки соединены только пептидными связями
Г) имеет дисульфидные мостики между радикалами аминокислот
Д) при ее разрушении наступает необратимая денатурация
Е) пространственная конфигурация полипептидной цепи
Установите последовательность событий при образовании структур белка, начиная с наименьшего уровня организации белковой молекулы. Запишите в таблицу соответствующую последовательность цифр.
1) Образование дисульфидных связей между глобулами.
2) Образование ионных связей между разными α-спиралями одной полипептидной цепи.
3) Образование водородных связей между витками α-спирали.
4) Образование аминокислотной цепи.
5) Присоединение олигосахарида к белку с четвертичной структурой.
РЕГУЛЯТОРНАЯ - СТРУКТУРНАЯ
Установите соответствие между характеристикой и функцией белка, которую он выполняет: 1) регуляторная, 2) структурная
А) входит в состав центриолей
Б) образует рибосомы
В) представляет собой гормон
Г) формирует мембраны клеток
Д) изменяет активность генов
ФЕРМЕНТАТИВНАЯ
1. Все приведенные ниже признаки, кроме двух, можно использовать для описания ферментов. Определите два признака, «выпадающих» из общего списка, и запишите цифры, под которыми они указаны.
1) входят в состав клеточных мембран и органоидов клетки
2) играют роль биологических катализаторов
3) имеют активный центр
4) оказывают влияние на обмен веществ, регулируя различные процессы
5) специфические белки
2. Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Ферменты – это вещества, которые
1) вырабатываются в железах внутренней секреции
2) являются белками
3) поступают в организм, как правило, вместе с пищей
4) являются в организме источником энергии
5) ускоряют протекание химических реакций
6) у человека выполняют свои функции при температуре около 36 градусов
ФУНКЦИИ БЕЛКОВ
Выберите три верных ответа из шести и запишите цифры, под которыми они указаны. Функциями белков в организме человека являются
1) строительная
2) передача наследственных признаков
3) защитная
4) запасающая
5) ферментативно-каталитическая
6) хранение генетической информации
ФУНКЦИИ БЕЛКОВ КРОМЕ
Все перечисленные характеристики используют для описания функций белков. Определите две характеристики, «выпадающие» из общего списка, и запишите цифры, под которыми они указаны.
1) регуляторная
2) двигательная
3) рецепторная
4) образуют клеточные стенки
5) служат коферментами

Рассмотрите рисунок с изображением полипептида и укажите (А) уровень его организации, (Б) форму молекулы и (В) вид взаимодействия, поддерживающий эту структуру. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) вторичная структура
3) третичная структура
4) взаимодействия между нуклеотидами
5) металлическая связь
6) гидрофобные взаимодействия
7) фибриллярная
8) глобулярная

Рассмотрите схему химического вещества. Укажите (А) название класса органических веществ, (Б) уровень организации полимерной молекулы и (В) название мономеров, из которых состоит данная молекула. Для каждой буквы выберите соответствующий термин из предложенного списка.
1) ДНК
2) белок
3) альфа-спираль
4) вторичная структура
5) третичная структура
6) аминокислоты
7) нуклеотиды
8) рибоза

Рассмотрите рисунок с изображением полипептида. Укажите (А) уровень его организации, (Б) мономеры, которые его образуют, и (В) вид химических связей между ними. Для каждой буквы выберите соответствующий термин или соответствующее понятие из предложенного списка.
1) первичная структура
2) водородные связи
3) двойная спираль
4) вторичная структура
5) аминокислота
6) альфа-спираль
7) нуклеотид
8) пептидные связи

Проанализируйте таблицу «Уровни организации белка». Для каждой ячейки, обозначенной буквой, выберите соответствующий термин из предложенного списка.
1) глобула
2) двойная спираль
3) эфирные
4) гидрофильные
5) пептидные
6) нитчатая
7) вторичная
8) четвертичная
Читайте также:
