Атомы металлов отдают электроны
Обновлено: 28.04.2024
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
найдите все значения а кратных числу 3 при которых будет верным неравенство 145
Лабораторная работа № 9.1.1. Российская империя на рубеже XIX – ХХ вв. и её место в мире
Документ № 1. Из письма министра финансов С.Ю. Витте Николаю II
В настоящее время политическая сила Великих держав, которые призваны решить грандиозные исторические задачи в мире, создаётся не только силой духа их народов, но также их экономическим устройством. Даже военный потенциал страны определяется… степенью её промышленного развития. Россия нуждается, возможно, более чем какая-либо другая страна, в надлежащей экономической основе для её национальной политики и культуры.
Документ № 2. О положении нашей промышленности. Из доклада министра финансов С.Ю. Витте.
Возрастание промышленности в сравнительно короткий срок само по себе представляется очень значительным. По быстроте и силе этого роста Россия стоит впереди всех иностранных экономически развитых государств, и не подлежит сомнению, что страна, которая оказалась в состоянии в два десятилетия более чем утроить свою горную и фабрично-заводскую промышленность, таит в себе запас внутренних сил для дальнейшего развития, а такое развитие в ближайшем будущем настоятельно необходимо, ибо как ни велики уже достигнутые результаты, тем не менее и по отношению к потребностям населения, и по сравнению с иностранными государствами наша промышленность ещё очень отстала.
В иностранных государствах промышленность не развивается так быстро, как в России, потому что она уже достигла там уровня гораздо более высокого, чем у нас.
Документ № 3 Темпы роста основных экономических показателей развития Российской империи к 1914 г. (уровень 1887 г. принят за 100%)
Валовые сборы хлебов – 177%
Протяжённость железных дорог – 257%
Обороты торговых заведений- 264%
Внешнеторговые обороты – 285%
Капиталы акционерных обществ – 392%
Стоимость продукции фабрично-заводской промышленности – 456%
Пассивы акционерных коммерческих банков – 1096%
Документ № 4 Производство чугуна и каменного угля на рубеже XIX – XX вв. ( в кг. на одного жителя)
Англия 208 1808
Германия 128 2304
Документ № 5 Мнение историка: из книги Л. Холмса «Социальная история России: 1917 – 1941»
… Индустриализация для России была абсолютной необходимостью. Россия уже долгое время играла роль великой державы и делала это довольно успешно со времён Петра Великого. Но в ХХ в., чтобы сохранить этот статус, ей нужна была индустриализация. Выбора не было: к лучшему или худшему; но Россия была частью Европы – и не могла избежать её конфликтов.
Документ № 6 Свидетельство Ф .А. Щербины, известного статистика начала XX в.
В 1884 г. из 100 опрошенных крестьян, по крайней мере, человек 60 или 70 заявляли, что школа им не нужна, что это – дело барское и для крестьянина неподходящее… Содержать школу казалось и дорого и тяжело населению… С тех пор прошло 15 лет, и картина сильно и ярко изменилась. И сельская школа, и народный учитель, и грамотность, и книга – всё это стало насущной необходимостью крестьянской среды… Знания заметно увеличились, и сельская школа… играла в этом отношении, если не единственную, то во всяком отношении преобладающую роль.
Документ № 7 Мнения крестьян (начало ХХ в.)
…Учиться стало нужно: в солдаты возьмут, облегчение даётся; записать, что по извозу; деньги получить… Письменный всюду гож: приведи к купцу, в лавочку, в шинок, его принимают; и дома – расписка, какая, и всякое дело – ему видней…
Мальчика обязательно надо учить: на чужую сторону пойдёт – может хорошее место получить. Кроме того, и в солдатах говорят, легче служить…
Документ № 8. Из данных статистики начала ХХ в.
Из 976 отзывов крестьян 88,4% высказались в пользу грамотности; в том числе было 66% неграмотных. Безразлично отнеслись 8,9%, а против высказались 2,7%. Правда, относительно девочек старый взгляд сохранился крепче… Но и тут положение улучшилось. Из 551 ответа на этот вопрос 376 (68,3%) оказалось положительных и только 84 (15,2%) отрицательных.
Документ № 9 Рост государственных расходов на начальное образование .
Годы сумма в рублях
Документ № 10. Из «Докладной записки Совета съездов Представителей Промышленности и Торговли о мерах к развитию производительных сил России и улучшению торгового баланса». 1914 г.
. Города растут у нас с поистине американской быстротой. Целый ряд железнодорожных станций, фабричных и заводских посёлков, особенно на юге, обратился в крупные центры городской культуры. Естественный в известные периоды экономического развития процесс концентрации населения, в силу происходящих сейчас коренных изменений в жизни сельскохозяйственного населения России, пойдёт, несомненно, с возрастающей быстротой и лет через 20-30 мы увидим, быть может, картину самых крупных в этой области перемен, но рост городов есть в то же время рост совершенно новых потребностей, для удовлетворения которых будут возникать целые отрасли промышленности, неизвестные или очень слабо развитые в настоящее время. Без преувеличения можно сказать, что рост городской жизни вызовет переворот в нашей промышленности.
Документ № 11. Из книги французского экономического обозревателя начала века Э. Тэри «Россия в 1914 г. Экономический обзор».
Благодаря протяжённости своей территории, разнообразию продукции, богатству недр и, в особенности, необыкновенному росту населения, Россия призвана стать великой промышленной державой.
Почти не существовавшая в середине прошлого века, русская промышленность развивалась благодаря строительству железных дорог, которые сделали легкодоступными богатые месторождения Кривого Рога, Донбасса, Польши, Урала и Кавказа и позволили ввести их в эксплуатацию.
Молодые страны имеют то преимущество, что могут немедленно воспользоваться плодами прогресса, добытыми долгими годами опыта в старых промышленных странах. Вот почему шахты и металлургические предприятия, созданные в пустынных степях южной России, были сразу оснащены по образцу наиболее усовершенствованных предприятий Западной Европы, т.е. сразу воспользовались апробированной технологией и самым совершенным оборудованием.
Металлическая связь
Теорию ионной связи предложил в 1916г. немецкий ученый В. Коссель. Эта теория объясняет образование связей между атомами типичных металлов и атомамитипичных неметаллов:CsF, CsCl, NaCl, KF, KCl, Na2O и др.
Согласно этой теории, при образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны.
В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами или катионами; а атомы неметаллов превращаются в отрицательные ионы — анионы. Заряд катиона равен числу отданных электронов.
Атомы металлов отдают электроны внешнего слоя, а образующиеся ионы имеют завершенные электронные структуры (предвнешнего электронного слоя).
Величина отрицательного заряда аниона равна числу принятых электронов.
Атомы неметаллов принимают такое количество электронов, какое им необходимо для завершения электронного октета (внешнего электронного слоя).
Например: общая схема образования молекулы NaCl из атомов Na и С1: Na°-le = Na +1 Образование ионов
Na +1 + Сl - = Nа + Сl -
Na°+ Сl°= Nа + Сl - Соединение ионов
· Связь между ионами называется ионной связью.
Соединения, которые состоят из ионов, называются ионными соединениями.
Алгебраическая сумма зарядов всех ионов в молекуле ионного соединения должна быть равна нулю,потому что любая молекула является электронейтральной частицей.
Резкой границы между ионной и ковалентнои связями не существует. Ионную связь можно рассматривать как крайний случай полярной ковалентнои связи, при образовании которой общая электронная пара полностьюсмещается к атому с большей электроотрицательностью.
Атомы большинства типичных металлов на внешнем электронном слое имеют небольшое число электронов (как правило, от 1 до 3); эти электроны называются валентными. В атомах металлов прочность связи валентных электронов с ядром невысокая, то есть атомы обладают низкой энергией ионизации. Это обусловливает легкость потери валентных электронов ч превращения атомов металла в положительно заряженные ионы (катионы):
В кристаллической структуре металла валентные электроны обладают способностью легко перемещаться от одного атома к другому, что приводит к обобществлению электронов всеми соседними атомами. Упрощенно строение кристалла металла представляется следующим образом: в узлах кристаллической решетки находятся ионы Ме п+ и атомы Ме°, а между ними относительно свободно перемещаются валентные электроны, осуществляя связь между всеми атомами и ионами металла (рис. 3). Это особый тип химической связи, называемой металлической.
· Металлическая связь — связь между атомами и ионами металлов в кристаллической решетке, осуществляемая обобществленными валентными электронами.
Благодаря этому типу химической связи металлы обладают определенным комплексом физических и химических свойств, отличающим их от неметаллов.
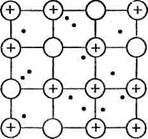
Рис. 3. Схема кристаллической решетки металлов.
Прочность металлической связи обеспечивает устойчивость кристаллической решетки и пластичность металлов (способность подвергаться разнообразной обработке без разрушения). Свободное передвижение валентных электронов позволяет металлам хорошо проводить электрический ток и тепло. Способность отражать световые волны (т.е. металлический блеск) также объясняется строением кристаллической решетки металла.
Таким образом, наиболее характерными физическими свойствами металлов в зависимости от наличия металлической связи являются:
■металлический блеск и непрозрачность;
■пластичность, ковкость, плавкость;
■высокие электро- и теплопроводность; и склонность к образованию сплавов.
Химические свойства. Атомы большинства металлов имеют на внешнем слое всего 1 или 2 электрона (s1, s2), которые сравнительно легко «отдают» при химическом взаимодействии
Атомы большинства металлов имеют на внешнем слое всего 1 или 2 электрона (s 1 , s 2 ), которые сравнительно легко «отдают» при химическом взаимодействии. Поэтому все металлы – типичные восстановители; имеют малые значения потенциала ионизации и малое сродство к электрону по сравнению с неметаллами, т.е. характеризуются малыми значениями электроотрицательности.
Если атомы металлов отдают электроны, то они превращаются в положительнозаряженные ионы:
Me 0 - ne = Me n + . Простых отрицательных ионов металлы не образуют!
Восстановительную активность металлов можно оценить по значению потенциала ионизации или стандартного ОВ-потенциала Е 0 (Me/Me n + ) (см. стандартный ряд напряжений металлов). Чем меньше эти величины, тем активнее металл. Последняя оценка справедлива для ионных реакций в водных растворах.
Изменение активности металлов по отдельным группам ПСЭ (направление стрелки соответствует увеличению активности).
Группа I A II A III A III Б Остальные d-металлы
s 1 s 2 s 2 p 1 d 1 s 2 d 2-10 s 2 ( или 1)
Al Ti V Cr Mn Fe Co Ni Cu Zn
Степени окисления.
Максимальная степень окисления соответствует № группы элемента (кроме элементов VIII Б и IА групп).
Металлы р-элементов IVA, VA групп и большинство d-, f-элементов имеют несколько степеней окисления.
Взаимодействие с неметаллами.
При взаимодействии металлов с кислородом образуются оксидыMexOy.
При взаимодействии с галогенами – галогениды(AlJ3, TiJ4, ZrJ4, UF6 и др.).
При взаимодействии с углеродом – карбиды:MeC (Ti, Nb, W, V, Ta) и Me2C (Nb, V, Ta) - по твердости подобны алмазу, температура плавления >3000 0 С; Me3C (Fe3C –цементит, входит в состав углеродистых сталей) и другие карбиды.
При взаимодействии с азотом – нитриды: MeN (Ti, V, Nb, Ta) – химически устойчивы, нерастворимы в царской водке, температуры плавления выше 2500 0 С, придают металлам твердость, но и хрупкость!
При взаимодействии с серой – сульфиды, например, MoS2 – смазочный материал для поверхностей скольжения при больших нагрузках и повышенных температурах.
Большинство оксидов в воде нерастворимы. Среди оксидов металлов есть основные, амфотерные и кислотные. Кислотный характер оксидов нарастает с увеличением степени окисления металла, например: MnO – MnO2 – MnO3 – Mn2O7 или CrO – Cr2O3 – CrO3.
осн амфот кисл кисл осн амфот кисл
Если степень окисления металла +5 и выше, то его оксид имеет кислотный характер, например, V2O5, CrO3 (растворим в воде), MoO3, WO3, MnO3, Mn2O7 (маслянистая жидкость темно-зеленого цвета, разлагается со взрывом).
Кислотные оксиды взаимодействуют с основаниями или основными оксидами с образованием солей соответствующих кислот:
CrO3 + 2NaOH = Na2CrO4 + H2O – соль хромат натрия
Если степень окисления металла в оксиде +1¸+4, то оксиды имеют основной или амфотерный характер.
Амфотерные оксиды взаимодействуют как с кислотами (кислотными оксидами), так и с основаниями (основными оксидами):
Al2O3 + 6HCl = 2AlCl3 + 3H2O, соль – хлорид алюминия,
Al2O3 + 2NaOH раствор + 3H2O = 2Na[Al(OH)4], соль – тетрагидроксоалюминат натрия,
Al2O3 + 2NaOHкрист сплавление = 2NaAlO2, соль – алюминат натрия
Получение оксидов.
1) Непосредственное взаимодействие металла с кислородом (окисление, горение). Компактные металлы окисляются медленно, порошок металла или стружка - горят.
2Mg + O2 = 2MgO – магниевая вспышка, ультрафиолетовая область спектра,
2) Косвенный путь – прокаливание гидроксидов или солей легко разлагающихся кислот: карбонатов, оксалатов.
Все гидроксиды (кроме щелочных металлов и Sr, Ba) труднорастворимы в воде. Их можно получить в растворе по реакциям обмена между растворами соли металла и основания (щелочь или раствор аммиака). Me n + + nOH - = Me(OH)n¯
Все гидроксиды растворимы в кислотах. Me(OH)n + nH + = Me n+ + nH2O
Амфотерные гидроксиды Be(OH)2, Pb(OH)2, Sn(OH)2, Zn(OH)2, Al(OH)3, Cr(OH)3 растворяются в растворах щелочей. Другие амфотерные гидроксиды взаимодействуют со щелочами при сплавлении.
Окислительно-восстановительные свойства металлов и их соединений.
1) В свободном состоянии все металлы – типичные восстановители.
2) Соединения металлов в высших степенях окисления проявляют только окислительные свойства: CrO4 2- , Cr2O7 2- , MnO4 - , NaBiO3 и др.
3) Соединения металлов с промежуточными степенями окисления могут проявлять восстановительные свойства, окисляясь до более высоких степеней окисления, или окислительные свойства, восстанавливаясь до более низких степеней окисления (вплоть до нулевой): Fe 2+ - e = Fe 3+ , Fe 2+ + 2e = Fe 0
О силе окислительной или восстановительной способности металлов или их соединений судят по значению потенциалов ЕOx/Red.
Взаимодействие металлов с кислотами.
Неокисляющие (слабоокисляющие) кислоты HCl, H2SO4 разбавленная, H3PO4, Hac и др. взаимодействуют только с активными металлами, для которых Е (Ме n+ /Me 0 ) < E (2H + /H2), при этом выделяется Н2: 2Al + 6HCl = 2AlCl3 + 3H2
Малоактивные металлы растворяются в указанных кислотах в присутстви окислителей (О2, Н2О2):
Окисляющие кислоты H2SO4 конц. , HNO3 (любой концентрации) окисляют металлы при растворении за счет S(+6) и N(+5), поэтому водород практически не выделяется. Продукты восстановления серы и азота зависят от активности металла и концентрации кислот.
Пассивация металлов.
Многие металлы при взаимодействии с концентрированными кислотами при комнатной температуре покрываются пленками оксидов (при действии азотной и серной кислот) или труднорастворимых солей (при действии серной, фосфорной, плавиковой кислот). Растворение металлов замедляется вплоть до полного прекращения реакции:
Повышение температуры способствует разрушению оксидных пленок и металлы начинают растворяться.
Растворение малоактивных металлов в смесях кислот.
Малоактивные металлы Au, Pt, Ag, платиноиды (Ru, Rh, Pd, Os, Ir), W, Mo, Nb, Ta, Zr, Ti растворяют в смесях кислот: (HNO3 + HCl) или (HNO3 + HF).
Смесь концентрированных азотной и соляной кислот в объемном отношении 1:3 называется «царской водкой».
Молекулярный хлор и особенно атомарный хлор – являются сильными окислителями.
В смеси азотной и плавиковой кислот присутствует сильный окислитель (HNO3) и комплексообразующий агент (HF). Образование комплексных соединений способствует растворению металлов.
Взаимодействие металлов с водой, щелочами (в присутствии кислорода и без него).
Действие воды на металлы зависит от активности металла, температуры, наличия растворенного кислорода и прочности защитной пленки оксидов на поверхности металла.
Н2О Û Н + + ОН - , рН = 7, [H + ] = 1×10 -7 моль/л.
В этих условиях электродный потенциал реакции 2Н2О + 2е = Н2 + 2ОН - , Е (2Н + /Н2) = -0.414 вольт. Следовательно, ионы водорода воды могут окислять металлы с Е (Ме n+ /Me) < - 0,414 вольт.
Mg + 2H2O =t= Mg(OH)2¯ + H2 (аналогично реагируют Ca, Znпорошок, Tiпорошок и др.)
Труднорастворимые гидроксиды на поверхности металла тормозят процесс растворения металла (пассивация). Растворение гидроксидной пленки способствует растворению металла. Например, магний хорошо растворяется в присутствии хлорида аммония: Mg(OH)2¯+2NH4Cl=MgCl2+2NH3×H2O; растворению цинка способствует добавление щелочи, которая растворяет амфотерный гидроксид цинка.
Очень активные металлы Be, Al нерастворимы в воде даже при нагревании, поскольку защищены очень прочными пленками оксидов (беспористыми, плотно сцепленными с поверхностью металла). Оксидные пленки можно удалить: а) механической зачисткой поверхности; б) обработкой поверхности металла раствором соли ртути; в) добавлением раствора щелочи, который растворяет амфотерные оксиды и гидроксиды.
Действие воды усиливается, если в ней растворен газообразный кислород. Тогда в воде могут растворяться даже малоактивные металлы:
2Cu + O2 + 2H2O = 2Cu(OH)2¯ - коррозия медной посуды во влажном воздухе.
CuO×xH2O (черная пленка)
Взаимодействие металлов с растворами солей.
Fe – 2e = Fe 2+ , E 0 = -0.44 вольт
Cu 2+ + 2e = Cu, E 0 = +0.34 вольт
Еокислителя > Евосстановителя, реакция идет
2) Al + CuSO4 ® реакция не идет, хотя алюминий более активный восстановитель, чем железо.
Реакции мешает пленка оксида алюминия на поверхности металла. Разрушению оксидной пленки способствуют ионы С1 - . Известно, что хлорид-ионы способствуют разрушению оксидной пленки и активируют процесс растворения металлов в целом.
Появление менее активного металла Cu на поверхности алюминия способствует дальнейшему интенсивному растворению алюминия за счет гальванокоррозии:
3) Процесс травления медной платы раствором хлорида железа (III):
Cu + FeCl3 реакция идет двумя путями ® CuCl2 + FeCl2
E 0 (Fe 3+ /Fe 2+ ) = +0.77
E 0 (Cu 2+ /Cu) = +0.34
E 0 (CuCl¯/Cu) = +0.54
Согласно потенциалам, оба процесса возможны. Образование осадка CuCl тормозит процесс растворения меди. Добавление хлорид-ионов в виде HCl или NaCl способствует растворению осадка хлорида меди (I): CuCl¯ + HCl = H[CuCl2].
Cu – e + Cl - = CuCl¯, E 0 = +0.137
Cu 2+ + e + Cl - = CuCl¯, E 0 = +0.54
Cu 0 + Cu 2+ + 2Cl - = 2CuCl¯
2CuCl¯ + 2HCl = 2H[CuCl2]
Нахождение в природе.
Самый распространенный – алюминий – массовая доля 7,5% и железо – 4,8%.
Самый редкий – радий - 2×10 -10 %.
В свободном состоянии встречаются только малоактивные металлы – Au, Pt, платиноиды Os, Ir, Rh, очень редко – Cu, Hg, Ag.
В основном металлы находятся в природе в окисленном состоянии, в виде различных соединений.
Сульфиды: FeS2 – пирит, MoS2 - молибденит (молибденовый блеск), другие блески – PbS, MnS, Cu2S, Ag2S, цинковая обманка ZnS, киноварь HgS, сульфидные полиметаллические медно-никелевые руды, содержащие Ag, Au, Pt-металлы.
Галогениды: NaCl –каменная соль, KCl - сильвин, KCl× MgCl2×6H2O - карналлит, CaF2 – флюорит.
Карбонаты: (CuOH)2CO3 – малахит, MgCO3 – магнезит, CaCO3 – кальцит (мел, известняк, мрамор), MgCa(CO3)2 – доломит.
Вольфраматы, ниобаты, танталаты: CaWO4 – шеелит. Другие минералы см. в разделе f-элементы.
Извлечение металлов из руд.
Рудами называются скопления металлосодержащих минералов, входящих в состав горных пород. Поскольку находящиеся в составе руд металлические элементы окислены, получение металлов может быть осуществлено посредством восстановления.
Примеси пустой породы затрудняют процессы восстановления, поэтому металлические руды предварительно обогащают – очищают от пустой породы.
Сульфидные руды преводят в оксидные соединения металлов путем окислительного обжига.
Для разделения элементов, входящих в состав полиметаллических руд используют метод хлорирования. Хлориды различных металлов, благодаря разной летучести, могут быть легко отделены друг от друга и от непрохлорированной части руды. Хлориды металлов затем легко восстанавливаются (чаще всего активными металлами) до свободных металлов.
Способы восстановления.
1) Электрохимическое восстановление из растворов солей или расплавов солей и оксидов.
Металл выделяется на катоде (!).
Электролизом расторов получают металлы , имеющие потенциалы Е(Ме n+ /Ме) > -1 вольт (Zn, Cu, Ni, Co и др.). Этот метод чаще используется для очистки указанных металлов.
Электролизом расплавов получают щелочные, щелочноземельные металлы, Be, Al, Zr, Nb, Ta, Mo, W, V.
Получение алюминия. Электролиз расплава глинозема (Al2O3) в криолите (AlF3×3NaF). Смесь имеет более низкую температуру плавления, чем отдельные компоненты.
(-) Al 3+ + 3e = Al(ж) ¯ (на дно печи)
Получение бериллия и магния. Электролиз расплавов MgCl2 – KCl, BeCl2 – NaCl.
На катоде осаждается металл, на аноде выделяется хлор.
2) Химическое восстановление активными восстановителями при высоких температурах:
А) водородом Н2 (получение Mo, W);
Б) углеродом или оксидом углерода (II) – карботермическое восстановление (получение Fe, W, Mo, Cu, Zn, Pb, Sn);
В) активными металлами (Na, Ca, Mg, Al) – металлотермическое восстановление (получение Ti, Zr, Cr, V, Mn, Nb, Ta, U, Th).
1) Получение молибдена, вольфрама.
Восстановление оксидов MoO3, WO3 водородом. Реакция идет через ряд промежуточных стадий:
Суммарная реакция: MoO3 + 3H2 = Mo + 3H2O
2) Получение железа.
Карботермическое восстановление оксидов.
Из природных соединений железо восстанавливают в доменных печах коксом. Кокс – продукт сухой перегонки каменного угля. Доменный восстановительный процесс очень сложен. Он разделяется на несколько стадий по высоте шахты доменной печи. Непосредственым восстановителем железа из его оксидов является оксид углерода (II), получаемый при взаимодействии кислорода, подаваемого в доменную печь, с коксом:
Оксид углерода (II) при высокой температуре последовательно взаимодействует с оксидами железа Fe2O3, Fe3O4 и FeO и даже с конечным продуктом восстановления – элементарным железом:
Образующийся карбид железа Fe3C (цементит) растворяется в жидком железе. В результате доменного процесса получается или передельный чугун с повышенным содержанием C, Mn, Si, используемый для производства стали, или литейный чугун для машиностроительных деталей, станин станков и т.п.
Атомы металлов главных подгрупп, отдавая электроны, приобретают электронную структуру внешнего энергетического уровня:
1. щелочных металлов
2. кислорода
3. благородных газов
Читайте также:
