Что не относится к щелочным металлам
Обновлено: 02.05.2024
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
ПОДГРУППА IА. ЩЕЛОЧНЫЕ МЕТАЛЛЫ
ЛИТИЙ, НАТРИЙ, КАЛИЙ, РУБИДИЙ, ЦЕЗИЙ, ФРАНЦИЙ
Электронное строение щелочных металлов характеризуется наличием на внешней электронной оболочке одного электрона, относительно слабо связанного с ядром. С каждого щелочного металла начинается новый период в периодической таблице. Щелочной металл способен отдавать свой внешний электрон легче, чем любой другой элемент этого периода. Разрез щелочного металла в инертной среде имеет яркий серебристый блеск. Щелочные металлы отличаются невысокой плотностью, хорошей электропроводностью и плавятся при сравнительно низких температурах (табл. 2).
Благодаря высокой активности щелочные металлы в чистом виде не существуют, а встречаются в природе только в виде соединений (исключая франций), например с кислородом (глины и силикаты) или с галогенами (хлорид натрия). Хлориды являются сырьем для получения щелочных металлов в свободном состоянии. Морская вода содержит ЩЕЛОЧНЫЕ МЕТАЛЛЫ3% NaCl и следовые количества других солей. Очевидно, что озера и внутренние моря, а также подземные отложения солей и рассолы содержат галогениды щелочных металлов в больших концентрациях, чем морская вода. Например, содержание солей в водах Большого Соленого озера (шт. Юта, США) составляет 13,827,7%, а в Мертвом море (Израиль) до 31% в зависимости от площади зеркала воды, изменяющейся от времени года. Можно полагать, что незначительное содержание KCl в морской воде по сравнению с NaCl объясняется усвоением иона K+ морскими растениями.
В свободном виде щелочные металлы получают электролизом расплавов таких солей, как NaCl, CaCl2, CaF2 или гидроксидов (NaOH), так как нет более активного металла, способного вытеснить щелочной металл из галогенида. При электролизе галогенидов необходимо изолировать выделяющийся на катоде металл, так как одновременно на аноде выделяется газообразный галоген, активно реагирующий с выделяющимся металлом.
См. также ЩЕЛОЧЕЙ ПРОИЗВОДСТВО
Поскольку у щелочных металлов на внешнем слое всего один электрон, каждый из них является наиболее активным в своем периоде, так, Li самый активный металл в первом периоде из восьми элементов, Na соответственно во втором, а K самый активный металл третьего периода, содержащего 18 элементов (первый переходный период). В подгруппе щелочных металлов (IA) способность отдавать электрон возрастает сверху вниз.
Химические свойства. Все щелочные металлы активно реагируют с кислородом, образуя оксиды или пероксиды, отличаясь в этом друг от друга: Li превращается в Li2O, а другие щелочные металлы в смесь M2O2 и MO2, причем Rb и Cs при этом возгораются. Все щелочные металлы образуют с водородом солеподобные термически стабильные при высоких температурах гидриды состава M+H, являющиеся активными восстановителями; гидриды разлагаются водой с образованием щелочей и водорода и выделением теплоты, вызывающей воспламенение газа, причем скорость этой реакции у лития выше, чем у Na и K.
См. также ВОДОРОД; КИСЛОРОД.
В жидком аммиаке щелочные металлы растворяются, образуя голубые растворы, и (в отличие от реакции с водой) могут быть выделены снова при испарении аммиака или добавлении соответствующей соли (например, NaCl из его аммиачного раствора). При реакции с газообразным аммиаком реакция протекает подобно реакции с водой:
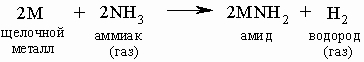
Амиды щелочных металлов проявляют основные свойства подобно гидроксидам. Большинство соединений щелочных металлов, кроме некоторых соединений лития, хорошо растворимы в воде. По атомным размерам и зарядовой плотности литий близок к магнию, поэтому свойства соединений этих элементов похожи. По растворимости и термической устойчивости карбонат лития подобен карбонатам магния и бериллия элементов подгруппы IIA; эти карбонаты разлагаются при относительно невысоких температурах вследствие более прочной связи МО. Соли лития лучше растворимы в органических растворителях (спиртах, эфирах, нефтяных растворителях), чем соли других щелочных металлов. Литий (как и магний) непосредственно реагирует с азотом, образуя Li3N (магний образует Mg3N2), тогда как натрий и другие щелочные металлы могут образовывать нитриды только в жестких условиях. Металлы подгруппы IA реагируют с углеродом, но наиболее легко протекает взаимодействие с литием (очевидно, благодаря его малому радиусу) и наименее легко с цезием. И наоборот, активные щелочные металлы непосредственно реагируют с СО, образуя карбонилы (например, K(CO)x), а менее активные Li и Na только в определенных условиях.
Применение. Щелочные металлы применяются как в промышленности, так и в химических лабораториях, например для синтезов. Литий используется для получения твердых легких сплавов, отличающихся, однако, хрупкостью. Большие количества натрия расходуются для получения сплава Na4Pb, из которого получают тетраэтилсвинец Pb(C2H5)4 антидетонатор бензинового топлива. Литий, натрий и кальций используются как компоненты мягких подшипниковых сплавов. Единственный и поэтому подвижный электрон на внешнем слое делает щелочные металлы прекрасными проводниками тепла и электричества. Сплавы калия и натрия, сохраняющие жидкое состояние в широком интервале температур, применяют как теплообменную жидкость в некоторых типах ядерных реакторов и благодаря высоким температурам в ядерном реакторе используются для производства пара. Металлический натрий в виде подводящих электрических шин используется в электрохимической технологии для передачи токов большой мощности. Гидрид лития LiH является удобным источником водорода, выделяющегося в результате реакции гидрида с водой. Литийалюминийгидрид LiAlH4 и гидрид лития используются в качестве восстановителей в органическом и неорганическом синтезе. Благодаря малому ионному радиусу и соответственно высокой зарядовой плотности литий активен в реакциях с водой, поэтому соединения лития сильно гигроскопичны, и хлорид лития LiCl используется для осушки воздуха при эксплуатации приборов. Гидроксиды щелочных металлов сильные основания, хорошо растворимые в воде; они применяются для создания щелочной среды. Гидроксид натрия как наиболее дешевая щелочь находит широкое применение (только в США ее расходуется в год более 2,26 млн. т).
Литий. Самый легкий металл, имеет два стабильных изотопа с атомной массой 6 и 7; более распространен тяжелый изотоп, его содержание составляет 92,6% от всех атомов лития. Литий был открыт А.Арфведсоном в 1817 и выделен Р.Бунзеном и А.Матисеном в 1855. Он используется в производстве термоядерного оружия (водородная бомба), для увеличения твердости сплавов и в фармацевтике. Соли лития применяют для увеличения твердости и химической стойкости стекла, в технологии щелочных аккумуляторных батарей, для связывания кислорода при сварке.
Натрий. Известен с древности, выделил его Х.Дэви в 1807. Это мягкий металл, широко применяются такие его соединения, как щелочь (гидроксид натрия NaOH), пищевая сода (бикарбонат натрия NaHCO3) и кальцинированная сода (карбонат натрия Na2CO3). Находит применение и металл в виде паров в неярких газоразрядных лампах уличного освещения.
Калий. Известен с древности, выделил его также Х.Дэви в 1807. Соли калия хорошо известны: калиевая селитра (нитрат калия KNO3), поташ (карбонат калия K2CO3), едкое кали (гидроксид калия KOH) и др. Металлический калий также находит различное применение в технологии теплообменных сплавов.
Рубидий был открыт методом спектроскопии Р.Бунзеном в 1861; содержит 27,85% радиоактивного рубидия Rb-87. Рубидий, как и другие металлы подгруппы IA, химически высокоактивен и должен храниться под слоем нефти или керосина во избежание окисления кислородом воздуха. Рубидий находит разнообразное применение, в том числе в технологии фотоэлементов, радиовакуумных приборов и в фармацевтике.
Цезий. Соединения цезия широко распространены в природе, обычно в малых количествах совместно с соединениями других щелочных металлов. Минерал поллуцит силикат содержит 34% оксида цезия Cs2O. Элемент был открыт Р.Бунзеном методом спектроскопии в 1860. Основным применением цезия является производство фотоэлементов и электронных ламп, один из радиоактивных изотопов цезия Cs-137 применяется в лучевой терапии и научных исследованиях.
Франций. Последний член семейства щелочных металлов франций настолько радиоактивен, что его нет в земной коре в более чем следовых количествах. Сведения о франции и его соединениях основаны на исследовании ничтожного его количества, искусственно полученного (на высокоэнергетическом ускорителе) при a-распаде актиния-227. Наиболее долгоживущий изотоп 22387Fr распадается за 21 мин на 22388Ra и b-частицы. Согласно приблизительной оценке, металлический радиус франция составляет 2,7 . Франций обладает большинством свойств, характерных для других щелочных металлов, и отличается высокой электронодонорной активностью. Он образует растворимые соли и гидроксид. Во всех соединениях франций проявляет степень окисления I.
Энциклопедия Кольера. — Открытое общество . 2000 .
Полезное
Смотреть что такое "ЩЕЛОЧНЫЕ МЕТАЛЛЫ" в других словарях:
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — хим. элементы (щелочные элементы), составляющие гл. подгруппу 1 группы периодич. системы элементов, а также отвечающие им простые вещества металлы. К Щ. м. относятся литий Li (ат. номер 3), натрий Na (11), калий К (19), рубидий Rb (37), це … Физическая энциклопедия
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — ЩЕЛОЧНЫЕ МЕТАЛЛЫ, одновалентные металлы, составляющие первую группу периодической таблицы: литий, НАТРИЙ, РУБИДИЙ, ЦЕЗИЙ и ФРАНЦИЙ. Это мягкие серебристо белые металлы, которые быстро окисляются на воздухе и дают бурную реакцию с водой, при… … Научно-технический энциклопедический словарь
Щелочные металлы — ЩЕЛОЧНЫЕ МЕТАЛЛЫ: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr. Мягкие металлы, легко режутся (кроме Li), Rb, Cs и Fr почти пастообразны при обычных условиях; Li самый лёгкий из всех металлов, Na и K легче воды. Химически очень… … Иллюстрированный энциклопедический словарь
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — химические элементы Li, Na, K, Rb, Cs, Fr. Название от щелочей гидроксидов щелочных металлов … Большой Энциклопедический словарь
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — элементы I группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr); очень мягкие, пластичные, легкоплавкие и легкие, как правило, серебристо белого цвета; химически очень активны; бурно реагируют с … Российская энциклопедия по охране труда
Щелочные металлы — Группа → 1 ↓ Период 2 3 Литий … Википедия
Щелочные металлы — Alkali metals Щелочные металлы. Металлы первой группы Периодической системы, а именно: литий, натрий, калий, рубидий, цезий и франций. Они образуют строго щелочные гидроксиды, отсюда и их название. (Источник: «Металлы и сплавы. Справочник.» Под… … Словарь металлургических терминов
Щелочные металлы — химические элементы Li, Na, К, Rb, Cs, Fr. Названы так потому, что их гидрооксиды наиболее сильные щелочи. Химически щелочные металлы наиболее активные металлы. Их активность возрастает от Li к Fr … Энциклопедический словарь по металлургии
ЩЕЛОЧНЫЕ МЕТАЛЛЫ — химические элементы Li, Na, К, Rb, Cs, Fr. Названы так потому, что их гидрооксиды наиболее сильные щелочи. Химически щелочные металлы наиболее активные металлы. Их активность возрастает от Li к Fr … Металлургический словарь
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
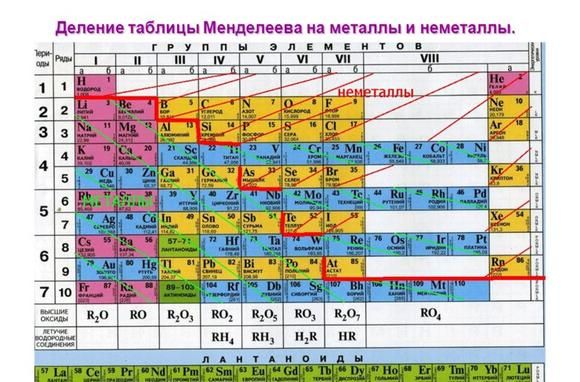
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
Общая характеристика
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
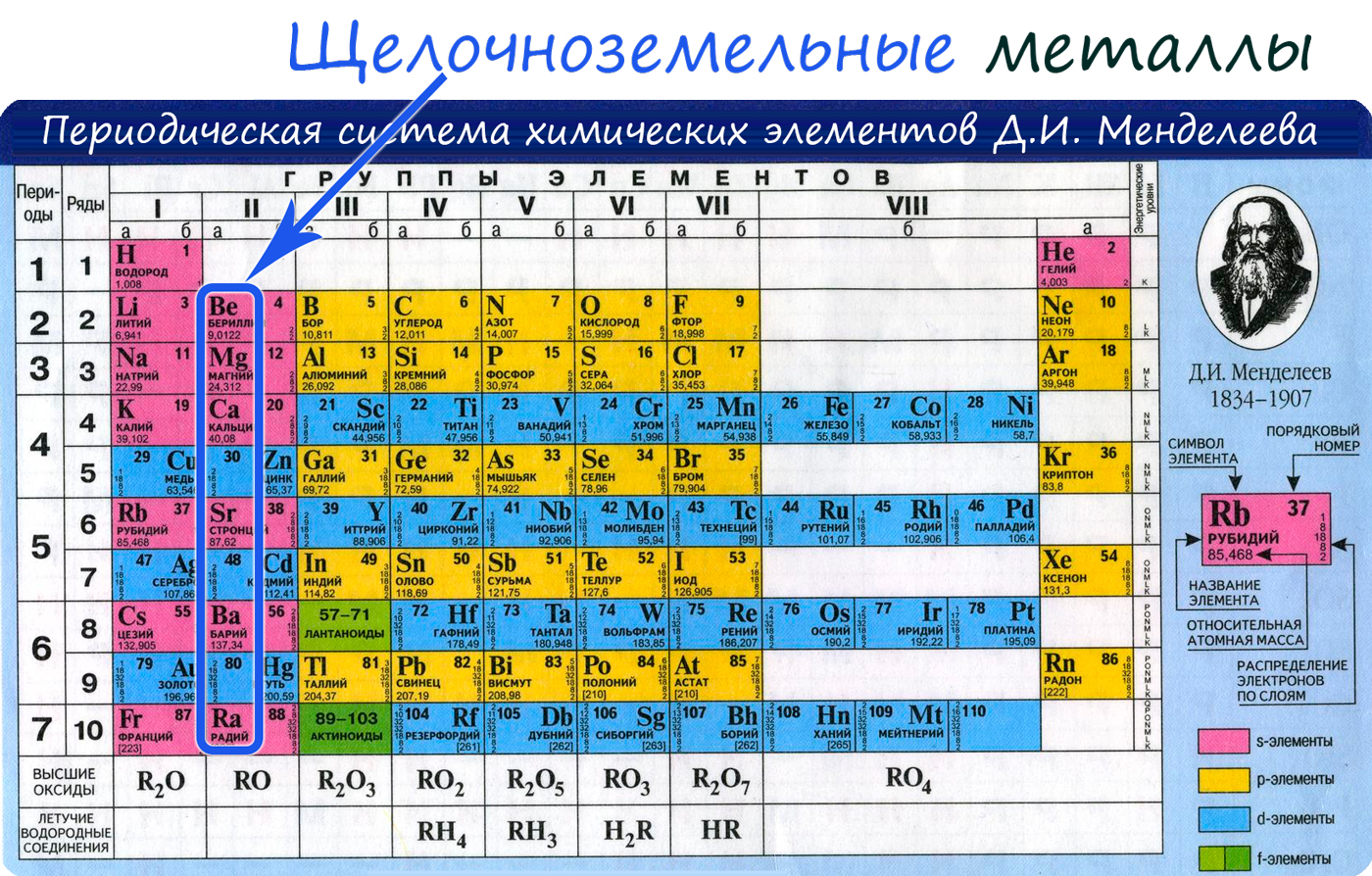
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
Природные соединения
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Получение
Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

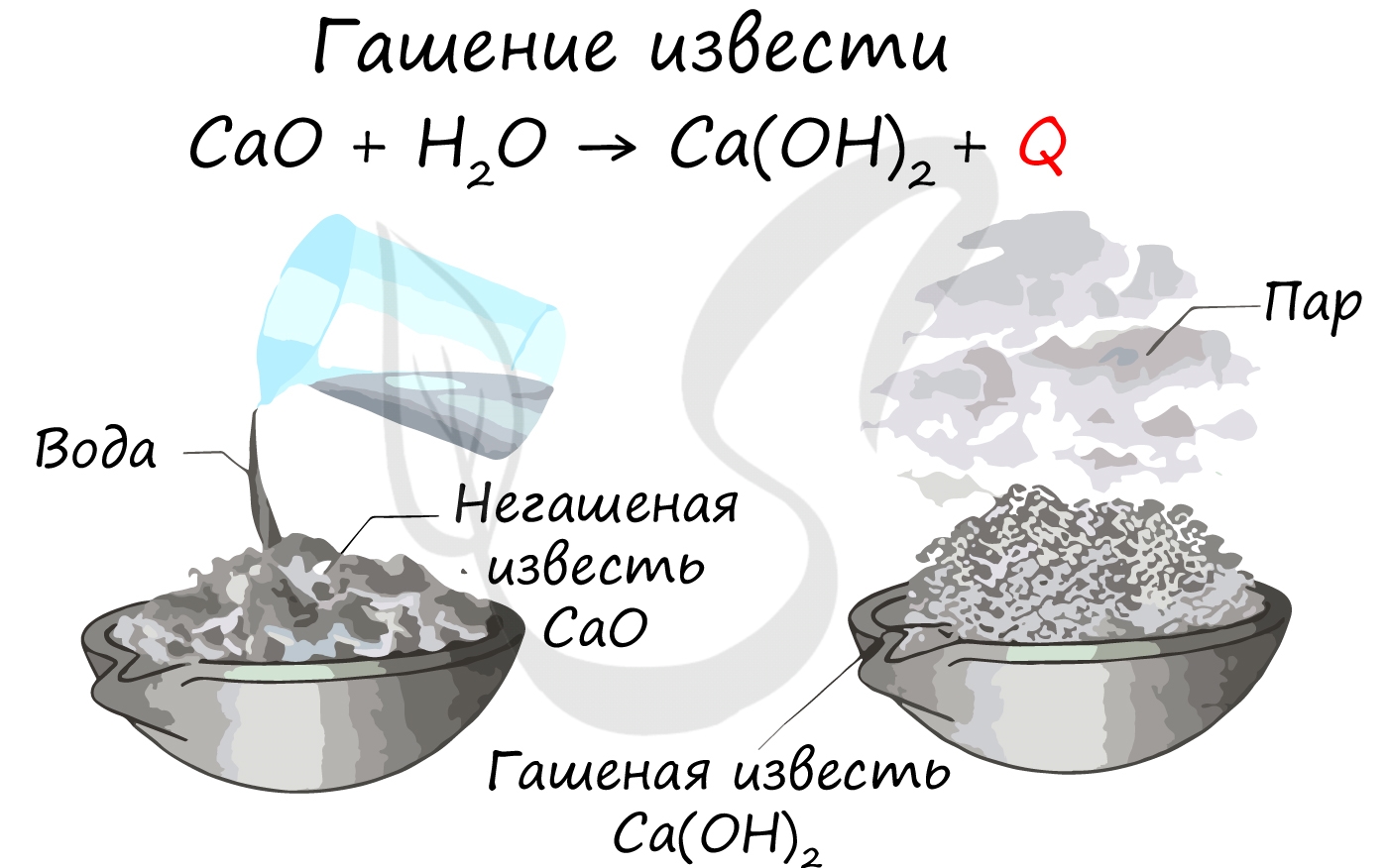
Химические свойства
Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
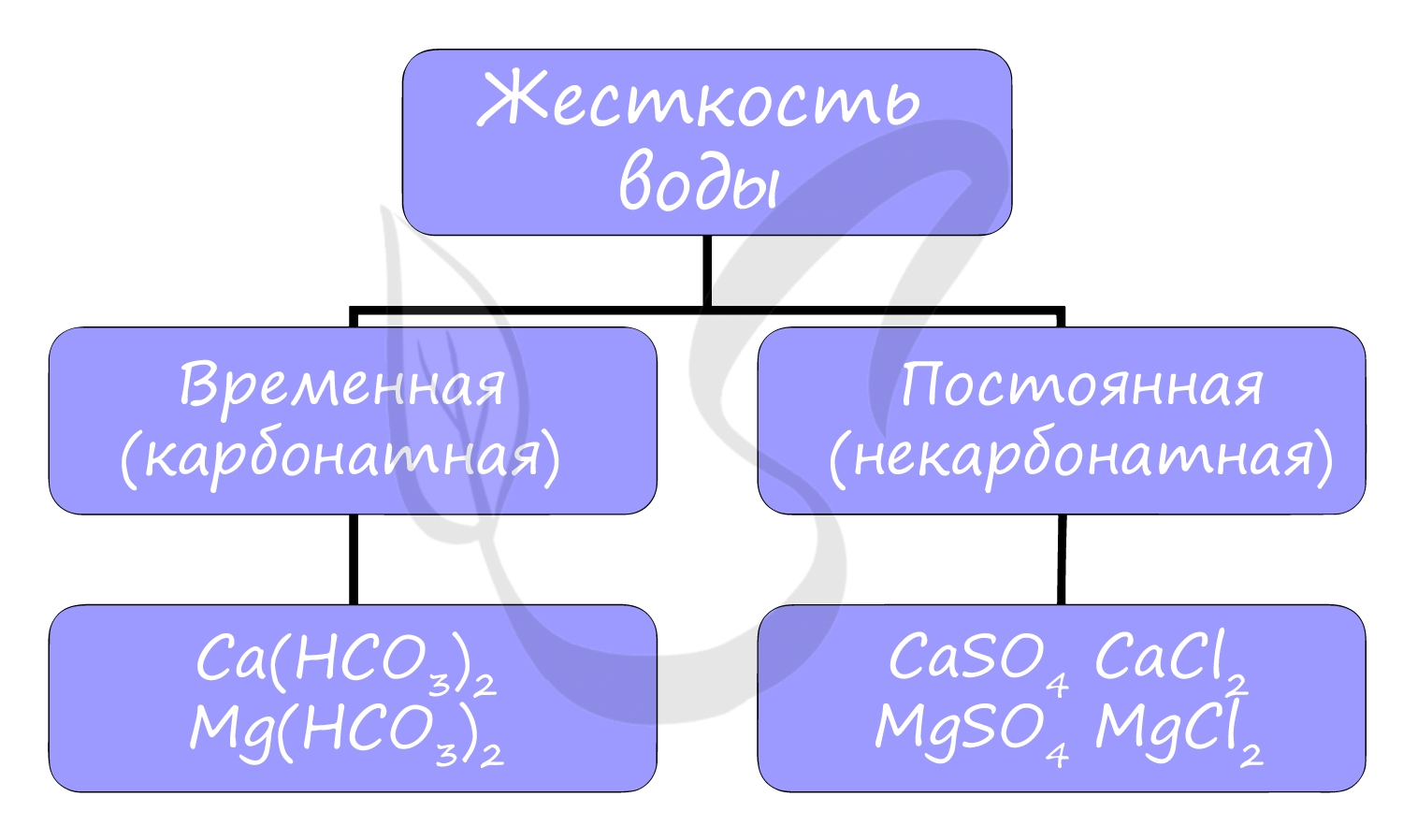
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Читайте также:
