Действие карбоновых кислот на металлы
Обновлено: 05.10.2024
Предельные одноосновные
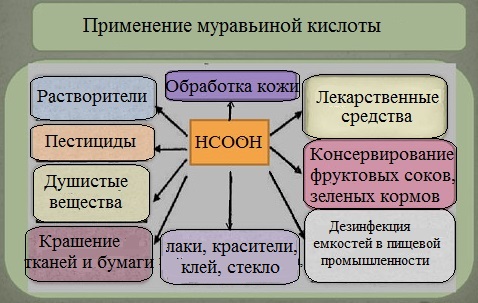
Благодаря своему уникальному молекулярному составу муравьиная кислота обладает антибактериальными свойствами, поэтому основная сфера ее применения – это пищевая промышленность (пищевая добавка E 236). В пищевой промышленности она используется в качестве дезинфицирующего и консервирующего средства при производстве кондитерских изделий, консервированных и молочных продуктов, безалкогольных напитков. Помимо этого, муравьиная кислота применяется для дезинфекции пивных и винных бочек.
Она применяется в химической промышленности в качестве восстановителя при синтезе органических веществ, при получении щавелевой кислоты. А также, при изготовлении стекла, промышленного клея, промышленных лаков и химических красителей.
Сложные эфиры муравьиной кислоты используют в качестве растворителей и душистых веществ.
В текстильной промышленности ее используют в качестве протравы при крашении тканей, в кожевенном производстве – для отмывания извести, используемой при обработке шкур.
Муравьиная кислота обладает болеутоляющим, бактерицидным, противовоспалительным, согревающим действием и благодаря этим свойствам находит широкое применение в медицине. Ее используют в медицине в качестве наружного обезболивающего средства. Смесь кислоты с водой, так называемый муравьиный спирт, используется как раздражающее кожу, рефлекторно действующее средство при ревматических и неврологических болях.
Муравьиная кислота входит в состав не только лечебных, но и косметических препаратов.
Кроме того ее применяют в сельском хозяйстве при заготовке различных кормов. Муравьиной кислотой обрабатывают сено, силос, что помогает замедлить процессы гниение и распада, благодаря чему корма способны храниться намного дольше.
Муравьиная кислота также используется для борьбы с паразитами в пчеловодстве.
Из всех карбоновых кислот уксусная кислота находит наиболее широкое применение. Она необходима для синтеза красителей для тканей, лекарственных веществ, сложных эфиров, растворителей лаков. Большое ее количество расходуются для производства искусственного волокна (ацетатного шелка), пластических масс, невоспламеняющейся кинопленки, органического стекла, ядохимикатов, стимуляторов роста растений.
В пищевой промышленности (пищевая добавка Е 260) уксусную кислоту применяют для консервирования овощей, грибов, рыбы и в качестве приправы к пище. Консервирующее действие кислоты связано с подавлением развития гнилостных бактерий и плесневых грибков.
Солями уксусной кислоты (Al, Fe, Cr) протравливают ткани при крашении, они способствуют закреплению красителей на волокне.
Ацетат свинца применяется для изготовления свинцовых белил и свинцовой примочки в медицине.
Соли уксусной кислоты используются также в сельском хозяйстве. В результате применения 2,4-дихлорфеноксиуксусной кислоты и ее солей на полях с зерновыми погибают только широколиственные сорняки, что используется при выращивании зерновых культур.
Уксусный ангидрид применяется в производстве пластических масс, искусственного шелка, ацетанилида.
Из монохлоруксусной кислоты получают негорючую кинопленку, органическое стекло, пропускающее ультрафиолетовые лучи.

Масляная кислота применяется для лечения некоторых заболеваний желудочно-кишечного тракта. В процессе ферментативных реакций кислота и ее соли создают в кишечнике кислую среду, благоприятную для развития полезных бактерий и подавляющую развитие патогенных, таких как возбудитель сальмонеллы и кишечная палочка. Кроме этого, масляная кислота способствует регуляции водно-электролитного баланса в кишечнике, регулирует его моторику.
Соли масляной кислоты используются в животноводстве, птицеводстве и рыбоводстве как кормовые добавки. Эти добавки усиливают иммунитет, способствуют лучшей усвояемости пищи, подавляют деятельность многих вредных кишечных бактерий, уменьшают необходимость применения антибиотиков.
Также она используется для изготовления лакокрасочных материалов, пластификаторов для лаков, эмульгаторов.
Применяется в парфюмерной и кондитерской промышленностях в виде сложных эфиров, являющихся ценными ароматическими веществами.
Стеариновая и пальмитиновая кислота входят в состав животных жиров и растительных масел. Натриевые и калиевые соли этих кислот входят в состав мыла.
Стеариновая кислота часто используется при изготовлении косметических средств, в качестве стабилизатора смеси и эмульгатора. Она делает состав непрозрачным и густым. Косметические средства, содержащие активные вещества стеарина быстро впитываются в сухую кожу и оказывают на нее благотворное влияние.
При производстве мыла часто используется соль стеариновой кислоты, поскольку она обладает хорошим моющим свойством и применяется в роли загустителя. Стеариновая кислота в мыле постепенно затвердевает.
Другое применение активных веществ стеарина – это возможность создания на их основе пластичных масок и наполнителей резиновых смесей. Эти компоненты помогают сделать резину более пластичной и однородной.
Пальмитиновая кислота используется в качестве одного из основных компонентов для приготовления напалма, различных моющих и косметических средств, а также при производстве стеарина (смесь со стеариновой кислотой).
Пальмитиновая кислота используется в производстве технических масел для смазки, для изготовления пластификаторов и свечей.
Пальмитат натрия находит свое применение в производстве хозяйственного и туалетного мыла, где он выполняет роль загустителя.
Соли пальмитиновой кислоты нашли применение в производстве косметических препаратов в качестве эмульгатора.
Метилпальминат (метиловый эфир пальмитиновой кислоты) используется для ароматизации некоторых пищевых продуктов.
Предельные двухосновные
Щавелевая кислота благодаря своим уникальным свойствам применяется во многих отраслях промышленности.
В химической промышленности щавелевая кислота используется при синтезе красителей, при производстве чернил, пластмасс, пиротехники.
Также она используется как дезинфицирующее и отбеливающее средство в составе синтетических моющих средств. В бытовой химии ее применяют в качестве одного из основных компонентов чистящих и моющих средств для раковин, унитазов.
В металлургической промышленности щавелевая кислота используется в виде специального состава при очистке металлов, котлов от коррозии, накипи, ржавчины, оксидов.
В кожевенной и текстильной промышленности она находит применение в качестве потравы при окраске шелка и шерсти, для дубления кожи. Это обработка поверхности необходима для того, чтобы краситель лег на материю равномерно.
Широко применяется щавелевая кислота для уменьшения жесткости воды и очистка ее от примесей.
В косметологии она применяется как отбеливающий компонент в кремах от пигментных пятен, веснушек.
В сельском хозяйстве ее используют как инсектицид, особенно она востребована у пчеловодов для обработки пчел.
В настоящее время щавелевая кислота широко применяется в пищевой промышленности для производства пищевых добавок.
Малоновая ( пропандиовая, метандикарбоновая кислота ) кислота используется при производстве непредельных кислот, флавонов, аминокислот, витаминов В 1 и В 6 .
Янтарная кислота нашла свое применение в медицинской промышленности для производства лекарственных препаратов, в косметологии, аналитической химии и химической промышленности — в производстве пластмасс и смол, в птицеводстве и животноводстве — как средство, снижающее заболеваемость, в сельском хозяйстве = как средство, повышающее урожайность растений и их устойчивость к неблагоприятным внешним факторам.
Она способна стимулировать адаптационные и защитные функции организма, повышать диастолическое артериальное давление и секреторную функцию желез желудка, улучшать аппетит, повышать физическую работоспособность, нейтрализует образующиеся свободные радикалы.
Янтарная кислота участвует в обменных процессах, протекающих в организме. Она необходима для обеспечения клеточного дыхания, синтеза белков, выработки внутриклеточной энергии. Кроме того янтарная кислота способствует выведению из организма отравляющих веществ и уменьшает токсическое действие алкоголя.
В аналитической химии с помощью щавелевой кислоты осаждают редкоземельные металлы.
Ненасыщенные кислоты
Акриловая кислота и её производные используются при производстве акриловых эмульсий для лакокрасочных материалов, пропитки тканей и кожи, в качестве сырья для полиакрилонитрильных волокон и акриловых каучуков, строительных смесей и клеев.
В производстве полимеров широко применяют сложные эфиры акриловой и метакриловой кислот. Например, полиакрилонитрил – основа волокна нитрон, используемого для производства лечебного белья.
Жирные ненасыщенные кислоты
Олеиновая кислота применяется как флотореагент и собиратель при обогащении руд цветных металлов.
Олеиновая кислота и ее эфиры применяют как пластификаторы для изготовления лакокрасочных материалов.
В пищевой промышленности она применяется при производстве ароматизаторов.
Также олеиновая кислота широко применяется в качестве смазывающе-охлаждающих жидкостей при сверлении и обработке труднообрабатываемых нержавеющих сталей и сплавов. Выступает эмульгатором в резинотехнической промышленности.
Олеиновая кислота применяется при изготовлении хозяйственного мыла, моющих средств.
Небольшие количества олеиновой кислоты используют в качестве наполнителя в фармацевтических препаратов.
Особенно нужно подчеркнуть роль линолевой и линоленовой кислот как соединений, незаменимых для человека (в организме они не могут быть синтезированы и должны поступать с пищей около 5 гр в день). По этой причине эти кислоты относят к так называемым незаменимым жирным кислотам. Линолевая и линоленовая кислоты содержатся в основном в растительных маслах.
Линолевая кислота регулирует жировой и белковый обмен, предотвращает накопление холестерина в сосудах, препятствует возникновению тромбов, защищает клетки от преждевременного старения, улучшает функции нервной системы, повышает усвояемость жирорастворимых витаминов и витаминов группы В. Она нормализует, а также ускоряет обменные процессы в организме, повышает иммунитет.
Линоленовая кислота регулирует артериальное давление, предупреждает инфаркт миокарда. Снижает уровень холестерина в крови, предотвращая развитие атеросклероза. Обладает противовоспалительными свойствами и применяется для лечения кожных заболеваний.
Линоленовая кислота улучшает усвоение жирорастворимых витаминов (D, А, Е, К). Витамин Е является важным элементом в питании беременной женщины, так как он снижает вероятность отслойки плаценты.
Она способствует сохранению влаги в коже и волосах, поэтому ее применяют для ухода за сухой кожей.
Ароматические кислоты
Бензойная кислота
Эфиры бензойной кислоты , обладающие сильным запахом, применяют в парфюмерной промышленности. Различные производные бензойной кислоты (нитро- и хлорбензойная кислота) широко применяют для синтеза красителей (например, анилинового синего).
Также ее используют в качестве консерванта для пищевых продуктов. Она проявляет антимикробное и антигрибковое действие, оказывает угнетающее воздействие на плесень, дрожжи и некоторые виды бактерий.
Бензойную кислоту применяют в медицине при кожных заболеваниях как наружное антисептическое (противомикробное) и фунгицидное (противогрибковое) средства, натриевую соль бензойной кислоты добавляют в сиропы от кашля, поскольку она обладает отхаркивающим свойством и разжижает мокроту. Оно прекрасно борется с потливостью ног.
Получение карбоновых кислот
1. Окисление спиртов, алкенов и алкинов
При окислении спиртов, алкенов, алкинов и некоторых других соединений подкисленным раствором перманганата калия образуются карбоновые кислоты.
| Например, при окислении этанола в жестких условиях образуется уксусная кислота |

2. Окисление альдегидов
Альдегиды реагируют с раствором перманганата или дихромата калия в кислой среде при нагревании, а также с гидроксидом меди при нагревании.
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота. |

| Например, при окислении альдегидов гидроксидом меди (II) также образуются карбоновые кислоты |

3. Щелочной гидролиз тригалогенидов
Тригалогеналканы, в которых три атома галогена расположены у одного атома углерода, с избытком щелочи образуется соль кислоты. При этом сначала происходит замещение галогенов на группы ОН.

Образуется неустойчивое вещество, которое распадается с отщеплением воды:

Так как щелочь в избытке, то образуется не сама кислота, а её соль:

4. Получение карбоновых кислот из солей
Карбоновые кислоты можно получить из солей действием минеральной кислоты на раствор соли:

| Например, муравьиную кислоту можно получить, подействовав на формиат натрия раствором серной кислоты: |

5. Гидролиз сложных эфиров
Сложные эфиры подвергаются гидролизу в кислой среде при нагревании:

| Например, метилацетат гидролизуется в кислой среде: |

6. Получение муравьиной кислоты из угарного газа
Соль муравьиной кислоты получают нагреванием оксида углерода (II) с твёрдым гидроксидом натрия под давлением:
7. Каталитическое окисление бутана
Уксусную кислоту в промышленности получают каталитическим окислением бутана:

8. Получение бензойной кислоты
Бензойную кислоту получают окислением гомологов бензола раствором перманганата калия в кислой среде.
| Например, при окислении толуола образуется бензойная кислота: |

9. Взаимодействие реактива Гриньяра с углекислым газом
При взаимодействии реактивов Гриньяра (алкилгалогенидов магния) с углекислым газом и последующем гидролизе образовавшегося промежуточного продукта образуется карбоновая кислота.
Химические свойства карбоновых кислот
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода . |

1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды . |
| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H 2О + ( CH 3 COO )2 Cu
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |

| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |

2. Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |

2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:

При нагревании карбоновые соли аммония разлагаются на амид и воду:

2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |

3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
| Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу. |
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
| Например, уксусная кислота реагирует с бромом в присутствии красного фосфора |

4. Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.

При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):

4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:
5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:

4.2. Реакции замещения в бензольном кольце
| Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. |

6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:

6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:

7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:

К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:

6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Читайте также:
|


