Двухатомный спирт с металлическим натрием
Обновлено: 27.09.2024
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Химические свойства этиленгликоля
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этиленгликоль взаимодействует с калием с образованием гликолята калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |

2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль : |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180 о С) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.

4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).

4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
Получение этиленгликоля
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2 → CH2(OH)-CH2OH
3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
Двухатомный спирт с металлическим натрием
При выполнении заданий с кратким ответом впишите в поле для ответа цифру, которая соответствует номеру правильного ответа, или число, слово, последовательность букв (слов) или цифр. Ответ следует записывать без пробелов и каких-либо дополнительных символов. Дробную часть отделяйте от целой десятичной запятой. Единицы измерений писать не нужно. Ответом на задания 1—25 является последовательность цифр или число.
Если вариант задан учителем, вы можете вписать или загрузить в систему ответы к заданиям с развернутым ответом. Учитель увидит результаты выполнения заданий с кратким ответом и сможет оценить загруженные ответы к заданиям с развернутым ответом. Выставленные учителем баллы отобразятся в вашей статистике.
В результате реакции предельного двухатомного спирта массой 30,4 г с избытком металлического натрия получено 8,96 л (н. у.) газа. Определите молекулярную формулу исходного спирта.
Решения заданий с развернутым ответом не проверяются автоматически.
На следующей странице вам будет предложено проверить их самостоятельно.
При взаимодействии одного и того же количества алкена с различными галогеноводородами образуется соответственно 7,85 г хлорпроизводного или 12,3 г бромпроизводного. Определите молекулярную формулу алкена.
Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
Cложный эфир массой 30 г подвергнут щелочному гидролизу. При этом получено 34 г натриевой соли предельной одноосновной кислоты и 16 г спирта. Установите молекулярную формулу этого эфира.
При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н. у.) углекислого газа, 0,63 г воды и 0,112 л (н. у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
Предельная одноосновная карбоновая кислота массой 48,4 г полностью растворяет оксид магния, полученный при прокаливании 23,1 г карбоната магния. Установите формулу кислоты.
При полном сгорании углеводорода образовалось 27 г воды и 33,6 л (н. у.) углекислого газа. Относительная плотность углеводорода по аргону равна 1,05. Установите его молекулярную формулу.
При окислении 5,6 л (н. у.) алкена холодным водным раствором перманганата калия образовалось 22,5 г двухатомного спирта. Реакция окисления идёт со 100%-м выходом. Установите молекулярную формулу алкена.
Для полного гидрирования гомолога бензола потребовалось 10,08 л (н. у.) водорода, при этом образовался циклоалкан массой 14,7 г. Запишите уравнение реакции в общем виде. Определите молекулярную формулу гомолога бензола. Считать выход продукта реакции равным 100%.
В результате сжигания 1,74 г органического соединения получено 5,58 г смеси и . Количества веществ и в этой смеси оказались равными. Определите молекулярную формулу органического соединения, если относительная плотность его по кислороду равна 1,81.
Тест по теме Решение задач по химии
N.B. Разделение на темы вопросов по химии носит приблизительный характер, так как сам формат большинства вопросов ЕГЭ по химии исключает возможность однозначного отнесения вопроса к одной определённой теме.
6752. В реактор постоянного объёма поместили некоторое количество оксида азота (IV) и кислорода. В результате протекания обратимой реакции в реакционной системе

установилось химическое равновесие.
Используя данные, приведённые в таблице, определите исходную концентрацию оксида азота(IV) и равновесную концентрацию оксида азота(II).
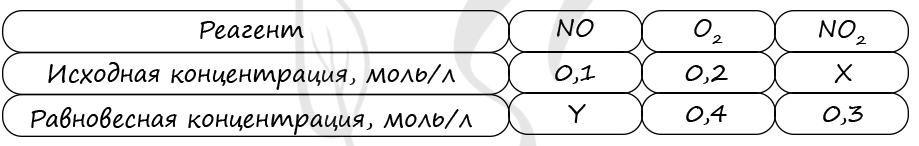

Верный ответ: 63
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6752.
6773. Сколько граммов щавелевой кислоты следует растворить в 200 г 5%-ного раствора её, чтобы массовая доля кислоты стала равной 8%? (Запишите число с точностью до десятых.)
Верный ответ: 6,5
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6773.
6780. Насыщенный при 20°С раствор нитрата серебра массой 140 г охладили до 0°С (растворимость нитрата серебра при 20°С 228 г/100 г воды, а при 0°С - 125 г/100 г воды), выпавшую в осадок безводную соль отделили, а от оставшегося раствора отобрали порцию массой 19,22 г. Вычислите, какой объем смеси сероводорода и азота (при н.у.), содержащий 40% сероводорода по массе, необходимо пропустить через эту порцию раствора, чтобы полностью осадить содержащиеся в ней ионы серебра (указывайте единицы измерения искомых физических величин).
2) Определим массу раствора и массу растворенного нитрата серебра после охлаждения

После охлаждения масса раствора равна (140 - 43,9) = 96,1 г. Масса растворенного нитрата серебра равна (97,3 - 43,9) = 53,4 г
3) Вычислим массу и объем сероводорода, который прореагирует с порцией раствора 96,1 : 19,22 = 5 ⟹ в порции раствора содержится 53,4 : 5 = 10,68 г
n(AgNO3) = 10,68 : 170 = 0,0628 моль
n(H2S) = 0,5n(AgNO3) = 0,0314 моль
m(H2S) = 0,0314 · 34 = 1,067 г, V(H2S) = 0,0314 · 22,4 = 0,7 л
4) Вычислим объем смеси
m(N2) = 0,6 · m(H2S) : 0,4 = 0,6 · 1,067 : 0,4 = 1,6 г
n(N2) = 1,6 : 28 = 0,057 моль, V(N2) = 0,057 · 22,4 = 1,27 л
V(смеси) = 0,7 + 1,27 = 1,97 л
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6780.
6781. В результате реакции предельного двухатомного спирта массой 30,4 г с избытком металлического натрия получено 8,96 л (н. у.) газа. Указанный спирт не взаимодействует со свежеполученным осадком гидроксида меди(II).
На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы спирта и запишите молекулярную формулу спирта;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) приведите уравнение реакции его взаимодействия с металлическим натрием.
Определена молекулярная формула вещества:
M(CnH2n(OH)2) = 12n + 2n + 34 = 76 г/моль
14n + 34 = 76
14n = 42
n = 3
Молекулярная формула: C3H6(OH)2
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6781.
6787. В реактор постоянного объёма поместили некоторое количество оксида азота(II) и кислорода. В результате протекания обратимой реакции в реакционной системе
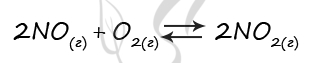
установилось химическое равновесие.
Используя данные, приведённые в таблице, определите исходную концентрацию кислорода и равновесную концентрацию оксида азота(II).

Верный ответ: 52
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 6787.
Тест по теме Реакции с различными веществами
7376. В результате сплавления органического вещества с гидроксидом натрия был получен алкан, 0,9 г которого занимают объём 672 мл (н.у.). Известно, что исходное вещество относится к классу солей. В этом соединении количество атомов кислорода равно количеству атомов углерода.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции сплавления исходного органического вещества с гидроксидом натрия (используйте структурные формулы органических веществ).
1) Вычислим молярную массу
n(CnH2n) = 0,672 : 22,4 = 0,03 моль
M(CnH2n) = 0,9 : 0,03 = 30 г/моль
M(CnH2n=2) = 12n + 2n = 30
14n = 28
n = 2
молекулярная формула алкана C2H6
2) Установлена структурная формула исходного органического вещества:
NaOOC-CH2-CH2-COONa
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7376.
7516. Углеводород нециклического строения массой 8,4 г реагирует с водородом в одну стадию и способен присоединить 3,36 л (н.у.) водорода в присутствии катализатора. Известно, что в результате присоединения бромоводорода к этому углеводороду образуется только одно бромпроизводное.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции исходного вещества с бромоводородом (используйте структурные формулы органических веществ).
1) Вычислим молярную массу углеводорода
n(H2) = 3,36 : 22,4 = 0,15 моль
n(CnH2n) = 0,15 моль
n(CnH2n) = 8,4 : 0,15 = 56 г/моль
Молекулярная формула углеводорода
M(CnH2n) = 12n + 2n = 56
14n = 56
n = 4
Молекулярная формула C4H8
2) Составлена структурная формула
CH3-CH=CH-CH3
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7516.
7831. Дегидрирование органического вещества приводит к образованию ароматического углеводорода, 0,3 моль которого имеют массу 27,6 г. Известно, что количество вещества водорода, выделившегося при дегидрировании исходного вещества, в 3 раза превышает количество вещества исходного углеводорода. Исходный углеводород не обесцвечивает бромную воду и раствор перманганата калия.
На основании данных условия задания:
1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества;
2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение реакции дегидрирования исходного вещества (используйте структурные формулы органических веществ).
1) Молярная масса углеводорода
M(CnH2n-6) = 27,6 : 0,3 = 92 г/моль
Установлена молекулярная формула ароматического углеводорода:
M(CnH2n-6) = 12n + 2n - 6 = 92
14n = 98
n = 7
Молекулярная формула - C7H8
2) Структурная формула метилциклогексана
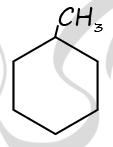
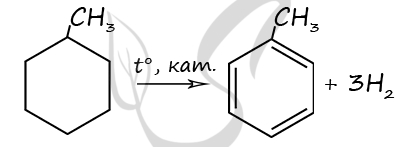
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7831.
7866. Дегидрирование органического вещества приводит к образованию ароматического углеводорода, 0,7 моль которого имеют массу 74,2 г. Известно, что количество вещества водорода, выделившегося при дегидрировании исходного вещества, в 3 раза превышает количество вещества исходного углеводорода. Исходный углеводород не обесцвечивает бромную воду и раствор перманганата калия. На основании данных условия задания: 1) проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу органического вещества; 2) составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле; 3) напишите уравнение реакции дегидрирования исходного вещества (используйте структурные формулы органических веществ).
1) Молярная масса углеводорода
M(CnH2n-6) = 74,2 / 0,7 = 106
M(CnH2n-6) = 12n + 2n - 6 = 106
14n = 112
n = 8
Молекулярная формула исходного вещества - C8H10
2) Структурная формула
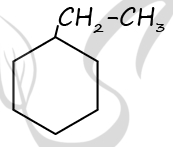
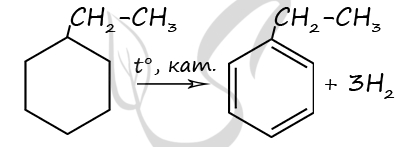
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7866.
В результате реакции предельного двухатомного спирта массой 30,4 г с избытком металлического натрия получено 8,96 л (н. у.) газа. Указанный спирт не взаимодействует со свежеполученным осадком гидроксида меди(ІІ).
На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы спирта и запишите молекулярную формулу спирта;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) приведите уравнение реакции его взаимодействия с металлическим натрием.
Данную задачу проверяют не автоматически, а вручную. Ознакомьтесь с критериями оценки, правильным решением и сами себе поставьте оценку от 0 до 3 баллов. Даже если вы ошиблись в цифровом ответе, можно получить несколько баллов за правильный ход решения. Форма для оценки находится внизу страницы.
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: 1) правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества; 2) записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; 3) с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
1) Напишем примерное уравнение реакции:
C X n H X 2 n ( O H ) X 2 + 2 N a → C X n H X 2 n ( O N a ) X 2 + H X 2 ↑ \ce(OH)2 + 2Na -> C_nH_(ONa)2 + H2 ^> C X n H X 2 n ( O H ) X 2 + 2 N a
C X n H X 2 n ( O N a ) X 2 + H X 2 ↑
Выбрана формула двухатомного спирта в уравнении реакции.
Найдём количество вещества водорода:
Исходя из уравнения реакции видим, что количество вещества водорода равно количеству вещества спирта:
Молярную массу исходного вещества можно найти исходя из массы, данной в условии, и количества вещества, найденного нами:
С помощью молярной массы можем определить молекулярную формулу:
2) В задании уже указано, что это спирт, причём многоатомный. Также есть подсказка, что он не взаимодействует со свежеприготовленным оскадком гидроксида меди, а, значит, что гидроксильные группы расположены не рядом, а у разных атомов углерода. Тогда структурная формула выглядит следующим образом:
3) Уравнение реакции вещества с натрием:
H O − C H X 2 − C H X 2 − C H X 2 − O H + 2 N a → N a O − C H X 2 − C H X 2 − C H X 2 − O N a + H X 2 ↑ \ce NaO-CH2-CH2-CH2-ONa + H2 ^> H O − C H X 2 − C H X 2 − C H X 2 − O H + 2 N a
N a O − C H X 2 − C H X 2 − C H X 2 − O N a + H X 2 ↑
Читайте также:


