Эффективный радиус атома металла формула
Обновлено: 04.05.2024
И наоборот, электронные конфигурации, близкие к наиболее устойчивым, весьма неустойчивы и стремятся перейти в устойчивые за счет соседних подуровней. Так, в случае Cr (4s 2 3d 4 ) неустойчивая 3d 4 конфигурация переходит в устойчивую 3d 5 за счет соседней 4s 2 , переходящей в 4s 1 (очевидно затрата энергии на удаление электрона с 4s-АО меньше выигрыша в энергии при заполнении 3d 4 -АО до 3d 5 ).
Такие отклонения имеют место во многих случаях:
для d-элементов: Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au;
для f-элементов: La, Gd, Ac, Th, Pa, U, Cm.
Причем нарушение последовательности заполнения АО у актиноидов связано также со сближением 6d- и 5f-подуровней, так что "легкие" актиноиды от Ac до Pu по своим свойствам похожи на d-элементы.
Орбитальные конфигурации и первые энергии ионизации атомов.Энергия, необходимая для отрыва электрона от атома называется энергией ионизации (I)
Э + I1 ® Э + + ē.
Отрыву первого электрона соответствует первая энергия ионизации I1 , второго – вторая I2 и т.д. Энергию ионизации выражают либо в кДж/моль, либо в электронвольтах (эВ).
Последовательная ионизация атома должна происходить в порядке, обратном заполнению электронами атомных орбиталей. (Однако и здесь имеют место некоторые нарушения порядка: для d-, и f-элементов первыми отрываются nsэлектроны, а затем – (n-1)dили(n-2)f;это связано с тем, что в ионах, по сравнению с атомами, порядок энергий АО нарушается (рис. 3.1).
Общая закономерность последовательных потенциалов ионизации – это их быстрое возрастание с увеличением кратности ионизации. Рассмотрим, например, атом Sc: ….3p 6 4s 2 3d 1 . Последовательные потенциалы ионизации от I1 до I5: 6,56; 12,8; 24,75; 74,5; 93,9 эВ (обычно измеряется в эВ; один эВ - это энергия, которую приобретает электрон в поле с разностью потенциалов 1В; эта энергия численно равна разности потенциалов, которую нужно приложить к атому, чтобы оторвать электрон: 1эВ = 96,49 кДж/моль).
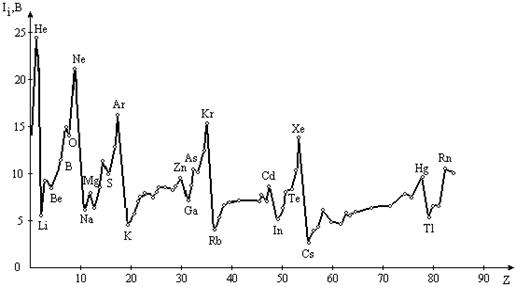
Рис. 3.1. Зависимость энергии ионизации атома
от порядкового номера элемента
Видно, что быстро растет с увеличением кратности ионизации, что связано с возрастанием электростатического взаимодействия между отрываемым электроном и все увеличивающимся зарядом ядра. Кроме того, можно отметить более резкое возрастание при отрыве электрона с нового квантового слоя (I1, I2 соответствует отрыву электрона с
4s -АО , I3 – c 3d-АО, а I4 и I5 – от 3p 6 - и 3p 5 -конфигураций); причем видно , что наибольший скачок приходится на отрыв первого электрона нового слоя. Вообще, резкое возрастание всегда приходится на начало нового уровня, а наименьшими обладают валентные электроны.
Сравним между собой первые энергии ионизации элементов I1(Э). Из рисунка 2.3 видно, что I1 изменяется в зависимости от номера элемента (Z) периодически. При этом максимумы приходятся на устойчивые электронные конфигурации : s 2 , p 3 , p 6 , d 10 . а минимумы – на неустойчивые : s 1 , p 1 , p 4 .
Сродство к электрону и электроотрицательность. Энергия, которая выделяется при присоединении электрона к атому, называется сродством к электрону (Eср) (кДж/моль или эВ).
Э 0 + е = Э - + Еср .
Величина Еср ,очевидно, равна по величине и обратна по знаку энергии ионизации отрицательно заряженного атома; величины Еср меньше, чем I1 , так как кулоновское взаимодействие между Э 0 и меньше, чем между Э + и . Однако характер изменения Еср = f(Z) такой же, как у I1, с учетом сдвига по шкале Z на одну единицу (так как у Э - на один электрон больше, чем у Э 0 , то одинаковой с Э - электронная конфигурация будет у элемента Э 0 с большим на одну единицу порядковым номером). В таблице 3.1 приведены величины Еср для ряда элементов (сродство к электрону известно не для всех атомов). Видно, что Еср также изменяется периодически; при этом видно влияние устойчивых электронных конфигураций.
Сродство к электрону атомов некоторых элементов
| Атом | Е, эВ | Атом | Е, эВ | Атом | Е, эВ | Атом | Е, эВ |
| H | 0,754 | C | 1,27 | Na | 0,34 | S | 2,077 |
| He | -0,22 | N | -0,21 | Mg | -0,22 | Cl | 3,614 |
| Li | 0,59 | O | 1,467 | Al | 0,5 | Br | 3,37 |
| Be | 0,38 | F | 3,488 | Si | 1,84 | I | 3,08 |
| B | 0,30 | Ne | -0,22 | P | 0,8 | Se | 2,02 |
Интересной и важной для химии величиной является сумма (I1 +Еср ). Так какЭ - + I1 + Eср = Э + + 2,то
c - электроотрицательность.Согласно Полингу, "электроотрицательность есть способность атома в молекуле или сложном ионе притягивать к себе электроны, участвующие в образовании связи". Очевидно, у инертных газов электроотрицательность отсутствует, т.к. внешний уровень в их атомах завершен и устойчив. Электроотрицательность возрастает в направлении слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов каждой главной подгруппы ПC (рис. 3.2.).

Рис. 3.2. Электроотрицательность элементов (по Полингу)
Электроотрицательность - энергия, удерживающая электроны (свои и чужие) у атома Э (элемента) в расчете на 1 электрон. Эта величина определяет, в частности, полярность химических связей: она тем больше, чем больше разность электроотрицательностей соединяющихся атомов. Причем чем больше электроотрицательность атома, тем больший на нем отрицательный заряд, так как он с большей энергией притягивает к себе электроны. Наибольшими значениями c обладают галогены (самой большой электроотрицательностью характеризуется фтор), а наименьшими - щелочные металлы (Fr - наиболее электроположительный).
Обычно cизмеряют не в эВ или Дж, а в условных относительных единицах. Кроме того, c определяют не только по I1 и Eср , но и по термохимическим данным. Поэтому существует около 20 шкал электроотрицательностей. В наиболее употребительной из них (шкала Полинга) c (F) принята равной 4.0, а c (Li) = 1. Следует однако отметить, что элементу часто нельзя приписать одно значение c , так как оно должно зависеть от валентного состояния атома в соединении. Несмотря на это, электроотрицательность полезна и широко применяется для качественного объяснения химической связи.
Атомные и ионные радиусы. Размер атомов и ионов не может быть определен точно, так как электронная плотность на их периферии убывает экспоненциально. Поэтому используются так называемые эффективные радиусы, то есть условные величины, определяемые в соответствии с каким-либо принципом или условием. Так, например, в качестве орбитальных радиусов атомов принимают расстояние от ядра до последнего максимума электронной плотности.
Размеры ионов (ионные радиусы) находят делением в определенной пропорции расстояния между ионами в ионных соединениях. В зависимости от способа определения имеется несколько систем ионных радиусов. Однако закономерности в изменении радиусов атомов и ионов не зависят от способов их определения. Основные из них следующие.
1. Радиус положительного иона меньше радиуса атома и уменьшается с увеличением положительного заряда иона. Это объясняется тем , что при образовании положительно заряженного иона происходит удаление электронов внешней оболочки. Обратная ситуация существует для отрицательных ионов: чем больше отрицательный заряд, тем больше радиус. Например, атомный радиус хлора равен 0,099 нм, для иона хлора он составляет 0,181 нм, а для Cl +5 – 0,034 нм.
2. Радиусы атомов и ионов одинакового заряда уменьшаются при за-
полнении рядов элементов одного типа (s, p, d и f)[1].
Это объясняется тем, что при увеличении заряда ядра в пределах одного (s, p, d, f) ряда элементов увеличивается притяжение ими электронов . В то же время электроны одной подоболочки не экранируют друг друга от ядра. Этот эффект можно называть s-, p-, d-, f-сжатием, соответственно. Однако практически применяют только последний термин в связи с тем, что он проявляется в побочных подгруппах элементов и является одним из главных факторов различия свойств в рядах f-элементов.
3. При одинаковом строении внешней валентной оболочки радиусы
атомов (или ионов одинакового заряда) тем больше, чем больше электронных слоев. Эта закономерность хорошо выполняется для элементов главных подгрупп (s-, p-элементов) (рис. 2.5).
Рис. 3.3. Зависимость орбитальных радиусов атомов
Однако для побочных подгрупп d-элементов радиус возрастает от элемента первого переходного ряда (от Sс до Zn ) ко второму (Y…Cd), а
элемент третьего переходного ряда (Lu ..Hf) имеет размер почти равный размеру элемента второго ряда. Это объясняется эффектом f-сжатия:
между вторым и третьим рядами происходит заполнение 4f-подуровня третьего снаружи слоя, который слабо экранирует внешние 6s 2 электроны от ядра, в то время как заряды ядер элементов третьего ряда намного больше, чем второго, и потому электроны сильно притягиваются к ядру.
На фоне общего уменьшения радиусов внутри каждого периода и ряда атомов имеются отклонения, связанные с существованием устойчивых (s 2 , p 3 , p 6 , d 5 , d 10 , f 7 , f 14 ) и неустойчивых (s 1 , p 1 , p 4 , d 1 , d 4 , d 6 , d 9 ) конфигураций. Например, орбитальный радиус Al (3s 2 3p 1 ) больше, чем у Mg (3s 2 3p 0 ); у Cr (4s 1 3d 5 ) больше, чем у V (4s 2 3d 3 ) и т. д. (рис. 2.5).
Пример 3. Учитывая положение в Периодической системе, дать общую характеристику и указать химические свойства фосфора.
Решение. Фосфор находится в третьем периоде, V группе, порядковый номер 15, молекулярная масса 31. Ядро атома состоит из 15 протонов и 31-15 = 16 нейтронов. 15 электронов расположены на трех энергетических уровнях (третий период), валентных электронов - 5 (V группа). Фосфор - элемент главной подгруппы, значит, все валентные электроны расположены на внешнем (третьем) уровне. Полная электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 3 . Электронная формула валентных электронов: . 3s 2 3p 3 . До начала заполнения следующего уровня (в соответствии с порядком заполнения - это 4s) остается 3 электрона: 3s 2 3p 3 + 3е ® 3s 2 3p 6 ; ближайшая устойчивая конфигурация при ионизации атома также отстоит на 3 электрона: 3s 2 3p 3 -3е ®3s 2 3p 0 . Следовательно, фосфор может быть и окислителем, и восстановителем. Наличие пяти электронов в наружном слое атома указывает, что это неметалл. Высшая положительная степень окисления равна пяти. Формула высшего оксида - Р2О5.
Пример 4. Вывести формулу валентных электронов и графическую электронную формулу элемента, расположенного в 4-м периоде, 5-й группе, побочной подгруппе. Какой это элемент?
Решение. Элемент расположен в четвертом периоде, следовательно, электроны распределены по четырем квантовым уровням (n = 4). В атоме данного элемента имеется 5 валентных электронов (5 группа). Валентные электроны заполняют внешний и предвнешний квантовый уровень (т.к. побочная подгруппа). Таким образом, электронная формула валентных электронов: . 4s 2 3d 3 ; графическая формула:Пример 5. Исходя из положения металла в периодической системе, объясните, какой из двух гидроксидов является более сильным основанием: Mg(OH)2 или Ва(OH)2; Cd(OH)2 или Sr(OH)2 ?
Решение. Ва и Мg являются элементами одной группы и имеют схожее электронное строение: Ва. 6s 2 , Mg. 3s 2 . Различие в том, что валентные электроны Mg расположены на третьем квантовом уровне, а Ва - на шестом. Поэтому у Ва сильнее выражены металлические свойства, чем у Mg (энергия ионизации уменьшается сверху вниз, атомный радиус увеличивается от Mg к Ва, связь электронов с ядром ослабевает, атом Ва легче отдает электроны, металлические свойства усиливаются). Следовательно, Ва(OH)2 - более сильное основание, чем Mg(OH)2.
Cd и Sr являются элементами одного периода (5-го) и одной группы (II). Но Cd - элемент побочной подгруппы, а Sr - главной. Электронная формула атомов: 38 Sr. 4s 2 4p 6 5s 2 48 Cd. 4s 2 4p 6 4d 10 5s 2 . Общим у этих элементов является наличие на внешнем уровне 2-х электронов. Но у Sr перед ними находится восьмиэлектронная оболочка, а у Cd - восемнадцатиэлектронная. Атомный радиус Sr больше, чем у Cd, а следовательно, энергия ионизации меньше, т.е. атом Sr легче отдает два электрона, чем атом Cd, металлические свойства у Sr выражены сильнее. Таким образом, Sr(OH)2 - более сильное основание, чем Cd(OH)2.
Большая Энциклопедия Нефти и Газа
Эффективные радиусы атомов и ионов в соединениях определяют по разности межъядерного расстояния d и известного эффективного радиуса одной из частиц. Так, разными методами установлено, что радиус иона F составляет 0 133 нм. Расшифровка же рентгенограмм кристалла NaF дает значение d - 0 231 нм. Следовательно, радиус иона Na равен 0 098 нм. [1]
Эффективные радиусы атомов и ионов в соединениях определяют по разности межъядерного расстояния и известного эффективного радиуса одной из частиц. Так, разными методами установлено, что ионный радиус иона F составляет 0 133 нм. С другой стороны, расшифровка рентгенограмм кристалла NaF дает значение d 0 231 нм. Следовательно, радиус иона Na равен 0 098 нм. [3]
Эффективный радиус атома в направлении, которое образует лишь небольшой угол с направлением ковалентной связи данного атома, меньше вандерваальсова радиуса ов противоположном направлении от данной связи. Так, в молекуле ССЦ атомы хлора находятся на расстоянии только 290 пм; и все же свойства данного вещества свидетельствуют о том, что в этом случае не наблюдается значительного напряжения, хотя данное расстояние много ( меньше вандерваальсова диаметра, равного 360 пм. [4]
Эффективный радиус атома в направлении, составляющем небольшой угод с направлением образуемой атомом ковалентной связи, меньше ван-дер-ваальсова радиуса в направлении, противоположном к связи. [6]
Эффективные радиусы атомов и ионов в соединениях определяют по разности межъядерного расстояния и известного эффективного радиуса одной из частиц. Так, разными методами установлено, что ионный радиус иона F составляет 0 133 нм. С другой стороны, расшифровка рентгенограмм кристалла NaF дает значение d - 0 231 нм. Следовательно, радиус иона Na равен 0 098 нм. [8]
Эффективным радиусом атома мы считаем радиус шара, касающегося другого в элементарной ячейке кристалла. [9]
Размер эффективного радиуса атомов и ионов зависит также от характерной для данной структуры координационного числа ( к. [10]
Величина эффективного радиуса атома в металле зависит от числа соседей атома в кристаллической структуре. Это вытекает из рассмотрения большого количества данных по структурам элементов и интерметаллических соединений, в особенности тех элементов, которые способны кристаллизоваться в нескольких модификациях ( ср. Отсюда следует, что значения величин эффективных радиусов металлов, приведенных в табл. 13, 14 и 15, сопоставимы лишь в пределах каждой таблицы. [11]
Уменьшение эффективного радиуса атома платины в ряду изученных соединений авторы [262] приписывают увеличению кратности связи Pt-С вследствие образования я-дативной связи. На основании всего сказанного сделан вывод, что трансвлияние углеродного донорного атома зависит от я-дативной составляющей в связи Pt-С. [13]
Под эффективным радиусом атома понимается гп ловина расстояния между ближайшими Друг к другу ато-маии в решетке. [14]
Под эффективным радиусом атома или иона понимается радиус сферы его действия, причем атом ( ион) считается несжимаемым шаром. Используя планетарную модель атома, атом представляют как ядро, вокруг которого по орбитам вращаются электроны. Последовательность элементов в периодической системе Менделеева соответствует последовательности заполнения электронных оболочек. Эффективный радиус иона зависит от заполненности электронных оболочек, но он не равен радиусу наружной орбиты. Для определения эффективного радиуса представляют атомы ( ионы) в структуре кристалла как соприкасающиеся жесткие шары, так что расстояние между их центрами равно сумме их радиусов. Атомные и ионные радиусы определены экспериментально по рентгеновским измерениям межатомных расстояний и вычислены теоретически на основе квантовомеханических представлений. [15]
Ван-дер-ваальсовы радиусы определяют эффективные размеры атомов благородных газов . Считают также, что эти радиусы равны половине межъядерного расстояния между ближайшими одинаковыми атомами, не связанными между собой хим. связью, т.е. принадлежащими разным молекулам, напр, в молекулярных кристаллах. Значения ван-дер-ваалъсовых радиусов находят, пользуясь принципом аддитивности А. [3]
Пси-функции дискретных состояний атома заметно отличны от нуля только в области порядка эффективных размеров атома . [4]
С другой стороны, измерения % представляют один из лучших способов нахождения эффективных размеров атомов . Подчеркнем, что все атомы и ионы имеют диамагнитную восприимчивость. Однако у некоторых ионов парамагнитная восприимчивость, связанная со спиновым магнитным моментом, превышает диамагнитную. [5]
Выбор модели для обменной структуры никеля и кислорода до некоторой степени зависит от относительных эффективных размеров атомов кислорода и никеля в поверхностном монослое. Вероятно, они не совпадают с размерами внутри кристаллической решетки окиси никеля, поскольку очевидно, что из-за различия в числе ближайших соседей характер связей и электронные переходы в обоих случаях также различаются. Весьма сомнительно, чтобы для поверхностного монослоя кристалла никеля, состоящего из кислородных и никелевых атомов, была применима жесткая сферическая модель. Следует отметить, что фотоэлектрические характеристики такой поверхности соответствуют фаулеровской кривой для металлов, в то время как после образования на поверхности полупроводящего окисла это не должно иметь места. [6]
Сдвиг полос, по-видимому, также связан с отмеченным выше перекрыванием электронных облаков и изменением эффективного размера атома при его возбуждении. Большинство атомов металлов крупнее атомов матрицы, но они занимают один узел в кристаллической решетке матрицы ( см. гл. Если размер атома в возбужденном состоянии больше, чем в основном, то потенциальная энергия сил отталкивания, действующих на увеличившийся возбужденный атом, возрастает и повышает энергию электронного перехода. [7]
При таком рассмотрении можно трактовать отсутствие стери: ческого ингибирования мезомерии в диизопропилкетоне и диизо-пропиловом эфире-в первом соединении как результат меньшего эффективного размера атома кислорода и во втором соединении-как результат отсутствия в нем другой группы, помимо R; действительно, в обоих случаях конформации, соответствующие XXVIII, представляются более вероятными. Некоторые данные, подкрепляющие это толкование, будут обсуждены ниже ( стр. [8]
Атом состоит из ядра ( в котором практически сосредоточена вся масса атома), окруженного орбитальными электронами. Атомы вследствие отталкивания орбитальных электронов и ядер не могут подходить друг к другу сколь угодно близко, и поэтому можно приписать атомам размеры, хотя, как уже отмечалось, эффективный размер атома непостоянен. Можно различать свойства, зависящие от присутствия массивного ядра, и свойства, возникающие от присутствия орбитальных электронов. К свойствам первой группы относятся масса и способность рассеивания других ядер ( например, з-частиц) и быстро движущихся электронов. [9]
Расстояние 0-я, соответствующее минимуму на кривой энергии, является минимально возможным расстоянием, при котором ковалентно несвязанные атомы могут существовать, не испытывая разъединяющего отталкивания. Половина расстояния, разделяющего атомы в точке а, определяется как ван-дер-ваальсов радиус атома. Таким образом, ван-дер-ваальсов радиус атома больше, чем его ковалентный радиус, и характеризует эффективный размер атома или группы. Значения ковалентных и ван-дер-вааль-совых радиусов сравниваются в табл. 1.8 ( подробнее о природе межмолекулярных сил см. в разд. [11]
Но такое допущение корректно лишь в предельном случае, когда два сорта атомов могут взаимозаменяться, не внося при этом никаких возмущений в положения атомов, т.е. когда атомы имеют строго одинаковые размеры. Например, для сплавов Си - Аи, хотя эффективный радиус атомов в сплавах не обязательно совпадает с их радиусом в одноатомных кристаллах, разница между постоя н-ными решетки Си и Аи примерно в 10 % ( 3 65 и 4 07 А) предполагает значительную разницу эффективных размеров атомов в сплавах. [12]
Кривая для Кг, приведенная на рисунке, получена при а - 3 66 А. А, то зависимости a - f ( T) для А г, Кг, и Хе хорошо укладываются на одну жривую. Аналогичный результат для Кг получили также Линн, Боуман и Азис [13], использовавшие закон соответственных состояний для интерпретации экспериментальных данных по скорости ультразвука. Таким образом, использование зависимости ( 1) в рамках закона соответственных состояний позволяет уточнить величину эффективного размера атомов криптона . Для остальных веществ сдвиг кривых ( рисунок), кроме зависимости от Я, обусловлен также различием вида межмолекулярного потенциала. Если для Не, Н2, D2, Ne в основном существенен первый фактор, то для N2, Co и особенно для - СР4 большую роль играет второй. Более всего это относится к CF4, имеющего тетраэдрическую структуру. [13]
Ван-дер-ваальсовы радиусы определяют кратчайшие расстояния между атомами, не связанными хим. связью. Их находят, пользуясь принципом аддитивности, из расстояний между соприкасающимися атомами соседних молекул в кристаллах. В пределах одной молекулы ван-дер-ваальсовы сферы валентно связанных атомов перекрываются. В кристалле молекулы, моделируемые таким способом, образуют плотную упаковку. Они характеризуют также эффективные размеры атомов в кристаллах отвердевших благородных газов. [14]
Периодичность свойств элементов
Так как электронное строение элементов изменяется периодически, то соответственно периодически изменяются и свойства элементов, определяемые их электронным строением, такие, как атомный радиус, энергия ионизации, энергия сродства к электрону, электроотрицательность.
Атомный радиус. Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому введены два условных понятия атомных радиусов:
Эффективный атомный радиус определяется экспериментально (из спектрографических данных) как ½ расстояния между центрами ядер двух соседних атомов в молекуле или кристалле.
Орбитальный атомный радиус – это расстояние от ядра атома до наиболее удаленного максимума электронной плотности.
Атомные радиусы элементов периодически изменяются в зависимости от величины заряда ядра (рис. 2.5):
1. В периоде атомные радиусы с ростом порядкового номера уменьшаются (от щелочного металла к инертному газу). Атом Na имеет радиус 1,8, Mg – 1,6, Сl – 0,73.Объяснить это можно тем, что с увеличением заряда ядра увеличивается сила кулоновского притяжения электронов к ядру, которая превалирует над силами взаимного отталкивания электронов.
Наибольшее уменьшение радиусов наблюдается у элементов малых периодов, у которых происходит заполнение электронами внешнего энергетического уровня. В больших периодах у d – и f – элементов наблюдается более плавное уменьшение радиусов при увеличении заряда ядра атома. Это уменьшение называется соответственно d – и f – сжатием.
2. В пределах каждой подгруппы элементов радиусы, как правило, увеличиваются при увеличении номера периода (или Z), так как возрастает число энергетических уровней.
У элементов III группы наблюдается исключение из этого правила – радиус атома галлия Ga (1,22) меньше радиуса атома алюминия Al (1,26). Причина кроется в том, что в 4-м периоде между s – и p – элементами расположены десять d – элементов, поэтому свойства галлия не укладываются в ряд B – Al – Ga, зато для триады B – Al – Sс атомные радиусы возрастают в соответствии с общим правилом, хотя B и Al p – элементы, а Sc d – элемент. Однако увеличение радиусов при том же возрастании заряда ядра в подгруппах s – и p – элементов больше такового в подгруппах d – элементов, например в V группе1:
p – элементы d - элементы
As……….33 0,148 V………..23 0,134
Sb……….51 0,161 Nb……….41 0,145
Bi……….83 0,182 Ta……….73 0,146
Как видно, в подгруппе мышьяка при переходе от As к Bi атомный радиус увеличивается на 0,034 нм, а в подгруппе ванадия при переходе от V к Ta – всего на 0,012 нм.
Существенно подчеркнуть еще одну особенность для подгрупп d – элементов. Увеличение атомных радиусов в подгруппах d – элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы d – элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от 5-го к 6-му периоду компенсируется f – сжатием2, вызванным заполнением 4f – подуровня у f – элементов 6-го периода. При аналогичных электронных конфигурациях внешних слоев и примерно одинаковых размерах атомов для d – элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
Радиусы ионов отличаются от радиусов атомов, т. к. они или лишились нескольких электронов, или присоединили последние. Поэтому радиусы положительно заряженных ионов меньше, а радиусы отрицательно заряженных ионов больше радиусов соответствующих атомов.
Энергия ионизации. Энергия, необходимая для отрыва электрона от невозбужденного атома, называется первой энергией ионизации I1:
В результате ионизации атомы превращаются в положительно заряженные ионы. Энергию ионизации выражают либо в кДж/моль, либо в эВ/атом (1эВ = 1,6∙10 -19 Дж).
Энергия ионизации характеризует восстановительную способность элемента или его металлические свойства. Первая энергия ионизации (рис. 2.6) определяется электронным строением элементов и ее изменение имеет периодический характер:
1. Первая энергия ионизации и восстановительные свойства элементов в периоде возрастают слева направо. Наименьшие значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода, что обусловлено возрастанием заряда ядра и уменьшением размеров атомов.
Наряду с резко выраженными максимумами и минимумами на кривой энергии ионизации наблюдаются слабо выраженные, что можно объяснить с помощью двух взаимосвязанных представлений: об экранировании заряда ядра и о проникновении электронов к ядру.
Эффект экранирования заряда ядра обусловлен наличием в атоме между данным электроном и ядром других электронов, которые экранируют, ослабляют воздействие на этот электрон положительного заряда ядра и тем самым ослабляют связь его с ядром. Понятно, что экранирование возрастает с увеличением внутренних электронных слоев.
Эффект проникновения электронов к ядру обусловлен тем, что, согласно квантовой механике, все электроны (даже внешние) определенное время находятся в области, близкой к ядру. Поэтому можно сказать, что внешние электроны проникают к ядру через слои внутренних электронов.
Концентрация электронной плотности у ядра (степень проникновения электронов) при одном и том же главном квантовом числе наибольшая для s - электрона, меньше – для р – электрона, еще меньше для d – электрона и т. д. Например, при n = 3 степень проникновения убывает в последовательности 3s>3p>3d.
Понятно, что эффект проникновения увеличивает прочность связи внешних электронов с ядром. Этим, в частности, определяется порядок заполнения в многоэлектронных атомах s - , p - , d - , f - …орбиталей при данном n.
Можно также сделать вывод, что вследствие более глубокого проникновения s – электроны в большей степени экранируют ядро, чем р – электроны, а последние – сильнее, чем d – электроны, и т. д.
Влияние на прочность связи электронов с ядром оказывает также взаимное отталкивание электронов одного и того же уровня и в особенности одной и той же орбитали.
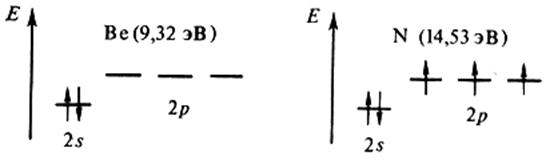 |
Воспользуемся сказанным для объяснения рис. 2.6. Как видно, внутренние максимумы на кривой первой энергии ионизации соответствуют элементам, у которых внешние уровни завершены – (Be, Mg, Zn) или заполнены наполовину – p 3 (N,P,As), что свидетельствует о повышенной устойчивости подобных конфигураций:
Следующий непосредственно затем минимум отвечает появлению электрона в новом, более далеком от ядра р – подуровне (B, Al, Ga), экранированном от ядра конфигурацией s 2 , либо взаимным отталкиванием двух электронов одной и той же р – орбитали (O, S, Se):
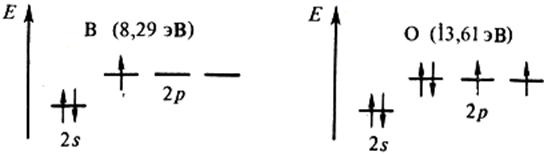
В соответствии с особенностями электронных структур у элементов d(f) – семейства энергии ионизации близки.
2. В главных подгруппах с увеличением порядкового номера энергия ионизации уменьшается, что обусловлено увеличением размеров атомов и усиливающимся (по мере увеличения числа электронных слоев) экранированием заряда ядра электронами, предшествующими внешним электронам.
3. В подгруппах d – элементов при переходе от 3d – к 5d – элементу энергии ионизации увеличиваются, что видно, например, на элементах V группы.
| р – элементы | d – элементы | ||
| Z | I1, эВ | Z | I1, эВ |
| As………. | 9,82 | V………. | 6,74 |
| Sb………. | 8,64 | Nb……….. | 6,88 |
| Bi………. | 7,29 | Ta………. | 7,89 |
Повышение энергии ионизации в подгруппах d – элементов можно объяснить эффектом проникновения электронов к ядру. Так, если у d – элементов 4-го периода 4s – электроны попадают под экран 3d – электронов, то у элементов 6-го периода 6s – электроны попадают уже под двойной экран 5d – и 4f – электронов. Отсюда при переходе от 4-го к 6-му периоду прочность связи внешних s – электронов с ядрам повышается, а поэтому и энергия ионизации d – элементов возрастает.
Кроме первой энергии ионизации, элементы с многоэлектронными атомами могут характеризоваться второй I2, третьей I3 и более высокой энергией ионизации, поскольку можно удалить 1, 2, 3… - электрона из атома.
Энергия ионизации увеличивается в следующем порядке:I1< I2< I3n , т. к. удаление электрона от электронейтрального атома происходит легче, чем от иона.
Энергия сродства к электрону(сродство к электрону). Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону E. Сродство к электрону выражается в кДж/моль или эВ/атом. Сродство к электрону характеризует окислительные или неметаллические свойства атома элемента. Принимая электроны, атом превращается в отрицательно заряженный ион по схеме:
Надежные значения сродства к электрону найдены лишь для небольшого числа элементов. Понятно, что сродство к электрону зависит от электронной конфигурации атома, и в характере его изменения с увеличением порядкового номера элемента наблюдается отчетливо выраженная периодичность (рис. 2.7). Сравнение с изменением энергии ионизации показывает, что максимумы и минимумы на кривой сродства к электрону смещены по сравнению с кривой энергии ионизации на один элемент влево.
В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают (исключение для N и P). В группах сверху вниз сродство к электрону, как правило, уменьшается.
Как следует из данных табл. 2.3 и рис. 2.7, наибольшим сродством к электрону обладают р – элементы VII группы. Наименьшее и даже отрицательное сродство к электрону имеют атомы с конфигурацией s 2 (Be, Mg, Zn) и s 2 p 6 (Ne, Ar, Kr) или с наполовину заполненным р – подуровнем (N, P, As). Это служит дополнительным доказательством повышенной устойчивости указанных электронных конфигураций.
Выделением энергии сопровождается присоединение одного электрона к атомам кислорода, серы, углерода и некоторым другим. Таким образом, для указанных элементов силы притяжения к ядру дополнительного электрона оказываются большими, чем силы отталкивания между дополнительным электроном и электронной оболочкой атома.
Сродство к электрону (Е) атомов некоторых элементов
| Элемент | Е, эВ | Элемент | Е, эВ | Элемент | Е,эВ |
| H | 0,754 | N | -0,21 | Al | 0,52 |
| He | -0,22 | O | 1,467 | Cl | 3,61 |
| Li | 0,59 | F | 3,45 | K | 0,52 |
| Be | -0,19 | Ne | -0,57 | Br | 3,54 |
| B | 0,3 | Na | 0,34 | I | 3,29 |
| C | 1,27 | Mg | -0,22 |
Присоединение последующих электронов, т. е. двух, трех электронов и более к атому, согласно квантово-механическим расчетам, невозможно. Поэтому одноатомные (простые) многозарядные анионы (О 2- , S 2- , N 3- ) в свободном состоянии существовать не могут.

Электроотрицательность.Понятие электроотрицательности (ЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен), электроотрицательность атома ЭО может быть выражена как полусумма его энергии ионизации и сродства к электрону: . Имеется около 20 шкал электроотрицательностей, в основу расчета значений которых положены разные свойства вещества. Значения электроотрицательностей разных шкал отличаются, но относительное расположение элементов в ряду электроотрицательностей примерно одинаково. В шкале относительных электроотрицательностей (ОЭО) по Полингу (рис. 2.8) электроотрицательность фтора принята равной 4,0.
Как видно из приведенных данных, в периодах наблюдается общая тенденция роста величины электроотрицательности, а в подгруппах - ее падения. Наименьшими значениями электроотрицательности характеризуются s – элементы I группы, а наибольшими – р – элементы VII группы.
Читайте также:
