Ионы какого металла обладают наибольшими окислительными свойствами
Обновлено: 29.04.2024
Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются передачей электронов:
Окисление и восстановление
Повышение степени окисления в ходе реакции, отвечающей потере (отдаче) электронов атомами элемента, называют окислением:
В данном примере окисляется S−II до SIV.
Понижение степени окисления элемента в ходе реакции, отвечающее присоединению ("взятию") электронов атомами этого элемента, называется восстановлением:
В данном примере O0 восстанавливается до О−II.
Вещество, частицы которого содержат окисляющиеся атомы, выполняет в реакции функцию восстановителя. В данном примере восстановитель - сероводород H2S.
Вещество, частицы которого содержат восстанавливающиеся атомы, выполняет в реакции функции окислителя. В данном примере окислитель - молекулярный кислород О2.
Типичные окислители и восстановители
Вещества, являющиеся окислителями во многих реакциях, представляют собой типичные (сильные) окислители. К ним относятся F2, Cl2, O2, KClO3, H2SO4, HNO3, KMnO4, MnO2, K2Cr2O7, PbO2 и др.
Типичными (сильными) восстановителями являются H2, C (графит) , Zn, Al, Ca, KI, HCl (конц.) , H2S, CO и др.
Многие вещества могут проявлять как окислительные, так и восстановительные свойства. К таким веществам принадлежат KNO2, H2O2, SO2, Nа2SO3 и др.
Окислительно-восстановительные свойства веществ связаны с положением элементов в Периодической системе Д. И. Менделеева. Простые вещества - неметаллы обладают большими окислительными свойствами, а металлы - большими восстановительными свойствами (O2, Cl2 - окислители, Na, Ba, Al, Zn - восстановители) .
В каждой группе Периодической системы элемент с более высоким порядковым номером обладает более ярко выраженными восстановительными свойствами в своей группе, а элемент с меньшим порядковым номером - более сильными окислительными свойствами. Так, кальций Ca - более сильный восстановитель, чем магний Mg, а молекулярный хлор Cl2 - более сильный окислитель, чем иод I2.
Соединения, содержащие атомы элементов в низшей степени окисления, будут восстановителями за счет этих атомов (например, NH3 - восстановитель за счет атома N−III, H2S - за счет атома S−II, KI за счет атома I−I). Соединения, включающие атомы элементов в высшей степени окисления, будут окислителями (например, HNO3 за счет атома N+V, K2Cr2O7 - за счет атома Cr+VI, KMnO4 - за счет атома Mn+VII).
Химические свойства веществ, в отличие от физических, не зависят от агрегатного состояния. Так, сера в любом агрегатном состоянии при сгорании образует сернистый газ (т. е. проявляет одно и то же химическое свойство) , но физические свойства серы в разных агрегатных состояниях весьма различны (например, плотность твердой серы равна 2,1 г/см3, жидкой серы 1,8 г/см3 и газообразной серы 0,004 г/см3).
Все вещества состоят из частиц и характеризуются определённым набором химических свойств - способностью веществ участвовать в химических реакциях.
Какой катион металла является лучшим окислителем?
Катион свинца Ответ: Катион свинца - лучший окислитель.
Какой металл является очень хорошим отражателем?
Серебристый металлСеребристый металл - лучший отражатель света.
Всегда ли ионы металлов являются окислителями?
Сами металлы представляют собой твердые материалы, некоторые твердые, другие мягкие, которые будут действовать как восстановители.
Ионы металлов представляют собой окисленную форму атомов металлов и действуют как окислители. Они уже потеряли электроны и, следовательно, имеют положительный заряд и все еще имеют относительно низкую электроотрицательность.
Реагирует ли металлическое серебро с соляной кислотой?
Соляная кислота недостаточно окисляется, чтобы реагировать с металлическим серебром
Какой металл становится изоэлектронным с криптоном?
Йод, I, имеет 53 электрона, поэтому у I− будет 54. Магний, Mg, имеет 12 электронов, поэтому Mg2 + будет иметь 10 электронов. Наконец, стронций, Sr, имеет 38 электронов, что означает, что катион Sr2 + будет иметь 36 электронов → изоэлектронен нейтральному атому криптона.
Как узнать, образует ли металл более одного катиона?
Металлы, образующие более одного катиона. В таких случаях положительный заряд металла обозначается римской цифрой в скобках сразу после названия металла. Таким образом, Cu + - это медь (I) (читается как «медная»), Fe 2+ - железо (II), Fe 3+ - железо (III), Sn 2+ - олово (II), а Sn 4+ - олово. (IV).
Почему лучше всего нержавеющая сталь?
Нержавеющая сталь 304 является наиболее распространенной формой нержавеющей стали, используемой во всем мире, благодаря ее превосходной коррозионной стойкости и стоимости. 304 может противостоять коррозии от большинства кислот-окислителей. Такая долговечность позволяет легко дезинфицировать 304, что делает его идеальным для кухни и пищевых продуктов.
Какой металл проводит электричество лучший научный проект?
Так является ли медь лучшим металлическим проводником? Медь - лучший проводник, чем железо, а это значит, что ток может проходить легче (с меньшим сопротивлением) через медь.
Гидроксиды металлов являются щелочами?
Гидроксиды щелочных металлов представляют собой класс химических соединений, которые состоят из катиона щелочного металла и аниона гидроксида (ОН-). Гидроксиды щелочных металлов: гидроксид лития (LiOH) гидроксид цезия (CsOH)
Когда металл теряет электрон, он становится катионом?
Когда атом теряет один или несколько своих электронов, он становится положительным ионом, катионом. Многоатомные ионы - это ионы, состоящие из группы атомов, которые связаны ковалентной связью и ведут себя как единое целое.
Какой металл лучше всего использовать в сплаве для увеличения?
Соответственно, какой металл лучше всего использовать в сплаве для увеличения? Серебро, медь, золото, алюминий и латунь являются лучшими проводниками в этом порядке. Лучше всего серебро, а латунь все еще хороша, но не лучше остальных.
Похожие вопросы и ответы
Hristo 'away' Iliev
Какая нержавеющая сталь наиболее устойчива к коррозии?
Нержавеющая сталь 304 Нержавеющая сталь 304 является наиболее распространенной формой нержавеющей стали, используемой во всем мире, благодаря превосходной коррозионной стойкости и стоимости. 304 может противостоять коррозии от большинства кислот-окислителей.
gavenkoa
Как называется процесс плавления металла?
Плавка - процесс, при котором из руды получают металл в виде элемента или простого соединения путем нагревания выше точки плавления, обычно в присутствии окислителей, таких как воздух, или восстановителей, таких как кокс.
Chris
Является ли водород катионом щелочного металла?
Группа 1А - Щелочные металлы.
Группа 1A (или IA) периодической таблицы - это щелочные металлы: водород (H), литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). .
Это (кроме водорода) мягкие, блестящие, легкоплавкие, высокореактивные металлы, тускнеющие при контакте с воздухом.
Tore Nestenius
Из какого металла лучше всего дирижировать?
Какой металл лучше всего проводит электричество? Материал Рейтинг IACS (Международный стандарт отожженной меди) Металл% Проводимость * 1 Серебро (чистое) 105% 2 Медь 100% 3 Золото (чистое) 70% Еще 10 рядов • 22 сентября 2015 г.
Tikhon Jelvis
Какой щелочной металл самый мелкий?
Li Поскольку O 2– является наименьшим из трех анионов кислорода, он образует стабильную ионную решетку с наименьшим катионом щелочного металла (Li +). Напротив, более крупные щелочные металлы - калий, рубидий и цезий - реагируют с кислородом воздуха с образованием супероксидов металлов.
pveentjer
Какой металл является самым сильным восстановителем?
литий Лучшим восстановителем является литий с максимальным отрицательным значением электродного потенциала.
Какой металл является наименее химически активным восстановителем?
Реакционная способность металлов группы 1 Самая реакционная способность натрия Магний Цинк Наименее реакционная медь
Steve Bennett
Какой металл является более сильным восстановителем?
Металлический литий Таким образом, металлический литий является самым сильным восстановителем (наиболее легко окисляемым) из щелочных металлов в водном растворе. Стандартные восстановительные потенциалы можно интерпретировать как ранжирование веществ в соответствии с их окислительной и восстанавливающей способностью.
Robert Rossney
arunkumar
Какой металл используется в качестве восстановителя?
натрий… реакция, натрий называют восстановителем (он дает электроны), а хлор называют окислителем (он потребляет электроны).
Наиболее распространенными восстановителями являются металлы, поскольку они имеют тенденцию терять электроны в своих реакциях с неметаллами.
Какое металлическое кольцо полезно для здоровья?
Серебро Как металл, серебро имеет значительные преимущества для здоровья, которые веками использовались в разных культурах. Серебро зарекомендовало себя как мощное противомикробное средство, борющееся с инфекциями, помогающее в профилактике простуды и гриппа, заживлении ран и многом другом. Серебро также помогает с внутренней регуляцией тепла и циркуляцией.
drewag
Какие металлические растворы заменит магний?
Кальций присутствует выше магния в ряду активности, поэтому он может замещать магний из своего солевого раствора.
Это потому, что кальций является более сильным восстановителем, чем магний.
Antonio Leonardo
Какой из следующих щелочных металлов имеет самую низкую восстанавливающую способность?
Натрий Литий - самый мощный, а натрий - наименее мощный восстановитель среди щелочных металлов.
Skilldrick
Карбонил какого из следующих металлов может действовать как окислитель?
полученный ответ - V (CO) 6.
einpoklum
Какой из следующих металлов имеет самую высокую восстанавливающую способность?
Что из следующего имеет наибольшую редуцирующую способность? HI.B. HBr.C. HCl.D. ВЧ решение. HI - самый сильный восстановитель среди галогеновых кислот из-за самой низкой энергии диссоциации связей.Jun 22, 2020
Krzysztof Słowiński
Какое свойство щелочноземельного металла снижается по группе?
Растворимость карбонатов и сульфатов быстро снижается по группе, поскольку энергия гидратации уменьшается с увеличением размера катиона. Растворимость карбоната и сульфатов щелочноземельных металлов снижается по группе из-за уменьшения энергии гидратации.
paxos1977
Какой восстановитель используется для извлечения высокореактивных металлов из руд?
Углерод Углерод - это «восстановитель», используемый для извлечения высокореактивных металлов из руд.
Tony Delroy
Почему нельзя получить высокореактивный металл из их оксидов, используя кокс в качестве восстановителя?
почему нельзя получить высокореактивные металлы из их оксидов, используя кокс в качестве восстановителя? Это потому, что эти металлы имеют большее сродство (большее притяжение) к кислороду, чем углерод. поэтому углерод не может удалить кислород из этих оксидов металлов и, следовательно, не может преобразовать их в свободные металлы.
Почему алюминий - металл, а углерод - нет?
Алюминий всегда образует катион, тогда как углерод образует анион, когда алюминий образует соединение, он отдает свои валентные электроны, что является характерной особенностью металла, тогда как углерод принимает некоторые валентные электроны, что является характерной особенностью неметалла.
Shubham Khatri
Почему нержавеющая сталь огнестойкая?
Отсутствует возможность возгорания нержавеющих сталей, а распространение пламени минимально, что снижает распространение огня. Поверхность металла инертна и устойчива в окислительных условиях, которые присутствуют почти во всех источниках пламени и тепла. Stewart Fraser Ltd. производит огнестойкие двери и рамы.
EboMike
Водород - это металл - да или нет?
Водород не является металлом, но делит группу с металлами из-за его способности образовывать катионы. Водород не считается металлом, хотя он присутствует в группе I (щелочные металлы) периодической таблицы.
Daniel G
Металл - восстановитель?
В реакции классификации химических соединений натрий называют восстановителем (он поставляет электроны), а хлор называют окислителем (он потребляет электроны). Наиболее распространенными восстановителями являются металлы, поскольку они имеют тенденцию терять электроны в своих реакциях с неметаллами.
Praneel PIDIKITI
Легковоспламеняется ли нержавеющая сталь?
Отсутствует возможность возгорания нержавеющих сталей, а распространение пламени минимально, что снижает распространение огня. Поверхность металла инертна и устойчива в окислительных условиях, которые присутствуют почти во всех источниках пламени и тепла.
Don McCurdy
Что такое восстановители на основе гидридов металлов?
LiAlH4 - мощный восстановитель, восстанавливающий не только альдегиды и кетоны, но и карбоновые кислоты, сложные эфиры, амиды и нитрилы. LiAlH4 бурно реагирует с водой, поэтому восстановление обычно проводят в растворителе, таком как безводный эфир. NBH является более мягким восстановителем, чем LAH.
Nitzan Tomer
Что представляют собой в основном оксиды металлов?
Оксиды металлов - это твердые кристаллические вещества, содержащие катион металла и анион оксида.
Обычно они реагируют с водой с образованием оснований или с кислотами с образованием солей.
Что означает реактивность металла?
Реактивный металл - это группа металлических элементов, которые могут вступать в реакцию с кислотами, водой, минеральными кислотами и сильными окисляющими кислотами. Начиная с нижней части ряда и поднимаясь вверх, реакционная способность металлов возрастает и теряет электроны, создавая положительные ионы.
briantist
Что это значит, когда металл реакционноспособен?
Реактивный металл - это группа металлических элементов, которые могут вступать в реакцию с кислотами, водой, минеральными кислотами и сильными окисляющими кислотами.
Начиная с нижней части ряда и поднимаясь вверх, реакционная способность металлов возрастает и теряет электроны, создавая положительные ионы.
Vencovsky
Что означает реактивный металл?
Что происходит, когда атом металла становится катионом?
Катионы образуются, когда атом теряет один или несколько электронов. Полученный катион имеет электронную конфигурацию атома благородного газа в строке над ним в периодической таблице.
Josien
Что происходит, когда металлический алюминий добавляют к разбавленной азотной кислоте?
(a) Разбавленная HCl: Алюминий реагирует с Al, реагирует с разбавленной HCl и образует хлорид алюминия с газообразным водородом, поэтому его нельзя хранить в алюминиевом контейнере. (b) Разбавленная HNO3: азотная кислота является окислителем, и в ее присутствии металлический алюминий образует защитный слой оксида, поэтому он не будет вступать в дальнейшие реакции.
Для чего используется металлический кальций?
Металлический кальций используется в качестве восстановителя при получении других металлов, таких как торий и уран.
Он также используется в качестве легирующего агента для сплавов алюминия, бериллия, меди, свинца и магния.
Соединения кальция широко используются.
Какой металл не может прожечь кислота?
Например, золото благородных металлов даже не реагирует с азотной кислотой, сильным окислителем, хотя оно растворяется в царской водке, растворе концентрированной азотной и соляной кислот. Платина, иридий, палладий и серебро - все благородные металлы и обладают хорошей стойкостью к коррозии под действием кислот.
adem caglin
Какой металл может заменить алюминий за одну реакцию замещения?
Если мы проверим ряд реакционной способности катионов, мы увидим, что магний более реакционноспособен, чем алюминий, поэтому мы прогнозируем, что произойдет единственная реакция замещения.
bodacydo
Каким металлом можно заменить железо?
Алюминий Алюминий образует катион, поэтому он может заменять только железо (Fe), которое также является катионом.
Mike Hogan
Какой катион щелочного металла наиболее гидратирован?
Li + образует самые большие гидратированные катионы, потому что у него самая высокая энергия гидратации. У него самый маленький размер, поэтому он наиболее гидратирован.
Linus Unnebäck
Какой щелочной металл имеет самую высокую восстанавливающую способность?
Литий Литий, который имеет высокое значение энергии ионизации в щелочных металлах, служит основным восстановителем раствора.
Alessandro Baffa
Какой щелочной металл имеет самую низкую мощность?
натрийЛитий является наиболее мощным восстановителем, а натрий - наименее мощным восстановителем среди щелочных металлов.
PineCoders-LucF
Какой щелочной металл имеет максимальную гидратацию?
литий Степень гидратации зависит от размера иона. Чем меньше накипь, создаваемая катионом, тем выше степень гидратации. Поскольку литий является самым маленьким (по размеру) из всех щелочных металлов, считается, что он имеет самую высокую энергию гидратации из всех щелочных металлов.
K-ballo
Какой щелочной металл является сильным восстановителем?
Литий металлический восстанавливающие агенты «восстанавливают» окислители.
Окислители «окисляют» восстановители.
Металлический литий является самым сильным восстановителем среди всех металлов из-за самого низкого стандартного восстановительного потенциала металлического лития.
TheMadTechnician
Какой щелочной металл является самым сильным восстановителем?
Однако наблюдается, что Li является самым сильным восстановителем в растворе среди щелочных металлов, поскольку значение E Li является максимальным.
itsaboutcode
Какой щелочной металл является наиболее сильным восстановителем?
Литий Литий, который имеет высокое значение энергии ионизации в щелочных металлах, служит основным восстановителем раствора. Однако наблюдается, что Li является самым сильным восстанавливающим агентом в растворе среди щелочных металлов, поскольку значение E Li является максимальным.
Stanislav
Какой щелочной металл самый сильный?
Литий, который имеет высокое значение энергии ионизации в щелочных металлах, служит основным восстановителем раствора.
refactor
Какой щелочной металл является самым сильным восстановителем и почему?
Литий, который имеет высокое значение энергии ионизации в щелочных металлах, служит основным восстановителем раствора. Однако наблюдается, что Li является самым сильным восстанавливающим агентом в растворе среди щелочных металлов, поскольку значение E Li является максимальным.
yann ziselman
Johan Dettmar
Matt Huggins
Какой щелочной металл является самым слабым восстановителем?
Li Таким образом, Li является самым слабым восстановителем, в то время как Cs является самым сильным восстановителем среди щелочных металлов в свободном газообразном состоянии.
Значение потенциала окисления - это не что иное, как тенденция элемента терять электроны в растворе, измеряемая его значением потенциала окисления.
Lundin
Какой щелочноземельный металл является наиболее сильным восстановителем?
Ba (E∘ = -2,92) - сильнейший восстановитель.
holmis83
Какой щелочноземельный металл является самым сильным восстановителем?
Mg. Ba (E∘ = -2,92) - сильнейший восстановитель.
Andrew Marshall
Какой щелочноземельный металл является самым слабым восстановителем?
Литий Утверждение: Литий - самый слабый восстановитель среди щелочных металлов.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Окислительно-восстановительные реакции

Разбираться в ОВР важно, чтобы хорошо сдать ЕГЭ по химии. Какие реакции называются окислительно-восстановительными, их типы, а также примеры окислителей и восстановителей — в нашей подробной статье.
11 класс, ЕГЭ/ОГЭ
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
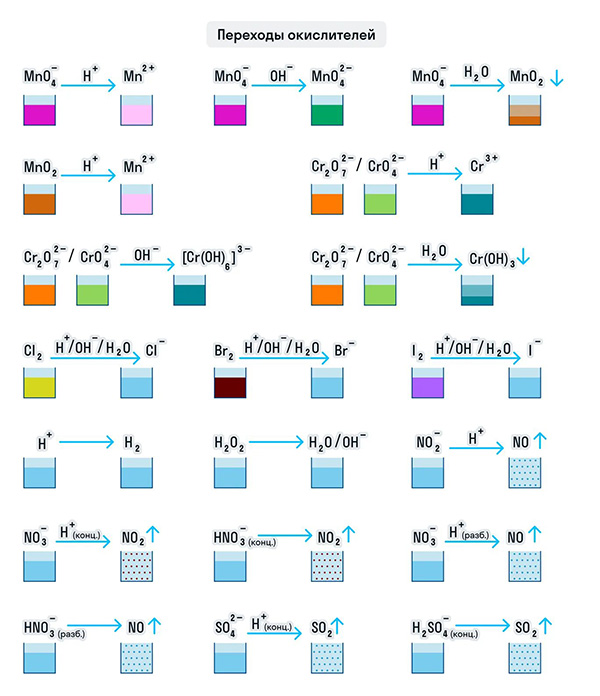
Примеры веществ-окислителей
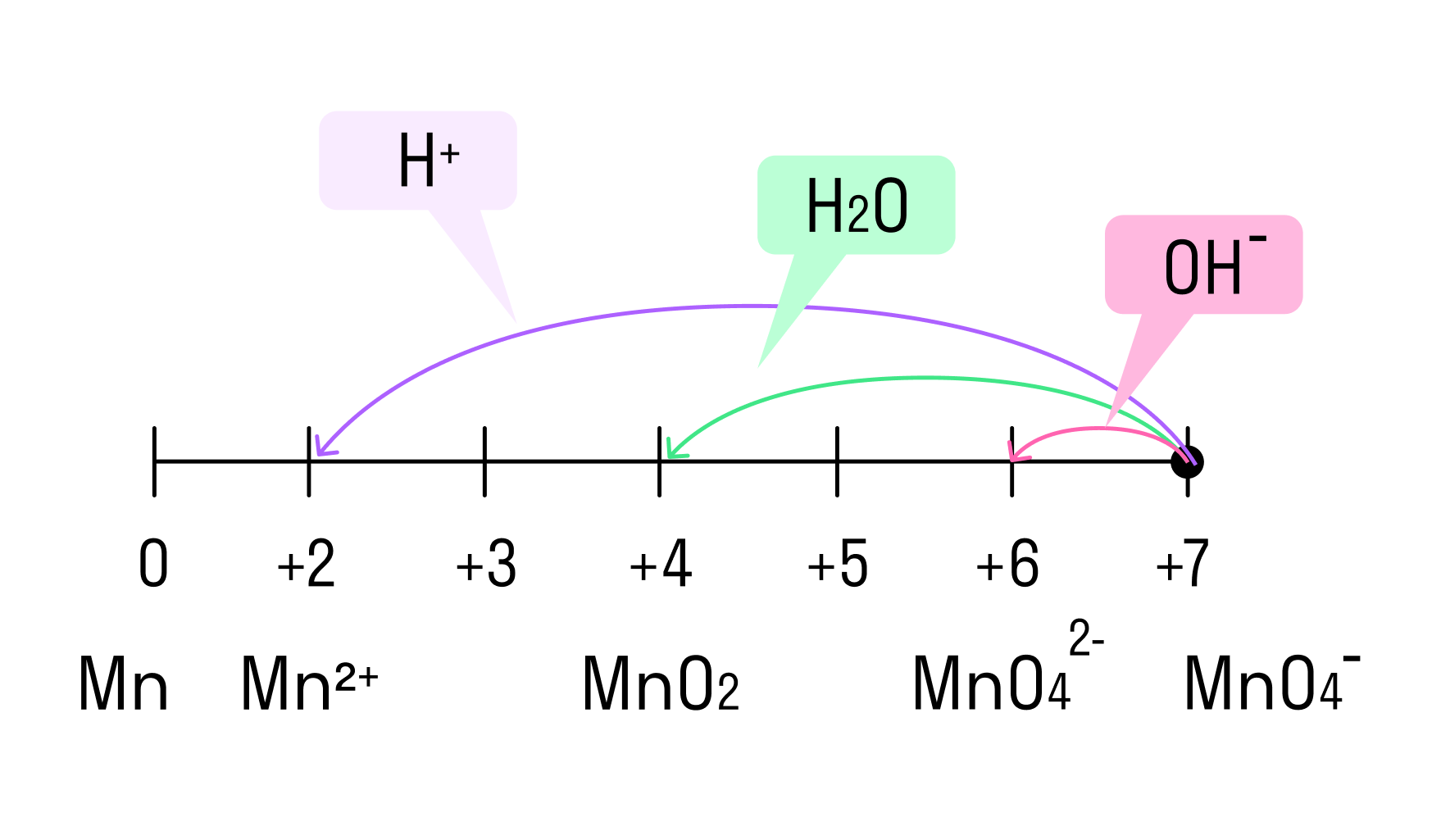
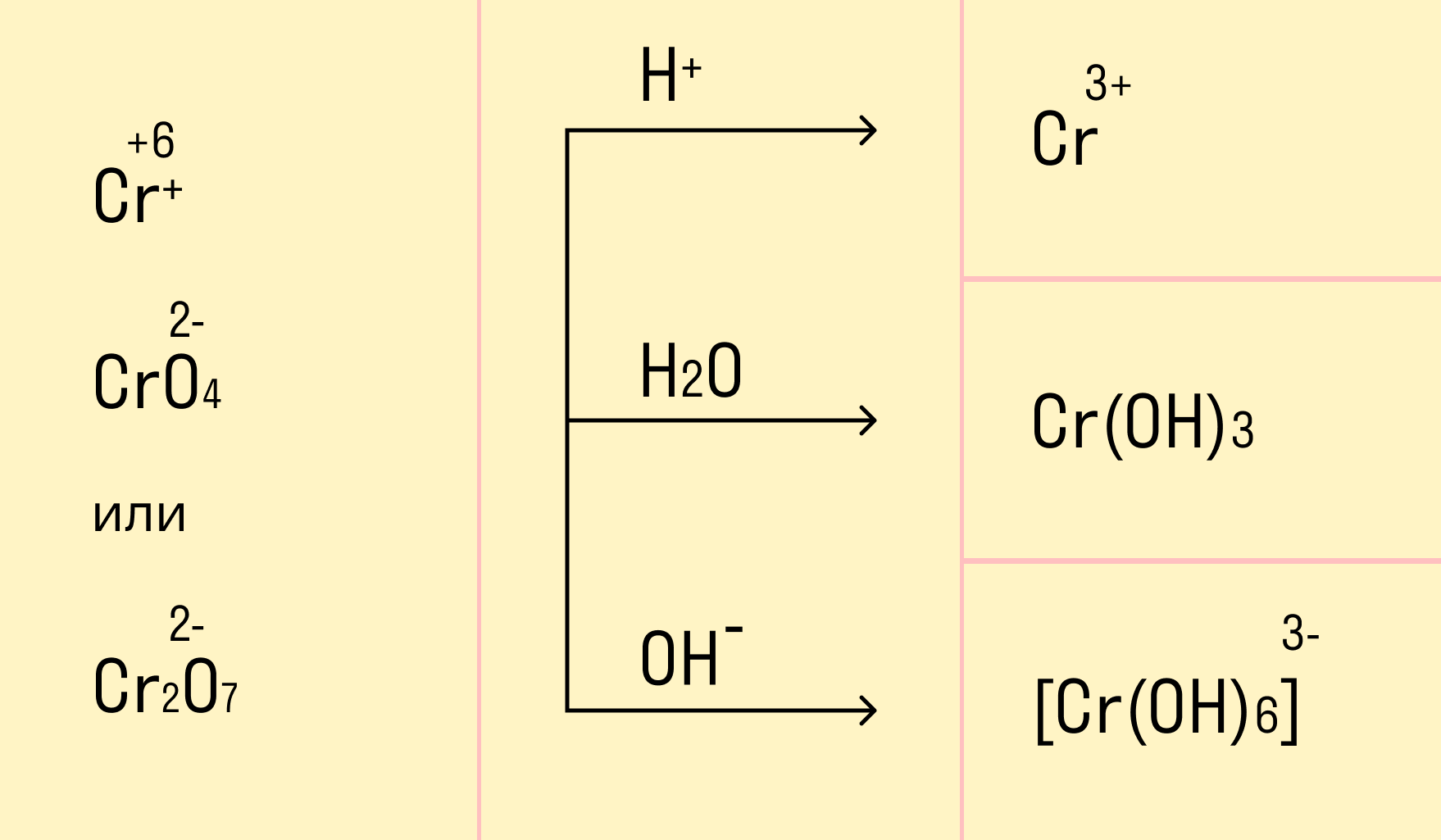
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
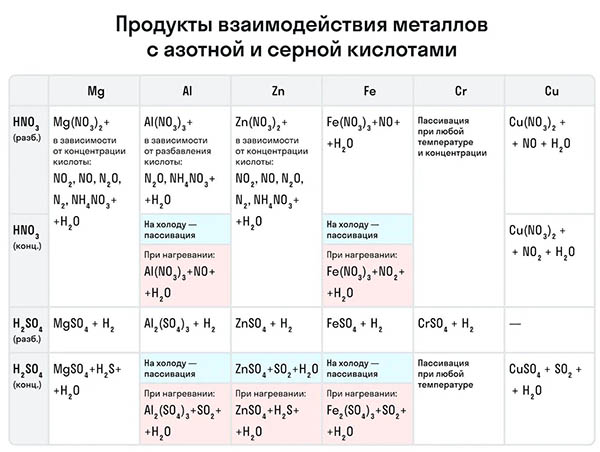
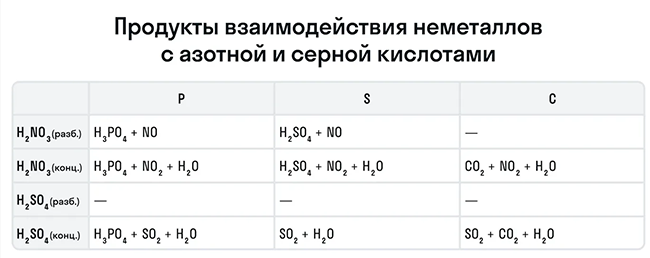
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
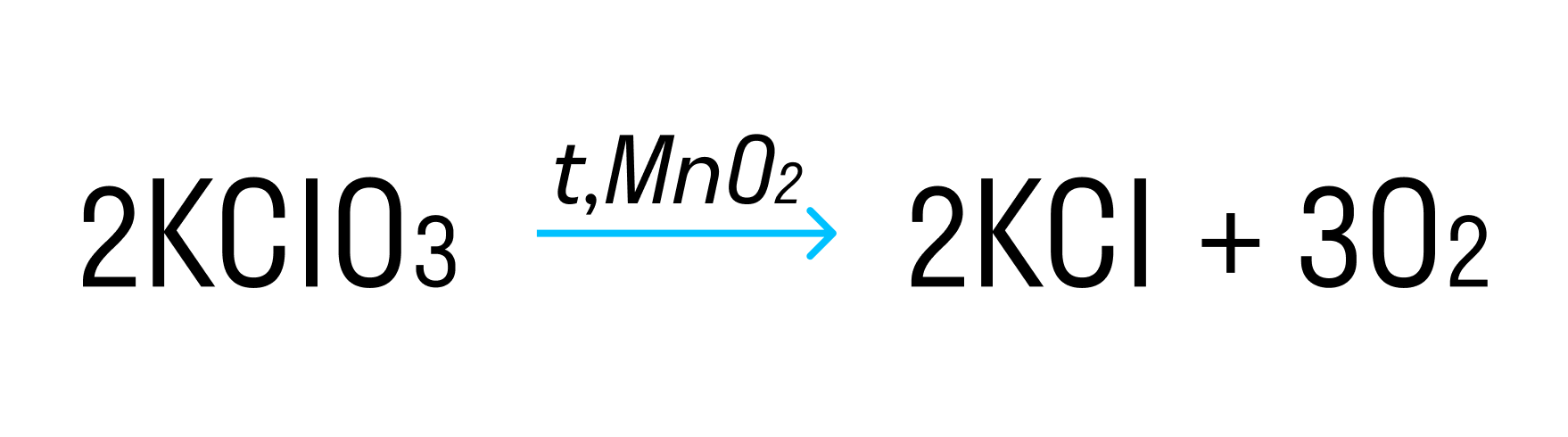
где Cl +5 — окислитель, а O −2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
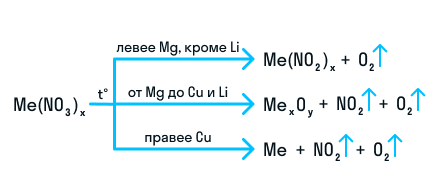
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Степень окисления элемента

В химии степень окисления элементов говорит о том, как проходят окислительно-восстановительные реакции, а точнее — как при этом атомы перераспределяют между собой электроны. Это не очень сложная тема, но в ней часто бывает путаница. Разберемся, как считать степень окисления в разных соединениях.
Что такое степень окисления
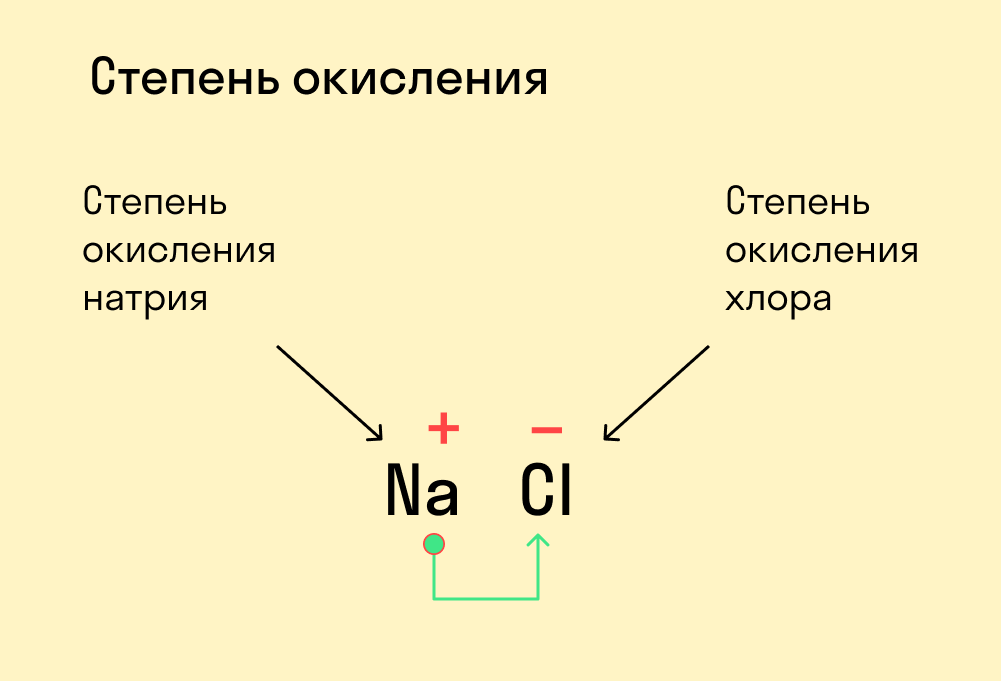
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Как рассчитать степень окисления
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
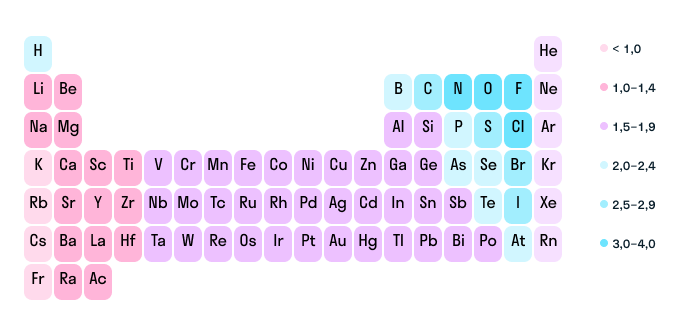
Шкала относительной электроотрицательности
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно +1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором +2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.

Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Степень окисления Cl2, S8 равна 0.
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 + равен +1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна +1.
Также известно, что водород всюду, кроме гидридов, имеет заряд +1. В данном случае есть 4 атома водорода, т. е. +1 × 4.
Составим формулу: х + (+1) × 4 = +1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N -3 H4 +1 .
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число +1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: (+1) × 2 + х + (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 +1 S -6 O4 -2 .
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 + и SO4 2- .
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 + формула для определения заряда азота будет следующей: х + (+1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO4 2- формула для серы х + (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен +6.
Получаем следующие окислительные числа: (N -3 H4 +1 )2S +6 O4 -2 .
Как определить высшую и низшую степень окисления
Выделяют высшую (или максимально положительную) и низшую (максимально отрицательную) степени окисления. В диапазоне между ними располагаются окислительные числа, которые могут принадлежать данному химическому элементу в различных соединениях. Для четных групп характерны четные числа в диапазоне, а для нечетных групп — нечетные.
Высшая степень окисления совпадает с номером группы элемента (для элементов в главной подгруппе) в короткой форме периодической системы.
Низшая степень окисления равна числу, которое получится, если от номера группы элемента отнять 8.
Исключения: фтор, железо, кобальт, родий, подгруппа никеля, кислород, благородные газы (помимо ксенона).
Проиллюстрируем на примере, как найти высшую и низшую степень окисления.
По степени окисления можно понять, как поведет себя вещество в окислительно-восстановительных реакциях. Если в соединении главный действующий элемент имеет высшую степень окисления, оно является окислителем, а если он имеет низшую степень окисления — восстановителем.
Например, серная кислота является окислителем, поскольку у серы в данном случае заряд +6. А вот в сернистой кислоте у серы заряд всего +4, поэтому она может проявлять и окислительную способность, и восстановительную. В сероводороде заряд серы равен −2, и это минимальная степень окисления, а значит, данное вещество — восстановитель.
Как найти степень окисления в органическом соединении
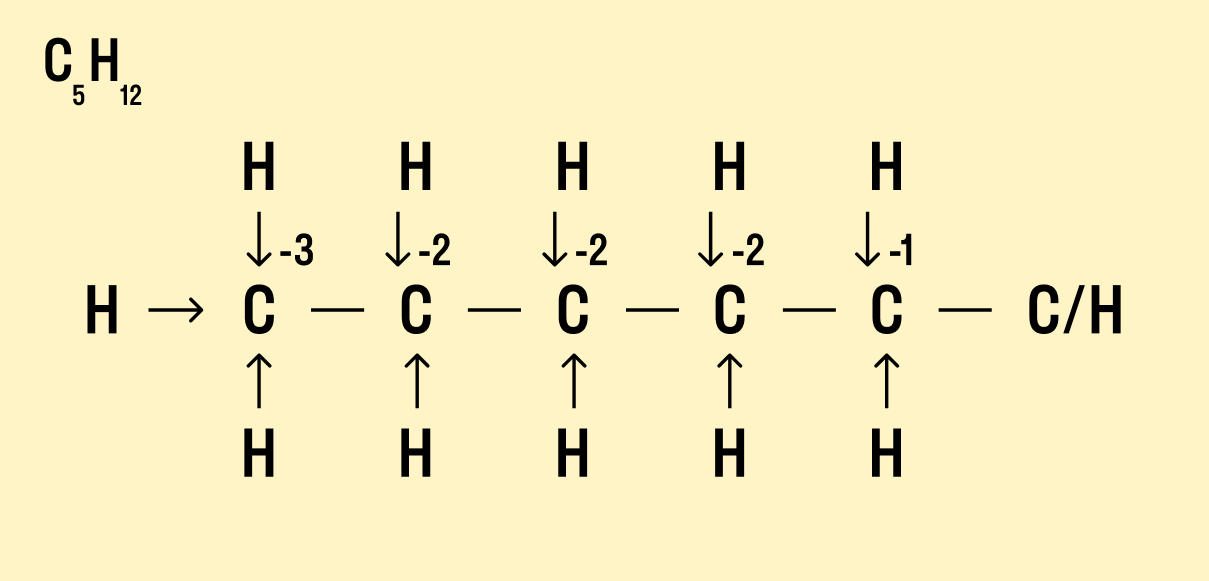
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число +1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х + (+1) × 4 + (+2) × 1 = 0
Заряд углерода равен −2, т. е. C -2 H4 +1 O -2 .
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это «+»), а затем суммируйте «+» и «−», чтобы узнать степень окисления.
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
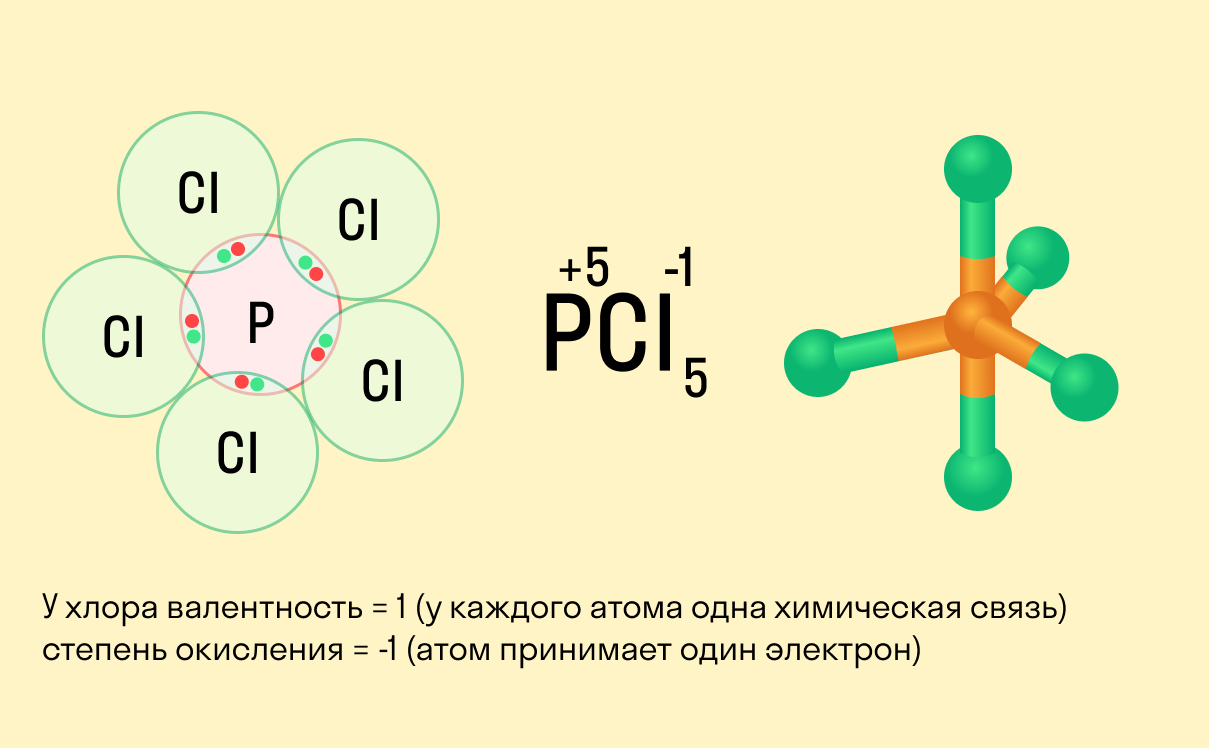
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть («+» или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Читайте также:
