Ионы металлов переменной валентности
Обновлено: 28.09.2024
Неспецифическая окислительная модификация структуры биомолекул ведет к нарушению их целостности, возникновению деструктивных процессов. Специфическая же окислительная модификация структуры биомолекул является нормальным метаболическим процессом, который определяет определенную физиологическую функцию.
В таблицах суммированы радикальные процессы в организме, которые реализуются в норме и при патологии
| В норме | При патологии |
| необходимое звено метаболизма, обеспечивающее нормальную жизнедеятельность | неспецифическая основа патогенеза различных заболеваний |
| модификация физико-химических свойств биологических мембран | нарушение проницаемости, структуры, функций биомембран |
| защитные функции, окисление ксенобиотиков, микробицидное действие | повреждение белков, липидов, нуклеиновых кислот |
| обмен веществ, аккумуляция и трансформация энергии | нарушение биоэнергетики, регуляторных и защитных функций |
| влияние на иммунитет, передачу информации | общетоксическое и канцерогенное действие |
Регуляция свободно-радикального окисления
| Неспецифические факторы | Специфические факторы |
| механизмы, регулирующее количество и структуру субстратов окисления и их доступность | ферменты, ответственные за образование и метаболизм активных форм кислорода (СОД, каталаза …) |
| факторы, влияющие на инициаторы окисления, в частности на состояние металлов переменной валентности | системы, утилизирующие пероксидные интермедиаты |
| физико-химические свойства биологических мембраны | ловушки активных форм кислорода |
| механизмы, поддерживающие низкое содержание кислорода в тканях |
Система антиоксидантной защиты является одной из важнейших в ряду систем, направленных на поддержание целостности организма и химического постоянства его внутренней среды. Система эта включает различные молекулярные факторы, способные как предотвращать образование свободных радикалов и инициацию цепных реакций, так и ликвидировать уже образовавшиеся субстанции этой природы.
1. В составе первой группы факторов, препятствующих образованию активных производных кислорода, особое место принадлежит комплексу эндогенных соединений, обеспечивающих практическое отсутствие "свободных" ионов металлов переменной валентности в организме (биохелаторы), а также механизмам, стабилизирующим редокс-состояние связанных ионов металлов на должном восстановленном или окисленном уровне. Хотя по своему содержанию в организме ионы металлов в восстановленном состоянии и превалируют в составе биокомплексов (в гемоглобине и миоглобине), однако окисленные их формы представлены более разнообразными металлорганическими соединениями (каталаза, геминовые пероксидазы, цитохромы, трансферрин, лактоферрин, ферритины, супероксиддисмутазы и др.), что снижает возможность одноэлектронного восстановления молекулярного кислорода и пероксида водорода до соответствующих радикальных форм. То есть, это системы депонирующие, транспортирующие и хелатирующие (комплексующие) факторы инициации окислительных реакций, в основном, металлы переменной валентности (специфические и неспецифические).
2. К второй группе факторов относятся ферментные системы, утилизирующие радикалы и разрушающие пероксиды (супероксиддисмутаза, каталаза и др.).
3. Низкомолекулярные водо- и жирорастворимые, экзогеннные и эндогенные АО. Неферментативные перехватчики свободной валентности, действующие в липидной фазе – это токоферолы, каротиноиды, убихинолы, в водной среде – это, главным образом, аскорбиновая и мочевая кислота. Их антиоксидантные свойства основаны на относительно легком отрыве H-атома от молекулы ингибитора с восстановлением активного ведущего цепь радикала. При этом из молекулы антиоксиданта образуется радикал, являющийся малоактивным по отношению к субстрату, не способный вести цепь, и который разрушается, в основном, в реакциях рекомбинации. Эти молекулярные компоненты системы антиоксидантной защиты, выступают "ликвидаторами" образовавшихся активных форм кислорода.
4. Высокомолекулярные АО, улавливающие свободные радикалы с помощью функциональных групп. Такие соединения, как правило белки, могут относится к АО системе защиты организма, выполняя специфическую функцию или улавливая радикалы ввиду особенностей строения – действуя неспецифически.
I. Биохелаторы ионов металлов переменной валентности.
Основными ионами металлов, относящимися к этой группе, являются ионы железа и меди. Степень окисления не имеет принципиального значения, так как вступая во взаимодействие с интермедиатами и субстратами в организме могут образовывать редокс-циклы их взаимопревращения. Значительно реже встречаются: ионы кобальта и марганца. Ионы перечисленных металлов весьма эффективно реагируют с пероксидом водорода и органическими гидропероксидами (которые в физиологических условиях относительно устойчивые соединения), приводя к образованию радикальных интермедиатов. Последние способны инициировать в присутствии молекулярного кислорода окисление биомолекул (что уже рассматривали на лекциях), оказывая повреждающее действие на молекулярные структуры биообъектов.
Например, цикл Габера-Вейса:

или реакции прямой активации молекулярного кислорода:

Если ион металла переменной валентности находится в составе хелатного комплекса его активность в приведенных и многих других реакциях, как правило, резко снижается.
Так как в массовом отношении больше всего в организме ионов железа по сравнению с другими металлами переменной валентности, то рассмотрим пример свободного и связанного распределения именного этого иона.
1. Значительная часть ионов железа и меди после попадания в кровь из окружающей среды селективно улавливается специальными депонирующими белками и белками переносчиками: ферритин, трансферрин, церрулоплазмин, гомосидерин и другими. Такие связанные ионы металлов не способны инициировать окислительные процессы, к тому же они создают важный пул данных ионов, необходимых для образования физиологически важных молекулярных структур, например гемоглобина, миоглобина, гем-содержащих ферментов и т.д.
2. Большая часть ионов железа (в виде Fe 2+ ) связана с протопорфириновым кольцом и входит в состав гемоглобина и миоглобина. В составе данных белков ионы железа выполняют депонирующую и транспортную функции в отношении молекулярного кислорода. Его присоединения железа и его отдачи осуществляются без изменения степени окисления. Окислительные процессы с участием оксигенированного гемоглобина практически исключены вследствие определенного гидрофобного окружения гема, которое создаётся радикалами аминокислот белка глобина. И в отличие от создаваемых условий in vitro, в нормальных физиологических условиях ими можно пренебречь.
3. Перечисленные выше ионы металлов переменной валентности могут образовывать не селективные комплексы с определёнными низкомолекулярными органическими соединениями, что известно из общих курсов органической и неорганической химии. Хелатные комплексы могут образовываться с аминокислотами, окси- и оксо-кислотами, углеводами (по аналогии с многоатомными спиртами), конденсированными системами и некоторыми другими соединениями.



4. В небольшом количестве по отношению к общему их содержанию в биообъекте, указанные выше ионы содержаться в составе важных для жизнедеятельности металло-ферментах. Таких как каталаза, супероксиддисмутаза, катехолоксидазы, лакказы, цитохрооксидазы и т.д. Также они содержатся в системе цитохромов дыхательной цепи и некоторых других электронно-транспортных системах. Суммарно содержание в таких системах ионов железа по отношению к общему количеству не превышает 1 %.
5. Также ионы железа и меди могут быть связаны с селективно и не селективно функциональными группами целого ряда биополимеров. Например, белками крови (альбумины, глобулины), гомо- и гетерополисахаридами (альгиновые кислоты, хондроэтинсульфаты, гепарин, гликоген, гиалуроновая кислота и другие).
Все эти хелатные комплексы значительно снижают концентрацию свободных ионов в биологических жидкостях организма и тем самым нивелируются реакции радикального распада гидропероксидов и активации молекулярного кислорода, которые могли бы идти с их участием. Согласно грубым оценкам, возможная теоретическая концентрация свободных ионов железа с учётом его суммарного количества в организме может достигать концентраций 10 -4 -10 -3 М. А реально, с учетом хелатообразования эта концентрация находится в пределах 10 -8 -10 -9 М.
© 2014-2022 — Студопедия.Нет — Информационный студенческий ресурс. Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав (0.008)
Большая Энциклопедия Нефти и Газа
Результаты, приведенные в работе, демонстрируют аналогию между нитроксилами и ионами металлов переменной валентности в окислительно-восстановительных реакциях. Существенным отличием их от ионов металлов переменной валентности является то, что они в меньшей степени склонны к образованию комплексов с субстратами и поэтому для них в большей мере характерны внешнесферные акты переноса электронов. [32]
Этот класс соединений, по-видимому, включает большинство порфириновых комплексов с ионами металлов переменной валентности и, следовательно, включает также биологически важные геминовые соединения, такие, как железопорфирины. [33]
Кислотно-каталитический способ улавливания SO2 из газов низкой концентрации основан на возбуждаемой ионами металлов переменной валентности ( Си, Fe, Mn) цепной реакции окисления SO2 в жидкой фазе до серной кислоты. Последняя находится в равновесии или переходит в дитионовую кислоту, которая часто образуется наряду с серной кислотой в окислительном процессе. [34]
Продолжает привлекать внимание исследователей и распад алкил - и арилалкилгидроперекисей, катализируемый ионами металлов переменной валентности , преимущественно Fe, Co, Си, Мп и Sn. [35]
Еще более существенное влияние на проектирование полимеризации АА и родственных ему мономеров оказывают ионы металлов переменной валентности , таких как железо, медь, церий, хром, никель и др. В зависимости от способа инициирования и типа используемого инициатора ионы металлов способны как увеличивать, так и уменьшать скорость полимеризации. [36]
Из экспериментов по термическому окислению органических веществ известно, что этот процесс катализируется ионами металлов переменной валентности . Добавка их в реакционный объем не только ускоряет окисление, но и сокращает или совсем уничтожает индукционный период. Механизм этого явления состоит в том, что валентный переход иона металла сопровождается образованием радикала из валентно-насыщенной молекулы. [37]
В процессах электроокисления, так же, как и при электровосстановлении, могут применятся ионы металлов переменной валентности ( Се, Со и др.), являющиеся переносчиками заряда от электрода в объем раствора к молекулам окисляемого вещества. [39]
Наряду с описанными выше окислительно-восстановительными процессами, катализ которых сопрово-жда тся изменением валентности металла катализатора, ионы металлов переменной валентности катализируют некоторые реакции, оказывая лишь активирующее влияние на молекулы реагентов без переноса электрона. К таким реакциям относится гидрирование непредельных соединений молекулярным водородом в жидкой фазе под влиянием ионов переходных металлов. [40]
В некоторых случаях в реакции продолжения цепи наряду со свободными радикалами могут участвовать в качестве активных центров ионы металлов переменной валентности . Например, в присутствии малых добавок солей железа ( III) разложение перекиси водорода проходит в результате трех чередующихся стадий ( более полно процесс рассмотрен в § 5 гл. [41]
Проведен анализ элементного состава и физико-химических свойств амортизо-ванных катализаторов гидроочистки масел и продуктов их переработки различными способами Показано, что содержание ионов металлов переменной валентности при переработке не изменяется, но при этом образуются новые активные центры. Это обуславливает возможность использования получаемых продуктов в качестве модификаторов адгезии резин к латунированному металлокорду. [42]
Для протекания этих реакций важно начальное появление в системе свободных радикалов, которые могут возникать, в частности за счет взаимодействия ионов металлов переменной валентности ( Fe2 и др.) либо с молекулярным кислородом, либо с гидропероксидами. [43]
Скорость реакции разложения ацильных перекисей и гидроперекисей может быть резко повышена за счет актов одноэлектрон-ного окисления-восстановления, вызываемых некоторыми органическими соединениями или ионами металлов переменной валентности . [45]
Ионы металлов переменной валентности ускоряют распад гидроперекиси циклогексанона, хотя и не так сильно, как распад гидроперекисей углеводородов. Так, например, оценка константы скорости распада а-гидроперекиси циклогексанона в нейтральном циклогексаноне при 90, проведенная на основании данных В. [1]
Ионы металлов переменной валентности и металлические поверхности способствуют окислению масел. Поэтому вторым направлением повышения термоокислительной стабильности загущенных масел является введение в них дезактиваторов металлов, которые связывают ионы металлов в комплексы, не обладающие каталитической активностью [ 95, с. Наиболее прочные так называемые хелатные комплексы образуются, если в молекуле лиганда содержатся также карбоксильные или гидроксильные группы, водород которых способен замещаться на металл. [2]
Ионы металлов переменной валентности в определенных условиях могут катализировать гемолитическое окисление альдегидов, - фенолов, спиртов и других органических соединений. Например, для окисления альдегидов издав-на применяются комплексы двухвалентной меди ( реактивы Фелинга и Бенедикта и аммиачный раствор соли серебра ( реактив Толленса), а для окисления фенолов может быть использован феррицианидный комплекс. [3]
Участие ионов металлов переменной валентности в реакциях продолжения цепи приводит к схемам, формально отличающимся от схемы чередования свободнорадикальных реакций. [4]
Постоянная окислительная активность иона металла переменной валентности в системе позволяет изучать кинетику реакций в стационарных условиях. [5]
В этих реакциях эффективны ионы металлов переменной валентности . Например, соли меди, кобальта, железа и марганца обладают высокой активностью, а соли алюминия, магния, цинка и свинца либо вообще неактивны, либо характеризуются лишь незначительной каталитической активностью. Представляющее, вероятно, наибольший практический интерес окисление углеводородов обычно проводят в присутствии нафтенатов, резинатов или стеаратов металлов. [6]
В этой реакции участвуют ионы металлов переменной валентности , отдающие один электрон гидроксильному радикалу, переходящему в ион-гидрбксил. Данный тип системы является наиболее распространенным. [7]
ОН даже в присутствии ионов металлов переменной валентности не восстанавливается до ОН -, что приводит к образованию значительного количества гомополимера. [8]
В системах этого типа участвуют ионы металлов переменной валентности , причем реакция всегда сопровождается переходом металла в низшую или высшую степень окисления. [9]
В системах этого типа участвуют ионы металлов переменной валентности , и в частности соли железа, которые каталитически ускоряют распад перекиси: при этом реакция всегда сопровождается переходом металла в высшую степень окисления. [10]
Такие простые восстановители, как ионы металлов переменной валентности нижних степеней окисления ( Fe2, Sn2, Ti3, Cr2, Со2), все еще не находят широкого применения для получения металлических покрытий химическим восстановлением. Это связано с тем, что процессы с их участием обычно не обладают достаточными автокаталитическими свойствами. Не применяется и такой удобный и широко распространенный в гидрометаллургии восстановитель, как водород. [11]
Окисление бензойного альдегида также катализируется ионами металлов переменной валентности . [12]
Если осуществлять прививку акрилонитрила в присутствии ионов металлов переменной валентности , то при разложении этой группы образуется только макрорадикал целлюлозы, и гомополи-мер вообще не образуется. Однако при прививке в тех же условиях метил акрил ата больше 80 % мономера расходуется на образование гомополимера. Этот метод также малоперспективен ввиду необходимости предварительного синтеза цианурцеллюлозы в присутствии органических растворителей. [13]
Если осуществлять прививку акрилонитрила в присутствии ионов металлов переменной валентности , то при разложении этой группы образуется только макрорадикал целлюлозы, и гомополи-мер вообще не образуется. Однако при прививке в тех же условиях метилакрилата больше 80 % мономера расходуется на образование гомополимера. Этот метод также малоперспективен ввиду необходимости предварительного синтеза цианурцеллюлозы в присутствии органических растворителей. [14]
Однако, если избирательность ионита к ионам металлов переменной валентности ( Fe2 и Fe3) велика по сравнению с избирательностью ко всем другим ионам, присутствующим в контактирующем водном расгворе, то такой ионит в отношении окислительно-восстановительных гетерогенных реакций будет проявлять себя подобно водонерастворимым редоксполимерам. [15]
Ионы металлов - стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg 2+ -ATФ. В этом случае ион Mg 2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е - фермент, S - субстрат, Me - ион металла.
Ионы металла - стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg 2+ , Mn 2+ , Zn 2+ , Co 2+ , Мо 2+ . В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
2. Роль металлов в стабилизации третичной
и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
3. Роль металлов в ферментативном
катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
4. Роль металлов в регуляции активности
ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са 2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков . Ионы Са 2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов .
Б. Коферменты
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD + , NADP + .
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
- производные витаминов;
- гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
- нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
- убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
- фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
- S-аденозилметионин (SAM) - донор метильной группы;
- глутатион, участвующий в окислительно-восстановительных реакциях.
В. Мультисубстратные реакции
Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент.
В этих случаях механизм ферментативной реакции, как правило, может идти по одному из двух путей: по механизму "пинг-понг" (механизму двойного замещения) или последовательному. Рассмотрим оба механизма.
1. Механизм "пинг-понг"
Схематично механизм "пинг-понг" может быть представлен следующим образом:
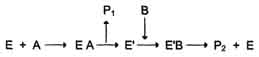
Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
Последовательный механизм
В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
· Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
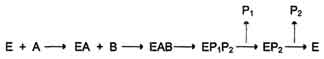
· Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
· Механизм случайного взаимодействия субстрата с активным центром фермента:

Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NAD + , NADP + .
Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона - в среду .
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными .
Читайте также:
