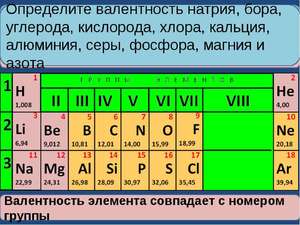
Как уменьшаются металлические свойства в таблице менделеева
Обновлено: 19.05.2024
1. Слева направо по периоду (см. Таблица Менделеева) :
- простых веществ ослабевают (уменьшаются) усиливаются (увеличиваются)
- радиус атома уменьшается (атомное сжатие из-за увеличения заряда ядра)
- электроотрицательность элементов возрастает (самый ЭО элемент - фтор)
- восстановительные свойства уменьшаются
- окислительные свойства увеличиваются
- основные свойства оксидов и гидроксидов уменьшаются
- Кислотные свойства оксидов и гидроксидовусиливаются
- идет увеличение числа электронов на внешнем уровне
- увеличивается максимальная валентность элементов
2. Сверху вниз по группе (см. Таблица Менделеева) (для главной подгруппы):
- металлические свойства простых веществ усиливаются
- неметаллические свойства ослабевают
- радиус атома увеличивается
- электроотрицательность элементов уменьшается
- основные свойства оксидов и гидроксидов усиливаются
- кислотные свойства оксидов и гидроксидов убывают
- Число электронов на внешнем уровне не меняется
3. К основным оксидам относятся оксиды металлов со степенью окисления +1 и +2
5. К амфотерным оксидам относятся Al2O3, BeO, ZnO, Cr2O3
Давайте порассуждаем вместе
1. Как изменяется радиус атома в ряду Be - Mg - Ca ?
1) уменьшается
2) увеличивается
3) не изменяется
4) сначала уменьшается, потом увеличивается
Ответ: все элементы находятся в одной группе, сверху вниз, значит радиус атома увеличивается
2. Как изменяются металлические свойства в ряду Li - Be - B?
1) не изменяются
2) сначала усиливаются, потом уменьшаются
3) ослабевают
4) усиливаются
Ответ: все элементы находятся в одном периоде слева направо, значит металлические свойства ослабевают
3. Как изменяется электроотрицательность в ряду F - O - N?
1) сначала усиливается, потом ослабевает
2) уменьшается
3) не изменяется
4) усиливается
Ответ: все элементы находятся в одном периоде справа налево, значит электроотрицательность уменьшается.
4. Как изменяются неметаллические свойства в ряду As - P - N?
1) уменьшаются
2) не изменяются
3) сначала усиливаются, потом уменьшаются
4) усиливаются
Ответ: все элементы находятся в одной группе снизу вверх, значит неметаллические свойства усиливаются
5. Как изменяется число валентных электронов в ряду Li - Na - K?
1) не изменяется
2) увеличивается
3) уменьшается
4) сначала уменьшается, затем увеличивается
Ответ: все элементы находятся в одной группе сверху вниз, значит число валентных электронов не изменяется
6. Как изменяются окислительные свойства в ряду O - S - Se?
1) увеличиваются
2) сначала уменьшаются, затем увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одной группе сверху вниз, значит окислительные свойства уменьшаются
7. Как изменяются восстановительные свойства в ряду Si - Al - Mg?
1) сначала уменьшаются, затем усиливаются
2) увеличиваются
3) не изменяются
4) уменьшаются
Ответ: все элементы находятся в одном периоде справа налево, значит восстановительные свойства усиливаются
8. Как изменяются свойства оксидов в ряду MgO -> Al2O3 --> SiO2
1) от основных к кислотным
2) от кислотных к основным
3) от кислотных к амфотерным
4) от основных к амфотерным
Ответ: все элементы находятся в одном периоде слева направо, значит свойства оксидов изменяются от основных к кислотным
Задания повышенной сложности
1. В главных подгруппах периодической системы с увеличением заряда ядра атомов химических элементов происходит:
1) усиление неметаллических свойств
2) усиление металлических свойств
3) высшая валентность элементов остается постоянной
4) изменяется валентность в водородных соединениях
5) уменьшается радиус атомов
Ответ: 2, 3
2. В главных подгруппах периодической системы восстановительная способность атомов увеличивается по мере
1) уменьшения радиуса атома
2) увеличения числа электронных слоев в атомах
3) уменьшения заряда ядра атомов
4) увеличения числа валентных электронов
5) увеличения порядкового номера элемента
Ответ: 2, 5
3. В ряду химических элементов Be, Mg, Ca, Sr
1) усиливается способность атомов отдавать электроны
2) уменьшается заряд ядра атомов
3) усиливается восстановительная способность
4) уменьшаются металлические свойства
5) усиливается способность атомов принимать электроны
Ответ: 1, 3
4. В ряду химических элементов I, Br, Cl, F восстановительная способность атомов уменьшается, потому что
1) увеличивается радиус атома
2) увеличивается заряд ядра атомов
3) увеличивается число электронных слоев в атомах
4) уменьшается число электронных слоев в атомах
5) уменьшается способность атомов отдавать электроны
Ответ: 4, 5
5. В ряду химических элементов As, P, N
1) увеличивается радиус атома
2) увеличивается электроотрицательность
3) усиливаются кислотные свойства их высших оксидов
4) возрастает значение высшей степени окисления
5) увеличивается число электронов во внешнем электронном слое атомов
Ответ: 2, 3
6. В ряду химических элементов P, N, O
1) уменьшается число электронов во внешнем электронном слое
2) увеличивается электроотрицательность
3) возрастает значение высшей валентности
4) ослабевают неметаллические свойства
5) усиливается способность атомов принимать электроны
Ответ: 2, 5
7. В ряду гидроксидов NaOH, Ca(OH)2, Al(OH)3
1) увеличивается термическая стойкость
2) ослабевают основные свойства
3) увеличивается способность к электролитической диссоциации
4) ослабевают окислительные свойства
5) уменьшается растворимость в воде
Ответ: 2,5
Усиление металлических и неметаллических свойств в таблице
Периодическая таблица Дмитрия Ивановича Менделеева очень удобна и универсальна в своём использовании. По ней можно определить некоторые характеристики элементов, и что самое удивительное, предсказать некоторые свойства ещё неоткрытых, не обнаруженных учёными, химических элементов (например, мы знаем некоторые свойства предполагаемого унбигексия, хотя его ещё не открыли и не синтезировали).
Что такое металлические и неметаллические свойства
Эти свойства зависят от способности элемента отдавать или притягивать к себе электроны. Важно запомнить одно правило, металлы – отдают электроны, а неметаллы – принимают. Соответственно металлические свойства – это способность определённого химического элемента отдавать свои электроны (с внешнего электронного облака) другому химическому элементу. Для неметаллов всё в точности наоборот. Чем легче неметалл принимает электроны, тем выше его неметаллические свойства.
Металлы никогда не примут электроны другого химического элемента. Такое характерно для следующих элементов;
- натрия;
- калия;
- лития;
- франция и так далее.
С неметаллами дела обстоят похожим образом. Фтор больше всех остальных неметаллов проявляет свои свойства, он может только притянуть к себе частицы другого элемента, но ни при каких условиях не отдаст свои. Он обладает наибольшими неметаллическими свойствами. Кислород (по своим характеристикам) идёт сразу же после фтора. Кислород может образовывать соединение с фтором, отдавая свои электроны, но у других элементов он забирает отрицательные частицы.
Список неметаллов с наиболее выраженными характеристиками:
Неметаллические и металлические свойства объясняются тем, что все химические вещества стремятся завершить свой энергетический уровень. Для этого на последнем электронном уровне должно быть 8 электронов. У атома фтора на последней электронной оболочке 7 электронов, стремясь завершить ее, он притягивает ещё один электрон. У атома натрия на внешней оболочке один электрон, чтобы получить 8, ему проще отдать 1, и на последнем уровне окажется 8 отрицательно заряженных частиц.
Благородные газы не взаимодействуют с другими веществами именно из-за того, что у них завершён энергетический уровень, им не нужно ни притягивать, ни отдавать электроны.
![Почему металлические свойства]()
Как изменяются металлические свойства в периодической системе
Периодическая таблица Менделеева состоит из групп и периодов. Периоды располагаются по горизонтали таким образом, что первый период включает в себя: литий, бериллий, бор, углерод, азот, кислород и так далее. Химические элементы располагаются строго по увеличению порядкового номера.
Группы располагаются по вертикали таким образом, что первая группа включает в себя: литий, натрий, калий, медь, рубидий, серебро и так далее. Номер группы указывает на количество отрицательных частиц на внешнем уровне определённого химического элемента. В то время, как номер периода указывает на количество электронных облаков.
Металлические свойства усиливаются в ряду справа налево или, по-другому, ослабевают в периоде. То есть магний обладает большими металлическими свойствами, чем алюминий, но меньшими, нежели натрий. Это происходит потому, что в периоде количество электронов на внешней оболочке увеличивается, следовательно, химическому элементу сложнее отдавать свои электроны.
В группе все наоборот, металлические свойства усиливаются в ряду сверху вниз. Например, калий проявляется сильнее, чем медь, но слабее, нежели натрий. Объяснение этому очень простое, в группе увеличивается количество электронных оболочек, а чем дальше электрон находится от ядра, тем проще элементу его отдать. Сила притяжения между ядром атома и электроном в первой оболочке больше, чем между ядром и электроном в 4 оболочке.
Сравним два элемента – кальций и барий. Барий в периодической системе стоит ниже, чем кальций. А это значит, что электроны с внешней оболочки кальция расположены ближе к ядру, следовательно, они лучше притягиваются, чем у бария.
Сложнее сравнивать элементы, которые находятся в разных группах и периодах. Возьмём, к примеру, кальций и рубидий. Рубидий будет лучше отдавать отрицательные частицы, чем кальций. Так как он стоит ниже и левее. Но пользуясь только таблицей Менделеева нельзя однозначно ответить на этот вопрос сравнивая магний и скандий (так как один элемент ниже и правее, а другой выше и левее). Для сравнения этих элементов понадобятся специальные таблицы (например, электрохимический ряд напряжений металлов).
![Почему металлические свойства]()
Как изменяются неметаллические свойства в периодической системе
Неметаллические свойства в периодической системе Менделеева изменяются с точностью до наоборот, нежели металлические. По сути, эти два признака являются антагонистами.
Неметаллические свойства усиливаются в периоде (в ряду справа налево). Например, сера способна меньше притягивать к себе электроны, чем хлор, но больше, нежели фосфор. Объяснение этому явлению такое же. Количество отрицательно заряженных частиц на внешнем слое увеличивается, и поэтому элементу легче закончить свой энергетический уровень.
Неметаллические свойства уменьшаются в ряду сверху вниз (в группе). Например, фосфор способен отдавать отрицательно заряженные частицы больше, чем азот, но при этом способен лучше притягивать, нежели мышьяк. Частицы фосфора притягиваются к ядру лучше, чем частицы мышьяка, что даёт ему преимущество окислителя в реакциях на понижение и повышение степени окисления (окислительно-восстановительные реакции).
Сравним, к примеру, серу и мышьяк. Сера находится выше и правее, а это значит, что ей легче завершить свой энергетический уровень. Как и металлы, неметаллы сложно сравнивать, если они находятся в разных группах и периодах. Например, хлор и кислород. Один из этих элементов выше и левее, а другой ниже и правее. Для ответа придётся обратиться к таблице электроотрицательности неметаллов, из которой мы видим, что кислород легче притягивает к себе отрицательные частицы, нежели хлор.
![Металлические свойства]()
Периодическая таблица Менделеева помогает узнать не только количество протонов в атоме, атомную массу и порядковый номер, но и помогает определить свойства элементов.
Видео
Видео поможет вам разобраться в закономерности свойств химических элементов и их соединений по периодам и группам.
Поставь лайк, это важно для наших авторов, подпишись на наш канал в Яндекс.Дзен и вступай в группу Вконтакте
Элементы в таблице Менделеева, металлы и неметаллы
Таблица Менделеева является одним из главных постулатов химии. С ее помощью можно найти все необходимые элементы, как щелочные, так и обычные металлы или неметаллы. В этой статье мы рассмотрим, как в такой таблице отыскать необходимые вам элементы.
Историческая справка
В середине 19 века было открыто 63 химических элемента. Первоначально предполагалось разместить элементы согласно увеличению атомной массы и поделить их на группы. Однако структурировать их не удавалось, а предложение химика Нуланда не было воспринято всерьез из-за попыток связать между собой химию и музыку.
В 1869 году Дмитрий Иванович Менделеев впервые опубликовал свою периодическую таблицу на страницах журнала Русского химического общества. Вскоре он известил о своем открытии химиков по всему миру. Менделеев впоследствии продолжал дорабатывать и улучшать свою таблицу, пока она не приобрела современный вид. Именно Менделеев сумел расставить химические элементы таким образом, чтобы они изменялись не монотонно, а периодически. Окончательно теория объединилась в периодический закон в 1871 году. Перейдем к рассмотрению неметаллов и металлов в таблице Менделеева.
Как ищутся металлы и неметаллы
Определение металлов теоретическим методом
- Все металлы, за исключением ртути, находятся в твердом агрегатном состоянии. Они пластичны и без проблем гнутся. Также данные элементы отличаются хорошими тепло- и электропроводящими свойствами.
- Если вам нужно определить список металлов, то проведите диагональную линию от бора до астата, ниже которой будут располагаться металлические компоненты. К ним относятся также все элементы побочных химических групп.
- В первой группе первой подгруппе находятся щелочные, например, литий или цезий. При растворении образую щелочи, а именно гидроксиды. Обладают электронной конфигурацией вида ns1 с одним валентным электроном, который при отдаче приводит проявлению восстановительных свойств.
Во второй группе главной подгруппы находятся щелочно-земельные металлы по типу радия или кальция. При обычной температуре они обладают твердым агрегатным состоянием. Их электронная конфигурация имеет вид ns2. Переходные металлы располагаются в побочных подгруппах. Они обладают переменными степенями окисления. В низших степенях проявляются основные свойства, промежуточные степени выявляют кислотные свойства, а в высших степенях амфотерные.
![Как найти металлы в таблице Менделеева]()
Теоретическое определение неметаллов
В первую очередь, такие элементы обычно находятся в жидком или газообразном состоянии, иногда в твердом. При попытке согнуть их они ломаются по причине хрупкости. Неметаллы плохо проводят тепло и электрический ток. Неметаллы находятся в верхней части диагональной линии, проведенной от бора до астата. В атомах неметаллов содержится большое количество электронов, из-за чего им выгоднее принимать дополнительные электроны, нежели отдавать. К неметаллам также относят водород и гелий. Все неметаллы располагаются в группах со второй по шестую.
![Способы определения металлов]()
Химические способы определения
Есть несколько способов:
- Нередко приходится применять химические методы определения металлов. Например, нужно определить количество меди в сплаве. Для этого следует нанести каплю азотной кислоты на поверхность и через некоторое время пойдет пар. Промокните фильтрованную бумагу и подержите над колбой с аммиаком. Если пятно окрасилось в темно-голубой цвет, то это свидетельствует о наличии меди в сплаве.
- Предположим, что вам надо отыскать золото, но вы не хотите спутать его с латунью. Наносите на поверхность концентрированный раствор азотной кислоты в соотношении 1 к 1. Подтверждением большого количества золота в сплаве будет отсутствие реакции на раствор.
- Очень популярным металлом считается железо. Для его определения нужно нагреть кусочек металла в соляной кислоте. Если это действительно железо, то колба окрасится в желтый цвет. Если для вас химия довольно проблемная тема, то возьмите магнит. Если это действительно железо,то оно притянется к магниту. Никель определяется практически таким же методом, как и медь, только дополнительно капните диметилглиоксин на спирт. Никель подтвердит себя красным сигналом.
Похожими методами определяются и остальные металлические элементы. Просто используйте необходимые растворы и все получится.
Заключение
Периодическая таблица Менделеева - важный постулат химии. Она позволяет найти все необходимые элементы, в особенности металлы и неметаллы. Если вы изучите некоторые особенности химических элементов, то сможете выявить ряд особенностей, помогающих отыскать необходимый элемент. Также можно воспользоваться химическими способами определения металлов и неметаллов, так как они позволяют на практике изучить данную сложную науку. Удачи при изучении химии и периодической таблицы Менделеева, это поможет вам при дальнейших научных исследованиях!
Из видео вы узнаете, как определять металлы и неметаллы по таблице Менделеева.
Периодический закон
Периодический закон — это фундаментальный закон, который был сформулирован Д.И. Менделеевым в 1869 году.
В формулировке Дмитрия Ивановича Менделеева периодическ ий закон звучал так: « Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы .» Периодическое изменение свойств элементов Менделеев связывал с атомной массой. Понимание периодичности изменения многих свойств позволило Дмитрию Ивановичу определить и описать свойства веществ, образованных еще не открытыми химическими элементами, предсказать природные рудные источники и даже места их залегания.
![]()
Более поздние исследования показали, что свойства атомов и их соединений зависят в первую очередь от электронного строения атома. А электронное строение определяется свойствами атомного ядра. В частности, зарядом ядра атома .
Поэтому современная формулировка периодического закона звучит так:
« Свойства элементов, форма и свойства образованных ими соединений находятся в периодической зависимости от величины заряда ядер их атомов «.
Следствие периодического закона – изменение свойств элементов в определенных совокупностях, а также повторение свойств по периодам, т.е. через определенное число элементов. Такие совокупности Менделеев назвал периодами.
Периоды – это горизонтальные ряды элементов с одинаковым количеством заполняемых электронных уровней. Номер периода обозначает число энергетических уровней в атоме элемента. Все периоды (кроме первого) начинаются щелочным металлом ( s -элементом), а заканчиваются благородным газом.
Группы – вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы. Различают главные и побочные подгруппы. Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns— и np— подуровнях.
1. Периодическая система химических элементов Д.И. Менделеева
Периодическая система элементов Д. И. Менделеева состоит из семи периодов, которые представляют собой горизонтальные последовательности элементов, расположенные по возрастанию заряда их атомного ядра.
Каждый период (за исключением первого) начинается атомами щелочных металлов (Li, Na, К, Rb, Cs, Fr) и заканчивается благородными газами (Ne, Ar, Kr, Xe, Rn), которым предшествуют типичные неметаллы.
В периодах слева направо возрастает число электронов на внешнем уровне.
В периодах слева направо постепенно ослабевают металлические и усиливаются неметаллические свойства.
1) Li 2) Ca 3) Cs 4) N 5) S
Ответ: 154
1) Be 2) Ba 3) Mg 4) N 5) F
Ответ: 541
В первом периоде имеются два элемента – водород и гелий. При этом водород условно размещают в IA или VIIA подгруппе, так как он проявляет сходство и со щелочными металлами, и с галогенами. Как и щелочные металлы, водород является восстановителем. Отдавая один электрон, водород образует однозарядный катион H + . Как и галогены, водород – неметалл, образует двухатомную молекулу H2 и может проявлять окислительные свойства при взаимодействии с активными металлами:
2Na + H2 → 2NaH
В четвертом периоде вслед за Са расположены 10 переходных элементов (от скандия Sc до цинка Zn), за которыми находятся остальные 6 основных элементов периода ( от галлия Ga до криптона Кr). Аналогично построен пятый период. Переходными элементами обычно называют любые элементы с валентными d– или f–электронами.
Шестой и седьмой периоды имеют двойные вставки элементов. За элементом Ва расположены десять d–элементов (от лантана La — до ртути Hg), а после первого переходного элемента лантана La следуют 14 f–элементов — лантаноидов (Се — Lu). После ртути Hg располагаются остальные 6 основных р-элементов шестого периода (Тl — Rn).
В седьмом (незавершенном) периоде за Ас следуют 14 f–элементов- актиноидов (Th — Lr). В последнее время La и Ас стали причислять соответственно к лантаноидам и актиноидам. Лантаноиды и актиноиды помещены отдельно внизу таблицы.
В Периодической системе каждый элемент расположен в строго определенном месте, которое соответствует его порядковому номеру .
Элементы в Периодической системе разделены на восемь групп (I – VIII), которые в свою очередь делятся на подгруппы — главные , или подгруппы А и побочные , или подгруппы Б. Подгруппа VIIIБ-особая, она содержит триады элементов, составляющих семейства железа (Fе, Со, Ni) и платиновых металлов (Ru, Rh, Pd, Os, Ir, Pt).
Внутри каждой подгруппы элементы проявляют похожие свойства и схожи по химическому строению. А именно:
В главных подгруппах сверху вниз усиливаются металлические свойства и ослабевают неметаллические.
В зависимости от того, какая энергетическая орбиталь заполняется в атоме последней, химические элементы можно разделить на s-элементы, р-элементы, d- и f-элементы.
У атомов s-элементов заполняются s-орбитали на внешних энергетических уровнях. К s-элементам относятся водород и гелий, а также все элементы I и II групп главных подгрупп (литий, бериллий, натрий и др.). У p-элементов электронами заполняются p-орбитали. К ним относятся элементы III-VIII групп, главных подгрупп. У d-элементов заполняются, соответственно, d-орбитали. К ним относятся элементы побочных подгрупп.
Номер периода соответствует числу заполняемых энергетических уровней.
Номер группы, как правило, соответствует числу валентных электронов в атоме (т.е. электроном, способных к образованию химической связи).
Номер группы, как правило, соответствует высшей положительной степени окисления атома. Но есть исключения!
О каких же еще свойствах говорится в Периодическом законе?
Периодически зависят от заряда ядра такие характеристики атомов, как орбитальный радиус, энергия сродства к электрону, электроотрицательность, энергия ионизации, степень окисления и др.
2. Радиус атома
Рассмотрим, как меняется атомный радиус . Вообще, атомный радиус – понятие довольно сложное и неоднозначное. Различают радиусы атомов металлов и ковалентные радиусы неметаллов.
Радиус атома металла равен половине расстояния между центрами двух соседних атомов в металлической кристаллической решетке. Атомный радиус зависит от типа кристаллической решетки вещества, фазового состояния и многих других свойств.
Мы говорим про орбитальный радиус изолированного атома .
Орбитальный радиус – это теоретически рассчитанное расстояние от ядра до максимального скопления наружных электронов.
Орбитальный радиус завит в первую очередь от числа энергетических уровней, заполненных электронами.
Чем больше число энергетических уровней, заполненных электронами, тем больше радиус частицы.
Например , в ряду атомов: F – Cl – Br – I количество заполненных энергетических уровней увеличивается, следовательно, орбитальный радиус также увеличивается.
![]()
Если количество заполняемых энергетических уровней одинаковое, то радиус определяется зарядом ядра частицы.
Чем больше заряд ядра, тем сильнее притяжение валентных электронов к ядру.
Чем больше притяжение валентных электронов к ядру, тем меньше радиус частицы. Следовательно:
Чем больше заряд ядра атома (при одинаковом количестве заполняемых энергетических уровней), тем меньше атомный радиус.
Например , в ряду Li – Be – B – C количество заполненных энергетических уровней, заряд ядра увеличивается, следовательно, орбитальный радиус также уменьшается.
![]()
В группах сверху вниз увеличивается число энергетических уровней у атомов. Чем больше количество энергетических уровней у атома, тем дальше расположены электроны внешнего энергетического уровня от ядра и тем больше орбитальный радиус атома.
В главных подгруппах сверху вниз увеличивается орбитальный радиус.
В периодах же число энергетических уровней не изменяется. Зато в периодах слева направо увеличивается заряд ядра атомов. Следовательно, в периодах слева направо уменьшается орбитальный радиус атомов.
В периодах слева направо орбитальный радиус атомов уменьшается.
![]()
1) O 2) Se 3) F 4) S 5) Na
Решение:
В одной группе Периодической системы находятся элементы кислород O, селен Se и сера S.
В группе снизу вверх атомный радиус уменьшается, а сверху вниз – увеличивается. Следовательно, правильный ответ: O, S, Se или 142.
Ответ: 142
1) K 2) Li 3) F 4) B 5) Na
Решение:
В одном периоде Периодической системы находятся элементы литий Li, фтор F и натрий Na.
В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. Следовательно, правильный ответ: Li, B, F или 243.
Ответ: 243
1) Ca 2) P 3) N 4) О 5) Ti
p-элементы это фосфор Р, азот N, кислород О.
В периоде слева направо атомный радиус уменьшается, а справа налево – увеличивается. В группе — сверху вниз увеличивается. Следовательно, правильный ответ: P, N, O или 234.
Ответ: 234
Рассмотрим закономерности изменения радиусов ионов : катионов и анионов.
Катионы – это положительно заряженные ионы. Катионы образуются, если атом отдает электроны.
Радиус катиона меньше радиуса соответствующего атома. С увеличением положительного заряда иона радиус уменьшается.
Например , радиус иона Na + меньше радиуса атома натрия Na:
![]()
Анионы – это отрицательно заряженные ионы. Анионы образуются, если атом принимает электроны.
Радиус аниона больше радиуса соответствующего атома.
Радиусы ионов также зависят от числа заполненных энергетических уровней в ионе и от заряда ядра.
Например , радиус иона Cl – больше радиуса атома хлора Cl.
Изоэлектронные ионы – это ионы с одинаковым числом электронов. Для изоэлектронных частиц радиус также определяется зарядом ядра: чем больше заряд ядра иона, тем меньше радиус.
Например : частицы Na + и F ‒ содержат по 10 электронов. Но заряд ядра натрия +11, а у фтора только +9. Следовательно, радиус иона Na + меньше радиуса иона F ‒ .
3. Электроотрицательность
Еще одно очень важное свойство атомов – электроотрицательность (ЭО).
Электроотрицательность – это способность атома смещать к себе электроны других атомов при образовании связи. Оценить электроотрицательность можно только примерно. В настоящее время существует несколько систем оценки относительной электроотрицательности атомов. Одна из наиболее распространенных – шкала Полинга.
![]()
По Полингу наиболее электроотрицательный атом – фтор (значение ЭО≈4). Наименее элекроотрицательный атом –франций (ЭО = 0,7).
В главных подгруппах сверху вниз уменьшается электроотрицательность.
В периодах слева направо электроотрицательность увеличивается.
1) Mg 2) P 3) O 4) N 5) Ti
Элементы-неметаллы – это фосфор Р, кислород О и азот N.
Электроотрицательность увеличивается в группах снизу вверх и слева направо в периодах. Следовательно, правильный ответ: P, N, O или 243.
Читайте также: