Какие условия необходимы для взаимодействия металлов с растворами солей
Обновлено: 07.07.2024
Более активные металлы вытесняют из солей менее активные металлы:
Fe + CuSO4 → Cu + FeSO4
Железо является более активным металлом, чем медь, так как стоит левее в ряду активностей металлов, следовательно вытесняет медь из ее соли. Такие реакции протекают в растворах, следовательно, соли должны быть растворимыми.
Ag + CuSO4 → реакция не идет, так как серебро стоит правее меди в ряду активностей металлов и, следовательно, является более слабым металлом.
2. Соли вступают в реакции ионного обмена с щелочами:
Условия: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
3. Соли вступают в реакции ионного обмена с кислотами:
Условие: должен выделяться газ, выпадать осадок или образовываться более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2 AgNO3 + HCl → AgCl K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
4. Некоторые соли могут вступать в окислительно-восстановительные реакции.
1) Соли, проявляющие окислительные свойства: соли кислородсодержащих кислот галогенов (KClO3, KClO4 и др.), KMnO4, K2CrO7, нитраты (KNO3 и др) и некоторые другие.
2KClO3 + 3FeSO4 + 12KOH → 2KCl + 3K2FeO4 + 3K2SO4 + 6H2O
3KBrO4 + 8NH3 → 3KBr + 4N2 + 12H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
K2Cr2O7 + 3KNO2 + 8HNO3 → 2Cr(NO3)3 + 5KNO3 + 4H2O
KNO3 + MnO2 + 2KOH → KNO2 + K2MnO4 + H2O
2FeCl3 + Fe → 3FeCl2
2) Соли, прявляющие восстановительные свойства: соли Fe +2 , Cr +2 , Cr +3 , Sn +2 , Cu + , K2S и сульфиды, K2SO3 и сульфиты и некоторые другие.
2CrCl2 + 4H2SO4(к) → Cr2(SO4)3 + SO2 + 4HCl + 2H2O
Cr2O3 + NaClO3 + 2K2CO3 → 2K2CrO4 + NaCl + 2CO2 Cu2S + 14HNO3(к) → H2SO4 + 2Cu(NO3)2 + 10NO2 3Na2S + K2Cr2O7 + 7H2SO4 → 3S Na2SO3 + H2O2 → Na2SO4 + H2O
5. Химические свойства кислых солей
1) Реагируют с металлами:
2KНSO4 + Ca → CaSO4 + K2SO4 + H2
2NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
2) Реагируют с оксидами и гидроксидами металлов:
2KHSO4 + MgO → MgSO4 + K2SO4 + H2O
2KHSO4 + 2NaOH → K2SO4 + Na2SO4 + 2H2O
2KHSO4 + Cu(OH)2 → K2SO4 + CuSO4 + 2H2O

3) Реагирую с солями, если выделяется газ или образуется осадок:
2KHSO4 + CaCO3 → K2SO4 + CaSO4 + CO2 2KHSO4 + CaCl2 → CaSO4 KHS + Cu(NO3)2 → CuS AgH2PO4 + NH4Br → AgBr 3NaHCO3 + AlCl3 → Al(OH)3 + 3NaCl + 3CO2
4) Реагируют с основаниями с образованием средних солей:
KНСO3 + KОН → K2СO3 + H2O
NaHCO3 + KOH → KNaCO3 + H2O
2KHCO3 + Ba(OH)2 → BaCO3 + K2CO3 + 2H2O или
KHCO3 + Ba(OH)2(изб.) → BaCO3 + KOH + H2O
3Mg(H2PO4)2 + 12KOH → Mg3(PO4)2 + 4K3PO4 + 12H2O или
Mg(H2PO4)2 + 6KOH → Mg(OH)2 + 2K3PO4 + 4H2O
3NaH2PO4 + 3Ba(OH)2 → Ba3(PO4)2 + Na3PO4 + 6H2O или
2NaH2PO4 + 3Ba(OH)2 → Ba3(PO4)2 + 2NaOH + 4H2O
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 2NH4H2PO4 + 3Ba(OH)2 → Ba3(PO4)2 + 6H2O
5) Реагируют с кислотами с образованием средних солей, если выделяется газ или образуется осадок:
NaHCO3 + HCl → NaCl + H2O + CO2
2KHS + H2SO4 → K2SO4 + 2H2S
6) Разлагаются при нагревании:
Ca(HCO3)2 → CaCO3 + CO2 + H2O (t)
Mg(HCO3)2 → MgCO3 + CO2 + H2O (t)
2NaHCO3 → Na2CO3 + CO2 + H2O (t)
NH4HCO3 → NH3 + CO2+ H2O (t)
6. Химические свойства комплексных солей
1) Реагируют с CO2 и SO2 с образованием амфотерных гидроксидов (могут образовываться как средние, так и ксилые соли):
Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3 или
2Na[Al(OH)4] + CO2 → Na2CO3 + 2Al(OH)3 + H2O
K3[Cr(OH)6]+ 3SO2 → 3KHSO3 + Cr(OH)3
2) Реагируют с кислотами (могут образовываться как средние, так и ксилые соли)
Na[Al(OH)4] + HCl → NaCl + Al(OH)3 K3[Cr(OH)6] + 3HNO3 → 3KNO3 + Cr(OH)3 K[Al(OH)4] + H2S(изб.) → KHS + Al(OH)3 Но:K2[Zn(OH)4] + 3H2S → 2KHS + ZnS
3) Разлагаются при нагревании:
Na[Al(OH)4] → NaAlO2 + 2H2O (t)
K2[Zn(OH)4] → K2ZnO2 + 2H2O (t)
7. Разложение средних солей при нагревании
1) Нерастворимые карбонаты разлагаются при нагревании:
CaCO3 → CaO + CO2 (t)
FeCO3 → FeO + CO2 (t)
MgCO3 → MgO + CO2 (t)
2) Нитраты разлагаются при нагревании. Продукты зависят от положения металла в ряду активности металлов:
| MNO3 → MNO2 + O2 | M – металл, находящийся в ряду активности металлов левее Mg, исключая Li. |
| MNO3 → MO + NO2 + O2 | M – металл, находящийся в ряду активности металлов от Mg до Cu (Mg и Cu включительно), а также Li. |
| MNO3 → M + NO2 + O2 | M – металл, находящийся в ряду активности металлов правее Cu. |
NH4Cl → NH3 + HCl (t)
(NH4)3PO4 → 3NH3 + H3PO4(t)
(NH4)2CO3 → 2NH3 + CO2
Соли аммония азотной и азотистой кислот разлагаются с изменением степени окисления:
NH4NO3 → N2O + H2O (t)
NH4NO2 → N2 + H2O (t)
2KClO3 → 2KCl + 3O2
Соли слабой кислоты и амфотерного металла реагируют с оксидами щелочных металов, щелочами и карбонатами щелочных металлов:
ZnCO3(тв.) + K2O(тв.) → K2ZnO2 + CO2 ZnCO3(тв.) + 2KOH(тв.) → K2ZnO2 + CO2 ZnCO3(тв.) + K2CO3(тв.) → K2ZnO2 + 2CO2Соли соединений Zn, Be и Al разлагаются водой, кислотами, хлоридом аммония:
§ 20. Металлы (окончание)
Для борьбы с коррозией используют много способов. Назовём некоторые из них.
1. Нанесение защитных покрытий на поверхность предохраняемого от коррозии металла. Для этого часто используют масляные краски, эмали, лаки. Эти неметаллические покрытия дешёвые, но обычно недолговечные. Раз в два года, а иногда и чаще их требуется обновлять. Так, например, красят Эйфелеву башню в Париже.

Защищаемый от коррозии металл можно покрыть слоем другого металла: золота, серебра, хрома, никеля, олова, цинка и др. Один из самых старых способов — это лужение, или покрытие железного листа слоем олова. Такое железо называют белой жестью.
2. Использование нержавеющих сталей, содержащих специальные добавки. Например, «нержавейка», из которой изготавливают столовые приборы, содержит до 12% хрома и до 10% никеля. В состав лёгких нержавеющих сплавов входят алюминий или титан. Памятник Ю. А. Гагарину (скульптор П. Бондаренко, архитекторы Я. Белопольский, Ф. Гажевский, 1980) облицован пластинками из титанового сплава (рис. 122). На его гладкой блестящей поверхности нет ни одного пятнышка ржавчины.
3. Введение в рабочую среду, где находятся металлические детали, веществ, которые в десятки и сотни раз уменьшают агрессивность среды. Такие вещества называют ингибиторами коррозии.
Ингибиторы коррозии вводят в замкнутые системы охлаждения, в нефтепродукты и даже впрыскивают в газопроводы для снижения коррозии труб изнутри. Для предотвращения коррозии железа в серной кислоте к ней добавляют в качестве ингибитора азотную кислоту.
4. Создание контакта с более активным металлом — протектором. Например, для защиты стальных корпусов морских судов обычно используют цинк. Да и на суше металлическую конструкцию (трубу, ЛЭП и т. д.) соединяют с листом или куском более активного металла. С этой же целью к деталям конструкции мостов приваривают куски цинка.

1. Какими особенностями строения отличаются: а) атомы; б) кристаллы металлов? Как их строение определяет свойства этого класса веществ? Каким одним словом можно охарактеризовать химические свойства металлов?
2. Что такое электрохимический ряд напряжений металлов? Какими двумя правилами ряда напряжений характеризуются свойства металлов?
3. Какие условия необходимы для взаимодействия металлов с растворами кислот?
4. Какие условия необходимы для взаимодействия металлов с растворами солей?
5. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) натрий → пероксид натрия → оксид натрия → гидроксид натрия → сульфат натрия;
б) железо → хлорид железа (II) → хлорид железа (III) → гидроксид железа (III) → оксид железа (III) → железо;
6. Что такое коррозия металлов? Какие виды коррозии различают?
7. Запишите уравнения всех возможных реакций, в результате которых литий корродирует на воздухе.
8. Что такое гальваностегия? Как её используют для защиты металлов от коррозии?
§ 20. Металлы (продолжение)
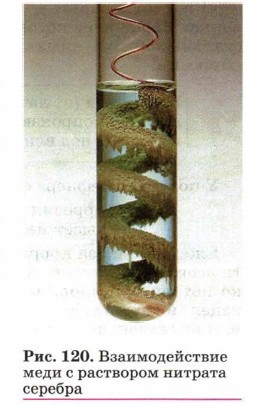
Металлы взаимодействуют с растворами солей при соблюдении ряда условий:
• металл должен находиться в ряду напряжений левее металла, образующего соль;
• в результате реакции должна образоваться растворимая соль, так как в противном случае она покроет металл осадком и доступ соли к металлу прекратится;
• для этих реакций не рекомендуется использовать щелочные металлы (почему?).
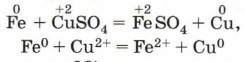
На рисунке 120 показана красивая реакция замещения медью серебра из раствора его соли:
Металлотермия
Некоторые активные металлы — литий, магний, кальций, алюминий — способны вытеснять другие металлы из их оксидов. Это свойство используют для получения некоторых металлов, а также для изготовления термитных смесей. Так, хром получают с помощью алюминотермии:
Коррозия металлов и способы защиты от неё
«Ржа ест железо» — гласит русская народная поговорка. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, — это яркий пример коррозии.

У поэта В. Шефнера есть очень образные строчки:
Коррозия — рыжая крыса,
Грызёт металлический лом.
Ежегодно из-за коррозии разрушается около четверти всего произведённого в мире железа. Однако не только потеря металлов, но и порча изготовленных из них изделий обходится очень дорого. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов и коммуникаций во много раз превышают стоимость металла, из которого они изготовлены.
Коррозия вызывает серьёзные экологические последствия. Утечка газа, нефти и других опасных химических продуктов из разрушенных коррозией трубопроводов приводит к загрязнению окружающей среды, что отрицательно влияет на здоровье и жизнь людей. Понятно, почему на защиту металлов и сплавов от коррозии тратят большие средства.
Коррозию металлов и сплавов (их окисление) вызывают такие компоненты окружающей среды, как вода, кислород, оксиды углерода и серы, содержащиеся в воздухе, водные растворы солей (морская вода, грунтовые воды). Эти компоненты непосредственно окисляют металл — происходит химическая коррозия.
Чаще всего коррозии подвергаются изделия из железа. Особенно сильно корродирует металл во влажном воздухе или в воде. Упрощённо этот процесс выражают с помощью следующего уравнения химической реакции:
Химически чистое железо почти не корродирует. Вместе с тем техническое железо, которое содержит различные примеси, например в чугунах и сталях, ржавеет, так как одной из причин возникновения коррозии является наличие примесей в металле, его неоднородность.
Химическую сущность коррозионного процесса для этого случая покажем на следующем примере. Если два различных металла, находящихся в контакте между собой, опустить в водный раствор электролита (в реальных условиях это, например, грунтовые воды, сконденсированная влага из атмосферы), то металл более активный, расположенный в электрохимическом ряду напряжений левее, будет разрушаться, предохраняя тем самым менее активный металл от коррозии. Например, при контакте железа с медью в водной среде железо, как более активный металл, будет постепенно растворяться, переходя в воду в виде ионов железа. При этом электроны, высвободившиеся из атомов железа, перейдут к меди и на её поверхности соединятся с ионами водорода, выделившимися из компонентов водной среды (например, серной или других кислот; вам, очевидно, известно такое выражение, как «кислотные дожди»). Этот электрохимический процесс можно представить так:
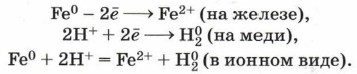
Эксперимент по влиянию условий окружающей среды на коррозию металлов представлен на рисунке 121.
Основания. Химические свойства и способы получения

Перед изучением этого раздела рекомендую прочитать следующую статью:
Основания – сложные вещества, которые состоят из катиона металла Ме + (или металлоподобного катиона, например, иона аммония NH4 + ) и гидроксид-аниона ОН — .
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания . Также есть неустойчивые основания, которые самопроизвольно разлагаются.

Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например , оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например , калий реагирует с водой очень бурно:
2K 0 + 2 H2 + O → 2 K + OH + H2 0


3. Электролиз растворов некоторых солей щелочных металлов . Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl

Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например , гидроксид меди (II) взаимодействует с сильной соляной кислотой:
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например , гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например , гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4 Fe +2 (OH)2 + O2 0 + 2H2O → 4 Fe +3 ( O -2 H)3
Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.


2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли , а в растворе – комплексные соли .
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например , при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.

3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
Например , при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе , при условии, что в продуктах образуется газ или осадок . Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Например , гидроксид калия взаимодействует с раствором нитрата аммония:
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид , взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла .
Например , избыток сульфата цинка реагирует в растворе с гидроксидом калия:
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей . Т аким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например , гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства и способы получения солей
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей

Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:


3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O

4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:


5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:

6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2

9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорит кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:

2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:

5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:

6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!

При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
2AgNO3 → 2Ag +2NO2 + O2
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3 + HCl
(NH4)2CO3 → 2NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3

7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
4KI — + 2Cu +2 Cl2 → 4KCl + 2Cu + l + I2 0

8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Читайте также:
