Какими особенностями строения отличаются атомы кристаллы металлов
Обновлено: 04.10.2024
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике.
Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы – один из классов конструкционных материалов, характеризующийся определ¨нным набором свойств:
· «металлический блеск» (хорошая отражательная способность);
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объ¨му металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определ¨нным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая реш¨тка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объ¨ма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
· размеры р¨бер элементарной ячейки. a, b, c – периоды реш¨тки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определ¨нными.
· углы между осями ().
· координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
· базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
· плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74)
Рис.1.1. Схема кристаллической решетки
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
· примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
· базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
· объемно-центрированный – атомы занимают вершины ячеек и ее центр;
· гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней
Рис. 1.2. Основные типы кристаллических решеток: а – объемно-центрированная кубическая; б– гранецентрированная кубическая; в – гексагональная плотноупакованная
Основными типами кристаллических реш¨ток являются:
1. Объемно - центрированная кубическая (ОЦК) (см. рис.1.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, )
2. Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы рассполагаются в вершинах куба и по центру куждой из 6 граней (Ag, Au, )
3. Гексагональная, в основании которой лежит шестиугольник:
o простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
o плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Понятие об изотропии и анизотропии
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим располохением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны
В кристаллических телах атомы правильно располагаются в пространстве, причем по разным направлениям расстояния между атомами неодинаковы, что предопределяет существенные различия в силах взаимодействия между ними и, в конечном результате, разные свойства. Зависимость свойств от направления называется анизотропией
Чтобы понять явление анизотропии необходимо выделить кристаллографические плоскости и кристаллографические направления в кристалле.
Плоскость, проходящая через узлы кристаллической решетки, называется кристаллографической плоскостью.
Прямая, проходящая через узлы кристаллической решетки, называется кристаллографическим направлением.
Для обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку вписывают в пространственную систему координат (оси X,Y, Z – кристаллографические оси). За единицу измерения принимается период решетки.
Рис.1.3. Примеры обозначения кристаллографических плоскостей (а) и кристаллографических направлений (б)
Для определения индексов кристаллографической кристаллографической плоскости необходимо:
· установить координаты точек пересечения плоскости с осями координат в единицах периода решетки;
· взять обратные значения этих величин;
· привести их к наименьшему целому кратному, каждому из полученных чисел.
Полученные значения простых целых чисел, не имеющие общего множителя, являются индексами Миллера для плоскости, указываются в круглых скобках. Примеры обозначения кристаллографических плоскостей на рис. 1.3 а.
Другими словами, индекс по оси показывает на сколько частей плоскость делит осевую единицу по данной оси. Плоскости,параллельные оси, имеют по ней индекс 0 (110)
Ориентация прямой определяется координатами двух точек. Для определения индексов кристаллографического направления необходимо:
· одну точку направления совместить с началом координат;
· установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки
· привести отношение этих координат к отношению трех наименьших целыж чисел.
Индексы кристаллографических направлений указываются в квадратных скобкаж [111]
В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют теже индексы [hkl].
Аллотропия или полиморфные превращения.
Способность некоторых металлов существовать в различных кристаллических формах в зависимости от внешних условий (давление, температура) называется аллотропией или полиморфизмом.
Каждый вид решетки представляет собой аллотропическое видоизменение или модификацию.
Примером аллотропического видоизменения в зависимости от температуры является железо (Fe).
Превращение одной модификации в другую протекает при постоянной температуре и сопровождается тепловым эффектом. Видоизменения элемента обозначается буквами греческого алфавита в виде индекса у основного обозначения металла.
Примером аллотропического видоизменения, обусловленного изменением давления, является углерод: при низких давлениях образуется графит, а при высоких – алмаз.
Используя явление полиморфизма, можно упрочнять и разупрочнять сплавы при помощи термической обработки.
Некоторые металлы намагничиваются под действием магнитного поля. После удаления магнитного поля они обладают остаточным магнетизмом. Это явление впервые обнаружено на железе и получило название ферромагнетизма. К ферромагнетикам относятся железо, кобальт, никель и некоторые другие металлы.
При нагреве ферромагнитные свойства металла уменьшаются постепенно: вначале слабо, затем резко, и при определ¨нной температуре (точка Кюри) исчезают (точка Кюри для железа – ). Выше этой температуры металлы становятся парамагнетиками. Магнитные превращения не связаны с изменением кристаллической решетки или микроструктуры, они обусловлены изменениями в характере межэлектронного взаимодействия.
Металлы, особенности атомно-кристаллического строения
Атомно-кристаллическое строение металлов
Все тела в зависимости от расположения атомов делятся на аморфные и кристаллические. В отличие от аморфных тел, атомы в которых расположены хаотично, металлы в твердом состоянии являются телами кристаллическими. Кристаллическое строение характеризуется закономерным расположением атомов.
Атомы металлов образуют кристаллическую решетку или ячейку. Каждый металл имеет определенный тип кристаллической решетки, чаще всего встречаются три типа решеток: кубическая объемноцентрированная – ОЦК (рис. 16, а), кубическая гранецентрированная – ГЦК (рис. 16, б) и гексагональная – ГПУ (рис. 16, в).
В кубической объемноцентрированной решетке атомы расположены в узлах ячейки и один атом в центре куба. Такие решетки имеют металлы: Feα, Сг, W, Mo, Tiβ, Nb, Та, Li n др.
В кубической гранецентрированной решетке атомы расположены в узлах ячейки и в центре каждой грани. Этот тип решетки имеют металлы: Feγ, Ni, Ag, Au, Pb, Сu, Соβ и др.
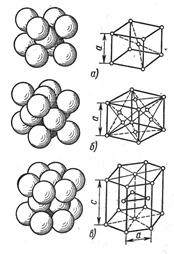
Рис. 16. Типы кристаллических решеток:
а – кубическая объемноцентрированная;
б – кубическая гранецентрированная;
В гексагональной решетке атомы расположены в узлах и центре шестигранных оснований призмы и три атома в средней плоскости призмы. Такую решетку имеют металлы: Zn, Cd, Be, Re, Coα, Tiα и др. Индексы α, β, γ обозначают, что у соответствующих металлов различные кристаллические решетки при различных температурах.
Типы кристаллических ячеек определяются при помощи рентгеноструктурного анализа.
Расстояния между центрами соседних атомов в кристаллической решетке называется периодом (а, b, с). Расстояния между атомами измеряются в ангстремах - , 1 = 1•10 -8 см.
Базис кристаллической решетки - это число атомов, принадлежащих одной элементарной кристаллической ячейке; для ОЦК базис равен 2, для ГЦК – 4, ГПУ – 6.
Плотность упаковки – это отношение объема занимаемого атомами к объему всей ячейки. Плотность упаковки для ОЦК составляет 68%, для ГЦК и ГПУ – 74%. Плотность упаковки характеризуется координационным числом, т. е. числом атомов, находящихся на равном и наименьшем расстоянии от данного атома. Координационное число для ОЦК – 8, для ГЦК и ГПУ – 12.
2.1. Полиморфизм металлов.
Полиморфизмом или аллотропией называют способность металла в твердом состоянии при изменении температуры перестраивать свою кристаллическую решетку. Полиморфные превращения сопровождаются выделением или поглощением теплоты, а также изменением свойств металла. Различные аллотропические состояния называют модификациями. Каждой модификации свойственно оставаться устойчивой лишь в пределах определенного для данного металла интервала температур. Аллотропические формы обозначаются греческими буквами α, β, γ и т. д. На кривых охлаждения и нагрева переход из одного состояния в другое характеризуется остановкой (для чистых металлов) или изменением характера кривой (для сплавов). При аллотропических превращениях кроме изменения свойств (теплопроводности, электропроводности, механических, магнитных и др.) наблюдают изменения объема металла и растворимости (например, углерода в железе). Аллотропические превращения свойственны многим металлам (железу, олову, титану и др.).
Железо известно в двух полиморфных модификациях — α и γ. На рис. 17 приведена кривая охлаждения, характеризующая его аллотропические превращения. Как видно, в интервале температур 911. 1392 °С железо имеет кубическую гранецентрированную решетку γ-железа (γFe), а в интервале от 0 до 911 °С и от 1392 до 1539 °С— объемноцентрированную решетку α-железа (αFe). Железо меняет свои магнитные свойства: выше 768 °С железо немагнитно, а ниже — магнитно.
Материаловедение – наука о связях между составом, строением и свойствами материалов и закономерностях их изменений при внешних физико-механических воздействиях. От правильного выбора материала зависит долговечность, надежность и срок службы изделий. Необходимые механические и технологические свойства материалов достигаются термической обработкой, выбор которой зависит от материала и его дальнейшей эксплуатации. Проектирование конкурентоспособных изделий, организация их производства невозможны без достаточного уровня знаний в области материаловедения.
Особенно интенсивно развивается металловедение в последние десятилетия. Это объясняется потребностью в новых материалах для исследования космоса, развития электроники, атомной энергетики, которые могут работать как при высоких температурах, так и при температурах, близких к абсолютному нулю. Современные компьютерные технологии используют материалы с особыми электрическими свойствами.
Задачи материаловедения в настоящее время связаны с производством металлов и сплавов, а также других материалов с заранее заданными свойствами. Решение таких задач достигается теоретическим знанием структуры и свойств материалов и умением приложить их к практическому применению.
Рассмотрено строение, свойства и области применения металлов и металлических сплавов, композиционных материалов и наноматериалов для получения заготовок и деталей высокого качества.
При изучении дисциплины решаются задачи приобретения знаний оценки технических свойств материалов, исходя из условий эксплуатации и изготовления изделий; формирования научно-обоснованных представлений о возможностях рационального изменения технических свойств материала путем изменения его структуры; о ознакомления со способами упрочнения материалов, обеспечивающими надежность изделий и инструментов.
СТРОЕНИЕ МЕТАЛЛОВ
Металлы, особенности атомно-кристаллического строения
Материаловедение – это наука о взаимосвязи электронного строения, структуры материалов с их составом, физическими, химическими, технологическими и эксплуатационными свойствами. Все материалы по химической основе делятся на две основные группы – металлические и неметаллические. В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место. Причина этого – в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы, или вещества, находящиеся в металлическом состоянии, обладают электронным строением, характеризующимся наличием незаполненных подуровней в валентной зоне. Валентные электроны не связаны с определенными атомами, а принадлежат всему металлическому телу, образуя электронный газ, окружающий каркас из положительно заряженных ионов. Металлическая связь между атомами ненаправленная. Каждый атом стремится окружить себя как можно большим числом соседних атомов, следствием чего является высокая компактность металлов.
Электроны, образующие электронный газ, называют электронами проводимости, поскольку они легко перемещаются во внешнем электрическом поле, создавая электрический ток. Недостроенность валентных энергетических зон металлов определяет их высокую электропроводность, теплопроводность, металлический блеск и др. Все металлы имеют положительный температурный коэффициент электрического сопротивления. Отсутствие сильных направленных связей между атомами, характерных для ионного и ковалентного типов связи, определяет пластичность металлов.
По ряду характерных признаков металлы делят на две группы: черные и цветные. К черным относят железо и его сплавы (стали, чугуны). Остальные металлы и сплавы на их основе – цветные.
Нередко к металлам железной группы относят Ni, Co и Мn.
Металлы со значением температуры плавления выше 1800 °С называют тугоплавкими. К ним принадлежат Ti, Zr, Cr, V, Nb, Mo, W и др. Металлы с низким значением температуры плавления (Hg, Sn, Bi, Cd, Pb, Zn, Sb и др.) относят к легкоплавким.
К легким относятся металлы с низкой плотностью. К ним принадлежат нашедшие широкое техническое применение Mg, Be, Al, Ti.
Металлы (Ag, Аu, Os, Ir, Pt, Rh, Pd и др.) составляют группу благородных. Они химически инертны. К благородным металлам часто относят медь, обладающую химической стойкостью в сухой атмосфере.
К редкоземельным металлам (РЗМ) относят металлы группы лантана – лантаноиды (Се, Pr, Nd и др.) и сходные с ними Y и Sc.
Группу урановых металлов составляют используемые в атомной технике актиноиды (Th, Pa, U и др.).
К группе щелочно-земельных металлов относят Li, Na, К и др. Их используют в качестве теплоносителей в ядерных реакторах.
Ряд металлов (Fe, Ni, Co, Gd) в связи с особенностями их электронного строения обладает ферромагнетизмом – способностью сильно намагничиваться во внешнем магнитном поле. Основные свойства ферромагнетиков определяются доменной структурой их кристаллов. Домен – это область кристалла размером 10‾ 4 –10‾ 6 м, которая при отсутствии внешнего магнитного поля спонтанно (самопроизвольно) намагничена до насыщения. Магнитные моменты отдельных доменов направлены различно, поэтому полный магнитный момент ферромагнетика равен нулю.
Свойства металлов разнообразны. Ртуть замерзает при температуре – 38,8 °С; вольфрам выдерживает рабочую температуру до 2000 °С; литий, калий, натрий легче воды; иридий и осмий в 42 раза тяжелее лития. Вместе с тем металлы имеют общие характерные свойства: высокую пластичность, высокие тепло- и электропроводность, положительный температурный коэффициент электрического сопротивления, хорошую отражательную способность, термоэлектронную эмиссию (способность к испусканию электронов при нагреве), кристаллическое строение.
| Рис. 1.1. Схема кристаллической решетки |
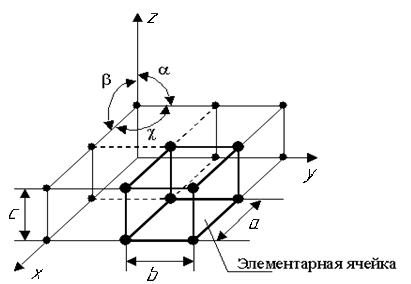
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, т.е. укладка атомов в них характеризуется закономерным расположением в пространстве, т.е. порядком – периодичностью как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка (рис. 1.1).
Кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Она характеризует особенности строения кристалла.
Основными параметрами кристалла являются:
– размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов. Период решетки выражается в нанометрах (1 нм = 10 –9 м). Пери-оды решетки для большинства металлов находятся в пределах 0,3 – 0,7 нм, размеры элементарных ячеек 0,2 – 50,3 нм;
– углы между осями (α, β, χ);
– координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке;
– базис решетки, число атомов, приходящихся на одну элементарную ячейку решетки;
– плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами, к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74).
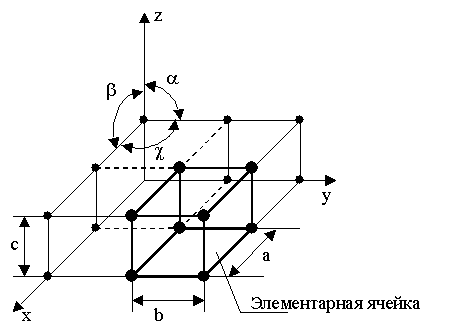
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве.
Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа:
– примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
– базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
– объемно-центрированный – атомы занимают вершины ячеек и ее центр;
– гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней.
Наиболее часто металлы имеют кристаллические решетки следующих типов:
1. Объемно-центрированная кубическая (ОЦК) (рис. 1.2, а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Feα).
2. Гранецентрированный куб (ГЦК) (рис. 1.2, б), атомы располагаются в вершинах куба и по центру каждой из шести граней (Ag, Au, Feγ,, Cu, Co, Ni и др.).
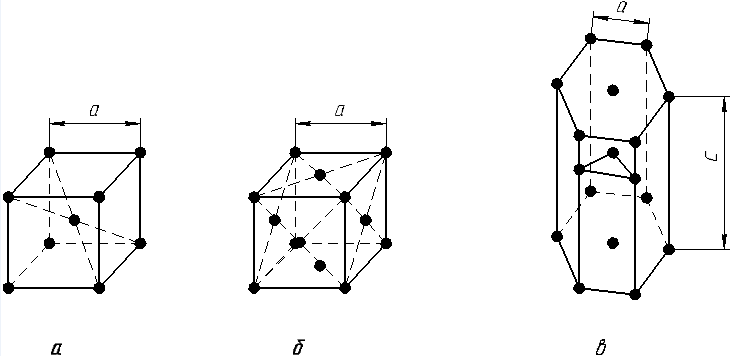
Рис. 1.2. Основные типы кристаллических решеток:
а – объемно-центрированная кубическая; б – гранецентрированная кубическая; в – гексагональная плотноупакованная
– простая – атомы располагаются в вершинах ячейки и по центру двух оснований (углерод в виде графита);
– плотноупакованная (ГПУ) – имеется три дополнительных атома в средней плоскости (Zn, Mg, Ti).
Лекционный материал для занятия по теме "Особенности атомно-кристаллического строения металлов"

Материал можно использовать для проведения занятия по дисциплине "Основы материаловедения" при изложении темы: "Особенности атомно-кристаллического строения металлов", так и для самостоятельной работы обучающихся.
Просмотр содержимого документа
«Лекционный материал для занятия по теме "Особенности атомно-кристаллического строения металлов"»
Особенности атомно-кристаллического строения металлов.
План занятия
Материаловедение - это наука о взаимосвязи электронного строения, структуры материалов с их составом, физическими, химическими, технологическими и эксплуатационными свойствами.
Создание научных основ металловедения по праву принадлежит. Чернову Д.К., который установил критические температуры фазовых превращений в сталях и их связь с количеством углерода в сталях. Этим были заложены основы для важнейшей в металловедении диаграммы состояния железоуглеродистых сплавов.
Открытием аллотропических превращений в стали, Чернов заложил фундамент термической обработки стали. Критические точки в стали, позволили рационально выбирать температуру ее закалки, отпуска и пластической деформации в производственных условиях.
В своих работах по кристаллизации стали, и строению слитка Чернов изложил основные положения теории литья, не утратившие своего научного и практического значения в настоящее время.
Великий русский металлург Аносов П.П. впервые применил микроскоп для исследования структуры металлов. Ему принадлежит приоритет в создании легированных сталей. Разработал теорию и технологию изготовления клинков из булатной стали. Из его работ стало ясно, что так называемый булатный узор на поверхности стали, непосредственно зависит от ее внутренней структуры.
В 1873-1876 г.г Гиббс изложил основные законы фазового равновесия и, в частности, правило фаз, основываясь на законах термодинамики. Для решения практических задач знание фазового равновесия в той или иной системе необходимо, но не достаточно для определения состава и относительного количества фаз. Обязательно знать структуру сплавов, то есть атомное строение фаз, составляющих сплав, а также распределение, размер и форму кристаллов каждой фазы.
Определение атомного строения фаз стало возможным после открытия Лауэ (1912 г), показавшего, что атомы в кристалле регулярно заполняют пространство, образуя пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую природу. Дифракция рентгеновских лучей на такой решетке дает возможность исследовать строение кристаллов.
В последнее время для структурного анализа, кроме рентгеновских лучей, используют электроны и нейтроны. Соответствующие методы исследования называются электронографией и нейтронографией. Электронная оптика позволила усовершенствовать микроскопию. В настоящее время на электронных микроскопах полезное максимальное увеличение доведено до 100000 раз.
В пятидесятых годах, когда началось исследование природы свойств металлических материалов, было показано, что большинство наиболее важных свойств, в том числе сопротивление пластической деформации и разрушению в различных условиях нагружения, зависит от особенностей тонкого кристаллического строения. Этот вывод способствовал привлечению физических теорий о строении реальных металлов для объяснения многих непонятных явлений и для конструирования сплавов с заданными механическими свойствами. Благодаря теории дислокаций, удалось получить достоверные сведения об изменениях в металлах при их пластической деформации.
Особенно интенсивно развивается металловедение в последние десятилетия. Это объясняется потребностью в новых материалах для исследования космоса, развития электроники, атомной энергетики.
Основными направлениями в развитии металловедения является разработка способов производства чистых и сверхчистых металлов, свойства которых сильно отличаются от свойств металлов технической чистоты, с которыми преимущественно работают. Генеральной задачей материаловедения является создание материалов с заранее рассчитанными свойствами применительно к заданным параметрам и условиям работы. Большое внимание уделяется изучению металлов в экстремальных условиях (низкие и высокие температуры и давление).
До настоящего времени основной материальной базой машиностроения служит черная металлургия, производящая стали и чугуны. Эти материалы имеют много положительных качеств и в первую очередь обеспечивают высокую конструкционную прочность деталей машин. Однако эти классические материалы имеют такие недостатки как большая плотность, низкая коррозионная стойкость. Потери от коррозии составляют 20% годового производства стали и чугуна. Поэтому, по данным научных исследований, через 20…40 лет все развитые страны перестроятся на массовое использование металлических сплавов на базе титана, магния, алюминия. Эти легкие и прочные сплавы позволяют в 2-3раза облегчить станки и машины, в 10 раз уменьшить расходы на ремонт.
По данным института имени Байкова А.Н. в нашей стране есть все условия чтобы в течение 10…15 лет машиностроение могло перейти на выпуск алюминиево-титановой подвижной техники, которая отличается легкостью, коррозионной стойкостью и большим безремонтным ресурсом.
Важное значение имеет устранение отставания нашей страны в области использования новых материалов взамен традиционных (металлических) – пластмасс, керамики, материалов порошковой металлургии, особенно композиционных материалов, что экономит дефицитные металлы, снижает затраты энергии на производство материалов, уменьшает массу изделий.
Расчетами установлено, что замена ряда металлических деталей легкового автомобиля на углепластики из эпоксидной смолы, армированной углеродными волокнами, позволит уменьшить массу машины на 40%; она станет более прочной; уменьшится расход топлива, резко возрастет стойкость против коррозии.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
«металлический блеск» (хорошая отражательная способность);
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определенными.
углы между осями ( координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74)
примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
объемно-центрированный – атомы занимают вершины ячеек и ее центр;
гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней

Основными типами кристаллических решеток являются:
Объемно - центрированная кубическая (ОЦК) (см. рис.1.2а), атомы располагаются в вершинах куба и в его центре (V, W, Ti, Гранецентрированная кубическая (ГЦК) (см. рис. 1.2б), атомы располагаются в вершинах куба и по центру каждой из 6 граней (Ag, Au,Гексагональная, в основании которой лежит шестиугольник:
простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Свойства тела зависят от природы атомов, из которых оно состоит, и от силы взаимодействия между этими атомами. Силы взаимодействия между атомами в значительной степени определяются расстояниями между ними. В аморфных телах с хаотическим расположением атомов в пространстве расстояния между атомами в различных направлениях равны, следовательно, свойства будут одинаковые, то есть аморфные тела изотропны

Для определения индексов кристаллографической плоскости необходимо:
установить координаты точек пересечения плоскости с осями координат в единицах периода решетки;
взять обратные значения этих величин;
привести их к наименьшему целому кратному, каждому из полученных чисел.
Другими словами, индекс по оси показывает, на сколько частей плоскость делит осевую единицу по данной оси. Плоскости, параллельные оси, имеют по ней индекс 0 (110)
одну точку направления совместить с началом координат;
установить координаты любой другой точки, лежащей на прямой, в единицах периода решетки
привести отношение этих координат к отношению трех наименьших целых чисел.
Индексы кристаллографических направлений указываются в квадратных скобках [111]
В кубической решетке индексы направления, перпендикулярного плоскости (hkl) имеют те же индексы [hkl].
Fe: t
911 0
1392 0 )
Контрольные вопросы:
Дайте определение материаловедения.
Какими свойствами обладают металлы?
Дайте определение элементарной ячейки.
Назовите основные параметры кристаллов.
Перечислите основные типы кристаллических решеток.
Приведите примеры металлов с объемно-центрированной кубической решеткой.
Приведите примеры металлов с гранецентрированной кубической решеткой.
Что называется анизотропией?
Что называется кристаллографической плоскостью?
Что надо сделать для определения индексов кристаллографической плоскости?
Читайте также:
